bHLH因子
BHLH因子
大塚 俊之
京都大学 ウイルス研究所 増殖制御学研究分野
DOI:10.14931/bsd.1644 原稿受付日:2012年5月22日 原稿完成日:2013年3月25日
担当編集委員:大隅 典子(東北大学 大学院医学系研究科 附属創生応用医学研究センター 脳神経科学コアセンター 発生発達神経科学分野)
| basic helix-loop-helix DNA-binding domain | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifiers | |||||||||
| Symbol | bHLH | ||||||||
| Pfam | PF00010 | ||||||||
| InterPro | IPR001092 | ||||||||
| SMART | SM00353 | ||||||||
| PROSITE | PDOC00038 | ||||||||
| SCOP | 1mdy | ||||||||
| SUPERFAMILY | 1mdy | ||||||||
| |||||||||
英語名:basic helix-loop-helix (bHLH) transcription factor
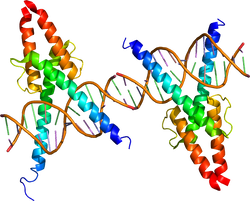
塩基性 helix-loop-helix (bHLH) 因子とは、DNA結合ドメインである塩基性 (basic) 領域とタンパク質相互作用に働くHLHモチーフを有する転写因子の一群である。神経系に限らず各種組織の発生・分化における様々な局面を制御し、種々の細胞への運命決定を行うことにより、細胞の多様性を生み出す上で重要な働きをすることが知られている。
Activator-typeのbHLH因子であるAscl1 (Mash1), Neurod, Neurog (Ngn) 等はプロニューラル因子と呼ばれ、ニューロン特異的遺伝子の転写を活性化し、ニューロン分化を促進する[2]。これに対してrepressor-typeのbHLH因子であるHESファミリー (Hes1, Hes3, Hes5) は、Notchシグナルのエフェクターとして働き、activator-typeのbHLH因子の転写及び機能を抑制することによりニューロン分化を抑制し、神経幹細胞及び神経前駆細胞の未分化性維持に働く[3]。
またニューロンサブタイプの決定やグリア細胞分化を制御するbHLH因子も知られており、脳の複雑な細胞構築及び形態形成において、各種bHLH因子による協調的分化制御が重要な役割を担っている[4][5]。
構造
DNA結合ドメインである塩基性領域と、その下流に存在しタンパク質相互作用に働くHLHモチーフにより特徴づけられる。塩基性領域はDNA上の特定のコンセンサス配列に結合する。Activator-typeのbHLH因子はE box (CANNTG) に結合し、repressor-typeのbHLH因子はN box (CACNAG), class C site (CACGCG) に結合する[6]。HLHモチーフは、2つのαヘリックスドメインがループ構造により連結されており、他のbHLH因子または塩基性領域を持たないHLH因子のHLHモチーフと相互作用することによりダイマー(ホモダイマーあるいはヘテロダイマー)を形成する。特定の遺伝子のプロモーター領域に存在するコンセンサス配列に結合したbHLH因子は、コアクチベーターあるいはコリプレッサーと結合し、転写を促進または抑制する。
種類
配列・認識配列・系統解析による分類
| グループ | 特徴(ドメイン・結合配列等) | 例 |
| A | E boxに結合 (CAGCTG または CACCTG) | Mesp, MyoD, Net, Neurod, Neurog, Olig, Tal, Tcf, Twist |
| B | E boxに結合 (CACGTG または CATGTTG) 多くがロイシンジッパードメインを持つ |
Mad, Max, Myc |
| C | ACGTG または GCGTG 配列に結合 PASドメインを持つ |
Arnt, Clock, Hif |
| D | 塩基性ドメインを欠く グループAタンパク質に対し拮抗的に働く |
Id |
| E | N boxに結合 (CACGAG または CACGCG) OrangeドメインとWRPWペプチドを持つ |
Hes, Hey |
| F | Coeドメインを持つ | Ebf |
発現パターンによる分類
- Class I 多くの組織に普遍的に存在 Tcf3 (E12/E47), Tcf4 (E2-2) etc.
- Class II 組織特異的に発現 MyoD, Neurog (Ngn), Hes etc.
組織特異的に発現するbHLH因子 (Class II) の多くはClass IのbHLH因子とへテロダイマーを形成してDNAに結合し転写を活性化する。
機能的分類
脳神経系における主要機能による分類。
- ニューロンへの分化促進
- Ascl1 (Mash1), Atoh1 (Math1), Ebf1, Ebf2, Ebf3, Ebf4, Hand1, Hand2, Hes6, Neurod1 (Neurod/Beta2), Neurod2 (Ndrf), Neurod4 (Math3), Neurod6 (Math2), Neurog1 (Ngn1), Neurog2 (Ngn2), Ptf1a, Sim1
- ニューロンへの分化抑制
- グリア分化
- 小脳発生
- 自律神経系ニューロン産生
- Ascl1 (Mash1), Hand1, Hand2
- 細胞周期
- Myc (c-Myc), Mycn (N-Myc)
- 概日リズム
- コファクター
また、HUGO遺伝子命名法委員会により、bHLHファミリーの名称が整理されている。
機能
ニューロン分化・サブタイプ決定
Activator-typeのbHLH因子であるAscl1 (Mash1) (Drosophila achaete-scute complexのホモログ), Neurod, Neurogenin (Neurog) (Drosophila atonalのホモログ)などは、他のbHLH因子であるコファクターTcf3 (E12/E47) とヘテロダイマーを形成し、ニューロン特異的遺伝子のプロモーター領域のE box (CANNTG) に結合してニューロン分化を促進する。この過程においては細胞周期と神経分化の同調的制御機構が働いており、サイクリン依存性キナーゼ (cyclin dependent kinase; CDK) の関与が示されている[8][9]。
bHLH因子はまた、脳の領域化及びニューロンサブタイプの決定にも関与する。Neurog1, Neurog2は終脳背側部に発現してグルタミン酸作動性ニューロンへの分化を誘導する一方、Ascl1 (Mash1) は終脳腹側部に強く発現してGABA作動性ニューロンへの分化を促進する[10][11]。末梢神経系においても、Neurog1, Neurog2は感覚神経への分化を、Ascl1 (Mash1) は自律神経への分化をそれぞれ誘導する[12]。更に後根神経節において、Neurog2は早期に産生されるTrkB及びTrkC陽性ニューロンの分化に、Neurog1は後期に産生されるTrkA陽性ニューロンの分化に必須である[13]。小脳の発生において、Math1は菱脳唇 (rhombic lip) の神経上皮に発現してグルタミン酸作動性ニューロンへの分化を誘導する一方、Ptf1aは小脳脳室帯に発現してGABA作動性ニューロンの産生を促進する[14]。また、Nhlh1 (Nscl1), Nhlh2 (Nscl2) はGnRH (gonadotropin releasing hormone) -1ニューロンへの運命決定に[15]、Hand2は交感神経系のノルアドレナリン作動性ニューロンへの運命決定に働く[16]。
bHLH因子が協調的に働くことにより、多様な細胞運命決定に働くことが知られている。Ascl1 (Mash1) 及びHes関連因子である Heslikeは、間脳及び中脳腹側において単独ではGABA作動性ニューロンの分化を誘導できないが、共発現し協調的に働くことによりGABA作動性ニューロンの分化を誘導する[17]。Olig1, Olig2は単独ではオリゴデンドロサイトの分化を誘導するが、Olig2とNeurog2が共発現すると運動ニューロンへの分化を促進する[18][19]。こうしてbHLH因子はその組み合わせによって異なる種類の細胞を産生し、細胞の多様性を生み出している。
ニューロン分化抑制・神経幹細胞維持
Repressor-typeのbHLH因子であるHESファミリー (Drosophila hairy, Enhancer of splitのホモログ; HES1-7) の中で、Hes1, Hes3, Hes5は発生過程における神経幹細胞に発現し、ノッチ (Notch) シグナルのエフェクターとして働き、神経分化を抑制する[3][20]。Hes1はHes1同士のホモダイマーあるいはHeyとのヘテロダイマーを形成して、神経分化促進因子 (activator-typeのbHLH因子) のプロモーター領域などに存在するN box (CACNAG) またはclass C site (CACGCG) に結合し、コリプレッサー (TLE/Grg) と複合体を形成してヒストン脱アセチル化酵素 (histone deacetylase; HDAC) をリクルートし転写を抑制する[21][22]。また、神経分化促進因子と非機能性へテロダイマーを形成するほか、神経分化促進因子のコファクターであるTcf3 (E12/E47) を捕捉することにより機能的にも阻害する[23]。こうして神経幹細胞からニューロンへの分化を抑制し、神経幹細胞の未分化性の維持に働く[24]。
Hes関連因子であるHeyもrepressor-typeのbHLH因子であり、Hey1, Hey2も同様に発生過程における神経幹細胞に発現し、神経分化抑制活性を有する[25]。HLH因子であるIdファミリーは塩基性領域を欠くためDNA結合能を有しないが、Hesと同様に神経分化促進因子と非機能性へテロダイマーを形成することにより神経分化を抑制する[26]。
グリア分化
Neurog1はニューロン分化を促進する一方で、グリア分化を抑制する活性を有している[27]。Neurog1はCBP-Smad1複合体を捕捉して、この複合体がグリア特異的遺伝子のプロモーターに結合するのを抑え、ニューロン特異的遺伝子の活性化に利用することで、ニューロン分化の促進と同時にグリア分化を抑制している。逆に神経分化促進因子 (Ascl1 (Mash1), Neurod4 (Math3), Neurog2) の発現を抑えると、ニューロン分化が抑制されグリア分化が促進される[28][29]。抑制性転写因子であるHes1, Hes5を発生後期に過剰発現させると、アストロサイト及び網膜のミュラーグリア産生が促進されるが、これはHesによる神経分化促進因子の抑制が一因と考えられる[24][30][31]。
Olig1, Olig2はソニックヘッジホッグ (Shh)の下流で働き、オリゴデンドロサイトの分化を誘導する。終脳におけるOlig1の強制発現、脊髄におけるOlig2, Nkx2.2の強制発現によりオリゴデンドロサイトの分化が促進される[32][33]。Tal1 (Scl) は脊髄のp2ドメインにおいて、Olig2と拮抗することによりオリゴデンドロサイトの分化を抑制し、アストロサイトへの分化を誘導する[34]。
細胞周期制御
Myc/Max/Madはネットワークを形成して、細胞増殖・分化・細胞死(アポトーシス)・癌化を制御している[35]。MycはMaxとヘテロダイマーを形成して標的遺伝子の転写を活性化し、細胞周期制御(増殖促進)・分化抑制・アポトーシス誘導などに関与する。MaxはまたMadともヘテロダイマーを形成し、MYC/MAXと共通の標的DNAに競合的に結合することにより、MYC/MAXの機能を阻害する。
時計遺伝子
視床下部の視交叉上核に発現するClockとArntl (Bmal1) はヘテロダイマーを形成し、時計遺伝子として概日リズムを制御している[36][37]。CLOCK/ARNTLがPer (period), Cry (cryptochrome) のプロモーター領域に存在するE boxに結合して転写を活性化し、翻訳されたPER, CRYはヘテロダイマーを形成する。そのPER/CRY複合体が核に移行し、CLOCK/ARNTL複合体に結合してその転写活性を阻害するというネガティブフィードバックループにより、24時間周期の概日リズムが形成・維持される。
参考文献
- ↑
Ma, P.C., Rould, M.A., Weintraub, H., & Pabo, C.O. (1994).
Crystal structure of MyoD bHLH domain-DNA complex: perspectives on DNA recognition and implications for transcriptional activation. Cell, 77(3), 451-9. [PubMed:8181063] [WorldCat] [DOI] - ↑
Bertrand, N., Castro, D.S., & Guillemot, F. (2002).
Proneural genes and the specification of neural cell types. Nature reviews. Neuroscience, 3(7), 517-30. [PubMed:12094208] [WorldCat] [DOI] - ↑ 3.0 3.1
Kageyama, R., Ohtsuka, T., & Kobayashi, T. (2008).
Roles of Hes genes in neural development. Development, growth & differentiation, 50 Suppl 1, S97-103. [PubMed:18430159] [WorldCat] [DOI] - ↑
Ross, S.E., Greenberg, M.E., & Stiles, C.D. (2003).
Basic helix-loop-helix factors in cortical development. Neuron, 39(1), 13-25. [PubMed:12848929] [WorldCat] [DOI] - ↑ Toshiyuki Ohtsuka, Ryoichiro Kageyama
The Basic Helix-Loop-Helix Transcription Factors in Neural Differentiation.fckLR
Cell Cycle Regulation and Differentiation in Cardiovascular and Neural Systems. Springer Science+Business Media, LLC :2010 - ↑ 6.0 6.1
Jones, S. (2004).
An overview of the basic helix-loop-helix proteins. Genome biology, 5(6), 226. [PubMed:15186484] [PMC] [WorldCat] [DOI] - ↑
Ledent, V., & Vervoort, M. (2001).
The basic helix-loop-helix protein family: comparative genomics and phylogenetic analysis. Genome research, 11(5), 754-70. [PubMed:11337472] [PMC] [WorldCat] [DOI] - ↑
Vernon, A.E., Devine, C., & Philpott, A. (2003).
The cdk inhibitor p27Xic1 is required for differentiation of primary neurones in Xenopus. Development (Cambridge, England), 130(1), 85-92. [PubMed:12441293] [WorldCat] [DOI] - ↑
Liu, Y., Encinas, M., Comella, J.X., Aldea, M., & Gallego, C. (2004).
Basic helix-loop-helix proteins bind to TrkB and p21(Cip1) promoters linking differentiation and cell cycle arrest in neuroblastoma cells. Molecular and cellular biology, 24(7), 2662-72. [PubMed:15024057] [PMC] [WorldCat] [DOI] - ↑
Fode, C., Ma, Q., Casarosa, S., Ang, S.L., Anderson, D.J., & Guillemot, F. (2000).
A role for neural determination genes in specifying the dorsoventral identity of telencephalic neurons. Genes & development, 14(1), 67-80. [PubMed:10640277] [PMC] [WorldCat] - ↑
Parras, C.M., Schuurmans, C., Scardigli, R., Kim, J., Anderson, D.J., & Guillemot, F. (2002).
Divergent functions of the proneural genes Mash1 and Ngn2 in the specification of neuronal subtype identity. Genes & development, 16(3), 324-38. [PubMed:11825874] [PMC] [WorldCat] [DOI] - ↑
Lo, L., Dormand, E., Greenwood, A., & Anderson, D.J. (2002).
Comparison of the generic neuronal differentiation and neuron subtype specification functions of mammalian achaete-scute and atonal homologs in cultured neural progenitor cells. Development (Cambridge, England), 129(7), 1553-67. [PubMed:11923194] [WorldCat] - ↑
Ma, Q., Fode, C., Guillemot, F., & Anderson, D.J. (1999).
Neurogenin1 and neurogenin2 control two distinct waves of neurogenesis in developing dorsal root ganglia. Genes & development, 13(13), 1717-28. [PubMed:10398684] [PMC] [WorldCat] [DOI] - ↑
Hoshino, M., Nakamura, S., Mori, K., Kawauchi, T., Terao, M., Nishimura, Y.V., ..., & Nabeshima, Y. (2005).
Ptf1a, a bHLH transcriptional gene, defines GABAergic neuronal fates in cerebellum. Neuron, 47(2), 201-13. [PubMed:16039563] [WorldCat] [DOI] - ↑
Krüger, M., Ruschke, K., & Braun, T. (2004).
NSCL-1 and NSCL-2 synergistically determine the fate of GnRH-1 neurons and control necdin gene expression. The EMBO journal, 23(21), 4353-64. [PubMed:15470499] [PMC] [WorldCat] [DOI] - ↑
Lucas, M.E., Müller, F., Rüdiger, R., Henion, P.D., & Rohrer, H. (2006).
The bHLH transcription factor hand2 is essential for noradrenergic differentiation of sympathetic neurons. Development (Cambridge, England), 133(20), 4015-24. [PubMed:17008447] [WorldCat] [DOI] - ↑
Miyoshi, G., Bessho, Y., Yamada, S., & Kageyama, R. (2004).
Identification of a novel basic helix-loop-helix gene, Heslike, and its role in GABAergic neurogenesis. The Journal of neuroscience : the official journal of the Society for Neuroscience, 24(14), 3672-82. [PubMed:15071116] [PMC] [WorldCat] [DOI] - ↑
Mizuguchi, R., Sugimori, M., Takebayashi, H., Kosako, H., Nagao, M., Yoshida, S., ..., & Nakafuku, M. (2001).
Combinatorial roles of olig2 and neurogenin2 in the coordinated induction of pan-neuronal and subtype-specific properties of motoneurons. Neuron, 31(5), 757-71. [PubMed:11567615] [WorldCat] [DOI] - ↑
Novitch, B.G., Chen, A.I., & Jessell, T.M. (2001).
Coordinate regulation of motor neuron subtype identity and pan-neuronal properties by the bHLH repressor Olig2. Neuron, 31(5), 773-89. [PubMed:11567616] [WorldCat] [DOI] - ↑
Ohtsuka, T., Ishibashi, M., Gradwohl, G., Nakanishi, S., Guillemot, F., & Kageyama, R. (1999).
Hes1 and Hes5 as notch effectors in mammalian neuronal differentiation. The EMBO journal, 18(8), 2196-207. [PubMed:10205173] [PMC] [WorldCat] [DOI] - ↑
Paroush, Z., Finley, R.L., Kidd, T., Wainwright, S.M., Ingham, P.W., Brent, R., & Ish-Horowicz, D. (1994).
Groucho is required for Drosophila neurogenesis, segmentation, and sex determination and interacts directly with hairy-related bHLH proteins. Cell, 79(5), 805-15. [PubMed:8001118] [WorldCat] [DOI] - ↑
Grbavec, D., & Stifani, S. (1996).
Molecular interaction between TLE1 and the carboxyl-terminal domain of HES-1 containing the WRPW motif. Biochemical and biophysical research communications, 223(3), 701-5. [PubMed:8687460] [WorldCat] [DOI] - ↑
Sasai, Y., Kageyama, R., Tagawa, Y., Shigemoto, R., & Nakanishi, S. (1992).
Two mammalian helix-loop-helix factors structurally related to Drosophila hairy and Enhancer of split. Genes & development, 6(12B), 2620-34. [PubMed:1340473] [WorldCat] [DOI] - ↑ 24.0 24.1
Ohtsuka, T., Sakamoto, M., Guillemot, F., & Kageyama, R. (2001).
Roles of the basic helix-loop-helix genes Hes1 and Hes5 in expansion of neural stem cells of the developing brain. The Journal of biological chemistry, 276(32), 30467-74. [PubMed:11399758] [WorldCat] [DOI] - ↑
Sakamoto, M., Hirata, H., Ohtsuka, T., Bessho, Y., & Kageyama, R. (2003).
The basic helix-loop-helix genes Hesr1/Hey1 and Hesr2/Hey2 regulate maintenance of neural precursor cells in the brain. The Journal of biological chemistry, 278(45), 44808-15. [PubMed:12947105] [WorldCat] [DOI] - ↑
Benezra, R., Davis, R.L., Lockshon, D., Turner, D.L., & Weintraub, H. (1990).
The protein Id: a negative regulator of helix-loop-helix DNA binding proteins. Cell, 61(1), 49-59. [PubMed:2156629] [WorldCat] [DOI] - ↑
Sun, Y., Nadal-Vicens, M., Misono, S., Lin, M.Z., Zubiaga, A., Hua, X., ..., & Greenberg, M.E. (2001).
Neurogenin promotes neurogenesis and inhibits glial differentiation by independent mechanisms. Cell, 104(3), 365-76. [PubMed:11239394] [WorldCat] [DOI] - ↑
Tomita, K., Moriyoshi, K., Nakanishi, S., Guillemot, F., & Kageyama, R. (2000).
Mammalian achaete-scute and atonal homologs regulate neuronal versus glial fate determination in the central nervous system. The EMBO journal, 19(20), 5460-72. [PubMed:11032813] [PMC] [WorldCat] [DOI] - ↑
Nieto, M., Schuurmans, C., Britz, O., & Guillemot, F. (2001).
Neural bHLH genes control the neuronal versus glial fate decision in cortical progenitors. Neuron, 29(2), 401-13. [PubMed:11239431] [WorldCat] [DOI] - ↑
Hojo, M., Ohtsuka, T., Hashimoto, N., Gradwohl, G., Guillemot, F., & Kageyama, R. (2000).
Glial cell fate specification modulated by the bHLH gene Hes5 in mouse retina. Development (Cambridge, England), 127(12), 2515-22. [PubMed:10821751] [WorldCat] - ↑
Furukawa, T., Mukherjee, S., Bao, Z.Z., Morrow, E.M., & Cepko, C.L. (2000).
rax, Hes1, and notch1 promote the formation of Müller glia by postnatal retinal progenitor cells. Neuron, 26(2), 383-94. [PubMed:10839357] [WorldCat] [DOI] - ↑
Lu, Q.R., Cai, L., Rowitch, D., Cepko, C.L., & Stiles, C.D. (2001).
Ectopic expression of Olig1 promotes oligodendrocyte formation and reduces neuronal survival in developing mouse cortex. Nature neuroscience, 4(10), 973-4. [PubMed:11574831] [WorldCat] [DOI] - ↑
Zhou, Q., Choi, G., & Anderson, D.J. (2001).
The bHLH transcription factor Olig2 promotes oligodendrocyte differentiation in collaboration with Nkx2.2. Neuron, 31(5), 791-807. [PubMed:11567617] [WorldCat] [DOI] - ↑
Muroyama, Y., Fujiwara, Y., Orkin, S.H., & Rowitch, D.H. (2005).
Specification of astrocytes by bHLH protein SCL in a restricted region of the neural tube. Nature, 438(7066), 360-3. [PubMed:16292311] [WorldCat] [DOI] - ↑
Lüscher, B., & Vervoorts, J. (2012).
Regulation of gene transcription by the oncoprotein MYC. Gene, 494(2), 145-60. [PubMed:22227497] [WorldCat] [DOI] - ↑
Reppert, S.M., & Weaver, D.R. (2002).
Coordination of circadian timing in mammals. Nature, 418(6901), 935-41. [PubMed:12198538] [WorldCat] [DOI] - ↑
Mohawk, J.A., Green, C.B., & Takahashi, J.S. (2012).
Central and peripheral circadian clocks in mammals. Annual review of neuroscience, 35, 445-62. [PubMed:22483041] [PMC] [WorldCat] [DOI]