Developing brain homeoboxファミリー
江角 重行
熊本大学大学院 生命科学研究部 形態構築学講座
DOI:10.14931/bsd.10443 原稿受付日:2023年5月8日 原稿完成日:2023年5月31日
担当編集委員:河崎 洋志(金沢大学 医学系 脳神経医学教室)
英語名:developing brain homeobox family
英略語:Dbx
ホメオボックス型転写因子Dbx (developing brain homeobox)ファミリーは、主に中枢・末梢神経系の発生時期に一過的・局所的に発現する転写因子であり、哺乳類ではDbx1とDbx2が存在し、細胞分化や細胞運命決定に関わる。Dbx1・Dbx2は発生期の脊髄前駆細胞ドメインに局所的かつ一過的に発現しており、脊髄の介在ニューロン運命決定に必須である。Dbx1は終脳の背側腹側境界領域や視索前領域、中脳、視床上部、背側視床、視床下部の原基などにも発現しており、大脳皮質発生過程に一過的に存在するカハールレチウス細胞・扁桃体・視床下部外側核・中脳の呼吸中枢・中脳の交連線維などの発生や分化に大きく関与する。Dbx2は脊髄前駆細胞ドメインだけでなく、脊髄から視床ZLI (zona limitans intrathalamica) 周囲に至る翼板と基板間の領域や間葉系の細胞の一部で発現しているが、機能についての報告はほとんどない。
Dbxファミリーとは
Dbxファミリーは、ホメオドメインを利用したクローニングによってマウスで同定された、進化的に保存された遺伝子である[1][2]。
哺乳類においては、Dbx1, Dbx2が存在し、細胞分化や細胞運命決定に関わる。脊髄発生においては、Dbx1、Dbx2は翼板(alar plate)と基板(basal plate)間に位置する領域(前駆細胞ドメイン)に一過的に発現し、介在ニューロンの発生に必須である[3][4]。
Dbx1は終脳発生過程でも一過的(胎生9.5-13.5日齢)に外套下部 /腹側外套(ventral pallium, VP/pallial-subpallial boundary, PSB)や、視索前領域(preoptic area, POA)に発現する。この領域で産生されたDbx1系譜神経細胞は大脳皮質のカハールレチウス細胞[5]、扁桃体基底外側核のグルタミン酸作動性興奮性ニューロンや扁桃体内側核のGABA作動性抑制性ニューロンになどに分化する[6]。
また、Dbx1は視床下部原基にも発現しており、視床下部外側核、弓状核ニューロンの発生を制御することがわかっている[7]。さらに、中脳の呼吸中枢(pre-Bötzinger複合体呼吸ニューロン)の発生にも必須であり[8]、Dbx1ノックアウトマウスは生後0日目に呼吸不全で死亡する[8]。
Dbx2については発生期の脊髄前駆細胞ドメインだけでなく、脊髄から視床ZLI周囲の至るまで翼板と基板間の領域や、肢芽、歯芽、成熟したアストロサイトや間葉系の細胞の一部で発現するが、機能については、未解な部分が多い。これはDbx2遺伝子改変マウスを用いた報告がほとんどないためである。
ショウジョウバエにおいては、Dbx1/2のオルソログであるDbxが見つかっており、介在ニューロンへの細胞分化や細胞運命決定に関わることが報告されている[9]。
サブファミリー
哺乳類では、Dbx1, Dbx2が存在し、細胞分化や細胞運命決定に関わる。ショウジョウバエにおいては、Dbx1/2のオルソログであるDbxが見つかっている[9]。その他、アフリカツメガエル[10][11]、ゼブラフィッシュ[12][13]のDbxファミリーが報告されている。
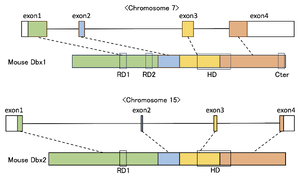
HD: Homeoboxドメイン
RD: Groucho/Tleファミリー依存的Engrailed阻害ドメイン
Cter: 酸性アミノ酸のクラスター
文献[14]より。
構造
Dbxファミリーは、ホメオボックスドメインに加え、Groucho/Tleファミリー依存的Engrailed阻害ドメイン(RD, Drosophila Groucho /Mammalian TLE family dependent Engrailed Repressor Domain)をDbx1は2箇所(RD1,RD2)、Dbx2は1箇所(RD1)持つ。Dbx1はさらにC末端に酸性アミノ酸のクラスター(Cter)を持つ[14](図1)。CterドメインはDbx1がEvx1/2を制御するのに必要であり、Dbx遺伝子を持つ種間では進化的に保存されている[14]。
発現
哺乳類
Dbx1
哺乳類では、終脳の外套下部 /腹側外套 (VP/PSB) や視索前領域(POA), 視床上部、背側視床、視床下部の原基などに、局所的かつ一過的 (胎生6.5-15.5日齢)に発現する[1][2]。脊髄発生過程においては前駆細胞ドメインp0, pd6に発現する。
Dbx2
脊髄発生過程における前駆細胞ドメインp0,p1,pd5,pd6に発現する[3][4][15]。中枢神経発生においては、脊髄から視床のzona limitans intrathalamica (ZLI)周囲の至るまで翼板と基板間の領域をバンド状に発現している。Dbx2は間葉系細胞でも発現しており、肢芽形成領域(limb bud)で胎生11.5日以降に発現すること[16][17][2]や、歯芽形成領域であるエナメル器周囲の間葉系細胞に胎生13.5日以降に発現が認められる [2]。
ショウジョウバエ
発生期 (larvae)のthoracic segmentのneuroblastや中枢の神経前駆細胞の一部に発現する。また、成体でもDbx1系譜神経細胞は存在し、大半はグルタミン酸脱炭酸酵素 (GAD) (GABA合成酵素)と共発現しているため、抑制性GABAニューロンであると考えられる[9]。
発現制御やシグナリング
脊髄ではソニックヘッジホッグ(sonic hedgehog, Shh)の影響を受けて発現が抑制されるため、Shhの濃度の薄い領域に発現する[3][4][15]。脊髄発生においてDbx1はEvx1 の上流として働く。Dbx1ノックアウトマウスでEvx1/2の発現が消失することからEvx1/2の上流であると考えられる。マウスやニワトリの大脳皮質・外套領域の解析からDbx1のプロモーター領域に存在するPax6応答配列は種を超えて保存されており、Pax6によるDbx1の発現誘導メカニズムは進化的に古い段階で獲得されていたと考えられる [18]。視索前領域においては、FoxG1がDbx1の発現を直接的に抑制することでDbx1の発現領域を限局させているとの報告[19]もある。
肢芽形成においてDbx2はHox13の下流として働く。Hox13ノックアウトマウスでDbx2やEvx2の発現は消失する[16][17]。
Dbx2については遺伝子改変マウスの報告がほとんどないため、発現制御やシグナリングについては今後の解析や報告が待たれる。Dbx1と同様にDbx2もEvx1/2の上流として働くと予想されている。
機能
Dbx1は中枢の発生過程で局所的かつ一過的(胎生6.5-15.5日齢、 領域ごとに異なる)に発現することがわかっている。一過的にDbx1を発現した細胞は、Dbx1系譜神経細胞 (Dbx1- lineage cells/neuron)と呼ぶ。Dbx1については、Dbx1-LacZマウス(ノックイン型)、Dbx1-Creマウス、Dbx1-CreERマウス、Dbx1-Floxedマウスなどを用いて解析が進んでいる。Dbx2については報告が少ないため、今後の解析や報告が待たれる。近年、肢芽形成におけるDbx2ノックアウトマウス(ホメオドメイン欠損型)の表現型が報告されたが、致死率は上昇するが、肢芽形成に異常は認められなかった[16][17]。
Dbx1
脊髄
Dbx1とNkx6-2, Dbx2とNkx6-1はそれぞれ排他的に発現している。Nkx6-1とNkx6-2はいずれもホメオドメイン型転写因子で脊髄発生においてはShhで誘導される[20][21]。
脊髄発生過程においてDbx1はEvx1/2 の上流として働き、Dbx1ノックアウトマウスでは、Evx1/2の発現が消失する。その結果、本来V0ニューロンになる予定の細胞群がEn1+(V1ニューロンのマーカーを発現する細胞)に細胞運命転換(fate change)する[15]。
Dbx1系譜前駆細胞はV0ニューロンに分化し、Dbx2系譜前駆細胞はV1ニューロンに分化すると考えらえる。Dbx2の機能についてはノックアウトマウスによる機能解析の報告が少なく、解析が待たれる [3][15][22][23]。
歩行機能は、脊髄の中枢パターン生成器 (central pattern generator, CPG)で制御されているが。この中枢パターン生成器は、筋肉に投射する興奮性運動ニューロンと抑制性ニューロン(介在ニューロン)で構成されている。この抑制性ニューロンの発生にDbx1が関わる。急性単離した胎生18.5日齢のDbx1ノックアウトマウスの脊髄を用いた解析では、脊髄のCPGにおいて交互発火 (co-burst)が起きない。この結果は左右のCPGにおける屈曲進展運動を制御する介在ニューロンはDbx1依存的に発生することを示唆する [24]。
中脳呼吸中枢
呼吸中枢は、延髄腹側部に両側に存在するpre-Bötzinger複合体 (pre-Bötzinger complex, preBotC)と呼ばれる領域に存在し、呼吸リズム形成に重要である。また、脊髄V0やV1領域の介在ニューロンはリズミカルな呼吸運動に必須である。Dbx1ノックアウトマウスは生後すぐに死亡するが、これはV0やV1領域の介在ニューロンの発生異常を原因とする運動活動の低下と、呼吸中枢の発生異常による呼吸不全のためである。このマウスでは呼吸活動の消失が認められる[8][15]。
呼吸リズムを発生するpre-Bötzinger複合体の介在ニューロンの性質や細胞系譜をPax7-Cre; Dbx1-floxedマウスで解析したところ、Dbx1はpre-Bötzinger複合体のリズム形成に必要なグルタミン酸性介在ニューロンの発生過程で細胞運命を制御していることがわかった。また、Dbx1-Cre; Robo3 (round about homolog3/robo3)-floxedマウスの解析から、Dbx1系譜神経細胞におけるRobo3の不活性化は左右のpreBotCの同期性を消失させる。左右のpreBotC領域に存在するDbx1系譜介在ニューロンの軸索誘導のシグナリングは、Robo3依存的に生じ、左右の呼吸リズムの同期させる機能に必須である[25]。
Dbx1-CreERT2マウスを用いた解析では、preBotC領域のソマトスタチン (SST)+/タキキニン受容体1 (NK1R+)/ソマトスタチン受容体2 (SST2aR)+ ニューロンは胎生9.5-11.5日齢に産生されたDbx1系譜神経細胞であることが示されている[8]。
近年では、pre-Bötzinger複合体領域と大脳皮質の高次機能との関連も報告されている。この領域を構成するカドヘリン9 (Cdh9)+, Dbx1系譜神経細胞 (吸気の前に強く興奮する)をDbx1-Cre; Cdh9-floxed-DTRマウスを使い除去すると、通常の呼吸は正常に維持されるが、ゆっくりとしたリズムの呼吸が増加した。また、個体レベルではcalm behavior が増え、覚醒している時間が短くなった。この結果から、Cdh9+; Dbx1系譜神経細胞は青斑核に直接投射しノルアドレナリンニューロンを活性化することで、呼吸のリズムを制御していることが明らかになった[26]。
中脳交連線維
Dbx1は、中脳背側から正中交差して左右の脳を繋ぐ交連ニューロンの運命決定に関与する。また、その軸索ガイダンスにおいては、Dbx1の活性化によってRobo3が働くことが正中交差において重要な働きを示すことが報告されている[27]。
大脳皮質
ヒトを含む哺乳類および胎児の大脳皮質辺縁層(いわゆる表層)にあたるプレプレート(preplate)には、リーリンタンパク質(reelin)を分泌し、大脳皮質の神経細胞の移動と層構造の形成に重要な役割を果たすカハールレチウス細胞が存在する。プレプレートは、神経細胞が移動して来た後に、カハールレチウス細胞を含み大脳皮質第I層となる辺縁層(marginal zone)とサブプレートに分かれる。カハールレチウス細胞は興奮性であり、胎生期に一過的に出現し、層構造形成に重要な働きを行う。生後の大脳皮質においては、細胞死によって数が著しく減少する[28]。生後の大脳皮質に散在するリーリン陽性の抑制性GABAニューロンは尾側基底核隆起 (caudal gaglionic eminence,CGE)を由来としており[29]、上記のカハールレチウス細胞(興奮性ニューロン)とは異なる。
カハールレチウス細胞は、胎生期終脳原基の外套下部 /腹側外套 (VP/PSB) 、中隔野 (pallial septum)、内側周辺部 (cortical hem)などの大脳皮質以外の領域で産生され、水平移動して大脳皮質に入る[5][30][31]。余談であるが、鳥類では、カハールレチウス細胞のような興奮性グルタミン酸ニューロンの水平移動は認められないが、GABA作動性抑制性ニューロン発生でみられる水平移動は観察されている[32]。
終脳の発生過程では、外套下部(VP/PSB)や中隔野でDbx1が胎生10.5~13.5日齢に一過性に発現する。この領域はprogenitor poolとして、大脳皮質や大脳辺縁系に細胞を供給している。外套下部や中隔野で産生されたDbx1系譜神経細胞の一部は水平方向に移動して、大脳皮質の辺縁層のカハールレチウス細胞[5]や 皮質板(cortical plate)に分布することが報告されている。この皮質板に広く分布するDbx1系譜神経細胞は興奮性グルタミン酸ニューロンであるが、約50%は生後0日目までにアポトーシスにより消失し、成体までにほぼ全ての大脳皮質のDbx1系譜興奮性グルタミン酸ニューロンは消失する[28]。また、Dbx1-Cre-Floxed-ジフテリア毒素 (DTA)マウスを用いて、外套下部(VP/PSB)や中隔野に由来するカハールレチウス細胞を含むDbx1系譜細胞を除去すると、大脳皮質の領野形成や領域化に影響を与えることも報告されている [33]。
外套下部(VP/PSB)由来のDbx1系譜神経細胞の一部は、扁桃体[6]や梨状葉[34]に移動して、基底外側核の興奮性グルタミン酸ニューロンに分化することもわかっている (後述)。
胎仔期のマウス終脳の外套下部で発現するDbx1はPax6の発現に依存している。一方、ニワトリ終脳の腹側外套では、Pax6が発現しているにも関わらずDbx1が発現しない。興味深いことに、ニワトリ終脳にPax6を強制発現するとDbx1の発現を誘導することができる。このことからDbx1プロモーター領域に存在するPax6応答配列は種を超えて保存されており、Pax6によるDbx1の発現誘導メカニズムは進化的に古い段階で獲得されていたことが推測される。[18](野村真先生より寄稿)。
ヒト胎生期のDbx1(DBX1)は、外套下部(VP/PSB)に限局して発現しているのではなく、大脳皮質のTbr1やPax6陽性の領域にも広がっている。さらにDbx1を発現する細胞は脳室下帯 (subventricular zone, SVZ)のCtip2陽性の領域でも認められる。霊長類のプロモーター領域を持つDbx1トランスジェニックマウスを解析すると、マウスでもヒトやサルなどの霊長類と類似したDbx1の発現が認められた。これは、進化的に獲得された霊長類の特異的なDbx1プロモーター配列(cis-regulatory-elements)が大脳皮質におけるDbx1の発現を誘導したためであると考えられる[35]。
扁桃体
扁桃体は終脳辺縁系に属する組織であり、側頭葉の内側に位置している。扁桃体は約15の神経核から成り立つ。それぞれの神経核は形態や機能、発現している分子マーカーなどが異なり、さらに基底核原基や外套下部(VP/PSB)などの異なった領域を由来[36]とし、複数の種類の神経細胞から構成されている[37]。
扁桃体の細胞系譜を調べるためにDbx1-Cre ERT2 マウスを用いて、Dbx1系譜神経細胞の運命決定を行った結果、外套下部 (VP/PSB)で誕生した細胞は腹側へと移動し、扁桃体の基底外側複合体や皮質核を構成する多くのグルタミン酸作動性興奮性神経細胞へと分化した[6]。
一方で視索前領域(POA)由来のDbx1系譜神経細胞は発生の早い時期から側方へと移動し、扁桃体内側核(medial amygdala)を構成するGABA作動性抑制性ニューロンに分化していた[38][6]。興味深いことに、この結果は同じDbx1系譜神経細胞であっても発生領域によって、興奮性・抑制性と性質の全く異なる神経細胞に分化することを示唆している。
また、視索前領域 (POA)においては、FoxG1がDbx1の発現を直接、抑制することでDbx1の発現領域を限局させているとの報告[19]もある。
性行動、攻撃行動、捕食者からの逃避行動などの内因性行動/本能行動に関与する扁桃体内側核を解析すると、Dbx1系譜神経細胞とFoxP2陽性細胞は排他的に分布していおり、それぞれの電気生理学的性質は異なっていた。また、Dbx1系譜神経細胞の多くはアロマターゼ陽性の細胞であった。内因性行動によって活性化される神経細胞を解析すると、Dbx1系譜神経細胞とFoxP2陽性細胞は、攻撃行動では雌雄とも活性化を示すが、性行動においては活性化される細胞群に雌雄差があった[39]。
視床下部
Dbx1は視床下部の原基となる領域に一過的(胎生9.5-13.5日齢)に発現する。視床下部発生過程におけるDbx1の機能や神経回路形成への関与を解析するため 視床下部原基でのみDbx1を欠損するコンディショナルノックアウトマウス(Nkx2-1-Cre; Dbx1-floxedマウス, Dbx1-cKOマウス)を解析した結果、胎生期では、外側核のPmch+ 細胞、オレキシン (Hcrt)+ 細胞の減少が認められた。一方で、Nkx2-4陽性細胞やカルビンジン+細胞の発現が増加していたことから、外側核のPmch+細胞の細胞運命はDbx1が欠損したことで変化したと考えられる。興味深いことに胎生期では減少が認められたHcrt+細胞は、生後の発達過程で細胞数がコントロール群と同程度に回復することから、Dbx1非依存的に陽性細胞数が決まると考えられる。
成体のDbx1-cKOマウスを組織レベルで解析すると、外側核のPmch+ニューロン、ニューロペプチドY (Npy)+ニューロンや弓状核のアグーチ関連ペプチド (Agrp)+ニューロンなど摂食に関係するペプチドを産生する神経細胞の減少が認められた。個体レベルの行動では、社会性行動の一種である捕食者の臭い(ラットの臭い)に対する逃避行動が低下しているだけでなく、コルチコステロンの上昇が認められなかった(ストレス応答の異常)。一方、クッキー発見テストでは異常は認められなかったため、嗅覚系は正常であった。体重は雌雄とも通常食では変化しなかったが、高脂肪食、高カロリー食で体重の減少が認められた[7]。これらの結果は、視床下部で一過的に発現するDbx1は視床下部外側核や弓状核の神経細胞分化・運命決定を制御することで、捕食者から逃避行動・ストレス応答・摂食などの内因性行動の基盤となる神経回路形成に寄与することを示唆する[7][40]。
Dbx2
肢芽形成
Hox13ノックアウトマウス(Hoxa13-/-;Hoxd13 -/- )で肢芽におけるDbx2やEvx2の発現が消失することから、肢芽形成においてDbx2はHox13の下流として働き、さらに下流でEvx2が働くと考えられる [17]。Dbx2ノックアウトマウス(ホメオドメイン欠損型)の解析では、致死率は上昇するが、肢芽形成に異常は認められなかった [16]。この報告から、Dbx2は肢芽形成におけるHox13の機能を担う主成分ではないと考えることができる。
癌細胞の増殖
Dbx2はShh-Gli1シグナリングを介して、肝細胞癌(Hepatocellular carcinoma)の成長を促進するとの報告もある[41]。 Dbx2はグリオブラストーマにおいて、直接、neuron-restrictive silencer factor (NRSF、別名repressor element 1 (RE-1) silencing transcription factor, REST) に結合して発現を上昇させることで、グリオブラストーマの増殖を促進させるという報告もある [42]。
アストロサイト
Dbx2のアストロサイトにおける発現は、生後初期(P4)では低いが、成体マウス(3ヶ月齢)では強いことがシングルセルRNAシーケンシングを用いた研究で報告された[43][44]。この結果はDbx2はアストロサイトの成熟に伴って強く発現する転写因子であることを示唆している。
関連語
参考文献
- ↑ 1.0 1.1
Lu, S., Bogarad, L.D., Murtha, M.T., & Ruddle, F.H. (1992).
Expression pattern of a murine homeobox gene, Dbx, displays extreme spatial restriction in embryonic forebrain and spinal cord. Proceedings of the National Academy of Sciences of the United States of America, 89(17), 8053-7. [PubMed:1355604] [PMC] [WorldCat] [DOI] - ↑ 2.0 2.1 2.2 2.3
Shoji, H., Ito, T., Wakamatsu, Y., Hayasaka, N., Ohsaki, K., Oyanagi, M., ..., & Takahashi, N. (1996).
Regionalized expression of the Dbx family homeobox genes in the embryonic CNS of the mouse. Mechanisms of development, 56(1-2), 25-39. [PubMed:8798145] [WorldCat] [DOI] - ↑ 3.0 3.1 3.2 3.3
Briscoe, J., Pierani, A., Jessell, T.M., & Ericson, J. (2000).
A homeodomain protein code specifies progenitor cell identity and neuronal fate in the ventral neural tube. Cell, 101(4), 435-45. [PubMed:10830170] [WorldCat] [DOI] - ↑ 4.0 4.1 4.2
Pierani, A., Brenner-Morton, S., Chiang, C., & Jessell, T.M. (1999).
A sonic hedgehog-independent, retinoid-activated pathway of neurogenesis in the ventral spinal cord. Cell, 97(7), 903-15. [PubMed:10399918] [WorldCat] [DOI] - ↑ 5.0 5.1 5.2
Bielle, F., Griveau, A., Narboux-Nême, N., Vigneau, S., Sigrist, M., Arber, S., ..., & Pierani, A. (2005).
Multiple origins of Cajal-Retzius cells at the borders of the developing pallium. Nature neuroscience, 8(8), 1002-12. [PubMed:16041369] [WorldCat] [DOI] - ↑ 6.0 6.1 6.2 6.3
Hirata, T., Li, P., Lanuza, G.M., Cocas, L.A., Huntsman, M.M., & Corbin, J.G. (2009).
Identification of distinct telencephalic progenitor pools for neuronal diversity in the amygdala. Nature neuroscience, 12(2), 141-9. [PubMed:19136974] [PMC] [WorldCat] [DOI] - ↑ 7.0 7.1 7.2
Sokolowski, K., Esumi, S., Hirata, T., Kamal, Y., Tran, T., Lam, A., ..., & Corbin, J.G. (2015).
Specification of select hypothalamic circuits and innate behaviors by the embryonic patterning gene dbx1. Neuron, 86(2), 403-16. [PubMed:25864637] [PMC] [WorldCat] [DOI] - ↑ 8.0 8.1 8.2 8.3
Gray, P.A., Hayes, J.A., Ling, G.Y., Llona, I., Tupal, S., Picardo, M.C., ..., & Del Negro, C.A. (2010).
Developmental origin of preBötzinger complex respiratory neurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(44), 14883-95. [PubMed:21048147] [PMC] [WorldCat] [DOI] - ↑ 9.0 9.1 9.2
Lacin, H., Zhu, Y., Wilson, B.A., & Skeath, J.B. (2009).
dbx mediates neuronal specification and differentiation through cross-repressive, lineage-specific interactions with eve and hb9. Development (Cambridge, England), 136(19), 3257-66. [PubMed:19710170] [PMC] [WorldCat] [DOI] - ↑
Gershon, A.A., Rudnick, J., Kalam, L., & Zimmerman, K. (2000).
The homeodomain-containing gene Xdbx inhibits neuronal differentiation in the developing embryo. Development (Cambridge, England), 127(13), 2945-54. [PubMed:10851138] [WorldCat] [DOI] - ↑
Ma, P., Zhao, S., Zeng, W., Yang, Q., Li, C., Lv, X., ..., & Mao, B. (2011).
Xenopus Dbx2 is involved in primary neurogenesis and early neural plate patterning. Biochemical and biophysical research communications, 412(1), 170-4. [PubMed:21806971] [WorldCat] [DOI] - ↑
Gribble, S.L., Nikolaus, O.B., & Dorsky, R.I. (2007).
Regulation and function of Dbx genes in the zebrafish spinal cord. Developmental dynamics : an official publication of the American Association of Anatomists, 236(12), 3472-83. [PubMed:17994542] [PMC] [WorldCat] [DOI] - ↑
Hjorth, J.T., Connor, R.M., & Key, B. (2002).
Role of hlx1 in zebrafish brain morphogenesis. The International journal of developmental biology, 46(4), 583-96. [PubMed:12141447] [WorldCat] - ↑ 14.0 14.1 14.2
Karaz, S., Courgeon, M., Lepetit, H., Bruno, E., Pannone, R., Tarallo, A., ..., & D'Onofrio, G. (2016).
Neuronal fate specification by the Dbx1 transcription factor is linked to the evolutionary acquisition of a novel functional domain. EvoDevo, 7, 18. [PubMed:27525057] [PMC] [WorldCat] [DOI] - ↑ 15.0 15.1 15.2 15.3 15.4
Pierani, A., Moran-Rivard, L., Sunshine, M.J., Littman, D.R., Goulding, M., & Jessell, T.M. (2001).
Control of interneuron fate in the developing spinal cord by the progenitor homeodomain protein Dbx1. Neuron, 29(2), 367-84. [PubMed:11239429] [WorldCat] [DOI] - ↑ 16.0 16.1 16.2 16.3
Beccari, L., Jaquier, G., Lopez-Delisle, L., Rodriguez-Carballo, E., Mascrez, B., Gitto, S., ..., & Duboule, D. (2021).
Dbx2 regulation in limbs suggests interTAD sharing of enhancers. Developmental dynamics : an official publication of the American Association of Anatomists, 250(9), 1280-1299. [PubMed:33497014] [PMC] [WorldCat] [DOI] - ↑ 17.0 17.1 17.2 17.3
Beccari, L., Yakushiji-Kaminatsui, N., Woltering, J.M., Necsulea, A., Lonfat, N., Rodríguez-Carballo, E., ..., & Duboule, D. (2016).
A role for HOX13 proteins in the regulatory switch between TADs at the HoxD locus. Genes & development, 30(10), 1172-86. [PubMed:27198226] [PMC] [WorldCat] [DOI] - ↑ 18.0 18.1
Yamashita, W., Takahashi, M., Kikkawa, T., Gotoh, H., Osumi, N., Ono, K., & Nomura, T. (2018).
Conserved and divergent functions of Pax6 underlie species-specific neurogenic patterns in the developing amniote brain. Development (Cambridge, England), 145(8). [PubMed:29661783] [PMC] [WorldCat] [DOI] - ↑ 19.0 19.1
Du, A., Wu, X., Chen, H., Bai, Q.R., Han, X., Liu, B., ..., & Zhao, C. (2019).
Foxg1 Directly Represses Dbx1 to Confine the POA and Subsequently Regulate Ventral Telencephalic Patterning. Cerebral cortex (New York, N.Y. : 1991), 29(12), 4968-4981. [PubMed:30843579] [WorldCat] [DOI] - ↑
Dessaud, E., Ribes, V., Balaskas, N., Yang, L.L., Pierani, A., Kicheva, A., ..., & Sasai, N. (2010).
Dynamic assignment and maintenance of positional identity in the ventral neural tube by the morphogen sonic hedgehog. PLoS biology, 8(6), e1000382. [PubMed:20532235] [PMC] [WorldCat] [DOI] - ↑
Lu, D.C., Niu, T., & Alaynick, W.A. (2015).
Molecular and cellular development of spinal cord locomotor circuitry. Frontiers in molecular neuroscience, 8, 25. [PubMed:26136656] [PMC] [WorldCat] [DOI] - ↑
Sander, M., Paydar, S., Ericson, J., Briscoe, J., Berber, E., German, M., ..., & Rubenstein, J.L. (2000).
Ventral neural patterning by Nkx homeobox genes: Nkx6.1 controls somatic motor neuron and ventral interneuron fates. Genes & development, 14(17), 2134-9. [PubMed:10970877] [PMC] [WorldCat] [DOI] - ↑
Vallstedt, A., Muhr, J., Pattyn, A., Pierani, A., Mendelsohn, M., Sander, M., ..., & Ericson, J. (2001).
Different levels of repressor activity assign redundant and specific roles to Nkx6 genes in motor neuron and interneuron specification. Neuron, 31(5), 743-55. [PubMed:11567614] [WorldCat] [DOI] - ↑
Lanuza, G.M., Gosgnach, S., Pierani, A., Jessell, T.M., & Goulding, M. (2004).
Genetic identification of spinal interneurons that coordinate left-right locomotor activity necessary for walking movements. Neuron, 42(3), 375-86. [PubMed:15134635] [WorldCat] [DOI] - ↑
Bouvier, J., Thoby-Brisson, M., Renier, N., Dubreuil, V., Ericson, J., Champagnat, J., ..., & Fortin, G. (2010).
Hindbrain interneurons and axon guidance signaling critical for breathing. Nature neuroscience, 13(9), 1066-74. [PubMed:20680010] [WorldCat] [DOI] - ↑
Yackle, K., Schwarz, L.A., Kam, K., Sorokin, J.M., Huguenard, J.R., Feldman, J.L., ..., & Krasnow, M.A. (2017).
Breathing control center neurons that promote arousal in mice. Science (New York, N.Y.), 355(6332), 1411-1415. [PubMed:28360327] [PMC] [WorldCat] [DOI] - ↑
Inamata, Y., & Shirasaki, R. (2014).
Dbx1 triggers crucial molecular programs required for midline crossing by midbrain commissural axons. Development (Cambridge, England), 141(6), 1260-71. [PubMed:24553291] [WorldCat] [DOI] - ↑ 28.0 28.1
Teissier, A., Griveau, A., Vigier, L., Piolot, T., Borello, U., & Pierani, A. (2010).
A novel transient glutamatergic population migrating from the pallial-subpallial boundary contributes to neocortical development. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(31), 10563-74. [PubMed:20685999] [PMC] [WorldCat] [DOI] - ↑
Miyoshi, G., Hjerling-Leffler, J., Karayannis, T., Sousa, V.H., Butt, S.J., Battiste, J., ..., & Fishell, G. (2010).
Genetic fate mapping reveals that the caudal ganglionic eminence produces a large and diverse population of superficial cortical interneurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(5), 1582-94. [PubMed:20130169] [PMC] [WorldCat] [DOI] - ↑
Takiguchi-Hayashi, K., Sekiguchi, M., Ashigaki, S., Takamatsu, M., Hasegawa, H., Suzuki-Migishima, R., ..., & Tanabe, Y. (2004).
Generation of reelin-positive marginal zone cells from the caudomedial wall of telencephalic vesicles. The Journal of neuroscience : the official journal of the Society for Neuroscience, 24(9), 2286-95. [PubMed:14999079] [PMC] [WorldCat] [DOI] - ↑
Yoshida, M., Assimacopoulos, S., Jones, K.R., & Grove, E.A. (2006).
Massive loss of Cajal-Retzius cells does not disrupt neocortical layer order. Development (Cambridge, England), 133(3), 537-45. [PubMed:16410414] [WorldCat] [DOI] - ↑
García-Moreno, F., Anderton, E., Jankowska, M., Begbie, J., Encinas, J.M., Irimia, M., & Molnár, Z. (2018).
Absence of Tangentially Migrating Glutamatergic Neurons in the Developing Avian Brain. Cell reports, 22(1), 96-109. [PubMed:29298437] [PMC] [WorldCat] [DOI] - ↑
Griveau, A., Borello, U., Causeret, F., Tissir, F., Boggetto, N., Karaz, S., & Pierani, A. (2010).
A novel role for Dbx1-derived Cajal-Retzius cells in early regionalization of the cerebral cortical neuroepithelium. PLoS biology, 8(7), e1000440. [PubMed:20668538] [PMC] [WorldCat] [DOI] - ↑
Shabangu, T., Chen, H.L., Zhuang, Z.H., Pierani, A., Chen, C.F., & Chou, S.J. (2021).
Specific contribution of neurons from the Dbx1 lineage to the piriform cortex. Scientific reports, 11(1), 8349. [PubMed:33863910] [PMC] [WorldCat] [DOI] - ↑
Arai, Y., Cwetsch, A.W., Coppola, E., Cipriani, S., Nishihara, H., Kanki, H., ..., & Pierani, A. (2019).
Evolutionary Gain of Dbx1 Expression Drives Subplate Identity in the Cerebral Cortex. Cell reports, 29(3), 645-658.e5. [PubMed:31618633] [WorldCat] [DOI] - ↑
Flames, N., Pla, R., Gelman, D.M., Rubenstein, J.L., Puelles, L., & Marín, O. (2007).
Delineation of multiple subpallial progenitor domains by the combinatorial expression of transcriptional codes. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(36), 9682-95. [PubMed:17804629] [PMC] [WorldCat] [DOI] - ↑
Waclaw, R.R., Ehrman, L.A., Pierani, A., & Campbell, K. (2010).
Developmental origin of the neuronal subtypes that comprise the amygdalar fear circuit in the mouse. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(20), 6944-53. [PubMed:20484636] [PMC] [WorldCat] [DOI] - ↑
Gelman, D., Griveau, A., Dehorter, N., Teissier, A., Varela, C., Pla, R., ..., & Marín, O. (2011).
A wide diversity of cortical GABAergic interneurons derives from the embryonic preoptic area. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(46), 16570-80. [PubMed:22090484] [PMC] [WorldCat] [DOI] - ↑
Abecassis, Z.A., Berceau, B.L., Win, P.H., García, D., Xenias, H.S., Cui, Q., ..., & Chan, C.S. (2020).
Npas1+-Nkx2.1+ Neurons Are an Integral Part of the Cortico-pallido-cortical Loop. The Journal of neuroscience : the official journal of the Society for Neuroscience, 40(4), 743-768. [PubMed:31811030] [PMC] [WorldCat] [DOI] - ↑
Sokolowski, K., Tran, T., Esumi, S., Kamal, Y., Oboti, L., Lischinsky, J., ..., & Corbin, J.G. (2016).
Molecular and behavioral profiling of Dbx1-derived neurons in the arcuate, lateral and ventromedial hypothalamic nuclei. Neural development, 11(1), 12. [PubMed:27209204] [PMC] [WorldCat] [DOI] - ↑
Hu, Y.T., Li, B.F., Zhang, P.J., Wu, D., Li, Y.Y., Li, Z.W., ..., & Zhu, X. (2019).
Dbx2 exhibits a tumor-promoting function in hepatocellular carcinoma cell lines via regulating Shh-Gli1 signaling. World journal of gastroenterology, 25(8), 923-940. [PubMed:30833799] [PMC] [WorldCat] [DOI] - ↑
He, R., Zhang, X., & Ding, L. (2022).
DBX2 Promotes Glioblastoma Cell Proliferation by Regulating REST Expression. Current pharmaceutical biotechnology, 23(8), 1101-1108. [PubMed:34463226] [WorldCat] [DOI] - ↑
Guo, Y., Ma, J., Huang, H., Xu, J., Jiang, C., Ye, K., ..., & Zhao, X. (2022).
Defining Specific Cell States of MPTP-Induced Parkinson's Disease by Single-Nucleus RNA Sequencing. International journal of molecular sciences, 23(18). [PubMed:36142685] [PMC] [WorldCat] [DOI] - ↑
Lattke, M., Goldstone, R., Ellis, J.K., Boeing, S., Jurado-Arjona, J., Marichal, N., ..., & Guillemot, F. (2021).
Extensive transcriptional and chromatin changes underlie astrocyte maturation in vivo and in culture. Nature communications, 12(1), 4335. [PubMed:34267208] [PMC] [WorldCat] [DOI]