「CRMP」の版間の差分
細 →CRMP4 |
細編集の要約なし |
||
| (4人の利用者による、間の41版が非表示) | |||
| 1行目: | 1行目: | ||
英:collapsin response mediator protein、英略語:CRMP | 英:collapsin response mediator protein、英略語:CRMP | ||
CRMPs(collapsin response mediator proteins)は、[[軸索]]の反発性因子である[[セマフォリン]]3A(Sema3A)の細胞内シグナルを伝達する分子として最初に同定された<ref name="ref1"><pubmed> 7637782 </pubmed></ref>。CRMPsは、細胞質タンパク質であり、これまでに5つのサブタイプ(CRMP1~5)が同定されている。これらの発現は主に発生時期の神経系に認められ、それぞれ特異的な発現分布と発現時期を示す<ref name="ref2"><pubmed> 14514985 </pubmed></ref>。CRMPsは線虫Unc-33の相同分子であり、Unc-33の突然変異は線虫の[[神経細胞]]において軸索の伸長やガイダンスの異常を引き起こす<ref name="ref3"><pubmed> 1468626 </pubmed></ref>。CRMPsはリン酸化タンパク質であり、リン酸化の制御は神経の発達や成熟に重要な役割を果たす<ref name="ref4"><pubmed> 17311006 </pubmed></ref><ref name="ref5"><pubmed> 22351471 </pubmed></ref>。また、初代培養神経細胞やノックアウトマウスを使った研究により、CRMPsの役割が明らかになってきており、極性・軸索形成や神経細胞の遊走、[[シナプス]]形成、[[シナプス可塑性]]、神経疾患といった様々な神経機能と病態に関与することが報告されている<ref name="ref4" /><ref name="ref5" />。 | |||
== | == CRMPの発現 == | ||
=== 発生期の神経系 === | === 発生期の神経系 === | ||
[[Image:CRMP table1.jpg|thumb|right|表1 CRMPs mRNAの発現時期]] | |||
| | |||
ラットにおけるCRMPsは、初期胚から有糸分裂後の神経細胞において強く発現し、生後1週間前後でピークに達し、その後は発現量が低下する。どのCRMPsも時空間的に調節された発現パターンを示す<ref name="ref2" />(表1) 。CRMP2は最も広範な発現パターンを示し、大多数の神経細胞の発生初期において発現する<ref name="ref6"><pubmed> 8815901 </pubmed></ref>。CRMP1とCRMP4は神経細胞の遊走後に発現し、胎生後期から出生後初期において最も発現量が高くなり、その後発現量が低下する<ref name="ref6" />。CRMP3の発現は、主に[[小脳]]の[[顆粒細胞]]に限られている<ref name="ref6" />。CRMP5の発現は[[新皮質]]、[[海馬]]、[[脊髄]]に顕著であり、有糸分裂後の神経細胞で発現する<ref name="ref7"><pubmed> 11549731 </pubmed></ref>。 | |||
=== 成体の神経系 === | === 成体の神経系 === | ||
ラットの成体脳において,CRMPsは劇的に発現量が低下し,主に可塑性や[[神経新生]]を保持する領域([[嗅球]]、海馬、小脳)で発現が認められる。CRMP1は主に小脳の[[プルキンエ細胞]]において発現する<ref name="ref6" />。CRMP2は成体脳においてはCRMPの中でも発現量が最も高く、嗅覚系や小脳、海馬で多く検出されている<ref name="ref2" /><ref name="ref6" />。CRMP3は小脳顆粒細胞や[[下オリーブ核]]、[[海馬歯状回]]で発現する<ref name="ref2" /><ref name="ref6" />。CRMP4は成体脳においてはCRMPsの中でも発現量が最も低く、嗅球や海馬、小脳の内顆粒層におけるわずかな細胞で発現が確認されている<ref name="ref2" /><ref name="ref8"><pubmed> 10931485 </pubmed></ref>。CRMP5は嗅球や嗅上皮における有糸分裂後の神経細胞、海馬歯状回で発現しており、また、[[末梢神経]]の軸索や[[感覚神経]]でも発現していることが報告されている<ref name="ref2" />。 | |||
== | == CRMPの機能 == | ||
=== CRMP1 === | === CRMP1 === | ||
[[Image: | [[Image:CRMP_fig1.jpg|thumb|right|図1 CRMP1を介したシグナル伝達機構]]<br> | ||
CRMP1は、生後1日目のラット[[大脳皮質]]で強く発現する<ref name="ref6" />。ノックアウトマウスの解析から、CRMP1は大脳皮質神経細胞の遊走を制御することが報告されている<ref name="ref9"><pubmed> 17182786 </pubmed></ref>。CRMP1は[[Fyn]]の基質であり、[[リーリン]](Reelin)が受容体(VLDLR/ApoER2)に結合すると、FynによりCRMP1と[[Dab1]]が[[チロシンリン酸化]]され、これらが相乗的にシグナルのメディエーターとして働き、神経細胞の遊走を制御すると考えられている(図1)<ref name="ref9" />。また、[[Cdk5]]によるCRMP1のリン酸化が、Sema3Aによる[[樹状突起スパイン]]の形成に関与することが報告されている(図1)<ref name="ref10"><pubmed> 18003833 </pubmed></ref>。 | |||
=== CRMP2 === | === CRMP2 === | ||
[[Image:CRMP fig2.jpg|thumb|right| | [[Image:CRMP fig2.jpg|thumb|right|図2 CRMP2を介したシグナル伝達機構]][[Image:CRMP fig3.jpg|thumb|right|図3 CRMP2はキネシン-1依存的軸索輸送に関与する]] | ||
[[Image:CRMP fig3.jpg|thumb|right| | |||
CRMP2はCRMPsの中でも最初に同定され、最も解析が進んでいる分子である。CRMP2は、様々な結合パートナーと相互作用することにより、神経[[極性形成]]、[[微小管]]ダイナミクス、軸索の伸長・退縮、[[キネシン]]依存的軸索輸送、Ca<sup>2+</sup>[[ホメオスタシス]]などに関与する<ref name="ref4" /><ref name="ref11"><pubmed> 21271304 </pubmed></ref>。 | CRMP2はCRMPsの中でも最初に同定され、最も解析が進んでいる分子である。CRMP2は、様々な結合パートナーと相互作用することにより、神経[[極性形成]]、[[微小管]]ダイナミクス、軸索の伸長・退縮、[[キネシン]]依存的軸索輸送、Ca<sup>2+</sup>[[ホメオスタシス]]などに関与する<ref name="ref4" /><ref name="ref11"><pubmed> 21271304 </pubmed></ref>。 | ||
| 141行目: | 31行目: | ||
CRMP2は培養海馬神経細胞の伸長中の軸索に濃縮し、CRMP2の過剰発現により複数本の軸索(過剰軸索)が誘導される<ref name="ref12"><pubmed> 11477421 </pubmed></ref>。誘導された過剰軸索は、[[シナプトフィジン]]陽性のシナプス末端を持つことから、CRMP2は成熟した軸索の形成を誘導し、維持すると考えられる<ref name="ref4" /><ref name="ref12" />。さらに、過剰発現により[[樹状突起]]が軸索に変化したことから、過剰発現されたCRMP2が未成熟な神経突起だけでなく、樹状突起にも軸索のアイデンティティを与え得ることが示唆された<ref name="ref4" /><ref name="ref12" />。 | CRMP2は培養海馬神経細胞の伸長中の軸索に濃縮し、CRMP2の過剰発現により複数本の軸索(過剰軸索)が誘導される<ref name="ref12"><pubmed> 11477421 </pubmed></ref>。誘導された過剰軸索は、[[シナプトフィジン]]陽性のシナプス末端を持つことから、CRMP2は成熟した軸索の形成を誘導し、維持すると考えられる<ref name="ref4" /><ref name="ref12" />。さらに、過剰発現により[[樹状突起]]が軸索に変化したことから、過剰発現されたCRMP2が未成熟な神経突起だけでなく、樹状突起にも軸索のアイデンティティを与え得ることが示唆された<ref name="ref4" /><ref name="ref12" />。 | ||
CRMP2による軸索形成の分子メカニズムとして、微小管ダイナミクスの制御が報告されている。CRMP2は[[チューブリン]]ヘテロ二量体と結合して微小管の重合を促進すること、また、この微小管重合活性がCRMP2により誘導される軸索伸長に必要であることが明らかになっている<ref name="ref13"><pubmed> 12134159 </pubmed></ref>。CRMP2のチューブリンへの結合はダイナミックに制御されており、Sema3A受容体である[[ニューロピリン]]-1(NP-1)や[[プレキシン]]A(PlexA)が[[Rac]]1を活性化し、下流の[[キナーゼ]]に影響を与え、最終的に[[GSK-3 beta]]が活性化され、CRMP2がリン酸化を受ける<ref name="ref11" /><ref name="ref14"><pubmed> 15652488 </pubmed></ref>。リン酸化されたCRMP2はチューブリンへのアフィニティーが弱くなり、軸索の退縮が促進される(図2)<ref name="ref14" />。逆に、[[ニューロトロフィン]]-3や[[脳由来神経成長因子]](BDNF)によりGSK-3 betaが阻害され、CRMP2のリン酸化が抑制されることで、軸索伸長が促進する(図2)<ref name="ref14" />。また、CRMP2の結合タンパク質として[[Numb]]が同定されており、CRMP2が軸索先端でNumbを介した[[L1]]の[[エンドサイトーシス]]およびリサイクリングに関与する可能性が示唆されている<ref name="ref15"><pubmed> 12942088 </pubmed></ref>。[[Rhoキナーゼ]]がCRMP2をリン酸化することにより、CRMP2がNumbと結合できなくなり、軸索伸長が阻害されることも報告されている<ref name="ref16">'''有村奈利子、木村俊秀、藤井佳代、貝淵弘三<br>RhoキナーゼによるCRMP-2のリン酸化とその活性制御について<br>''脳21'':2004 </ref>。 | |||
CRMP2はキネシン依存性軸索輸送にも関与する。CRMP2がチューブリンヘテロ二量体もしくは[[Sra-1]]をキネシン-1につなぎとめ、CRMP2/キネシン-1複合体がチューブリン二量体やSra-1/[[WAVE]]-1複合体の輸送を制御する(図3)<ref name="ref17"><pubmed> 16364893 </pubmed></ref><ref name="ref18"><pubmed> 16260607 </pubmed></ref>。また、[[Trk]]B/Slp1/[[Rab]]27複合体がCRMP2を介してキネシン-1に結合し、これらが順行性輸送されることが報告されている(図3)<ref name="ref19"><pubmed> 19460344 </pubmed></ref>。 | |||
CRMP2のCa<sup>2+</sup>ホメオスタシスへの関与としては、CRMP2が直接的に[[CaV2.2]](N-type voltage-gated Ca<sup>2+</sup> channel)と結合すると、[[プレシナプス]]の膜表面でのCaV2.2の局在が増加してCa<sup>2+</sup>の流入が増加することにより、[[神経伝達物質]]の放出が増加することが報告されている<ref name="ref20"><pubmed> 19755421 </pubmed></ref>。 | |||
=== CRMP3 === | === CRMP3 === | ||
CRMP3ノックアウトマウスの海馬において、樹状突起の長さや枝分かれの数が減少することが報告された<ref name="ref21"><pubmed> 17785607 | CRMP3ノックアウトマウスの海馬において、樹状突起の長さや枝分かれの数が減少することが報告された<ref name="ref21"><pubmed> 17785607 </pubmed></ref>。さらに、樹状突起スパインの形成も異常になることから、CRMP3は樹状突起の形成や樹状突起スパインの成熟に関与すると考えられている<ref name="ref21" />。また、CRMP3のその他の役割として、微小管の重合を阻害することにより神経突起の伸長を抑制することや、[[興奮毒性]]のある[[グルタミン酸]]で処理した神経細胞において、神経細胞が壊死する前の[[核凝縮]]時に[[カルパイン]]により切断されたCRMP3が核膜孔を通り核内に移行することで核凝縮に関わる可能性が示唆されている<ref name="ref22"><pubmed> 19559021 </pubmed></ref>。 | ||
=== CRMP4 === | === CRMP4 === | ||
CRMP4をノックアウトすると、海馬[[CA1]]の[[ | CRMP4をノックアウトすると、海馬[[CA1]]の[[錐体神経細胞]]の[[尖端樹状突起]]が二分枝化する表現型が増加し<ref name="ref23"><pubmed> 22234963 </pubmed></ref>、これはSema3Aのノックアウトマウスにおいても観察される<ref name="ref5" />。Sema3Aにより樹状突起の伸長や枝分かれが促進されるが、CRMP4ノックアウトマウスの培養海馬神経細胞においては、Sema3Aを加えてもこれらの促進が認められない<ref name="ref23" />。これらのことから、Sema3AシグナルがCRMP4に伝わり、海馬CA1における錐体神経細胞の尖端樹状突起の二分枝化を負に制御することが示唆されている<ref name="ref5" /><ref name="ref23" />。 | ||
また、CRMP4をノックダウンした大脳皮質神経細胞や海馬神経細胞において、樹状突起の分枝点の数が増加したことから、CRMP4は樹状突起の分枝を抑制する可能性が示唆されている<ref name="ref23" />。 | |||
=== CRMP5 === | === CRMP5 === | ||
CRMP5はCRAMと名付けられたCRMP-associated proteinとして同定された。CRMP5は[[成長円錐]]の[[糸状仮足]]に局在し、糸状仮足のダイナミクスや成長円錐の形態を制御するのに重要な役割を果たす<ref name="ref24"><pubmed> 15509652 </pubmed></ref> | CRMP5はCRAMと名付けられたCRMP-associated proteinとして同定された。CRMP5は[[成長円錐]]の[[糸状仮足]]に局在し、糸状仮足のダイナミクスや成長円錐の形態を制御するのに重要な役割を果たす<ref name="ref24"><pubmed> 15509652 </pubmed></ref>。また、CRMP5がMAP2およびチューブリンと複合体を形成し、これにより神経突起の伸長が阻害されることが報告されている<ref name="ref25"><pubmed> 20702696 </pubmed></ref>。海馬神経細胞において、CRMP5は発生の初期段階では[[Minor process]]と呼ばれる未成熟な突起に強く発現しており、将来樹状突起になる突起の伸長を抑制する<ref name="ref25" />。一方、CRMP5とCRMP2の両方が共発現している際には、CRMP2により誘導される神経突起伸長を抑制すると考えられている<ref name="ref25" />。 | ||
小脳のプルキンエ細胞において、CRMP5はシナプス可塑性に重要な役割を果たすことが報告されている<ref name="ref26"><pubmed> 21289187 </pubmed></ref>。プルキンエ細胞におけるCRMP5の発現は、出生後21日から28日において確認されており、CRMP5をノックアウトすると、プルキンエ細胞の細胞体のサイズや樹状突起の長さが減少する。さらに、[[平行線維]]とプルキンエ細胞間の[[興奮性シナプス伝達]]の[[長期抑圧]](LTD;long-term depression)の誘導が阻害されることが報告されている<ref name="ref26" />。プルキンエ細胞の樹状突起の形態制御にはBDNF-TrkBシグナルが関与する可能性が示唆されている<ref name="ref5" />。CRMP5ノックアウトマウスのプルキンエ細胞におけるBDNFの効果はまだ解析されていないが、ノックアウトマウスの培養海馬神経細胞において、BDNFにより誘導される樹状突起伸長の促進が減弱し、樹状突起の形態も損なわれる。さらに、TrkBによりCRMP5がチロシンリン酸化されることも明らかになり、BDNF-TrkBシグナルがCRMP5に伝わり、プルキンエ細胞の樹状突起の形態の制御に関与する可能性が示唆されている<ref name="ref5" /><ref name="ref26" />。 | 小脳のプルキンエ細胞において、CRMP5はシナプス可塑性に重要な役割を果たすことが報告されている<ref name="ref26"><pubmed> 21289187 </pubmed></ref>。プルキンエ細胞におけるCRMP5の発現は、出生後21日から28日において確認されており、CRMP5をノックアウトすると、プルキンエ細胞の細胞体のサイズや樹状突起の長さが減少する。さらに、[[平行線維]]とプルキンエ細胞間の[[興奮性シナプス伝達]]の[[長期抑圧]](LTD;long-term depression)の誘導が阻害されることが報告されている<ref name="ref26" />。プルキンエ細胞の樹状突起の形態制御にはBDNF-TrkBシグナルが関与する可能性が示唆されている<ref name="ref5" />。CRMP5ノックアウトマウスのプルキンエ細胞におけるBDNFの効果はまだ解析されていないが、ノックアウトマウスの培養海馬神経細胞において、BDNFにより誘導される樹状突起伸長の促進が減弱し、樹状突起の形態も損なわれる。さらに、TrkBによりCRMP5がチロシンリン酸化されることも明らかになり、BDNF-TrkBシグナルがCRMP5に伝わり、プルキンエ細胞の樹状突起の形態の制御に関与する可能性が示唆されている<ref name="ref5" /><ref name="ref26" />。 | ||
== CRMPと神経疾患 == | |||
中枢神経系では、特定領域の神経変性が[[アルツハイマー病]]や[[パーキンソン病]]などの[[神経変性疾患]]の発症に重要な役割を果たしている。これまでの研究により、CRMP2がアルツハイマー病の発症に関与している可能性が示唆されている。3F4と呼ばれる抗リン酸化CRMP2抗体が、粗精製した過剰にリン酸化されたタウの集合体([[神経原線維変化]])と反応することが報告された<ref name="ref27"><pubmed> 9545313 </pubmed></ref>。この抗体はCdk5やGSK3-betaによりリン酸化されたCRMP2を認識することから、CRMP2のリン酸化がアルツハイマー病の原因因子の一つである可能性がある<ref name="ref28"><pubmed> 10757975 </pubmed></ref>。さらに、リン酸化CRMP2がアルツハイマー病の脳やアルツハイマー病の疾患モデルマウスにおいて増加することが確認されている<ref name="ref29"><pubmed> 17683481 </pubmed></ref>。また、アルツハイマー病の海馬CA1領域においてSema3A陽性神経細胞の数が増加することが報告されていることから<ref name="ref30"><pubmed> 15485501 </pubmed></ref>、アルツハイマー病の脳において、増加したSema3Aのシグナル伝達によりCRMP2のリン酸化が促進される可能性が考えられる。近年、アルツハイマー病以外に、CRMPsが[[統合失調症]]の発症にも関与することが示唆されており<ref name="ref5" />、これらの病態解明や治療法の開発を含め、さらなる研究が期待される。 | |||
中枢神経系では、特定領域の神経変性が[[アルツハイマー病]]や[[パーキンソン病]]などの[[神経変性疾患]] | |||
== 参考文献 == | |||
<references /> | |||
(執筆者:久保祐亮、稲垣直之 担当編集委員:大隅典子) | |||
2012年8月3日 (金) 14:04時点における版
英:collapsin response mediator protein、英略語:CRMP
CRMPs(collapsin response mediator proteins)は、軸索の反発性因子であるセマフォリン3A(Sema3A)の細胞内シグナルを伝達する分子として最初に同定された[1]。CRMPsは、細胞質タンパク質であり、これまでに5つのサブタイプ(CRMP1~5)が同定されている。これらの発現は主に発生時期の神経系に認められ、それぞれ特異的な発現分布と発現時期を示す[2]。CRMPsは線虫Unc-33の相同分子であり、Unc-33の突然変異は線虫の神経細胞において軸索の伸長やガイダンスの異常を引き起こす[3]。CRMPsはリン酸化タンパク質であり、リン酸化の制御は神経の発達や成熟に重要な役割を果たす[4][5]。また、初代培養神経細胞やノックアウトマウスを使った研究により、CRMPsの役割が明らかになってきており、極性・軸索形成や神経細胞の遊走、シナプス形成、シナプス可塑性、神経疾患といった様々な神経機能と病態に関与することが報告されている[4][5]。
CRMPの発現
発生期の神経系
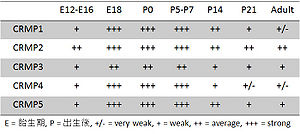
ラットにおけるCRMPsは、初期胚から有糸分裂後の神経細胞において強く発現し、生後1週間前後でピークに達し、その後は発現量が低下する。どのCRMPsも時空間的に調節された発現パターンを示す[2](表1) 。CRMP2は最も広範な発現パターンを示し、大多数の神経細胞の発生初期において発現する[6]。CRMP1とCRMP4は神経細胞の遊走後に発現し、胎生後期から出生後初期において最も発現量が高くなり、その後発現量が低下する[6]。CRMP3の発現は、主に小脳の顆粒細胞に限られている[6]。CRMP5の発現は新皮質、海馬、脊髄に顕著であり、有糸分裂後の神経細胞で発現する[7]。
成体の神経系
ラットの成体脳において,CRMPsは劇的に発現量が低下し,主に可塑性や神経新生を保持する領域(嗅球、海馬、小脳)で発現が認められる。CRMP1は主に小脳のプルキンエ細胞において発現する[6]。CRMP2は成体脳においてはCRMPの中でも発現量が最も高く、嗅覚系や小脳、海馬で多く検出されている[2][6]。CRMP3は小脳顆粒細胞や下オリーブ核、海馬歯状回で発現する[2][6]。CRMP4は成体脳においてはCRMPsの中でも発現量が最も低く、嗅球や海馬、小脳の内顆粒層におけるわずかな細胞で発現が確認されている[2][8]。CRMP5は嗅球や嗅上皮における有糸分裂後の神経細胞、海馬歯状回で発現しており、また、末梢神経の軸索や感覚神経でも発現していることが報告されている[2]。
CRMPの機能
CRMP1
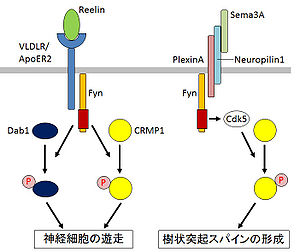
CRMP1は、生後1日目のラット大脳皮質で強く発現する[6]。ノックアウトマウスの解析から、CRMP1は大脳皮質神経細胞の遊走を制御することが報告されている[9]。CRMP1はFynの基質であり、リーリン(Reelin)が受容体(VLDLR/ApoER2)に結合すると、FynによりCRMP1とDab1がチロシンリン酸化され、これらが相乗的にシグナルのメディエーターとして働き、神経細胞の遊走を制御すると考えられている(図1)[9]。また、Cdk5によるCRMP1のリン酸化が、Sema3Aによる樹状突起スパインの形成に関与することが報告されている(図1)[10]。
CRMP2
CRMP2はCRMPsの中でも最初に同定され、最も解析が進んでいる分子である。CRMP2は、様々な結合パートナーと相互作用することにより、神経極性形成、微小管ダイナミクス、軸索の伸長・退縮、キネシン依存的軸索輸送、Ca2+ホメオスタシスなどに関与する[4][11]。
CRMP2は培養海馬神経細胞の伸長中の軸索に濃縮し、CRMP2の過剰発現により複数本の軸索(過剰軸索)が誘導される[12]。誘導された過剰軸索は、シナプトフィジン陽性のシナプス末端を持つことから、CRMP2は成熟した軸索の形成を誘導し、維持すると考えられる[4][12]。さらに、過剰発現により樹状突起が軸索に変化したことから、過剰発現されたCRMP2が未成熟な神経突起だけでなく、樹状突起にも軸索のアイデンティティを与え得ることが示唆された[4][12]。
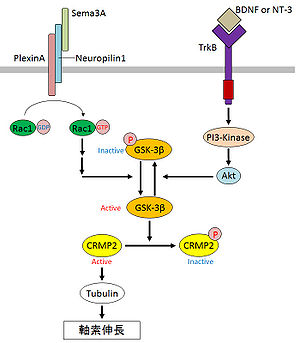
CRMP2による軸索形成の分子メカニズムとして、微小管ダイナミクスの制御が報告されている。CRMP2はチューブリンヘテロ二量体と結合して微小管の重合を促進すること、また、この微小管重合活性がCRMP2により誘導される軸索伸長に必要であることが明らかになっている[13]。CRMP2のチューブリンへの結合はダイナミックに制御されており、Sema3A受容体であるニューロピリン-1(NP-1)やプレキシンA(PlexA)がRac1を活性化し、下流のキナーゼに影響を与え、最終的にGSK-3 betaが活性化され、CRMP2がリン酸化を受ける[11][14]。リン酸化されたCRMP2はチューブリンへのアフィニティーが弱くなり、軸索の退縮が促進される(図2)[14]。逆に、ニューロトロフィン-3や脳由来神経成長因子(BDNF)によりGSK-3 betaが阻害され、CRMP2のリン酸化が抑制されることで、軸索伸長が促進する(図2)[14]。また、CRMP2の結合タンパク質としてNumbが同定されており、CRMP2が軸索先端でNumbを介したL1のエンドサイトーシスおよびリサイクリングに関与する可能性が示唆されている[15]。RhoキナーゼがCRMP2をリン酸化することにより、CRMP2がNumbと結合できなくなり、軸索伸長が阻害されることも報告されている[16]。
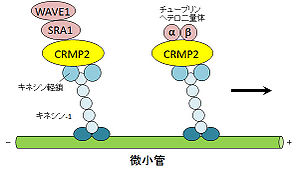
CRMP2はキネシン依存性軸索輸送にも関与する。CRMP2がチューブリンヘテロ二量体もしくはSra-1をキネシン-1につなぎとめ、CRMP2/キネシン-1複合体がチューブリン二量体やSra-1/WAVE-1複合体の輸送を制御する(図3)[17][18]。また、TrkB/Slp1/Rab27複合体がCRMP2を介してキネシン-1に結合し、これらが順行性輸送されることが報告されている(図3)[19]。
CRMP2のCa2+ホメオスタシスへの関与としては、CRMP2が直接的にCaV2.2(N-type voltage-gated Ca2+ channel)と結合すると、プレシナプスの膜表面でのCaV2.2の局在が増加してCa2+の流入が増加することにより、神経伝達物質の放出が増加することが報告されている[20]。
CRMP3
CRMP3ノックアウトマウスの海馬において、樹状突起の長さや枝分かれの数が減少することが報告された[21]。さらに、樹状突起スパインの形成も異常になることから、CRMP3は樹状突起の形成や樹状突起スパインの成熟に関与すると考えられている[21]。また、CRMP3のその他の役割として、微小管の重合を阻害することにより神経突起の伸長を抑制することや、興奮毒性のあるグルタミン酸で処理した神経細胞において、神経細胞が壊死する前の核凝縮時にカルパインにより切断されたCRMP3が核膜孔を通り核内に移行することで核凝縮に関わる可能性が示唆されている[22]。
CRMP4
CRMP4をノックアウトすると、海馬CA1の錐体神経細胞の尖端樹状突起が二分枝化する表現型が増加し[23]、これはSema3Aのノックアウトマウスにおいても観察される[5]。Sema3Aにより樹状突起の伸長や枝分かれが促進されるが、CRMP4ノックアウトマウスの培養海馬神経細胞においては、Sema3Aを加えてもこれらの促進が認められない[23]。これらのことから、Sema3AシグナルがCRMP4に伝わり、海馬CA1における錐体神経細胞の尖端樹状突起の二分枝化を負に制御することが示唆されている[5][23]。
また、CRMP4をノックダウンした大脳皮質神経細胞や海馬神経細胞において、樹状突起の分枝点の数が増加したことから、CRMP4は樹状突起の分枝を抑制する可能性が示唆されている[23]。
CRMP5
CRMP5はCRAMと名付けられたCRMP-associated proteinとして同定された。CRMP5は成長円錐の糸状仮足に局在し、糸状仮足のダイナミクスや成長円錐の形態を制御するのに重要な役割を果たす[24]。また、CRMP5がMAP2およびチューブリンと複合体を形成し、これにより神経突起の伸長が阻害されることが報告されている[25]。海馬神経細胞において、CRMP5は発生の初期段階ではMinor processと呼ばれる未成熟な突起に強く発現しており、将来樹状突起になる突起の伸長を抑制する[25]。一方、CRMP5とCRMP2の両方が共発現している際には、CRMP2により誘導される神経突起伸長を抑制すると考えられている[25]。
小脳のプルキンエ細胞において、CRMP5はシナプス可塑性に重要な役割を果たすことが報告されている[26]。プルキンエ細胞におけるCRMP5の発現は、出生後21日から28日において確認されており、CRMP5をノックアウトすると、プルキンエ細胞の細胞体のサイズや樹状突起の長さが減少する。さらに、平行線維とプルキンエ細胞間の興奮性シナプス伝達の長期抑圧(LTD;long-term depression)の誘導が阻害されることが報告されている[26]。プルキンエ細胞の樹状突起の形態制御にはBDNF-TrkBシグナルが関与する可能性が示唆されている[5]。CRMP5ノックアウトマウスのプルキンエ細胞におけるBDNFの効果はまだ解析されていないが、ノックアウトマウスの培養海馬神経細胞において、BDNFにより誘導される樹状突起伸長の促進が減弱し、樹状突起の形態も損なわれる。さらに、TrkBによりCRMP5がチロシンリン酸化されることも明らかになり、BDNF-TrkBシグナルがCRMP5に伝わり、プルキンエ細胞の樹状突起の形態の制御に関与する可能性が示唆されている[5][26]。
CRMPと神経疾患
中枢神経系では、特定領域の神経変性がアルツハイマー病やパーキンソン病などの神経変性疾患の発症に重要な役割を果たしている。これまでの研究により、CRMP2がアルツハイマー病の発症に関与している可能性が示唆されている。3F4と呼ばれる抗リン酸化CRMP2抗体が、粗精製した過剰にリン酸化されたタウの集合体(神経原線維変化)と反応することが報告された[27]。この抗体はCdk5やGSK3-betaによりリン酸化されたCRMP2を認識することから、CRMP2のリン酸化がアルツハイマー病の原因因子の一つである可能性がある[28]。さらに、リン酸化CRMP2がアルツハイマー病の脳やアルツハイマー病の疾患モデルマウスにおいて増加することが確認されている[29]。また、アルツハイマー病の海馬CA1領域においてSema3A陽性神経細胞の数が増加することが報告されていることから[30]、アルツハイマー病の脳において、増加したSema3Aのシグナル伝達によりCRMP2のリン酸化が促進される可能性が考えられる。近年、アルツハイマー病以外に、CRMPsが統合失調症の発症にも関与することが示唆されており[5]、これらの病態解明や治療法の開発を含め、さらなる研究が期待される。
参考文献
- ↑
Goshima, Y., Nakamura, F., Strittmatter, P., & Strittmatter, S.M. (1995).
Collapsin-induced growth cone collapse mediated by an intracellular protein related to UNC-33. Nature, 376(6540), 509-14. [PubMed:7637782] [WorldCat] [DOI] - ↑ 2.0 2.1 2.2 2.3 2.4 2.5
Charrier, E., Reibel, S., Rogemond, V., Aguera, M., Thomasset, N., & Honnorat, J. (2003).
Collapsin response mediator proteins (CRMPs): involvement in nervous system development and adult neurodegenerative disorders. Molecular neurobiology, 28(1), 51-64. [PubMed:14514985] [WorldCat] [DOI] - ↑
Li, W., Herman, R.K., & Shaw, J.E. (1992).
Analysis of the Caenorhabditis elegans axonal guidance and outgrowth gene unc-33. Genetics, 132(3), 675-89. [PubMed:1468626] [PMC] [WorldCat] - ↑ 4.0 4.1 4.2 4.3 4.4
Arimura, N., & Kaibuchi, K. (2007).
Neuronal polarity: from extracellular signals to intracellular mechanisms. Nature reviews. Neuroscience, 8(3), 194-205. [PubMed:17311006] [WorldCat] [DOI] - ↑ 5.0 5.1 5.2 5.3 5.4 5.5 5.6
Yamashita, N., & Goshima, Y. (2012).
Collapsin response mediator proteins regulate neuronal development and plasticity by switching their phosphorylation status. Molecular neurobiology, 45(2), 234-46. [PubMed:22351471] [WorldCat] [DOI] - ↑ 6.0 6.1 6.2 6.3 6.4 6.5 6.6
Wang, L.H., & Strittmatter, S.M. (1996).
A family of rat CRMP genes is differentially expressed in the nervous system. The Journal of neuroscience : the official journal of the Society for Neuroscience, 16(19), 6197-207. [PubMed:8815901] [WorldCat] - ↑
Ricard, D., Rogemond, V., Charrier, E., Aguera, M., Bagnard, D., Belin, M.F., ..., & Honnorat, J. (2001).
Isolation and expression pattern of human Unc-33-like phosphoprotein 6/collapsin response mediator protein 5 (Ulip6/CRMP5): coexistence with Ulip2/CRMP2 in Sema3a- sensitive oligodendrocytes. The Journal of neuroscience : the official journal of the Society for Neuroscience, 21(18), 7203-14. [PubMed:11549731] [PMC] [WorldCat] - ↑
Nacher, J., Rosell, D.R., & McEwen, B.S. (2000).
Widespread expression of rat collapsin response-mediated protein 4 in the telencephalon and other areas of the adult rat central nervous system. The Journal of comparative neurology, 424(4), 628-39. [PubMed:10931485] [WorldCat] [DOI] - ↑ 9.0 9.1
Yamashita, N., Uchida, Y., Ohshima, T., Hirai, S., Nakamura, F., Taniguchi, M., ..., & Goshima, Y. (2006).
Collapsin response mediator protein 1 mediates reelin signaling in cortical neuronal migration. The Journal of neuroscience : the official journal of the Society for Neuroscience, 26(51), 13357-62. [PubMed:17182786] [PMC] [WorldCat] [DOI] - ↑
Yamashita, N., Morita, A., Uchida, Y., Nakamura, F., Usui, H., Ohshima, T., ..., & Goshima, Y. (2007).
Regulation of spine development by semaphorin3A through cyclin-dependent kinase 5 phosphorylation of collapsin response mediator protein 1. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(46), 12546-54. [PubMed:18003833] [PMC] [WorldCat] [DOI] - ↑ 11.0 11.1
Hensley, K., Venkova, K., Christov, A., Gunning, W., & Park, J. (2011).
Collapsin response mediator protein-2: an emerging pathologic feature and therapeutic target for neurodisease indications. Molecular neurobiology, 43(3), 180-91. [PubMed:21271304] [WorldCat] [DOI] - ↑ 12.0 12.1 12.2
Inagaki, N., Chihara, K., Arimura, N., Ménager, C., Kawano, Y., Matsuo, N., ..., & Kaibuchi, K. (2001).
CRMP-2 induces axons in cultured hippocampal neurons. Nature neuroscience, 4(8), 781-2. [PubMed:11477421] [WorldCat] [DOI] - ↑
Fukata, Y., Itoh, T.J., Kimura, T., Ménager, C., Nishimura, T., Shiromizu, T., ..., & Kaibuchi, K. (2002).
CRMP-2 binds to tubulin heterodimers to promote microtubule assembly. Nature cell biology, 4(8), 583-91. [PubMed:12134159] [WorldCat] [DOI] - ↑ 14.0 14.1 14.2
Yoshimura, T., Kawano, Y., Arimura, N., Kawabata, S., Kikuchi, A., & Kaibuchi, K. (2005).
GSK-3beta regulates phosphorylation of CRMP-2 and neuronal polarity. Cell, 120(1), 137-49. [PubMed:15652488] [WorldCat] [DOI] - ↑
Nishimura, T., Fukata, Y., Kato, K., Yamaguchi, T., Matsuura, Y., Kamiguchi, H., & Kaibuchi, K. (2003).
CRMP-2 regulates polarized Numb-mediated endocytosis for axon growth. Nature cell biology, 5(9), 819-26. [PubMed:12942088] [WorldCat] [DOI] - ↑ 有村奈利子、木村俊秀、藤井佳代、貝淵弘三
RhoキナーゼによるCRMP-2のリン酸化とその活性制御について
脳21:2004 - ↑
Arimura, N., & Kaibuchi, K. (2005).
Key regulators in neuronal polarity. Neuron, 48(6), 881-4. [PubMed:16364893] [WorldCat] [DOI] - ↑
Kawano, Y., Yoshimura, T., Tsuboi, D., Kawabata, S., Kaneko-Kawano, T., Shirataki, H., ..., & Kaibuchi, K. (2005).
CRMP-2 is involved in kinesin-1-dependent transport of the Sra-1/WAVE1 complex and axon formation. Molecular and cellular biology, 25(22), 9920-35. [PubMed:16260607] [PMC] [WorldCat] [DOI] - ↑
Arimura, N., Kimura, T., Nakamuta, S., Taya, S., Funahashi, Y., Hattori, A., ..., & Kaibuchi, K. (2009).
Anterograde transport of TrkB in axons is mediated by direct interaction with Slp1 and Rab27. Developmental cell, 16(5), 675-86. [PubMed:19460344] [WorldCat] [DOI] - ↑
Brittain, J.M., Piekarz, A.D., Wang, Y., Kondo, T., Cummins, T.R., & Khanna, R. (2009).
An atypical role for collapsin response mediator protein 2 (CRMP-2) in neurotransmitter release via interaction with presynaptic voltage-gated calcium channels. The Journal of biological chemistry, 284(45), 31375-90. [PubMed:19755421] [PMC] [WorldCat] [DOI] - ↑ 21.0 21.1
Quach, T.T., Massicotte, G., Belin, M.F., Honnorat, J., Glasper, E.R., Devries, A.C., ..., & Kolattukudy, P.E. (2008).
CRMP3 is required for hippocampal CA1 dendritic organization and plasticity. FASEB journal : official publication of the Federation of American Societies for Experimental Biology, 22(2), 401-9. [PubMed:17785607] [PMC] [WorldCat] [DOI] - ↑
Aylsworth, A., Jiang, S.X., Desbois, A., & Hou, S.T. (2009).
Characterization of the role of full-length CRMP3 and its calpain-cleaved product in inhibiting microtubule polymerization and neurite outgrowth. Experimental cell research, 315(16), 2856-68. [PubMed:19559021] [WorldCat] [DOI] - ↑ 23.0 23.1 23.2 23.3
Niisato, E., Nagai, J., Yamashita, N., Abe, T., Kiyonari, H., Goshima, Y., & Ohshima, T. (2012).
CRMP4 suppresses apical dendrite bifurcation of CA1 pyramidal neurons in the mouse hippocampus. Developmental neurobiology, 72(11), 1447-57. [PubMed:22234963] [WorldCat] [DOI] - ↑
Hotta, A., Inatome, R., Yuasa-Kawada, J., Qin, Q., Yamamura, H., & Yanagi, S. (2005).
Critical role of collapsin response mediator protein-associated molecule CRAM for filopodia and growth cone development in neurons. Molecular biology of the cell, 16(1), 32-9. [PubMed:15509652] [PMC] [WorldCat] [DOI] - ↑ 25.0 25.1 25.2
Brot, S., Rogemond, V., Perrot, V., Chounlamountri, N., Auger, C., Honnorat, J., & Moradi-Améli, M. (2010).
CRMP5 interacts with tubulin to inhibit neurite outgrowth, thereby modulating the function of CRMP2. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(32), 10639-54. [PubMed:20702696] [PMC] [WorldCat] [DOI] - ↑ 26.0 26.1 26.2
Yamashita, N., Mosinger, B., Roy, A., Miyazaki, M., Ugajin, K., Nakamura, F., ..., & Goshima, Y. (2011).
CRMP5 (collapsin response mediator protein 5) regulates dendritic development and synaptic plasticity in the cerebellar Purkinje cells. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(5), 1773-9. [PubMed:21289187] [PMC] [WorldCat] [DOI] - ↑
Yoshida, H., Watanabe, A., & Ihara, Y. (1998).
Collapsin response mediator protein-2 is associated with neurofibrillary tangles in Alzheimer's disease. The Journal of biological chemistry, 273(16), 9761-8. [PubMed:9545313] [WorldCat] [DOI] - ↑
Gu, Y., Hamajima, N., & Ihara, Y. (2000).
Neurofibrillary tangle-associated collapsin response mediator protein-2 (CRMP-2) is highly phosphorylated on Thr-509, Ser-518, and Ser-522. Biochemistry, 39(15), 4267-75. [PubMed:10757975] [WorldCat] [DOI] - ↑
Cole, A.R., Noble, W., van Aalten, L., Plattner, F., Meimaridou, R., Hogan, D., ..., & Sutherland, C. (2007).
Collapsin response mediator protein-2 hyperphosphorylation is an early event in Alzheimer's disease progression. Journal of neurochemistry, 103(3), 1132-44. [PubMed:17683481] [WorldCat] [DOI] - ↑
Good, P.F., Alapat, D., Hsu, A., Chu, C., Perl, D., Wen, X., ..., & Kohtz, D.S. (2004).
A role for semaphorin 3A signaling in the degeneration of hippocampal neurons during Alzheimer's disease. Journal of neurochemistry, 91(3), 716-36. [PubMed:15485501] [WorldCat] [DOI]
(執筆者:久保祐亮、稲垣直之 担当編集委員:大隅典子)