「GSK-3β」の版間の差分
タグ: 巻き戻し |
細 →活性調節 |
||
| (4人の利用者による、間の18版が非表示) | |||
| 1行目: | 1行目: | ||
{{PBB|geneid=2932}} | {{PBB|geneid=2932}} | ||
グリコーゲン合成酵素キナーゼ3(Glycogen synthase kinase 3; GSK-3)は、[[wikipedia:ja:プロリン|プロリン]]指向性セリン/スレオニン[[タンパク質リン酸化酵素|リン酸化酵素]]のひとつであり、最初に[[wikipedia:ja:グリコーゲン合成酵素|グリコーゲン合成酵素]]を[[リン酸化]]して不活化する酵素として見出された。そのうちGSK-3βは、[[Wnt]], [[Shh]]などの[[シグナル伝達]]の制御に関与しており、[[wikipedia:ja:胚発生|胚発生]]における[[体軸形成]]や神経系の[[分化]]に重要な役割を果たしている<ref name=ref3><pubmed>1333807</pubmed></ref>。 | |||
==ファミリー== | ==ファミリー== | ||
プロリン哺乳類では、GSK-3は51 kDaのα (GSK-3α)と47kDaのβ(GSK-3β)の二つのアイソフォームに分類される<ref name=ref1><pubmed>7980435</pubmed></ref>。これらの2つのアイソフォームは、キナーゼドメイン内では98%と高い相同性を示すが、76個のC末アミノ酸残基では36%の相同性しかない。GSK-3βには、プロリンスプライシング変異体;GSK-3β2が存在する。GSK-3β2の量はGSK-3β全体の15%以下であり、GSK-3βのキナーゼドメイン内に13アミノ酸残基の挿入を認める。 | |||
GSK-3β2は、[[tauタンパク質]]に対するキナーゼ活性がGSK-3βよりも減弱している<ref name=ref2><pubmed>19607922</pubmed></ref>。 | GSK-3β2は、[[tauタンパク質]]に対するキナーゼ活性がGSK-3βよりも減弱している<ref name=ref2><pubmed>19607922</pubmed></ref>。 | ||
| 21行目: | 10行目: | ||
==構造== | ==構造== | ||
(編集コメント:ドメイン構造等についての御記述を御願い致します) | |||
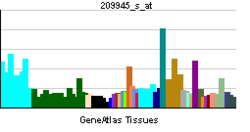
==発現== | |||
[http://mouse.brain-map.org/experiment/show/68269508 GSK-3β]は | |||
(編集コメント:組織発現パタンに関する御記述を御願い出来ればと思います) | |||
(編集コメント:細胞内発現パタンに関する御記述を御願い出来ればと思います) | |||
GSK-3β2は[[細胞体]]に認められる。 | |||
[[ | |||
==活性調節== | |||
===Aktによるリン酸化による調節=== | ===Aktによるリン酸化による調節=== | ||
GSK-3βは、細胞が静止状態にあるときには活性型である。細胞が[[インスリン]]などの物質で処理をされると、GSK-3βは[[ホスファチジルイノシトール#ホスファチジルイノシトール3キナーゼとPI3キナーゼシグナル伝達経路|ホスファチジルイノシトール‐3キナーゼ]](PI-3K)の関与で不活化される。つまり、インスリンなどで処理された細胞の内部ではPI-3K-[[Akt]]経路が活性化し、その結果GSK-3βの[[wikipedia:ja:セリン|セリン]]9のリン酸化が起こり不活性型となる<ref name=ref4><pubmed>11440715</pubmed></ref>。 | |||
===基質のプライミングリン酸化による調節=== | |||
GSK-3βの基質は、本来のリン酸化部位のC末に位置する"priming"残基が先にリン酸化(priming phosphorylation)を受けている方が効率よくリン酸化できる。GSK-3βのactivation loop (T-loop)に位置する[[wikipedia:ja:スレオニン|スレオニン]]216のリン酸化により基質結合部位が開き、[[wikipedia:ja:アルギニン|アルギニン]]96, アルギニン180, [[wikipedia:ja:リシン|リシン]]205からなるpositively charged pocketにリン酸化された基質の"priming"残基が結合する。この結合によってキナーゼドメインの方向が最適化され、基質がGSK-3βのcatalytic grooveの適切な位置にはまりリン酸化をうける<ref name=ref4 /> 。 | |||
GSK-3βは、細胞が静止状態にあるときには活性型である。細胞が[[ | |||
[[ | |||
==機能== | ==機能== | ||
| 57行目: | 31行目: | ||
=== Wntシグナル経路 === | === Wntシグナル経路 === | ||
Wntの非存在下では、GSK-3βは[[β-カテニン]]、[[Axin]]や[[ | Wntの非存在下では、GSK-3βは[[β-カテニン]]、[[Axin]]や[[がん抑制遺伝子]]産物[[APC]], [[カゼインキナーゼ]]1αと複合体を形成しており、この複合体内でカゼインキナーゼ1αとともに効率よくβ-カテニンをリン酸化する。リン酸化されたβ-カテニンは[[ユビキチン化]]を受け、[[プロテオソーム]]内で分解される。Wntが7回膜貫通型受容体の[[Frizzled]](Fz)と1回膜貫通型受容体の[[LRP5]]/[[LRP6|6]]に結合すると、そのシグナルが細胞内に伝達され[[Dishevelled]]がGSK-3β依存性のβ-カテニンのリン酸化を抑制する。低リン酸化状態のβ-カテニンはプロテオソーム内での分解を免れ、細胞質内に蓄積して[[核]]へ移行しWnt-β-カテニン経路下流の遺伝子発現を調節する<ref name=ref5><pubmed>20648061</pubmed></ref>。 | ||
=== Shhシグナル経路 === | === Shhシグナル経路 === | ||
| 63行目: | 37行目: | ||
GSK-3βは[[ヘッジホッグ]]シグナルでも重要な役割を果たしている。ヘッジホッグシグナルは[[ショウジョウバエ]]から[[wikipedia:ja:哺乳類|哺乳類]]にいたる様々な生物に見られるシグナル伝達経路である<ref name=ref6><pubmed>7916661</pubmed></ref>。 | GSK-3βは[[ヘッジホッグ]]シグナルでも重要な役割を果たしている。ヘッジホッグシグナルは[[ショウジョウバエ]]から[[wikipedia:ja:哺乳類|哺乳類]]にいたる様々な生物に見られるシグナル伝達経路である<ref name=ref6><pubmed>7916661</pubmed></ref>。 | ||
ヘッジホッグシグナルは、シグナル[[受容体]]である[[Patched]] (Ptc) とシグナルトランスデューサーである[[Smoothened]] (Smo) によって調節されている。ヘッジホッグタンパクが存在しない時、PtcがSmoの活性化を抑制している。この状態では、ヘッジホッグシグナル下流分子である[[Cubitus interruptus]] (Ci) は、GSK-3β-[[サイクリン依存性キナーゼ阻害因子]] (CKI)-[[プロテインキナーゼA]] (PKA) 複合体にリン酸化され、プロセッシングを受け抑制型になる。ヘッジホッグタンパクがPtcと結合すると、GSK-3βを含む複合体からCiが解離しリン酸化を受けていない活性型の状態で核に移行、ヘッジホッグシグナル下流分子の[[wikipedia:ja:転写|転写]]活性を上昇させる<ref name=ref7><pubmed>11955435</pubmed></ref> <ref name=ref8><pubmed>16386907</pubmed></ref>。 | |||
ヘッジホッグの[[wikipedia:ja:脊椎動物|脊椎動物]]ホモログの一つである[[ソニックヘッジホッグ]]は、哺乳類の神経系も含めた胚発生に大事な役目を果たしている。脊椎動物では、[[Gli1]], [[Gli2]], [[Gli3]]という3種類のCiホモログが存在している。Gli1は活性型のみで、Gli2とGli3は活性型と不活性型の2つの形態をとる。脊椎動物では、GSK-3βは[[Supressor of Fused]] ( | ヘッジホッグの[[wikipedia:ja:脊椎動物|脊椎動物]]ホモログの一つである[[ソニックヘッジホッグ]]は、哺乳類の神経系も含めた胚発生に大事な役目を果たしている。脊椎動物では、[[Gli1]], [[Gli2]], [[Gli3]]という3種類のCiホモログが存在している。Gli1は活性型のみで、Gli2とGli3は活性型と不活性型の2つの形態をとる。脊椎動物では、GSK-3βは[[Supressor of Fused]] (Sufu) と複合体を形成している。ソニックヘッジホッグが存在しない時、Gli2またはGli3はGSK-3βによってリン酸化を受けprimary ciliumでプロセスシングをうけ抑制型になる。Gli2の抑制型はプロテオソームで速やかに分解されるが、Gli3の抑制型は核に移行しソニックヘッジホッグシグナル下流の転写因子の発現を抑制する。ソニックヘッジホッグが存在するときは、Gli2またはGli3はGSK-3β-Sufu複合体と解離し核に移行する。核に移行したGli2は、ソニックヘッジホッグシグナル下流の転写因子の発現を促進する。Gli3では活性型ではなく抑制型がソニックヘッジホッグシグナル下流の因子の転写調節をになっている<ref name=ref9><pubmed>21317289</pubmed></ref>。 | ||
=== PI3キナーゼ/Akt/GSK-3β/CRMP-2シグナル経路 === | === PI3キナーゼ/Akt/GSK-3β/CRMP-2シグナル経路 === | ||
[[CRMP|CRMP-2]] (Collapsin response mediating protein-2) は神経[[軸索]]形成を誘導する因子として、神経細胞の[[ | [[CRMP|CRMP-2]] (Collapsin response mediating protein-2) は神経[[軸索]]形成を誘導する因子として、神経細胞の[[極性]]決定に重要な役割を担っている<ref name=ref10><pubmed>12134159</pubmed></ref>。CRMP-2は[[微小管]]の構成分子である[[チューブリン]]等と結合して微小管の重合を促進するとともに、軸索形成に必要なタンパク質の輸送や接着分子のリサイクリングにも関与し軸索伸長を制御している<ref name=ref11><pubmed>11477421</pubmed></ref>。 | ||
PI3キナーゼはAktを介してGSK-3βを制御している。GSK-3βがCRMP-2のスレオニン154をリン酸化すると、CRMP-2は不活性化しチューブリンとの結合能が低下し神経軸索形成が抑制される<ref name=ref12><pubmed>15652488</pubmed></ref>。 | PI3キナーゼはAktを介してGSK-3βを制御している。GSK-3βがCRMP-2のスレオニン154をリン酸化すると、CRMP-2は不活性化しチューブリンとの結合能が低下し神経軸索形成が抑制される<ref name=ref12><pubmed>15652488</pubmed></ref>。 | ||
| 83行目: | 57行目: | ||
<references /> | <references /> | ||
(執筆者:河野利恵、太田訓正 担当編集委員:大隅典子) | |||
2012年10月10日 (水) 23:34時点における版
グリコーゲン合成酵素キナーゼ3(Glycogen synthase kinase 3; GSK-3)は、プロリン指向性セリン/スレオニンリン酸化酵素のひとつであり、最初にグリコーゲン合成酵素をリン酸化して不活化する酵素として見出された。そのうちGSK-3βは、Wnt, Shhなどのシグナル伝達の制御に関与しており、胚発生における体軸形成や神経系の分化に重要な役割を果たしている[1]。
ファミリー
プロリン哺乳類では、GSK-3は51 kDaのα (GSK-3α)と47kDaのβ(GSK-3β)の二つのアイソフォームに分類される[2]。これらの2つのアイソフォームは、キナーゼドメイン内では98%と高い相同性を示すが、76個のC末アミノ酸残基では36%の相同性しかない。GSK-3βには、プロリンスプライシング変異体;GSK-3β2が存在する。GSK-3β2の量はGSK-3β全体の15%以下であり、GSK-3βのキナーゼドメイン内に13アミノ酸残基の挿入を認める。
GSK-3β2は、tauタンパク質に対するキナーゼ活性がGSK-3βよりも減弱している[3]。
構造
(編集コメント:ドメイン構造等についての御記述を御願い致します)
発現
(編集コメント:組織発現パタンに関する御記述を御願い出来ればと思います)
(編集コメント:細胞内発現パタンに関する御記述を御願い出来ればと思います) GSK-3β2は細胞体に認められる。
活性調節
Aktによるリン酸化による調節
GSK-3βは、細胞が静止状態にあるときには活性型である。細胞がインスリンなどの物質で処理をされると、GSK-3βはホスファチジルイノシトール‐3キナーゼ(PI-3K)の関与で不活化される。つまり、インスリンなどで処理された細胞の内部ではPI-3K-Akt経路が活性化し、その結果GSK-3βのセリン9のリン酸化が起こり不活性型となる[4]。
基質のプライミングリン酸化による調節
GSK-3βの基質は、本来のリン酸化部位のC末に位置する"priming"残基が先にリン酸化(priming phosphorylation)を受けている方が効率よくリン酸化できる。GSK-3βのactivation loop (T-loop)に位置するスレオニン216のリン酸化により基質結合部位が開き、アルギニン96, アルギニン180, リシン205からなるpositively charged pocketにリン酸化された基質の"priming"残基が結合する。この結合によってキナーゼドメインの方向が最適化され、基質がGSK-3βのcatalytic grooveの適切な位置にはまりリン酸化をうける[4] 。
機能
Wntシグナル経路
Wntの非存在下では、GSK-3βはβ-カテニン、Axinやがん抑制遺伝子産物APC, カゼインキナーゼ1αと複合体を形成しており、この複合体内でカゼインキナーゼ1αとともに効率よくβ-カテニンをリン酸化する。リン酸化されたβ-カテニンはユビキチン化を受け、プロテオソーム内で分解される。Wntが7回膜貫通型受容体のFrizzled(Fz)と1回膜貫通型受容体のLRP5/6に結合すると、そのシグナルが細胞内に伝達されDishevelledがGSK-3β依存性のβ-カテニンのリン酸化を抑制する。低リン酸化状態のβ-カテニンはプロテオソーム内での分解を免れ、細胞質内に蓄積して核へ移行しWnt-β-カテニン経路下流の遺伝子発現を調節する[5]。
Shhシグナル経路
GSK-3βはヘッジホッグシグナルでも重要な役割を果たしている。ヘッジホッグシグナルはショウジョウバエから哺乳類にいたる様々な生物に見られるシグナル伝達経路である[6]。
ヘッジホッグシグナルは、シグナル受容体であるPatched (Ptc) とシグナルトランスデューサーであるSmoothened (Smo) によって調節されている。ヘッジホッグタンパクが存在しない時、PtcがSmoの活性化を抑制している。この状態では、ヘッジホッグシグナル下流分子であるCubitus interruptus (Ci) は、GSK-3β-サイクリン依存性キナーゼ阻害因子 (CKI)-プロテインキナーゼA (PKA) 複合体にリン酸化され、プロセッシングを受け抑制型になる。ヘッジホッグタンパクがPtcと結合すると、GSK-3βを含む複合体からCiが解離しリン酸化を受けていない活性型の状態で核に移行、ヘッジホッグシグナル下流分子の転写活性を上昇させる[7] [8]。
ヘッジホッグの脊椎動物ホモログの一つであるソニックヘッジホッグは、哺乳類の神経系も含めた胚発生に大事な役目を果たしている。脊椎動物では、Gli1, Gli2, Gli3という3種類のCiホモログが存在している。Gli1は活性型のみで、Gli2とGli3は活性型と不活性型の2つの形態をとる。脊椎動物では、GSK-3βはSupressor of Fused (Sufu) と複合体を形成している。ソニックヘッジホッグが存在しない時、Gli2またはGli3はGSK-3βによってリン酸化を受けprimary ciliumでプロセスシングをうけ抑制型になる。Gli2の抑制型はプロテオソームで速やかに分解されるが、Gli3の抑制型は核に移行しソニックヘッジホッグシグナル下流の転写因子の発現を抑制する。ソニックヘッジホッグが存在するときは、Gli2またはGli3はGSK-3β-Sufu複合体と解離し核に移行する。核に移行したGli2は、ソニックヘッジホッグシグナル下流の転写因子の発現を促進する。Gli3では活性型ではなく抑制型がソニックヘッジホッグシグナル下流の因子の転写調節をになっている[9]。
PI3キナーゼ/Akt/GSK-3β/CRMP-2シグナル経路
CRMP-2 (Collapsin response mediating protein-2) は神経軸索形成を誘導する因子として、神経細胞の極性決定に重要な役割を担っている[10]。CRMP-2は微小管の構成分子であるチューブリン等と結合して微小管の重合を促進するとともに、軸索形成に必要なタンパク質の輸送や接着分子のリサイクリングにも関与し軸索伸長を制御している[11]。
PI3キナーゼはAktを介してGSK-3βを制御している。GSK-3βがCRMP-2のスレオニン154をリン酸化すると、CRMP-2は不活性化しチューブリンとの結合能が低下し神経軸索形成が抑制される[12]。
関連項目
参考文献
- ↑
Plyte, S.E., Hughes, K., Nikolakaki, E., Pulverer, B.J., & Woodgett, J.R. (1992).
Glycogen synthase kinase-3: functions in oncogenesis and development. Biochimica et biophysica acta, 1114(2-3), 147-62. [PubMed:1333807] [WorldCat] [DOI] - ↑
Stambolic, V., & Woodgett, J.R. (1994).
Mitogen inactivation of glycogen synthase kinase-3 beta in intact cells via serine 9 phosphorylation. The Biochemical journal, 303 ( Pt 3), 701-4. [PubMed:7980435] [PMC] [WorldCat] [DOI] - ↑
Wood-Kaczmar, A., Kraus, M., Ishiguro, K., Philpott, K.L., & Gordon-Weeks, P.R. (2009).
An alternatively spliced form of glycogen synthase kinase-3beta is targeted to growing neurites and growth cones. Molecular and cellular neurosciences, 42(3), 184-94. [PubMed:19607922] [WorldCat] [DOI] - ↑ 4.0 4.1
Dajani, R., Fraser, E., Roe, S.M., Young, N., Good, V., Dale, T.C., & Pearl, L.H. (2001).
Crystal structure of glycogen synthase kinase 3 beta: structural basis for phosphate-primed substrate specificity and autoinhibition. Cell, 105(6), 721-32. [PubMed:11440715] [WorldCat] [DOI] - ↑
Hur, E.M., & Zhou, F.Q. (2010).
GSK3 signalling in neural development. Nature reviews. Neuroscience, 11(8), 539-51. [PubMed:20648061] [PMC] [WorldCat] [DOI] - ↑
Echelard, Y., Epstein, D.J., St-Jacques, B., Shen, L., Mohler, J., McMahon, J.A., & McMahon, A.P. (1993).
Sonic hedgehog, a member of a family of putative signaling molecules, is implicated in the regulation of CNS polarity. Cell, 75(7), 1417-30. [PubMed:7916661] [WorldCat] [DOI] - ↑
Price, M.A., & Kalderon, D. (2002).
Proteolysis of the Hedgehog signaling effector Cubitus interruptus requires phosphorylation by Glycogen Synthase Kinase 3 and Casein Kinase 1. Cell, 108(6), 823-35. [PubMed:11955435] [WorldCat] [DOI] - ↑
Smelkinson, M.G., & Kalderon, D. (2006).
Processing of the Drosophila hedgehog signaling effector Ci-155 to the repressor Ci-75 is mediated by direct binding to the SCF component Slimb. Current biology : CB, 16(1), 110-6. [PubMed:16386907] [WorldCat] [DOI] - ↑
Chen, Y., Yue, S., Xie, L., Pu, X.H., Jin, T., & Cheng, S.Y. (2011).
Dual Phosphorylation of suppressor of fused (Sufu) by PKA and GSK3beta regulates its stability and localization in the primary cilium. The Journal of biological chemistry, 286(15), 13502-11. [PubMed:21317289] [PMC] [WorldCat] [DOI] - ↑
Fukata, Y., Itoh, T.J., Kimura, T., Ménager, C., Nishimura, T., Shiromizu, T., ..., & Kaibuchi, K. (2002).
CRMP-2 binds to tubulin heterodimers to promote microtubule assembly. Nature cell biology, 4(8), 583-91. [PubMed:12134159] [WorldCat] [DOI] - ↑
Inagaki, N., Chihara, K., Arimura, N., Ménager, C., Kawano, Y., Matsuo, N., ..., & Kaibuchi, K. (2001).
CRMP-2 induces axons in cultured hippocampal neurons. Nature neuroscience, 4(8), 781-2. [PubMed:11477421] [WorldCat] [DOI] - ↑
Yoshimura, T., Kawano, Y., Arimura, N., Kawabata, S., Kikuchi, A., & Kaibuchi, K. (2005).
GSK-3beta regulates phosphorylation of CRMP-2 and neuronal polarity. Cell, 120(1), 137-49. [PubMed:15652488] [WorldCat] [DOI]
(執筆者:河野利恵、太田訓正 担当編集委員:大隅典子)