「ステロイド」の版間の差分
細 →関連項目 |
細 →作用機序 |
||
| (3人の利用者による、間の21版が非表示) | |||
| 1行目: | 1行目: | ||
英語名:steroid 独:Steroide 仏:stéroïdes | 英語名:steroid 独:Steroide 仏:stéroïdes | ||
ステロイドとは、分子中にステロイド核と称する骨格構造をもつ一連の有機化合物の総称である。ほとんどの動植物で生合成され、コレステロール、胆汁酸、ビタミンD、ステロイドホルモン等がその代表例である。 | ステロイドとは、分子中にステロイド核と称する骨格構造をもつ一連の有機化合物の総称である。ほとんどの動植物で生合成され、コレステロール、胆汁酸、ビタミンD、ステロイドホルモン等がその代表例である。 | ||
[[Image:Steroid structure.png|thumb|right|300px|'''図1 ステロイド核の構造''']] | |||
==基本骨格== | ==基本骨格== | ||
ステロイド核とは、シクロペンタノペルヒドロフェナントレン核のことを指し、3つのイス型シクロヘキサン環と1つのシクロペンタン環がつながった構造を持つ<ref>'''G. P. Moss'''<br> Nomenclature of Steroids (Recommendations 1989)<br>''Pure & Appl. Chem.'':1989, 61(10);1783–1822</ref>。図1のように[[wikipedia:ja:構造式|構造式]]を書いた場合、それぞれの環を左下から順にA環、B環、C環、D環と呼ぶ。一部あるいはすべての炭素が水素化され、通常はC-10とC-13に[[wikipedia:ja:メチル基|メチル基]]を、また多くの場合C-17に[[wikipedia:ja:アルキル基|アルキル基]]を有する。生体物質としてのステロイドはC-3位が[[wikipedia:ja:ヒドロキシル基|ヒドロキシル化]]ヒドロキシル化もしくは[[wikipedia:ja:カルボニル基|カルボニル化]]された[[wikipedia:ja:ステロール|ステロール]]類である。 | ステロイド核とは、シクロペンタノペルヒドロフェナントレン核のことを指し、3つのイス型シクロヘキサン環と1つのシクロペンタン環がつながった構造を持つ<ref>'''G. P. Moss'''<br> Nomenclature of Steroids (Recommendations 1989)<br>''Pure & Appl. Chem.'':1989, 61(10);1783–1822</ref>。図1のように[[wikipedia:ja:構造式|構造式]]を書いた場合、それぞれの環を左下から順にA環、B環、C環、D環と呼ぶ。一部あるいはすべての炭素が水素化され、通常はC-10とC-13に[[wikipedia:ja:メチル基|メチル基]]を、また多くの場合C-17に[[wikipedia:ja:アルキル基|アルキル基]]を有する。生体物質としてのステロイドはC-3位が[[wikipedia:ja:ヒドロキシル基|ヒドロキシル化]]ヒドロキシル化もしくは[[wikipedia:ja:カルボニル基|カルボニル化]]された[[wikipedia:ja:ステロール|ステロール]]類である。 | ||
[[Image:Steroid synthesis.png|thumb|right|500px|''' | [[Image:Steroid synthesis.png|thumb|right|500px|'''図2 ステロイドホルモンの構造と生合成経路'''<br> | ||
P450 scc:コレステロール側鎖切断酵素(cholesterole side chain cleavage)<br> | P450 scc:コレステロール側鎖切断酵素(cholesterole side chain cleavage)<br> | ||
3β-HSD:3β-ヒドキシステロイド脱水素酵素・異性化酵素 (3β-hydroxysteroid dehydrogenase)<br> | 3β-HSD:3β-ヒドキシステロイド脱水素酵素・異性化酵素 (3β-hydroxysteroid dehydrogenase)<br> | ||
| 26行目: | 16行目: | ||
P450arom:アロマターゼ (aromatase) <br> | P450arom:アロマターゼ (aromatase) <br> | ||
17β-HSD: 17β-ヒドキシステロイド脱水素酵素 ]] | 17β-HSD: 17β-ヒドキシステロイド脱水素酵素 ]] | ||
==ステロイドホルモン== | ==ステロイドホルモン== | ||
ステロイド核をもつホルモンをステロイドホルモンと呼ぶ。[[ | ステロイド核をもつホルモンをステロイドホルモンと呼ぶ。[[wikipedia:ja:副腎|副腎]]、[[wikipedia:ja:精巣|精巣]]、[[wikipedia:ja:卵巣|卵巣]]等の[[wikipedia:ja:内分泌|内分泌]]器官より分泌される。特に脳で合成されるステロイドはニューロステロイドと呼ばれる。ステロイドホルモンの特徴は、脂溶性かつ分子量が低いために[[細胞膜]]や[[脳血液関門]]を容易に通過できること、また細胞質に存在する[[wikipedia:ja:ステロイドホルモン受容体|ステロイドホルモン受容体]]に結合し、核内にて標的遺伝子の[[wikipedia:ja:転写|転写]]活性を調節することである。近年、このような核受容体による遺伝子発現を介したステロイドホルモンのゲノミック作用に加え、膜受容体を介した遺伝子発現を伴わないノンゲノミック作用が注目されている<ref><pubmed>21357682</pubmed></ref>。 | ||
===生合成=== | ===生合成=== | ||
全てのステロイドホルモンはコレステロールより合成される(図2)<ref name="takemori" />。炭素数27のコレステロールは、コレステロール側鎖切断酵素(P450 scc)の作用により、側鎖(炭素数6)が切断されてプレグネノロン(炭素数21)となる。この過程はすべてのステロイドホルモン分泌器官で共通したプロセスである。最終的に、副腎では炭素数は21の[[糖質コルチコイド]]と[[鉱質コルチコイド]]が、また精巣では炭素数がさらに2個減少した[[アンドロゲン]](炭素数19)が、卵巣では炭素数が1個減少した[[エストロゲン]](炭素数18)が生成される。 | |||
表に挙げるものがステロイドホルモン合成酵素であり、これらのうち、3β-HSDと17β-HSD以外はシトクロムP450である。どの酵素も[[小胞体]]膜か[[ミトコンドリア]]内膜のどちらかに局在する。 | 表に挙げるものがステロイドホルモン合成酵素であり、これらのうち、3β-HSDと17β-HSD以外はシトクロムP450である。どの酵素も[[小胞体]]膜か[[ミトコンドリア]]内膜のどちらかに局在する。 | ||
| 42行目: | 31行目: | ||
| '''略称''' | | '''略称''' | ||
|- | |- | ||
| [[ | | [[wikipedia:ja:コレステロールモノオキシゲナーゼ (側鎖開裂)| コレステロール側鎖切断酵素]](cholesterole side chain cleavage) | ||
| P450 scc | | P450 scc | ||
|- | |- | ||
| [[ | | [[wikipedia:ja:3β-ヒドロキシ-Δ5-ステロイドデヒドロゲナーゼ|3β-ヒドキシステロイド脱水素酵素・異性化酵素]] (3β-hydroxysteroid dehydrogenase) | ||
| 3β-HSD | | 3β-HSD | ||
|- | |- | ||
| 51行目: | 40行目: | ||
| P450c17 | | P450c17 | ||
|- | |- | ||
| [[ | | [[wikipedia:ja:ステロイド-21-モノオキシゲナーゼ|21‐水酸化酵素]] (C21-hydroxylase) | ||
| P450c21 | | P450c21 | ||
|- | |- | ||
| 63行目: | 52行目: | ||
| P450arom | | P450arom | ||
|- | |- | ||
| [[ | | [[wikipedia:ja:3(or17)β-ヒドロキシステロイドデヒドロゲナーゼ|17β-ヒドキシステロイド脱水素酵素]] | ||
| 17β-HSD | | 17β-HSD | ||
|} | |} | ||
| 75行目: | 64行目: | ||
=====鉱質コルチコイド===== | =====鉱質コルチコイド===== | ||
アルドステロンは[[ | アルドステロンは[[wikipedia:ja:副腎皮質球状帯|副腎皮質球状帯]]で合成され、腎臓の[[wikipedia:ja:集合管|集合管]]に作用してナトリウムイオンの再吸収とカリウムイオンの排泄を促進する。ナトリウムイオンの再吸収によって[[wikipedia:ja:間質液|間質液]]の[[wikipedia:ja:浸透圧|浸透圧]]が上昇し水の再吸収も増加するため、体液量の調節にも重要な役割を果たす<ref name="ref1">坂井建雄、岡田隆夫<br>解剖生理学-人体の構造と機能-第7版3刷<br>医学書院:2007 </ref>。<br> | ||
=====糖質コルチコイド===== | =====糖質コルチコイド===== | ||
コルチゾール(コルチコステロン)は[[wikipedia:ja:副腎皮質束状帯|副腎皮質束状帯]]と[[wikipedia:ja:副腎皮質網状帯|副腎皮質網状帯]]にて合成され、その作用は[[wikipedia:ja:糖代謝|糖代謝]]の調節、抗[[wikipedia:ja:炎症|炎症]]作用、[[中枢神経系]]を介した[[情動]]や[[認知機能]]に対する作用、抗[[ストレス]]作用など多岐にわたる。糖代謝に関しては、[[wikipedia:ja:糖新生|糖新生]]を促進して[[wikipedia:ja:血糖|血糖]]値を上昇させる。抗炎症作用においては3つの作用機序が考えられている。まずは、[[リソソーム]]膜の安定化によりタンパク質分解酵素の遊出を防ぐことによる炎症部位拡大の防御、次に[[wikipedia:ja:肥満細胞|肥満細胞]]による[[wikipedia:ja:ヒスタミン|ヒスタミン]]の放出を防ぎ、[[wikipedia:ja:毛細血管|毛細血管]]の透過性上昇を抑えることによる[[wikipedia:ja:浮腫|浮腫]]の軽減、最後に[[プロスタグランジン]]の合成を抑制することによる抗[[体温調節の神経機構|発熱]]・[[鎮痛]]作用である<ref name="ref1" />。 | |||
====精巣ホルモン==== | ====精巣ホルモン==== | ||
精巣の[[ | 精巣の[[wikipedia:ja:ライディッヒ細胞|ライディッヒ細胞]]から分泌されるアンドロゲンは[[男性ホルモン]]とも呼ばれ、雄性化作用を持つホルモンの総称であり、また女性ホルモンのひとつ、[[エストロゲン]]の前駆体でもある。生体内の主たるアンドロゲンは[[テストステロン]]である。テストステロン以外にも[[アンドロステンジオン]]や[[ジヒドロテストステロン]]もアンドロゲン作用を持つ。 | ||
アンドロゲンはタンパク質同化作用を持ち、男性の[[ | アンドロゲンはタンパク質同化作用を持ち、男性の[[wikipedia:ja:二次性徴|二次性徴]]を促進するホルモンである。[[wikipedia:ja:骨格筋|骨格筋]]の発達促進に加え、体毛の発育促進、頭髪の減少、[[wikipedia:ja:皮脂腺|皮脂腺]]の発達、[[wikipedia:ja:精子|精子]]形成促進、[[wikipedia:ja:輸精管|輸精管]]・[[wikipedia:ja:前立腺|前立腺]]・[[wikipedia:ja:精嚢|精嚢]]・[[wikipedia:ja:カウパー腺|カウパー腺]]の維持等を担い、また、交尾等の[[生殖行動の神経回路|性行動]]もアンドロゲンによって促進される<ref name="ref1" />。 | ||
アンドロゲンは脳の[[性分化]]にも重要なホルモンである。「アンドロゲンシャワー」と呼ばれる、周生期動物の[[ | アンドロゲンは脳の[[性分化]]にも重要なホルモンである。「アンドロゲンシャワー」と呼ばれる、周生期動物の[[wikipedia:ja:精巣|精巣]]から分泌される高濃度のアンドロゲン作用によって脳の雄性化と脱雌性化が起こり、脳の性分化の方向が決められる<ref name="kondo">近藤保彦、小川園子、菊水健史、山田一夫、富原一哉<br>脳とホルモンの行動学<br>西村書店:2010 </ref>。例えば、雄ラットの精巣を生後直後に摘出すると成熟後に雌特有の性行動を引き起こし、また出生一週間頃までの雌ラットにアンドロゲンを投与すると性成熟後も性周期は回帰せず無排卵となる。脳がアンドロゲンに対して高い感受性を示す時期は「脳の性分化の臨界期」と呼ばれる<ref name="kondo" />。 | ||
テストステロンは、攻撃行動に深く関わるホルモンである。多くの動物種では、雌に比べて雄の攻撃性が高いことが知られ、また、精巣を除去するとテストステロンの減少と共に攻撃行動は低下するが、テストステロンの投与により攻撃行動の回復が見られる。 | テストステロンは、攻撃行動に深く関わるホルモンである。多くの動物種では、雌に比べて雄の攻撃性が高いことが知られ、また、精巣を除去するとテストステロンの減少と共に攻撃行動は低下するが、テストステロンの投与により攻撃行動の回復が見られる。 | ||
| 97行目: | 86行目: | ||
卵巣から分泌される女性ホルモンは、エストロゲン(卵胞ホルモン)と[[プロゲステロン]](黄体ホルモン)である。エストロゲンには、[[エストラジオール]]、[[エストロン]]、[[エストリオール]]の3種類が存在し、最も活性が高いのはエストラジオールである。<br> | 卵巣から分泌される女性ホルモンは、エストロゲン(卵胞ホルモン)と[[プロゲステロン]](黄体ホルモン)である。エストロゲンには、[[エストラジオール]]、[[エストロン]]、[[エストリオール]]の3種類が存在し、最も活性が高いのはエストラジオールである。<br> | ||
エストロゲンとプロゲステロンは、共同して[[ | エストロゲンとプロゲステロンは、共同して[[wikipedia:ja:子宮|子宮]]に[[wikipedia:ja:月経周期|月経周期]]をもたらすと共に、[[wikipedia:ja:思春期|思春期]]における二次性徴の発現に関与する。エストロゲンは、[[wikipedia:ja:卵胞期|卵胞期]]の[[wikipedia:ja:子宮内膜|子宮内膜]]を増殖や卵胞の成長を促進する。妊娠中は子宮筋を肥大させ、子宮筋の興奮性を高める。思春期には[[wikipedia:ja:乳腺|乳腺]]の[[wikipedia:ja:乳管|乳管]]の成長を促進して乳房を大きくするとともに、[[wikipedia:ja:皮下脂肪|皮下脂肪]]の蓄積・[[wikipedia:ja:生殖器|生殖器]]の発育など、一次性徴と二次性徴を発現させて女性らしい体型にする。さらに[[wikipedia:ja:骨端|骨端]]の閉鎖をおこさせ、思春期以後の身長の伸びを抑制する。また、女性の性欲を亢進させ、[[生殖行動の神経回路|発情行動]]を引き起こす。プロゲステロンは、[[wikipedia:ja:排卵|排卵]]後に形成される[[wikipedia:ja:黄体|黄体]]から分泌される。妊娠中は[[wikipedia:ja:胎盤|胎盤]]からも分泌される。プロゲステロンの効果はエストロゲンがあらかいじめ作用している状態で発揮されることが多く、子宮では、子宮内膜を分泌期にして受精卵が着床しやすい状態にする。妊娠中は子宮筋の興奮性を抑え、妊娠を継続させるように作用する。乳房に対しては、乳腺の腺房の発達を刺激する。体温上昇作用があり、排卵後の基礎体温を上昇させる<ref name="ref1" />。 | ||
エストロゲンは雌の性行動にも深く関与する。多くのげっ歯類では、[[生殖行動の神経回路|ロードーシス]]の発現は卵巣から分泌されるエストロゲンにより制御され、通常の性周期では、ロードーシス反射はエストロゲン分泌の高まる排卵前後でのみ起こる。また卵巣を摘出しても、通常のホルモン分泌パターンと類似させ、エストロゲンとプロゲステロンを連続的に投与すると雌はロードーシスを示す。エストロゲン受容体には[[ | エストロゲンは雌の性行動にも深く関与する。多くのげっ歯類では、[[生殖行動の神経回路|ロードーシス]]の発現は卵巣から分泌されるエストロゲンにより制御され、通常の性周期では、ロードーシス反射はエストロゲン分泌の高まる排卵前後でのみ起こる。また卵巣を摘出しても、通常のホルモン分泌パターンと類似させ、エストロゲンとプロゲステロンを連続的に投与すると雌はロードーシスを示す。エストロゲン受容体には[[wikipedia:ja:エストロゲン受容体#.E6.A0.B8.E5.86.85.E5.8F.97.E5.AE.B9.E4.BD.93|ERα]]と[[wikipedia:ja:エストロゲン受容体#.E6.A0.B8.E5.86.85.E5.8F.97.E5.AE.B9.E4.BD.93|ERβ]]の2種類が存在するが、ロードーシス反射に関与しているのは主にERαだと考えられている。ERα遺伝子を損傷したαERKOマウスの雌は、エストロゲンとプロゲステロンを投与しても全くロードーシスを示さない。一方ERβ遺伝子を欠損したERβKOマウスの雌は通常の性周期を示し、発情期には野生型の雌とほぼ同等のロードーシス反応を示す<ref><pubmed>10536018</pubmed></ref><ref><pubmed>9832446</pubmed></ref> 。<br> | ||
====ニューロステロイド==== | ====ニューロステロイド==== | ||
脳で合成されるステロイドをニューロステロイドと呼ぶ。ニューロステロイドの研究は、フランスの内分泌学者Baulieuが1981年にラットの脳にプレグネノロンと[[デヒドロエピアンドロステロン]](DHEA)を見出したことより始まり、現在では、[[ | 脳で合成されるステロイドをニューロステロイドと呼ぶ。ニューロステロイドの研究は、フランスの内分泌学者Baulieuが1981年にラットの脳にプレグネノロンと[[デヒドロエピアンドロステロン]](DHEA)を見出したことより始まり、現在では、[[wikipedia:ja:脊椎動物|脊椎動物]]のほとんどがニューロステロイドを合成していることが知られる<ref><pubmed>19505496 </pubmed></ref>。 | ||
ニューロステロイドは、[[ニューロン]]、[[アストロサイト]]、[[オリゴデンドロサイト]]のすべての細胞種で合成されるが、発現するステロイド合成酵素の種類は細胞間で違いが見られる<ref><pubmed>10433246</pubmed></ref>。アストロサイトでは、P450scc, P450c17, 3βHSD, 17βHSD, P450aromを発現し、プレグネノロン、プロゲステロン、デヒドロエピアンドロステンジオン、アンドロゲン、エストロゲンを合成している。ニューロンもほぼアストロサイトと同様の合成酵素発現を示すが、17βHSDを持たずテストステロン合成を行わない点でアストロサイトと異なる。オリゴデンドロサイトはP450sccと3βHSDを発現し、プレグネノロンとプロゲステロンを合成する。 | ニューロステロイドは、[[ニューロン]]、[[アストロサイト]]、[[オリゴデンドロサイト]]のすべての細胞種で合成されるが、発現するステロイド合成酵素の種類は細胞間で違いが見られる<ref><pubmed>10433246</pubmed></ref>。アストロサイトでは、P450scc, P450c17, 3βHSD, 17βHSD, P450aromを発現し、プレグネノロン、プロゲステロン、デヒドロエピアンドロステンジオン、アンドロゲン、エストロゲンを合成している。ニューロンもほぼアストロサイトと同様の合成酵素発現を示すが、17βHSDを持たずテストステロン合成を行わない点でアストロサイトと異なる。オリゴデンドロサイトはP450sccと3βHSDを発現し、プレグネノロンとプロゲステロンを合成する。 | ||
小脳プルキンエ細胞は、P450sccや3βHSD、[[ | 小脳プルキンエ細胞は、P450sccや3βHSD、[[wikipedia:ja:Steroid sulfotransferase|ステロイド硫酸基転移酵素]](HST)を発現しており、プレグネノロン、プレグネノロン硫酸エステル、プロゲステロン、[[プロゲステロン代謝ステロイド]](3α,5α-テトラハイドロプロゲステロン)を合成する<ref><pubmed> 10771104</pubmed></ref><ref><pubmed> 10373637</pubmed></ref>。 プロゲステロンは、新生児期の小脳において合成が活発となり、[[プルキンエ細胞]]の[[樹状突起]]伸長や[[スパイン]]形成を促進する<ref><pubmed>11487645</pubmed></ref> <ref><pubmed>11958856</pubmed></ref>。またプレグネノロン硫酸エステルは傍分泌により、プルキンエ細胞に投射する[[GABA]]ニューロンに作用し、GABAの[[放出頻度]]を増加させることが報告されている<ref><pubmed>10373637</pubmed></ref>。 | ||
[[Image:Cholesterol.png|thumb|right|300px|'''図3 コレステロールの構造''']] | |||
[[Image:Cholic and deoxycholic.png|thumb|right|300px|'''図4.コール酸とデオキシコール酸の構造''']] | |||
===受容体と標的遺伝子=== | ===受容体と標的遺伝子=== | ||
| 113行目: | 105行目: | ||
ステロイドホルモンの作用機序は大きく2つに分けられる。ひとつは[[核内受容体]]を介して標的遺伝子の発現調節を行うゲノミック作用であり、もうひとつは膜受容体を介した遺伝子発現調節を伴わず数分以内の速い作用が特徴のノンゲノミック作用である。 | ステロイドホルモンの作用機序は大きく2つに分けられる。ひとつは[[核内受容体]]を介して標的遺伝子の発現調節を行うゲノミック作用であり、もうひとつは膜受容体を介した遺伝子発現調節を伴わず数分以内の速い作用が特徴のノンゲノミック作用である。 | ||
核内受容体には、[[グルココルチコイド受容体]]([[GR]])、[[ミネラルコルチコイド受容体]]([[MR]])、[[ | 核内受容体には、[[グルココルチコイド受容体]]([[GR]])、[[ミネラルコルチコイド受容体]]([[MR]])、[[アンドゲン受容体]]([[AR]])、[[エストロゲン受容体]]([[ERα|ERα]]と[[ERβ|ERβ]])、[[プロゲステロン受容体]]([[PR]])があり、細胞質を通過したステロイドホルモンと複合体を形成して核へ移行し、標的遺伝子の[[ホルモン応答配列]]([[hormone response element]]: [[HRE]])に結合し転写調節を行う。しかし、これら核内受容体はゲノミック作用のみならず、細胞膜や細胞質にも存在することが確認されており、細胞質のセカンドメッセンジャー(PKA, PKC, MAPKや細胞内カルシウム等)に対してノンゲノミックな作用も有する。 | ||
また近年、[[Gタンパク質共役型受容体]]([[G protein-coupled receptor]]: [[GPCR]])もステロイドホルモンの膜受容体として注目されている。 | また近年、[[Gタンパク質共役型受容体]]([[G protein-coupled receptor]]: [[GPCR]])もステロイドホルモンの膜受容体として注目されている。 | ||
| 119行目: | 111行目: | ||
====エストロゲン受容体==== | ====エストロゲン受容体==== | ||
エストロゲン受容体にはERαとERβとがあり、これらは独立した遺伝子から産生される(スプライシングバリアントではない)。ER受容体はリガンドフリーの状態でも核内に存在するが、リガンドと結合すると二量体を形成して標的遺伝子の[[転写調節領域]]に結合する。ERは[[エストロゲン応答配列]] ([[estrogen response element]]: [[ERE]])に直接に結合する以外にも、[[AP-1]]やc[[yclic AMP応答エレメント]]([[cyclic AMP-responsive element]], [[CRE]])様配列にも間接的に作用し遺伝子発現を調節することが知られる。 | |||
ERの標的遺伝子としては[[プロラクチン]]、[[オボアルブミン]]、[[インスリン様成長因子-1]] ([[insulin-like growth factor-1]], [[IGF-1]])、プレセニリン-2 (trefoil factor 1, TFF-1/pS2)、[[カテプシン]]D、[[c-Myc]], [[cyclin D1]]等が知られる。エストロゲンによるプロラクチン遺伝子の発現調節はEREによるものであるが、オボアルブミンやIGF-1遺伝子の発現調節はAP-1によるものであることが報告されており、発現調節のメカニズムにおいては遺伝子ごとの詳細な解析が必要とされる。 | ERの標的遺伝子としては[[プロラクチン]]、[[オボアルブミン]]、[[インスリン様成長因子-1]] ([[insulin-like growth factor-1]], [[IGF-1]])、プレセニリン-2 (trefoil factor 1, TFF-1/pS2)、[[カテプシン]]D、[[c-Myc]], [[cyclin D1]]等が知られる。エストロゲンによるプロラクチン遺伝子の発現調節はEREによるものであるが、オボアルブミンやIGF-1遺伝子の発現調節はAP-1によるものであることが報告されており、発現調節のメカニズムにおいては遺伝子ごとの詳細な解析が必要とされる。 | ||
| 129行目: | 121行目: | ||
====アンドロゲン受容体==== | ====アンドロゲン受容体==== | ||
アンドロゲン受容体(AR)はGRなどと同様にリガンド非存在下では細胞質に存在し、リガンドと結合すると核へ移行し標的遺伝子の転写を調節する。ARの標的遺伝子には[[前立腺特異抗原]]([[prostate specific antigen]], [[PSA]])、[[線維芽細胞成長因子8]] ([[fibroblast growth factor 8]], [[FGF8]])、[[サイクリン依存性キナーゼ1]] (cyclin-dependent kinase 1. Cdk1), Cdk2, PMDPA1, [[transmembrane protease, serine 2]] (TMPRSS2)、[[D-dopachrome tautomerase]] (DDT)、[[グルタチオン-S-転位酵素θ2]] ([[glutathione S-transferase θ2]] ([[GSTT2]])、[[Ca2+/リン脂質依存性タンパク質リン酸化酵素|Ca<sup>2+</sup>/リン脂質依存性タンパク質リン酸化酵素]] (protein kinase C&delta | アンドロゲン受容体(AR)はGRなどと同様にリガンド非存在下では細胞質に存在し、リガンドと結合すると核へ移行し標的遺伝子の転写を調節する。ARの標的遺伝子には[[前立腺特異抗原]]([[prostate specific antigen]], [[PSA]])、[[線維芽細胞成長因子8]] ([[fibroblast growth factor 8]], [[FGF8]])、[[サイクリン依存性キナーゼ1]] (cyclin-dependent kinase 1. Cdk1), Cdk2, PMDPA1, [[transmembrane protease, serine 2]] (TMPRSS2)、[[D-dopachrome tautomerase]] (DDT)、[[グルタチオン-S-転位酵素θ2]] ([[glutathione S-transferase θ2]] ([[GSTT2]])、[[Ca2+/リン脂質依存性タンパク質リン酸化酵素|Ca<sup>2+</sup>/リン脂質依存性タンパク質リン酸化酵素]] (protein kinase C&delta, PRKCD)、[[ピロリン-5-カルボン酸レダクターゼI]] ([[pyrroline-5-carboxylate reductase I]], [[PYXRI]])等が知られる。[[wikipedia:ja:哺乳動物|哺乳動物]]の[[中枢神経]]においては、これまでにアンドロゲンのノンゲノミック作用に直接関与するような膜型受容体は見つかっていない。 | ||
====プロゲステロン受容体==== | ====プロゲステロン受容体==== | ||
プロゲステロン受容体(PR)はPR-BとPR- | プロゲステロン受容体(PR)はPR-BとPR-Aの2つのアイソフォームが存在し、これらは同一遺伝子から産生され、PR-AはPR-BのN末端のアミノ酸が164個欠落したものである。PR-Bはリガンドの非存在下では細胞質と核の両方に分布するが、PR-Aはリガンド非存在下でも核内に局在し、いずれも標的遺伝子の転写を調節する。さらに、PR-Bは膜シグナル伝達分子である[[c-Src]]を代表とする[[Srcファミリーチロシンキナーゼ]] ([[Src family tyrosine kinase]], [[SFK]])と相互作用し、SFKを活性化することによりその下流の[[MAPK]]へシグナルを伝達することが報告されている<ref><pubmed>15242342</pubmed></ref>。 | ||
標的遺伝子として、fumarylacetoacetate、[[プロラクチン]]、[[Sox17]]などが知られる<ref><pubmed>22638070</pubmed></ref>。 | |||
''グルココルチコイドとその受容体に関しては[[グルココルチコイド]]の項目参照。'' | ''グルココルチコイドとその受容体に関しては[[グルココルチコイド]]の項目参照。'' | ||
==コレステロール== | ==コレステロール== | ||
コレステロールの分子式はC<sub>27</sub>H<sub>46</sub> | コレステロールの分子式はC<sub>27</sub>H<sub>46</sub>Oで表わされ、ステロイド核の3位の炭素にヒドロキシル基がついたステロールを基礎骨格とし、17位の炭素はアルキル化されている。動物では、コレステールの一部は食事から摂取されるが、主に肝臓と小腸でアセチルCoAより合成され、血液を介して全身に運ばれ、ホルモンや胆汁酸、ビタミンDの原料となる。また、コレステロールは、[[リン脂質]]と共に代表的な[[細胞膜]]の成分であり、コレステロールに富む膜領域は膜の流動性が低いことが知られる。細胞膜マイクロドメインとして知られる[[カベオラ]]や[[脂質ラフト]]は、コレステロールや[[スフィンゴミエリン]]に富んでおり、[[受容体]]タンパク質の集積や[[シグナル伝達]]が行われる場として研究が行われている。 | ||
==胆汁酸== | ==胆汁酸== | ||
胆汁酸(bile acid)は、[[wikipedia:ja:胆汁|胆汁]]に含まれるステロイド誘導体の総称であり、ヒトでは[[コール酸]]や[[デオキシコール酸]]がその代表である。胆汁酸は、[[wikipedia:ja:肝臓|肝臓]]にて[[シトクロムP450]]の作用によるコレステロールの酸化により合成される。胆汁酸は通常、[[グリシン]]や[[wikipedia:ja:タウリン|タウリン]]と結合して、グリココール酸(C<sub>26</sub>H<sub>43</sub>NO<sub>6</sub>)、やタウロコール酸(C26H45NO7S)等の抱合体として[[wikipedia:ja:胆嚢|胆嚢]]に蓄積され、[[wikipedia:ja:ビリルビン|ビリルビン]]と共に胆汁として[[wikipedia:ja:十二指腸|十二指腸]]に排出される。胆汁酸の主な役割は、[[wikipedia:ja:脂質|脂質]]の[[wikipedia:ja:乳化|乳化]]を促進し、食物脂肪の吸収を助けることである。 | 胆汁酸(bile acid)は、[[wikipedia:ja:胆汁|胆汁]]に含まれるステロイド誘導体の総称であり、ヒトでは[[コール酸]]や[[デオキシコール酸]]がその代表である。胆汁酸は、[[wikipedia:ja:肝臓|肝臓]]にて[[シトクロムP450]]の作用によるコレステロールの酸化により合成される。胆汁酸は通常、[[グリシン]]や[[wikipedia:ja:タウリン|タウリン]]と結合して、グリココール酸(C<sub>26</sub>H<sub>43</sub>NO<sub>6</sub>)、やタウロコール酸(C26H45NO7S)等の抱合体として[[wikipedia:ja:胆嚢|胆嚢]]に蓄積され、[[wikipedia:ja:ビリルビン|ビリルビン]]と共に胆汁として[[wikipedia:ja:十二指腸|十二指腸]]に排出される。胆汁酸の主な役割は、[[wikipedia:ja:脂質|脂質]]の[[wikipedia:ja:乳化|乳化]]を促進し、食物脂肪の吸収を助けることである。 | ||
==ビタミンD== | ==ビタミンD== | ||
[[Image:Provitamin to vitamin.png|thumb|right| | [[Image:Provitamin to vitamin.png|thumb|right|300px|'''図5 プロビタミンからビタミンDへの変換''']] | ||
ビタミンDは、ステロイド核のB環が9- | ビタミンDは、ステロイド核のB環が9-10位の間で開環した構造を持つ。ビタミンDは側鎖構造の違いから、D2(エルゴカルシフェロール)とD3(コレカルシフェロール)に分けられ、D2は植物に、D3は動物に多く含まれる。ビタミンDは、コレステロールが代謝を受けてプロビタミンD3(7-デヒドロコレステロール)となった後、[[wikipedia:ja:皮膚|皮膚]]上で[[wikipedia:ja:紫外線|紫外線]]によりステロイド核のB環が開きプレビタミンD3((6Z)-タカルシオール)となる(図4)。プレビタミンD3は更に、ビタミンD3(コレカルシフェロール)へと異性化する。ビタミンD自体は生理活性を持たないが、肝臓と腎臓にて3つのP450([[wikipedia:ja: CYP2R1|ビタミンD25-水酸化酵素]]、[[wikipedia:ja:カルシジオール-1-モノオキシゲナーゼ|ビタミンD1α-水酸化酵素]]、[[wikipedia:CYP24A1|ビタミンD24-水酸化酵素]])の働きにより活性型ビタミンD(1,25-ジヒドロキシコレカルシフェロール)へと変換され、[[wikipedia:ja:ビタミンD受容体|ビタミンD受容体]]を介して[[wikipedia:ja:核|核]]内の標的遺伝子の転写活性を制御することによって作用を発揮する<ref name="takemori">'''武森重樹'''<br>ステロイドホルモン<br>''共立出版'', 1998 </ref>。標的遺伝子の1つとして[[wikipedia:ja:カルシウム|カルシウム]]結合タンパク質である[[カルビンディン]]が挙げられる。ビタミンD受容体は[[wikipedia:ja:小腸|小腸]]、[[wikipedia:ja:腎臓|腎臓]]、[[wikipedia:ja:骨|骨]]組織に存在しておりカルシウム代謝と密接な関わりを持ち、腸管におけるカルシウムの吸収や[[wikipedia:ja:腎尿細管|腎尿細管]]におけるカルシウムの再吸収を促進する。活性型ビタミンDの不足は小児では[[wikipedia:ja:くる病|くる病]]、成人では[[wikipedia:ja:骨軟化症|骨軟化症]]となる。 | ||
== 関連項目== | |||
*[[シトクロムP450]] | *[[シトクロムP450]] | ||
*[[グルココルチコイド]] | *[[グルココルチコイド]] | ||
== 参考文献 == | == 参考文献 == | ||
<references/> | <references/> | ||
(執筆者:堀井 謹子、西 真弓 担当編集員:林 康紀) | |||
2012年12月7日 (金) 23:59時点における版
英語名:steroid 独:Steroide 仏:stéroïdes
ステロイドとは、分子中にステロイド核と称する骨格構造をもつ一連の有機化合物の総称である。ほとんどの動植物で生合成され、コレステロール、胆汁酸、ビタミンD、ステロイドホルモン等がその代表例である。
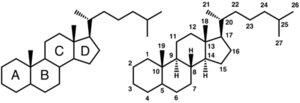
基本骨格
ステロイド核とは、シクロペンタノペルヒドロフェナントレン核のことを指し、3つのイス型シクロヘキサン環と1つのシクロペンタン環がつながった構造を持つ[1]。図1のように構造式を書いた場合、それぞれの環を左下から順にA環、B環、C環、D環と呼ぶ。一部あるいはすべての炭素が水素化され、通常はC-10とC-13にメチル基を、また多くの場合C-17にアルキル基を有する。生体物質としてのステロイドはC-3位がヒドロキシル化ヒドロキシル化もしくはカルボニル化されたステロール類である。
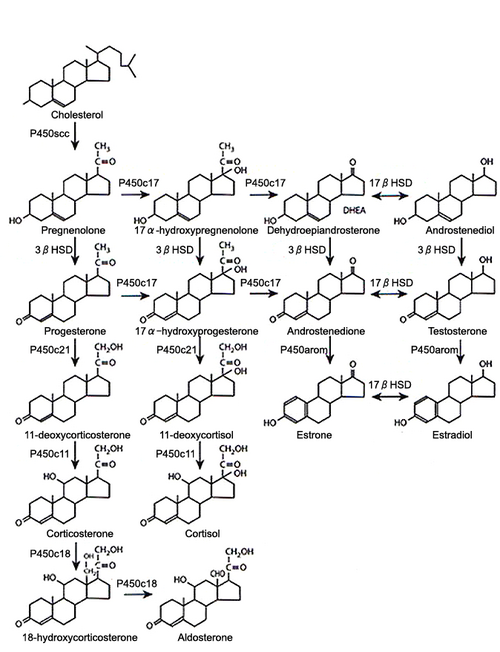
P450 scc:コレステロール側鎖切断酵素(cholesterole side chain cleavage)
3β-HSD:3β-ヒドキシステロイド脱水素酵素・異性化酵素 (3β-hydroxysteroid dehydrogenase)
P450c17:17α-水酸化・開裂酵素 (17 α-hydoroxylase/17, 20 lyase)
P450c21:21‐水酸化酵素 (C21-hydroxylase)
P450c11:11β-水酸化酵素 (11β-hydroxylase)
P450c18:アルドステロン合成酵素または18-水酸化酵素 (18-hydroxylase)
P450arom:アロマターゼ (aromatase)
17β-HSD: 17β-ヒドキシステロイド脱水素酵素
ステロイドホルモン
ステロイド核をもつホルモンをステロイドホルモンと呼ぶ。副腎、精巣、卵巣等の内分泌器官より分泌される。特に脳で合成されるステロイドはニューロステロイドと呼ばれる。ステロイドホルモンの特徴は、脂溶性かつ分子量が低いために細胞膜や脳血液関門を容易に通過できること、また細胞質に存在するステロイドホルモン受容体に結合し、核内にて標的遺伝子の転写活性を調節することである。近年、このような核受容体による遺伝子発現を介したステロイドホルモンのゲノミック作用に加え、膜受容体を介した遺伝子発現を伴わないノンゲノミック作用が注目されている[2]。
生合成
全てのステロイドホルモンはコレステロールより合成される(図2)[3]。炭素数27のコレステロールは、コレステロール側鎖切断酵素(P450 scc)の作用により、側鎖(炭素数6)が切断されてプレグネノロン(炭素数21)となる。この過程はすべてのステロイドホルモン分泌器官で共通したプロセスである。最終的に、副腎では炭素数は21の糖質コルチコイドと鉱質コルチコイドが、また精巣では炭素数がさらに2個減少したアンドロゲン(炭素数19)が、卵巣では炭素数が1個減少したエストロゲン(炭素数18)が生成される。
表に挙げるものがステロイドホルモン合成酵素であり、これらのうち、3β-HSDと17β-HSD以外はシトクロムP450である。どの酵素も小胞体膜かミトコンドリア内膜のどちらかに局在する。
| 酵素名 | 略称 |
| コレステロール側鎖切断酵素(cholesterole side chain cleavage) | P450 scc |
| 3β-ヒドキシステロイド脱水素酵素・異性化酵素 (3β-hydroxysteroid dehydrogenase) | 3β-HSD |
| 17α-水酸化・開裂酵素 (17 α-hydoroxylase/17, 20 lyase) | P450c17 |
| 21‐水酸化酵素 (C21-hydroxylase) | P450c21 |
| 11β-水酸化酵素 (11β-hydroxylase) | P450c11 |
| アルドステロン合成酵素または18-水酸化酵素 (aldosterone synthase or 18-hydroxylase) | P450c18 |
| アロマターゼ (aromatase) | P450arom |
| 17β-ヒドキシステロイド脱水素酵素 | 17β-HSD |
種類と作用
副腎皮質ホルモン
副腎皮質ホルモンは、鉱質コルチコイドと糖質コルチコイドの2種に大別される。鉱質コルチコイドにはアルドステロンが含まれ、糖質コルチコイドにはコルチゾールやコルチコステロンが含まれる。
鉱質コルチコイド
アルドステロンは副腎皮質球状帯で合成され、腎臓の集合管に作用してナトリウムイオンの再吸収とカリウムイオンの排泄を促進する。ナトリウムイオンの再吸収によって間質液の浸透圧が上昇し水の再吸収も増加するため、体液量の調節にも重要な役割を果たす[4]。
糖質コルチコイド
コルチゾール(コルチコステロン)は副腎皮質束状帯と副腎皮質網状帯にて合成され、その作用は糖代謝の調節、抗炎症作用、中枢神経系を介した情動や認知機能に対する作用、抗ストレス作用など多岐にわたる。糖代謝に関しては、糖新生を促進して血糖値を上昇させる。抗炎症作用においては3つの作用機序が考えられている。まずは、リソソーム膜の安定化によりタンパク質分解酵素の遊出を防ぐことによる炎症部位拡大の防御、次に肥満細胞によるヒスタミンの放出を防ぎ、毛細血管の透過性上昇を抑えることによる浮腫の軽減、最後にプロスタグランジンの合成を抑制することによる抗発熱・鎮痛作用である[4]。
精巣ホルモン
精巣のライディッヒ細胞から分泌されるアンドロゲンは男性ホルモンとも呼ばれ、雄性化作用を持つホルモンの総称であり、また女性ホルモンのひとつ、エストロゲンの前駆体でもある。生体内の主たるアンドロゲンはテストステロンである。テストステロン以外にもアンドロステンジオンやジヒドロテストステロンもアンドロゲン作用を持つ。
アンドロゲンはタンパク質同化作用を持ち、男性の二次性徴を促進するホルモンである。骨格筋の発達促進に加え、体毛の発育促進、頭髪の減少、皮脂腺の発達、精子形成促進、輸精管・前立腺・精嚢・カウパー腺の維持等を担い、また、交尾等の性行動もアンドロゲンによって促進される[4]。
アンドロゲンは脳の性分化にも重要なホルモンである。「アンドロゲンシャワー」と呼ばれる、周生期動物の精巣から分泌される高濃度のアンドロゲン作用によって脳の雄性化と脱雌性化が起こり、脳の性分化の方向が決められる[5]。例えば、雄ラットの精巣を生後直後に摘出すると成熟後に雌特有の性行動を引き起こし、また出生一週間頃までの雌ラットにアンドロゲンを投与すると性成熟後も性周期は回帰せず無排卵となる。脳がアンドロゲンに対して高い感受性を示す時期は「脳の性分化の臨界期」と呼ばれる[5]。
テストステロンは、攻撃行動に深く関わるホルモンである。多くの動物種では、雌に比べて雄の攻撃性が高いことが知られ、また、精巣を除去するとテストステロンの減少と共に攻撃行動は低下するが、テストステロンの投与により攻撃行動の回復が見られる。
テストステロンの作用経路は3種類存在し、テストステロンのままアンドロゲン受容体に結合して作用する経路に加え、5α-リダクターゼによりジヒドロテストステロンに代謝されアンドロゲン受容体に結合する経路、さらにアロマターゼによりエストラジオールに転換されてからエストロゲン受容体に結合して作用する経路が挙げられる。程度の差はあるが、これら3種類の作用経路はどれも攻撃行動に関与する。近年、ノックアウトマウスを用いた攻撃行動解析が行われ、アロマターゼのノックアウトマウスでは、エストラジオールへの転換が起こらず血中テストステロン量が増大しているが、攻撃行動は出現しないこと[6]、アンドロゲン受容体やエストロゲンα受容体のノックアウトマウスでは、精巣除去前もしくは精巣除去後にテストステロンを投与してもほとんど攻撃行動を示さないことが報告されている[7][8][9]。
卵巣ホルモン
卵巣から分泌される女性ホルモンは、エストロゲン(卵胞ホルモン)とプロゲステロン(黄体ホルモン)である。エストロゲンには、エストラジオール、エストロン、エストリオールの3種類が存在し、最も活性が高いのはエストラジオールである。
エストロゲンとプロゲステロンは、共同して子宮に月経周期をもたらすと共に、思春期における二次性徴の発現に関与する。エストロゲンは、卵胞期の子宮内膜を増殖や卵胞の成長を促進する。妊娠中は子宮筋を肥大させ、子宮筋の興奮性を高める。思春期には乳腺の乳管の成長を促進して乳房を大きくするとともに、皮下脂肪の蓄積・生殖器の発育など、一次性徴と二次性徴を発現させて女性らしい体型にする。さらに骨端の閉鎖をおこさせ、思春期以後の身長の伸びを抑制する。また、女性の性欲を亢進させ、発情行動を引き起こす。プロゲステロンは、排卵後に形成される黄体から分泌される。妊娠中は胎盤からも分泌される。プロゲステロンの効果はエストロゲンがあらかいじめ作用している状態で発揮されることが多く、子宮では、子宮内膜を分泌期にして受精卵が着床しやすい状態にする。妊娠中は子宮筋の興奮性を抑え、妊娠を継続させるように作用する。乳房に対しては、乳腺の腺房の発達を刺激する。体温上昇作用があり、排卵後の基礎体温を上昇させる[4]。
エストロゲンは雌の性行動にも深く関与する。多くのげっ歯類では、ロードーシスの発現は卵巣から分泌されるエストロゲンにより制御され、通常の性周期では、ロードーシス反射はエストロゲン分泌の高まる排卵前後でのみ起こる。また卵巣を摘出しても、通常のホルモン分泌パターンと類似させ、エストロゲンとプロゲステロンを連続的に投与すると雌はロードーシスを示す。エストロゲン受容体にはERαとERβの2種類が存在するが、ロードーシス反射に関与しているのは主にERαだと考えられている。ERα遺伝子を損傷したαERKOマウスの雌は、エストロゲンとプロゲステロンを投与しても全くロードーシスを示さない。一方ERβ遺伝子を欠損したERβKOマウスの雌は通常の性周期を示し、発情期には野生型の雌とほぼ同等のロードーシス反応を示す[10][11] 。
ニューロステロイド
脳で合成されるステロイドをニューロステロイドと呼ぶ。ニューロステロイドの研究は、フランスの内分泌学者Baulieuが1981年にラットの脳にプレグネノロンとデヒドロエピアンドロステロン(DHEA)を見出したことより始まり、現在では、脊椎動物のほとんどがニューロステロイドを合成していることが知られる[12]。
ニューロステロイドは、ニューロン、アストロサイト、オリゴデンドロサイトのすべての細胞種で合成されるが、発現するステロイド合成酵素の種類は細胞間で違いが見られる[13]。アストロサイトでは、P450scc, P450c17, 3βHSD, 17βHSD, P450aromを発現し、プレグネノロン、プロゲステロン、デヒドロエピアンドロステンジオン、アンドロゲン、エストロゲンを合成している。ニューロンもほぼアストロサイトと同様の合成酵素発現を示すが、17βHSDを持たずテストステロン合成を行わない点でアストロサイトと異なる。オリゴデンドロサイトはP450sccと3βHSDを発現し、プレグネノロンとプロゲステロンを合成する。
小脳プルキンエ細胞は、P450sccや3βHSD、ステロイド硫酸基転移酵素(HST)を発現しており、プレグネノロン、プレグネノロン硫酸エステル、プロゲステロン、プロゲステロン代謝ステロイド(3α,5α-テトラハイドロプロゲステロン)を合成する[14][15]。 プロゲステロンは、新生児期の小脳において合成が活発となり、プルキンエ細胞の樹状突起伸長やスパイン形成を促進する[16] [17]。またプレグネノロン硫酸エステルは傍分泌により、プルキンエ細胞に投射するGABAニューロンに作用し、GABAの放出頻度を増加させることが報告されている[18]。
受容体と標的遺伝子
ステロイドホルモンの作用機序は大きく2つに分けられる。ひとつは核内受容体を介して標的遺伝子の発現調節を行うゲノミック作用であり、もうひとつは膜受容体を介した遺伝子発現調節を伴わず数分以内の速い作用が特徴のノンゲノミック作用である。
核内受容体には、グルココルチコイド受容体(GR)、ミネラルコルチコイド受容体(MR)、アンドゲン受容体(AR)、エストロゲン受容体(ERαとERβ)、プロゲステロン受容体(PR)があり、細胞質を通過したステロイドホルモンと複合体を形成して核へ移行し、標的遺伝子のホルモン応答配列(hormone response element: HRE)に結合し転写調節を行う。しかし、これら核内受容体はゲノミック作用のみならず、細胞膜や細胞質にも存在することが確認されており、細胞質のセカンドメッセンジャー(PKA, PKC, MAPKや細胞内カルシウム等)に対してノンゲノミックな作用も有する。
また近年、Gタンパク質共役型受容体(G protein-coupled receptor: GPCR)もステロイドホルモンの膜受容体として注目されている。
エストロゲン受容体
エストロゲン受容体にはERαとERβとがあり、これらは独立した遺伝子から産生される(スプライシングバリアントではない)。ER受容体はリガンドフリーの状態でも核内に存在するが、リガンドと結合すると二量体を形成して標的遺伝子の転写調節領域に結合する。ERはエストロゲン応答配列 (estrogen response element: ERE)に直接に結合する以外にも、AP-1やcyclic AMP応答エレメント(cyclic AMP-responsive element, CRE)様配列にも間接的に作用し遺伝子発現を調節することが知られる。
ERの標的遺伝子としてはプロラクチン、オボアルブミン、インスリン様成長因子-1 (insulin-like growth factor-1, IGF-1)、プレセニリン-2 (trefoil factor 1, TFF-1/pS2)、カテプシンD、c-Myc, cyclin D1等が知られる。エストロゲンによるプロラクチン遺伝子の発現調節はEREによるものであるが、オボアルブミンやIGF-1遺伝子の発現調節はAP-1によるものであることが報告されており、発現調節のメカニズムにおいては遺伝子ごとの詳細な解析が必要とされる。
エストロゲン受容体のノンゲノミック作用はミリ秒から数分でおこり、従来のゲノミックな作用機序とは異なる。免疫電子顕微鏡の研究から従来のERαおよびERβが細胞膜や細胞質に分布し、視床下部や海馬の神経細胞では樹状突起スパインや軸索終末にも存在することが報告されている。特に、海馬神経細胞においてはエストロゲンのシグナル伝達にカベオリンタンパク質が重要な働きをしており、ERαおよびERβが膜に存在することを示唆している[19]。
一方、従来のERαやERβではなく、GPCRの1つであるGPR30がノンゲノミック作用を示すことが報告されている。さらに、遺伝子は未だにクローニングされていないが、ER-XおよびGq-coupled membrane ER(Gq-mER)などもエストロゲン膜受容体の可能性が示されている。これら膜受容体の作用機序としては、ERα、ERβおよびER-XはMAPK系を介して、またGPR30やGq-mERはGタンパク質を介して作用する。さらに、エストロゲンはNMDA型グルタミン酸受容体やAMPA型グルタミン酸受容体に作用することも報告されている[20]。
アンドロゲン受容体
アンドロゲン受容体(AR)はGRなどと同様にリガンド非存在下では細胞質に存在し、リガンドと結合すると核へ移行し標的遺伝子の転写を調節する。ARの標的遺伝子には前立腺特異抗原(prostate specific antigen, PSA)、線維芽細胞成長因子8 (fibroblast growth factor 8, FGF8)、サイクリン依存性キナーゼ1 (cyclin-dependent kinase 1. Cdk1), Cdk2, PMDPA1, transmembrane protease, serine 2 (TMPRSS2)、D-dopachrome tautomerase (DDT)、グルタチオン-S-転位酵素θ2 (glutathione S-transferase θ2 (GSTT2)、Ca2+/リン脂質依存性タンパク質リン酸化酵素 (protein kinase C&delta, PRKCD)、ピロリン-5-カルボン酸レダクターゼI (pyrroline-5-carboxylate reductase I, PYXRI)等が知られる。哺乳動物の中枢神経においては、これまでにアンドロゲンのノンゲノミック作用に直接関与するような膜型受容体は見つかっていない。
プロゲステロン受容体
プロゲステロン受容体(PR)はPR-BとPR-Aの2つのアイソフォームが存在し、これらは同一遺伝子から産生され、PR-AはPR-BのN末端のアミノ酸が164個欠落したものである。PR-Bはリガンドの非存在下では細胞質と核の両方に分布するが、PR-Aはリガンド非存在下でも核内に局在し、いずれも標的遺伝子の転写を調節する。さらに、PR-Bは膜シグナル伝達分子であるc-Srcを代表とするSrcファミリーチロシンキナーゼ (Src family tyrosine kinase, SFK)と相互作用し、SFKを活性化することによりその下流のMAPKへシグナルを伝達することが報告されている[21]。
標的遺伝子として、fumarylacetoacetate、プロラクチン、Sox17などが知られる[22]。
グルココルチコイドとその受容体に関してはグルココルチコイドの項目参照。
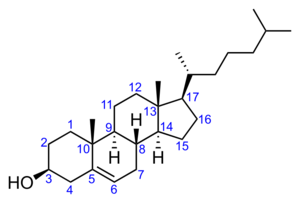
コレステロール
コレステロールの分子式はC27H46Oで表わされ、ステロイド核の3位の炭素にヒドロキシル基がついたステロールを基礎骨格とし、17位の炭素はアルキル化されている。動物では、コレステールの一部は食事から摂取されるが、主に肝臓と小腸でアセチルCoAより合成され、血液を介して全身に運ばれ、ホルモンや胆汁酸、ビタミンDの原料となる。また、コレステロールは、リン脂質と共に代表的な細胞膜の成分であり、コレステロールに富む膜領域は膜の流動性が低いことが知られる。細胞膜マイクロドメインとして知られるカベオラや脂質ラフトは、コレステロールやスフィンゴミエリンに富んでおり、受容体タンパク質の集積やシグナル伝達が行われる場として研究が行われている。
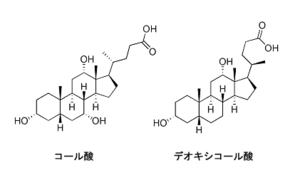
胆汁酸
胆汁酸(bile acid)は、胆汁に含まれるステロイド誘導体の総称であり、ヒトではコール酸やデオキシコール酸がその代表である。胆汁酸は、肝臓にてシトクロムP450の作用によるコレステロールの酸化により合成される。胆汁酸は通常、グリシンやタウリンと結合して、グリココール酸(C26H43NO6)、やタウロコール酸(C26H45NO7S)等の抱合体として胆嚢に蓄積され、ビリルビンと共に胆汁として十二指腸に排出される。胆汁酸の主な役割は、脂質の乳化を促進し、食物脂肪の吸収を助けることである。
ビタミンD
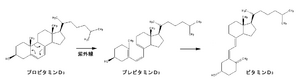
ビタミンDは、ステロイド核のB環が9-10位の間で開環した構造を持つ。ビタミンDは側鎖構造の違いから、D2(エルゴカルシフェロール)とD3(コレカルシフェロール)に分けられ、D2は植物に、D3は動物に多く含まれる。ビタミンDは、コレステロールが代謝を受けてプロビタミンD3(7-デヒドロコレステロール)となった後、皮膚上で紫外線によりステロイド核のB環が開きプレビタミンD3((6Z)-タカルシオール)となる(図4)。プレビタミンD3は更に、ビタミンD3(コレカルシフェロール)へと異性化する。ビタミンD自体は生理活性を持たないが、肝臓と腎臓にて3つのP450(ビタミンD25-水酸化酵素、ビタミンD1α-水酸化酵素、ビタミンD24-水酸化酵素)の働きにより活性型ビタミンD(1,25-ジヒドロキシコレカルシフェロール)へと変換され、ビタミンD受容体を介して核内の標的遺伝子の転写活性を制御することによって作用を発揮する[3]。標的遺伝子の1つとしてカルシウム結合タンパク質であるカルビンディンが挙げられる。ビタミンD受容体は小腸、腎臓、骨組織に存在しておりカルシウム代謝と密接な関わりを持ち、腸管におけるカルシウムの吸収や腎尿細管におけるカルシウムの再吸収を促進する。活性型ビタミンDの不足は小児ではくる病、成人では骨軟化症となる。
関連項目
参考文献
- ↑ G. P. Moss
Nomenclature of Steroids (Recommendations 1989)
Pure & Appl. Chem.:1989, 61(10);1783–1822 - ↑
Groeneweg, F.L., Karst, H., de Kloet, E.R., & Joëls, M. (2011).
Rapid non-genomic effects of corticosteroids and their role in the central stress response. The Journal of endocrinology, 209(2), 153-67. [PubMed:21357682] [WorldCat] [DOI] - ↑ 3.0 3.1 武森重樹
ステロイドホルモン
共立出版, 1998 - ↑ 4.0 4.1 4.2 4.3 坂井建雄、岡田隆夫
解剖生理学-人体の構造と機能-第7版3刷
医学書院:2007 - ↑ 5.0 5.1 近藤保彦、小川園子、菊水健史、山田一夫、富原一哉
脳とホルモンの行動学
西村書店:2010 - ↑
Toda, K., Saibara, T., Okada, T., Onishi, S., & Shizuta, Y. (2001).
A loss of aggressive behaviour and its reinstatement by oestrogen in mice lacking the aromatase gene (Cyp19). The Journal of endocrinology, 168(2), 217-20. [PubMed:11182758] [WorldCat] [DOI] - ↑
Sato, T., Matsumoto, T., Kawano, H., Watanabe, T., Uematsu, Y., Sekine, K., ..., & Kato, S. (2004).
Brain masculinization requires androgen receptor function. Proceedings of the National Academy of Sciences of the United States of America, 101(6), 1673-8. [PubMed:14747651] [PMC] [WorldCat] [DOI] - ↑
Ogawa, S., Lubahn, D.B., Korach, K.S., & Pfaff, D.W. (1997).
Behavioral effects of estrogen receptor gene disruption in male mice. Proceedings of the National Academy of Sciences of the United States of America, 94(4), 1476-81. [PubMed:9037078] [PMC] [WorldCat] [DOI] - ↑
Ogawa, S., Washburn, T.F., Taylor, J., Lubahn, D.B., Korach, K.S., & Pfaff, D.W. (1998).
Modifications of testosterone-dependent behaviors by estrogen receptor-alpha gene disruption in male mice. Endocrinology, 139(12), 5058-69. [PubMed:9832445] [WorldCat] [DOI] - ↑
Ogawa, S., Chan, J., Chester, A.E., Gustafsson, J.A., Korach, K.S., & Pfaff, D.W. (1999).
Survival of reproductive behaviors in estrogen receptor beta gene-deficient (betaERKO) male and female mice. Proceedings of the National Academy of Sciences of the United States of America, 96(22), 12887-92. [PubMed:10536018] [PMC] [WorldCat] [DOI] - ↑
Ogawa, S., Eng, V., Taylor, J., Lubahn, D.B., Korach, K.S., & Pfaff, D.W. (1998).
Roles of estrogen receptor-alpha gene expression in reproduction-related behaviors in female mice. Endocrinology, 139(12), 5070-81. [PubMed:9832446] [WorldCat] [DOI] - ↑
Do Rego, J.L., Seong, J.Y., Burel, D., Leprince, J., Luu-The, V., Tsutsui, K., ..., & Vaudry, H. (2009).
Neurosteroid biosynthesis: enzymatic pathways and neuroendocrine regulation by neurotransmitters and neuropeptides. Frontiers in neuroendocrinology, 30(3), 259-301. [PubMed:19505496] [WorldCat] [DOI] - ↑
Zwain, I.H., & Yen, S.S. (1999).
Neurosteroidogenesis in astrocytes, oligodendrocytes, and neurons of cerebral cortex of rat brain. Endocrinology, 140(8), 3843-52. [PubMed:10433246] [WorldCat] [DOI] - ↑
Tsutsui, K., Ukena, K., Usui, M., Sakamoto, H., & Takase, M. (2000).
Novel brain function: biosynthesis and actions of neurosteroids in neurons. Neuroscience research, 36(4), 261-73. [PubMed:10771104] [WorldCat] [DOI] - ↑
Tsutsui, K., & Ukena, K. (1999).
Neurosteroids in the cerebellar Purkinje neuron and their actions (review). International journal of molecular medicine, 4(1), 49-56. [PubMed:10373637] [WorldCat] - ↑
Sakamoto, H., Ukena, K., & Tsutsui, K. (2001).
Effects of progesterone synthesized de novo in the developing Purkinje cell on its dendritic growth and synaptogenesis. The Journal of neuroscience : the official journal of the Society for Neuroscience, 21(16), 6221-32. [PubMed:11487645] [PMC] [WorldCat] - ↑
Sakamoto, H., Ukena, K., & Tsutsui, K. (2002).
Dendritic spine formation in response to progesterone synthesized de novo in the developing Purkinje cell in rats. Neuroscience letters, 322(2), 111-5. [PubMed:11958856] [WorldCat] [DOI] - ↑
Tsutsui, K., & Ukena, K. (1999).
Neurosteroids in the cerebellar Purkinje neuron and their actions (review). International journal of molecular medicine, 4(1), 49-56. [PubMed:10373637] [WorldCat] - ↑
Micevych, P.E., & Mermelstein, P.G. (2008).
Membrane estrogen receptors acting through metabotropic glutamate receptors: an emerging mechanism of estrogen action in brain. Molecular neurobiology, 38(1), 66-77. [PubMed:18670908] [PMC] [WorldCat] [DOI] - ↑
Cyr, M., Ghribi, O., Thibault, C., Morissette, M., Landry, M., & Di Paolo, T. (2001).
Ovarian steroids and selective estrogen receptor modulators activity on rat brain NMDA and AMPA receptors. Brain research. Brain research reviews, 37(1-3), 153-61. [PubMed:11744083] - ↑
Boonyaratanakornkit, V., & Edwards, D.P. (2004).
Receptor mechanisms of rapid extranuclear signalling initiated by steroid hormones. Essays in biochemistry, 40, 105-20. [PubMed:15242342] [WorldCat] - ↑
Rubel, C.A., Lanz, R.B., Kommagani, R., Franco, H.L., Lydon, J.P., & DeMayo, F.J. (2012).
Research resource: Genome-wide profiling of progesterone receptor binding in the mouse uterus. Molecular endocrinology (Baltimore, Md.), 26(8), 1428-42. [PubMed:22638070] [PMC] [WorldCat] [DOI]
(執筆者:堀井 謹子、西 真弓 担当編集員:林 康紀)