「シナプス小胞」の版間の差分
細編集の要約なし |
|||
| (2人の利用者による、間の6版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">[http://researchmap.jp/read0148418 高森 茂雄]、[http://researchmap.jp/read0191133 熊丸 絵美]</font><br> | <font size="+1">[http://researchmap.jp/read0148418 高森 茂雄]、[http://researchmap.jp/read0191133 熊丸 絵美]</font><br> | ||
''同志社大学''<br> | ''同志社大学''<br> | ||
DOI [[XXXX]]/XXXX 原稿受付日:2014年4月22日 原稿完成日:2014年月日<br> | |||
担当編集委員:[http://researchmap.jp/2rikenbsi 林 康紀](独立行政法人理化学研究所 脳科学総合研究センター)</div> | 担当編集委員:[http://researchmap.jp/2rikenbsi 林 康紀](独立行政法人理化学研究所 脳科学総合研究センター)</div> | ||
| 9行目: | 9行目: | ||
同義語:シナプス顆粒 | 同義語:シナプス顆粒 | ||
{{box|text= | {{box|text= シナプス顆粒は、[[神経細胞]]の[[軸索]]終末である[[シナプス前終末]]に蓄積している分泌小胞の総称である。シナプス顆粒は、神経細胞の興奮に応じて[[シナプス前膜]]と[[膜融合]]を起こし、内容物([[神経伝達物質]])を[[シナプス間隙]]に放出([[エキソサイトーシス]])することによって、[[シナプス伝達]]を行う。シナプス前終末にはこれらの[[分泌小胞]]が多数密集して存在しており、[[wikipedia:ja:電子顕微鏡|電子顕微鏡]]像では顆粒状に観察される。[[海馬]]や[[大脳皮質]]に存在する1 μm程度のシナプス前終末では〜200個のシナプス顆粒が含まれている。 神経伝達物質は、特異的な[[小胞トランスポーター]]タンパク質によってシナプス小胞内に濃縮される。シナプス小胞は、[[アクティブゾーン]]にドックしており、Ca<sup>2+</sup>の流入とともに膜融合を引き起こし、神経伝達物質を放出する。その過程においては、Ca<sup>2+</sup>を感知する[[シナプトタグミン]]、[[SNAREタンパク質]]である[[シナプトブレビン]]と[[シンタキシン]]、[[SNAP-25]]が重要な役割を果たしている。膜融合後は、エンドサイトーシスにより小胞膜画分が回収され、再利用される。その過程は速度によっていくつかのメカニズムが考えられるが、[[クラスリン]]被覆に依存したメカニズムが一つである。}} | ||
== はじめに == | == はじめに == | ||
| 15行目: | 15行目: | ||
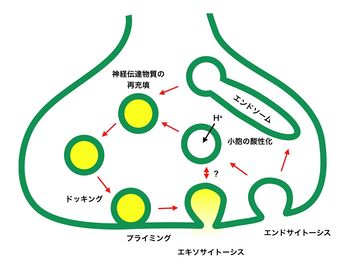
[[image:シナプス小胞1.jpg|thumb|350px|'''図2.シナプス小胞のリサイクリング''']] | [[image:シナプス小胞1.jpg|thumb|350px|'''図2.シナプス小胞のリサイクリング''']] | ||
神経間の情報伝達は[[シナプス]] | 神経間の情報伝達は[[シナプス]]と呼ばれる微小な微小な神経接合部において行なわれる。シナプスは機能的にも形態的にも異なる[[シナプス前部]]とシナプス後部から構成され、[[シナプス前]]部から放出された[[神経伝達物質]]が、隣接したシナプス後部表面に存在する[[受容体]]に結合することによりシグナルが伝達される。 | ||
1960年代に[[wj:ベルンハルト・カッツ|Bernard Katz]]らは[[wj:カエル|カエル]]の神経−筋接合部を用いて電気生理学的な実験を行い、シナプス後部(この場合は[[wj:筋肉|筋肉]])で観察される応答は、シナプス前部から放出される一定量のシグナル物質(彼らは「quanta(量子)」と名付けた)によって引き起されることを提唱した<ref name=ref1><pubmed>13175199</pubmed></ref>。 | 1960年代に[[wj:ベルンハルト・カッツ|Bernard Katz]]らは[[wj:カエル|カエル]]の神経−筋接合部を用いて電気生理学的な実験を行い、シナプス後部(この場合は[[wj:筋肉|筋肉]])で観察される応答は、シナプス前部から放出される一定量のシグナル物質(彼らは「quanta(量子)」と名付けた)によって引き起されることを提唱した<ref name=ref1><pubmed>13175199</pubmed></ref>。 | ||
| 55行目: | 55行目: | ||
'''(2)プライミング''':電子顕微鏡像では形態的にドッキングしているにも関わらず、電気生理学的に神経伝達物質が放出されない遺伝子欠損マウスが幾つか報告されており、その結果からドッキングと膜融合の間に、小胞が膜融合する能力を獲得するステップ、すなわちプライミングの存在が提唱された。[[CAPS]] ([[Calcium-dependent Activator Protein for Secretion]])や [[Munc13]]などがプライミング因子の候補として挙げられている<ref name=ref20><pubmed>24363652</pubmed></ref>。これらのプライミング因子はSNAREタンパク質等の膜融合装置や形質膜での[[セカンドメッセンジャー]]([[PIP2]]や[[ジアシルグリセロール]])を介して働いていると考えられる。 | '''(2)プライミング''':電子顕微鏡像では形態的にドッキングしているにも関わらず、電気生理学的に神経伝達物質が放出されない遺伝子欠損マウスが幾つか報告されており、その結果からドッキングと膜融合の間に、小胞が膜融合する能力を獲得するステップ、すなわちプライミングの存在が提唱された。[[CAPS]] ([[Calcium-dependent Activator Protein for Secretion]])や [[Munc13]]などがプライミング因子の候補として挙げられている<ref name=ref20><pubmed>24363652</pubmed></ref>。これらのプライミング因子はSNAREタンパク質等の膜融合装置や形質膜での[[セカンドメッセンジャー]]([[PIP2]]や[[ジアシルグリセロール]])を介して働いていると考えられる。 | ||
'''(3)膜融合''':シナプス小胞の形質膜への融合過程においては、3つのSNAREタンパク質が重要な役割を果たしている。[[w:ジェームズ・ロスマン|James Rothman]]らは、[[ゴルジ装置]]における物質輸送に必要な可溶性タンパク質として[[N-エチルマレイミド感受性因子]] ([[N-ethylmaleimide-sensitive factor]], [[NSF]]) | '''(3)膜融合''':シナプス小胞の形質膜への融合過程においては、3つのSNAREタンパク質が重要な役割を果たしている。[[w:ジェームズ・ロスマン|James Rothman]]らは、[[ゴルジ装置]]における物質輸送に必要な可溶性タンパク質として[[N-エチルマレイミド感受性因子]] ([[N-ethylmaleimide-sensitive factor]], [[NSF]])と可溶性[[N-エチルマレイミド感受性因子付着タンパク質]] ([[Soluble NSF attachment protein]], [[SNAP]])という二種類のタンパク質を同定した。更にRothmanは、これら可溶性タンパク質の膜受容体(SNAP receptor = SNARE)を探索するにあたり、NSFとSNAP複合体に結合するタンパク質を脳由来の膜画分を用いて行なった結果、既にシナプスで同定されていたシナプトブレビンとシンタキシン、SNAP-25が同定された<ref name=ref21><pubmed>8455717</pubmed></ref>。シナプトブレビンがシナプス小胞膜、シンタキシンとSNAP-25が形質膜にあることから、Rothmanはそれぞれ[[vesicular SNARE]] ([[v-SNARE]])と[[target-SNARE]] ([[t-SNARE]])と名付け、シナプス小胞の形質膜の融合にはv-SNAREとt-SNAREがNSFやSNAPと巨大なタンパク質複合体を形成する必要があると提唱した。この「[[SNARE仮説]]」とその後の実証研究の功績によりRothmanは2013年[[wj:ノーベル医学生理学賞|ノーベル医学生理学賞]]を受賞した。現在では、NSFやSNAPは膜融合ではなく、膜融合後のSNAREタンパク質複合体を乖離させる働きをしていることが分かったが<ref name=ref22><pubmed>10769209</pubmed></ref> <ref name=ref23><pubmed>9177194</pubmed></ref>、SNAREタンパク質が膜融合を促進させるタンパク質であることは、[[リポソーム]]再構成実験によって示された<ref name=ref24><pubmed>9529252</pubmed></ref>。 | ||
また、神経毒として知られる各種[[ボツリヌス毒素]]や[[テタヌス毒素]]が神経伝達物質の放出を阻害する作用は、それらがSNAREタンパク質を特異的に切断することによる<ref name=ref25><pubmed>9759724</pubmed></ref>。 | また、神経毒として知られる各種[[ボツリヌス毒素]]や[[テタヌス毒素]]が神経伝達物質の放出を阻害する作用は、それらがSNAREタンパク質を特異的に切断することによる<ref name=ref25><pubmed>9759724</pubmed></ref>。 | ||
| 106行目: | 106行目: | ||
中枢神経系シナプスの一部にはシナプス小胞よりも大きく(直径100~300ナノメートル)、電子顕微鏡で内腔が黒く見える[[大型有芯顆粒]](Large Dense Core Vesicle: LDCV)が含まれるものがある(図1)。 | 中枢神経系シナプスの一部にはシナプス小胞よりも大きく(直径100~300ナノメートル)、電子顕微鏡で内腔が黒く見える[[大型有芯顆粒]](Large Dense Core Vesicle: LDCV)が含まれるものがある(図1)。 | ||
シナプス小胞はシナプス前部の形質膜形質膜近傍からクラスター状に多数存在するのに対して、LDCVはシナプス部位から離れた部位に散在している。シナプス小胞には速い神経伝達を担うグルタミン酸、GABA、[[グリシン]]、アセチルコリンが含まれているのに対して、LDCVには[[ドーパミン]]などの[[モノアミン]]類や[[神経ペプチド]]、多種多様な[[神経栄養因子]]を神経伝達物質として含まれている。また、[[交感神経]]のシナプスにおいては、[[ノルエピネフリン]]や[[セロトニン]]を含む60〜80 nmの[[有芯小胞]]が見られ、これをLDCVと区別して | シナプス小胞はシナプス前部の形質膜形質膜近傍からクラスター状に多数存在するのに対して、LDCVはシナプス部位から離れた部位に散在している。シナプス小胞には速い神経伝達を担うグルタミン酸、GABA、[[グリシン]]、アセチルコリンが含まれているのに対して、LDCVには[[ドーパミン]]などの[[モノアミン]]類や[[神経ペプチド]]、多種多様な[[神経栄養因子]]を神経伝達物質として含まれている。また、[[交感神経]]のシナプスにおいては、[[ノルエピネフリン]]や[[セロトニン]]を含む60〜80 nmの[[有芯小胞]]が見られ、これをLDCVと区別して[[small dense core vesicle]](SDCV)と呼ぶ場合もある。シナプス小胞とLDCVは中に含まれる神経伝達物質の違いに加え、様々な性質が異なる。シナプス小胞から放出される神経伝達物質神経伝達物質は、主にシナプス後部側の[[イオンチャネル]]型受容体に作用するため、シナプス後部側に電気的なシナプス応答を引き起こす。一方、LDCVに含まれる伝達物質はシナプス後部側の[[Gタンパク共役型受容体]]や[[神経栄養因子受容体]]に作用し、[[セカンドメッセンジャー]]を介したシナプス伝達の修飾を行う。 | ||
中枢神経系でのLDCVからの伝達物質放出機構は明らかではないが、[[クロム親和性細胞]]を用いた研究から、シナプス小胞同様、SNARE複合体による膜融合で伝達物質放出を行っていると考えられている。しかし、シナプス小胞とLDCVでは[[カルシウム]]に対する応答性に違いがあることが知られている。伝達物質放出のためにシナプス小胞がシナプス前部局所での高濃度のCa<sup>2+</sup>濃度上昇を必要とするのに対し、LDCVは持続的な低濃度のCa<sup>2+</sup>濃度上昇を必要とする<ref name=ref48><pubmed>15572159</pubmed></ref>。SNARE複合体に含まれるシナプトブレビンやCa<sup>2+</sup>センサーであるシナプトタグミンなどにはアイソフォームがあり、シナプス小胞とLDCVに存在するこれらのアイソフォームが異なる可能性が示唆されている <ref name=ref50 /><ref name=ref49><pubmed>21551071</pubmed></ref>。 | 中枢神経系でのLDCVからの伝達物質放出機構は明らかではないが、[[クロム親和性細胞]]を用いた研究から、シナプス小胞同様、SNARE複合体による膜融合で伝達物質放出を行っていると考えられている。しかし、シナプス小胞とLDCVでは[[カルシウム]]に対する応答性に違いがあることが知られている。伝達物質放出のためにシナプス小胞がシナプス前部局所での高濃度のCa<sup>2+</sup>濃度上昇を必要とするのに対し、LDCVは持続的な低濃度のCa<sup>2+</sup>濃度上昇を必要とする<ref name=ref48><pubmed>15572159</pubmed></ref>。SNARE複合体に含まれるシナプトブレビンやCa<sup>2+</sup>センサーであるシナプトタグミンなどにはアイソフォームがあり、シナプス小胞とLDCVに存在するこれらのアイソフォームが異なる可能性が示唆されている <ref name=ref50 /><ref name=ref49><pubmed>21551071</pubmed></ref>。 | ||
| 121行目: | 121行目: | ||
*[[シンタキシン]] | *[[シンタキシン]] | ||
*[[シナプトフィジン]] | *[[シナプトフィジン]] | ||
*[[ | *[[小胞型アセチルコリントランスポーター]] | ||
*[[ | *[[小胞型グルタミン酸トランスポーター]] | ||
*[[ | *[[小胞型モノアミントランスポーター]] | ||
*[[CAPS]] | *[[CAPS]] | ||
*[[有芯顆粒]] | *[[有芯顆粒]] | ||
2014年4月25日 (金) 09:59時点における版
高森 茂雄、熊丸 絵美
同志社大学
DOI XXXX/XXXX 原稿受付日:2014年4月22日 原稿完成日:2014年月日
英:synaptic vesicle 独:synaptisches Bläschen 仏:vésicule synaptique
同義語:シナプス顆粒
シナプス顆粒は、神経細胞の軸索終末であるシナプス前終末に蓄積している分泌小胞の総称である。シナプス顆粒は、神経細胞の興奮に応じてシナプス前膜と膜融合を起こし、内容物(神経伝達物質)をシナプス間隙に放出(エキソサイトーシス)することによって、シナプス伝達を行う。シナプス前終末にはこれらの分泌小胞が多数密集して存在しており、電子顕微鏡像では顆粒状に観察される。海馬や大脳皮質に存在する1 μm程度のシナプス前終末では〜200個のシナプス顆粒が含まれている。 神経伝達物質は、特異的な小胞トランスポータータンパク質によってシナプス小胞内に濃縮される。シナプス小胞は、アクティブゾーンにドックしており、Ca2+の流入とともに膜融合を引き起こし、神経伝達物質を放出する。その過程においては、Ca2+を感知するシナプトタグミン、SNAREタンパク質であるシナプトブレビンとシンタキシン、SNAP-25が重要な役割を果たしている。膜融合後は、エンドサイトーシスにより小胞膜画分が回収され、再利用される。その過程は速度によっていくつかのメカニズムが考えられるが、クラスリン被覆に依存したメカニズムが一つである。
はじめに
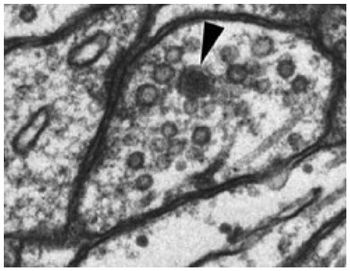
透明な顆粒がシナプス小胞、黒い顆粒が有芯小胞(矢頭)。
文献[1]より許可を得て転載 (Elsevier License ; 2903510133723)。
神経間の情報伝達はシナプスと呼ばれる微小な微小な神経接合部において行なわれる。シナプスは機能的にも形態的にも異なるシナプス前部とシナプス後部から構成され、シナプス前部から放出された神経伝達物質が、隣接したシナプス後部表面に存在する受容体に結合することによりシグナルが伝達される。
1960年代にBernard Katzらはカエルの神経−筋接合部を用いて電気生理学的な実験を行い、シナプス後部(この場合は筋肉)で観察される応答は、シナプス前部から放出される一定量のシグナル物質(彼らは「quanta(量子)」と名付けた)によって引き起されることを提唱した[2]。
ちょうど同時期にPaladeらは電子顕微鏡で脳組織を観察し、シナプス前部と思われる構造体に数百もの小さな袋状の膜構造物を観察し、この小胞がquantaの正体であることを提唱した(図1)。「シナプス小胞」の発見である[3]。
1980年代になり、HeuserとReeseらは電気刺激直後(5ミリ秒)に固定した神経筋接合部を電子顕微鏡下で観察し、シナプス小胞と形質膜が融合している像を見いだし、神経伝達物質の放出は伝達物質を貯蔵したシナプス小胞の膜と形質膜の膜融合によって起こることを提唱した[4]。また、痙攣を引き起こすショウジョウバエの温度感受性変異体であるshibireミュータントでは、シナプス前部からシナプス小胞が枯渇し、形質膜上にはオメガ(Ω)様の膜陥入像が見られた[5]。温度を下げるとシナプス前部にシナプス小胞が再び現れることから、形質膜に融合したシナプス小胞はシナプス前部において再合成されることが示唆された。これらの歴史的な知見により、神経伝達物質の充填→エキソサイトーシスによる膜融合→エンドサイトーシスによる再形成形成というシナプス小胞の一連のサイクルが明らかになった(図2)。
物理化学的性質
電子顕微鏡で観察されるシナプス小胞のクラスターはシナプス前部を形態学的に同定するための目印となる。脳の部位によって直径が35~50ナノメートルと多少のばらつきが見られるものの、平均すると40ナノメートル余りであり、細胞内小器官の中でも最小の部類である[6]。また、興奮性のグルタミン酸シナプスでは均一な球形であるが、抑制性のGABAシナプスでは楕円形に見えることが知られているが、これはサンプルの固定時におけるアーティファクトであると考えられている[7]。
ラット脳から精製したシナプス小胞の定量的解析から、平均的なシナプス小胞の質量は約30アトグラム (3 x 10–17グラム)であり、そのうちの17アトグラムはタンパク質、残りが脂質である。内腔の体積は約2 x 10–20リットル程度であり、内腔の神経伝達物質濃度が100 mMだとすると、およそ1,000分子が存在すると試算でできる[6]。
生合成過程
シナプス小胞膜上のタンパク質は他の分泌経路のタンパク質と同じように小胞体で合成されゴルジ装置で修飾されたのちシナプス前部に運ばれる。しかしながら、シナプス前部への経路である軸索内にシナプス小胞と似た大きさの小胞が観察されないことから、シナプス小胞自体はシナプス前部で合成されると考えられている。シナプス小胞タンパク質がどのようにシナプス前部に運ばれるのかは定かではないが、直径80ナノメートル程の前駆体小胞に載って軸索内を移動して、シナプス前部の形質膜と融合した後にシナプス小胞が作られるとする説がある[8]。前駆体小胞の軸索への選択的輸送には、モータータンパク質であるキネシン・ファミリータンパク質が関与している[9]。
機能分子
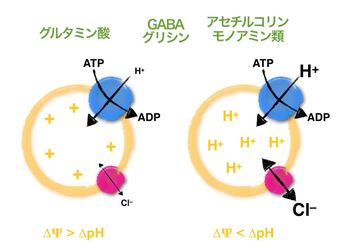
神経伝達物質のシナプス小胞への再充填はプロトンポンプが形成するプロトン電気化学勾配に依存している。グルタミン酸は膜電位勾配 (DY)を、アセチルコリン・モノアミン類は化学勾配(DpH)を主に駆動力として用いる。GABAやグリシンは、その中間に位置する。
神経伝達物質の再充填
形質膜上に存在し、放出された神経伝達物質の回収を行なうトランスポーターが細胞内外のナトリウムイオン勾配で駆動されるのに対して、シナプス小胞膜上の神経伝達物質トランスポーターは液胞型プロトンATPase (V-ATPase) が形成するプロトン(水素イオン)の電気化学勾配によって駆動される[10]。
V-ATPaseは少なくとも13個のサブユニットからなり分子量800 kDaを越える巨大な分子複合体で、1つのV-ATPase複合体はシナプス小胞総タンパク質の10%近くを占める。1つのATPをADPに加水分解する際に発生するエネルギーを用いて、約4つのプロトンを小胞内腔に運ぶことにより、膜電位とpH勾配を形成する。
膜電位とpH勾配の割合は小胞膜に存在する塩化物イオンチャネルの活性によって制御されていると考えられている[11]。哺乳類脳内に存在する神経伝達物質の内、正の電荷をもつアセチルコリンやモノアミン類はpH勾配によって輸送されるが、負の電荷をもつグルタミン酸は主に膜電位によって輸送される(図3)。GABAやグリシンはそれらの中間に位置する。すでにVAChT(アセチルコリン)、VMAT1/2(モノアミン)、VGLUT1/2/3(グルタミン酸)、VGAT(GABAとグリシン)がクローニングされているが、それぞれのトランスポーターの輸送メカニズムは不明である。最近、VGLUTの相同遺伝子として小胞へのATP輸送を司るVNUTが同定された[12] [13]。
Katzらが提唱したシナプス小胞の量子仮説(Quantal hypothesis)によれば、シナプス小胞内に含まれる神経伝達物質量は一定とされている。しかしながら、小胞型神経伝達物質トランスポーターを過剰発現させるとquantaが増大するとの報告がある[14] [15]。また、トランスポーターの発現量が減少しているヘテロマウスでは、てんかん様の症状の他、精神障害や認知機能の低下などの症状が見られることから、シナプス小胞再充填過程の破綻が脳機能に影響を与える可能性が示唆されている[16] [17]。
エキソサイトーシスの分子機構
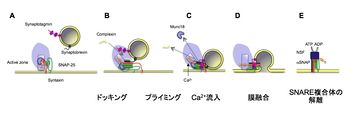
A. アクティブゾーン(active zone)には、Munc13, Rim, CASTなどの巨大タンパク質が存在し、Munc18やSyntaxinと複合体を形成している。
B. SNARE複合体を形成するとコンプレキシンが結合し、融合を阻害している。C→D. 細胞質にカルシウムが流入すると、Munc18やコンプレキシンが解離し、SynaptotagminがCa2+センサーとして働く。E. 小胞膜と形質膜が融合した後のSNARE複合体はNSFとaSNAPの働きで解離する。
シナプス前部におけるエキソサイトーシスは、時空間的に厳密な制御を受けている。活動電位がシナプス前部に到達すると電位依存性Ca2+チャネルを通じて細胞外からCa2+が流入し、100ミリ秒以内にエキソサイトーシスが起こる。従って、Ca2+依存的なシナプス小胞と形質膜の膜融合過程には、複雑な酵素反応が入る余地がない。すなわち、瞬時に放出可能な一部のシナプス小胞は形質膜に結合(ドッキング)した状態で、Ca2+濃度の上昇によるエキソサイトーシスの惹起に備えていると考えられている。現在では、シナプス小胞のエキソサイトーシスは、以下に詳述する(1)ドッキング、(2)プライミング、(3)膜融合、の3つの過程が異なる分子で制御されていると考えられている(図4)。
(1)ドッキング:シナプス前部には100個〜10万個のシナプス小胞が存在しているが、一部のシナプス小胞はアクティブゾーンと呼ばれる電子顕微鏡で電子密度が高い部位に存在し、形質膜と物理的に接しているように見える。このシナプス小胞の状態をドッキングと呼ぶ。シナプス小胞のドッキングを司るタンパク質として、可溶性タンパク質であるMunc18が知られている。Munc18は形質膜にあるt-SNAREであるシンタキシンの結合タンパク質として同定されたが、その遺伝子欠損マウスではシナプス伝達が完全に消失している[18] [19]。
ニューロンにおいてはシナプス小胞のドッキング過程が破綻している電子顕微鏡像は得られないが、副腎髄質のクロム親和性顆粒細胞では分泌顆粒のドッキングが著しく欠落していることが明らかとなった。現在では、小胞膜に存在するシナプトタグミン(後述)と2つのt-SNARE (シンタキシン, SNAP-25)もドッキング過程に重要であることが示唆されている[20]。ニューロンにおけるシナプス小胞ドッキングを司る分子機構は不明な点が多い。
(2)プライミング:電子顕微鏡像では形態的にドッキングしているにも関わらず、電気生理学的に神経伝達物質が放出されない遺伝子欠損マウスが幾つか報告されており、その結果からドッキングと膜融合の間に、小胞が膜融合する能力を獲得するステップ、すなわちプライミングの存在が提唱された。CAPS (Calcium-dependent Activator Protein for Secretion)や Munc13などがプライミング因子の候補として挙げられている[21]。これらのプライミング因子はSNAREタンパク質等の膜融合装置や形質膜でのセカンドメッセンジャー(PIP2やジアシルグリセロール)を介して働いていると考えられる。
(3)膜融合:シナプス小胞の形質膜への融合過程においては、3つのSNAREタンパク質が重要な役割を果たしている。James Rothmanらは、ゴルジ装置における物質輸送に必要な可溶性タンパク質としてN-エチルマレイミド感受性因子 (N-ethylmaleimide-sensitive factor, NSF)と可溶性N-エチルマレイミド感受性因子付着タンパク質 (Soluble NSF attachment protein, SNAP)という二種類のタンパク質を同定した。更にRothmanは、これら可溶性タンパク質の膜受容体(SNAP receptor = SNARE)を探索するにあたり、NSFとSNAP複合体に結合するタンパク質を脳由来の膜画分を用いて行なった結果、既にシナプスで同定されていたシナプトブレビンとシンタキシン、SNAP-25が同定された[22]。シナプトブレビンがシナプス小胞膜、シンタキシンとSNAP-25が形質膜にあることから、Rothmanはそれぞれvesicular SNARE (v-SNARE)とtarget-SNARE (t-SNARE)と名付け、シナプス小胞の形質膜の融合にはv-SNAREとt-SNAREがNSFやSNAPと巨大なタンパク質複合体を形成する必要があると提唱した。この「SNARE仮説」とその後の実証研究の功績によりRothmanは2013年ノーベル医学生理学賞を受賞した。現在では、NSFやSNAPは膜融合ではなく、膜融合後のSNAREタンパク質複合体を乖離させる働きをしていることが分かったが[23] [24]、SNAREタンパク質が膜融合を促進させるタンパク質であることは、リポソーム再構成実験によって示された[25]。
また、神経毒として知られる各種ボツリヌス毒素やテタヌス毒素が神経伝達物質の放出を阻害する作用は、それらがSNAREタンパク質を特異的に切断することによる[26]。
シナプス小胞のエキソサイトーシスの特徴は、Ca2+によって迅速に制御される点が挙げられる。シナプス小胞に豊富に存在するタンパク質であるシナプトタグミンは、リン脂質依存性タンパク質リン酸化酵素 (protein kinase C, PKC)のCa2+結合部位と相同性を持つC2ドメインを有するCa2+結合タンパク質であると同時にリン脂質やSNAREタンパク質への結合能を有する膜タンパク質であり、シナプス小胞膜上のCa2+センサーの候補である[27]。
Thomas Südhofらは、シナプトタグミン 1ノックアウトマウス由来の神経培養細胞を解析した結果、活動電位に同期して起こる迅速なシナプス伝達が消失していることを見いだした。しかしながら、活動電位に同期しない遅いシナプス応答は依然として見られることから、シナプトタグミンが速いシナプス小胞のエキソサイトーシスにおけるCa2+センサーであると考えられている[28]。実際、Ca2+に対する親和性が低下するシナプトタグミン変異体のノックインマウスの海馬培養細胞では、小胞の放出確率が優位に有為に低下することが示されている[29]。
遅いエキソサイトーシスを担うCa2+センサーとして、他のシナプトタグミンイソ型の関与が提唱されている[30]。また、自発的エキソサイトーシスや遅いエキソサイトーシスに関わるCa2+センサーとしてCa2+親和性の高い可溶性Ca2+結合タンパク質であるDoc2の関与も示唆されている[31] [32]。
Ca2+濃度の上昇後、極めて迅速にエキソサイトーシスが起こることを考えると、プライミングされたシナプス小胞において形成されたSNARE複合体が、Ca2+濃度の上昇が起こらない時には膜融合を引き起こさないように抑制している因子の存在が考えられる。この役割を果たしていると考えられているのがコンプレキシンという小さな可溶性タンパク質である。コンプレキシンはSNAREタンパク質単独には結合せずSNARE複合体に高い親和性を有するタンパク質として知られている[33]。現在のモデルでは、コンプレキシンがSNARE複合体に結合することで、v-SNAREとt-SNAREの複合体形成が不完全な状態で保たれており(clamped)、Ca2+濃度の上昇に伴いコンプレキシンが複合体から解離し、そこにCa2+センサーであるシナプトタグミンが複合体に入ることによりエキソサイトーシスが達成すると考えられている[34] [35]。
エンドサイトーシスの分子機構
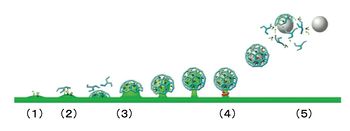
エンドサイトーシスには、刺激頻度に応じて要する時間が異なる幾つかの仕組みが存在すると考えられている。比較的弱い刺激でエキソサイトーシスを起こした場合、クラスリン被覆に依存したエンドサイトーシスが1分以内で完了する(時定数15−20秒程度)。それに対して、1秒以内に完了する高速のエンドサイトーシスも観察されており、Kiss-and-Runと呼ばれている。また、強い連続刺激を与えた時には、エンドサイトーシスを支える分子機構が飽和するため、遅いエンドサイトーシスが起こる。この時、エキソサイトーシスで形質膜に挿入したシナプス小胞膜成分を回収するために、大きな膜構造の陥入像が見られるため、バルクエンドサイトーシスと名付けられている。クラスリン被覆依存的エンドサイトーシスの分子機構については、多くの研究により詳細が明らかになっているので、以下の(1)〜(6)に概説する[36](図5)。
(1)エンドサイトーシスの開始:エキソサイトーシスで形質膜に挿入されたシナプス小胞膜構成成分を回収するための目印となるのがPIP2であると考えられている。その部位にインターセクチンやeps15等のタンパク質が集積する。
(2)アダプタータンパク質群の集積:脂質膜とクラスリン被覆の結合を媒介するのが、AP-2やAP180などのアダプタータンパク質である。ストニン 2、エプシンなどの関与も示唆されている。
(3)クラスリン被覆の形成:アダプタータンパク質タンパク質群にリクルートされる形でクラスリン被覆が集積し、球状のクラスリン被覆小胞が形成される。クラスリンは重鎖と軽鎖からなり三脚巴構造(Triskelion)を形成する。これが複数重合することによって格子を形成し、サッカーボール状のクラスリン被覆小胞が作られる。
(4)膜の分断:クラスリン被覆小胞が最終的に形質膜から分断される過程を司るのはダイナミンというタンパク質である。ダイナミンはGTP分解酵素活性をもち、GTPを加水分解する時のエネルギーを使って、立体構造を変化させることで膜の分断を行なうと考えられている。古くはショウジョウバエの温度感受性変異体であるshibireの変異遺伝子としてエンドサイトーシス過程における膜の最終的な分断に関わることが提唱されていた[5](上述)。一方、ダイナミン1ノックアウトマウスの研究から、ダイナミン1がなくてもエンドサイトーシスが完全に損なわれるわけではないことが示された[37]。電子顕微鏡像の三次元再構築を行なうと、ダイナミン1ノックアウトマウスのシナプス前部には、出来かけのクラスリン被覆小胞が形質膜から伸びた管状の膜構造に房状に付着していると思われる様子が観察された。
(5)クラスリン被覆の脱落:クラスリン被覆小胞が形質膜から分断されると、シナプス前部細胞質においてクラスリン被覆の脱落が起こる。遺伝子欠損マウスの結果から、この過程では分子シャペロンHsc70やcyclin G依存的キナーゼであるオーキシンが重要な役割を果たしていると考えられている。
(6)多様なエンドサイトーシス関連タンパク質群:上記以外にもエンドサイトーシスに関わるとされるタンパク質が多く見つかっているが、その詳細な機能は未解明である。エンドフィリンやアンフィフィシンなどはBAR部位という特徴的な部位を持ち、膜に結合することで膜の歪曲を決定すると考えられている。例えばエンドフィリンは発見当初、クラスリン被覆小胞の形成が完了する際に、形質膜と小胞のつなぎ目のネック部分に集積して、ネックの直径を決めると考えられていた[38]。また、エンドフィリンのC末端側がダイナミンと直接結合することでダイナミンをネック部分に集積させる役割が提唱されていた。しかしながら、エンドフィリン1~3トリプルノックアウトマウスでは、予想されたクラスリン被覆小胞の形質膜での集積ではなく、シナプス前部細胞質におけるクラスリン被覆小胞の割合の増加が観察された[39]。このことからエンドフィリンはクラスリン被覆小胞の形質膜からの分断以降のクラスリン被覆の脱落過程において重要な役割を果たしていることが明らかになった。その他にも脂質脱リン酸化酵素であるシナプトジャニンを含め多くのタンパク質がエンドサイトーシスを制御していると考えられている。
シナプス小胞リサイクリングの研究手法
シナプス小胞は直径40ナノメートルと小さいため、通常の光学顕微鏡で動態を観察するのは困難である。そのため従来のシナプス前部研究はシナプス後部において測定するシナプス応答から類推したり、脳幹に存在する巨大シナプスであるヘルドのカリックスシナプスを標本とした実験に頼っていた。近年、蛍光指示薬や蛍光タンパク質を利用したイメージング技術が開発され、分子操作が容易な神経培養細胞を用いたシナプス前部研究が可能になった。以下に、シナプス小胞リサイクリングを研究するための代表的な研究手法を紹介する。
神経初代培養を用いた電気生理学的解析
胎児期あるいは生誕直後の海馬や大脳皮質から神経細胞の分散培養を作成し、電気生理学的手法により後シナプス電流を検出することにより、シナプス前部での現象を類推することができる。胎生致死の遺伝子欠損マウスの場合でも、神経初代培養は作成できる場合が多いのが利点である。初期のシナプス小胞タンパク質の機能解析は、特に海馬由来のオータプス培養(1つの神経細胞が自分自身にシナプスを作る)が積極的に用いられた。神経培養細胞に遺伝子導入する方法も改良が重ねられ、遺伝子欠損の影響のみならず、レスキュー実験やタンパク質の構造−機能連関研究などに威力を発揮できる実験系である[28] [29] [40]。
ヘルドのカリックスシナプスを用いた電気生理学的解析
哺乳類の脳幹部位に存在する聴覚系の中継シナプスである。その類い稀な大きさ故、脳幹スライス標本においてシナプス前部とシナプス後部から同時にパッチクランプ記録が可能である。また、シナプス前部側のガラス電極にシグナル分子を修飾する薬物や内在性タンパク質相互作用を修飾する抗体やペプチドを導入し、そのシナプス伝達に対する効果をシナプス後部側の応答で検証できる。更に、膜容量測定法を適用することで、エキソサイトーシスやエンドサイトーシスに伴う膜容量の変化を測定することも可能であり、シナプス前部の分子メカニズムを調べるための中枢神経系のモデル標本として用いられている[41]。
欠点としては、急性スライス標本であるため遺伝子の導入が困難であることや、胎生致死の遺伝子欠損マウスの解析が不可能であることが挙げられるが、近年、ウイルスベクターを利用してヘルドのカリックスシナプスに選択的に遺伝子導入する方法も開発されている[42]。
FM色素を用いた解析
1990年代にWillam Betzらはスチリル色素(FM色素)を開発し、生きた細胞の細胞膜を蛍光標識することに成功した[43] [44]。FM色素は両親媒性の蛍光色素で、疎水性の部分が膜に侵入するが、親水性の部分があるために脂質二重膜の片側に留まる性質を持つ。また、膜に結合することで蛍光が数十倍〜100倍に上昇すること、膜への結合は可逆的であることも特徴である。
これらの性質を利用すると、神経刺激依存的に形質膜からエンドサイトーシスされるシナプス小胞を蛍光標識できる。また、一度取り込まれたFM色素はエキソサイトーシスに伴い小胞から放出される性質を持つため、シナプス小胞のリサイクリングの特性を解析できるツールとしてしばしば用いられている。FM色素には、疎水性の異なるものが幾つかあり(FM1-43、FM2-10)、疎水性の度合いにより膜への吸着や解離の特性が異なる。そのため、エンドサイトーシス時に標識されるシナプス小胞のプールに違いが見られ、またエキソサイトーシス時に解離する度合いが異なることから、シナプス小胞リサイクリングの多様な特性が明らかになってきた。
pH感受性GFP(pHluorin)を用いた解析
緑色蛍光蛋白質(GFP)の蛍光強度は溶液のpHにより変化する。GFPの遺伝子に変異を加え蛍光強度のpH依存的変化を増幅させた変異体がpHluorinである[45]。pHluorinは7.1程度のpKa値を示し、中性域では強い蛍光を発するが、弱酸性域では蛍光が減弱する。この蛍光変化は可逆的である。シナプス小胞内腔はV-ATPaseの働きにより弱酸性に保たれているため、pHluorinをシナプス小胞タンパク質の内腔側に融合させて遺伝子導入させると、小胞内腔に存在する時は蛍光を発せず、エキソサイトーシスに伴って細胞外の中性溶液に暴露された時に強い蛍光を発する。その後形質膜に移行したpHluorinを持つシナプス小胞タンパク質がエンドサイトーシスによって新たな小胞に回収されると、小胞内腔が酸性化され、再び蛍光が消失する。最初に用いられたシナプトブレビンに融合させたSynaptopHluorinは細胞表面への局在が多くシグナル−ノイズ比が低いことが問題となっていたが、その後シナプトフィジンやVGLUT1の内腔側に融合させた改良版が作られ[46] [47]、1小胞イメージングなども可能となり、エンドサイトーシスや小胞酸性化の動態や速度論的解析が現在活発に進められている[48]。ただし、厳密に言えばpHluorinを融合させたタンパク質の動態を観察しているのであり、小胞「膜」のエンドサイトーシスを直接観察している訳ではないことに留意する必要がある。
有芯顆粒
中枢神経系シナプスの一部にはシナプス小胞よりも大きく(直径100~300ナノメートル)、電子顕微鏡で内腔が黒く見える大型有芯顆粒(Large Dense Core Vesicle: LDCV)が含まれるものがある(図1)。
シナプス小胞はシナプス前部の形質膜形質膜近傍からクラスター状に多数存在するのに対して、LDCVはシナプス部位から離れた部位に散在している。シナプス小胞には速い神経伝達を担うグルタミン酸、GABA、グリシン、アセチルコリンが含まれているのに対して、LDCVにはドーパミンなどのモノアミン類や神経ペプチド、多種多様な神経栄養因子を神経伝達物質として含まれている。また、交感神経のシナプスにおいては、ノルエピネフリンやセロトニンを含む60〜80 nmの有芯小胞が見られ、これをLDCVと区別してsmall dense core vesicle(SDCV)と呼ぶ場合もある。シナプス小胞とLDCVは中に含まれる神経伝達物質の違いに加え、様々な性質が異なる。シナプス小胞から放出される神経伝達物質神経伝達物質は、主にシナプス後部側のイオンチャネル型受容体に作用するため、シナプス後部側に電気的なシナプス応答を引き起こす。一方、LDCVに含まれる伝達物質はシナプス後部側のGタンパク共役型受容体や神経栄養因子受容体に作用し、セカンドメッセンジャーを介したシナプス伝達の修飾を行う。
中枢神経系でのLDCVからの伝達物質放出機構は明らかではないが、クロム親和性細胞を用いた研究から、シナプス小胞同様、SNARE複合体による膜融合で伝達物質放出を行っていると考えられている。しかし、シナプス小胞とLDCVではカルシウムに対する応答性に違いがあることが知られている。伝達物質放出のためにシナプス小胞がシナプス前部局所での高濃度のCa2+濃度上昇を必要とするのに対し、LDCVは持続的な低濃度のCa2+濃度上昇を必要とする[49]。SNARE複合体に含まれるシナプトブレビンやCa2+センサーであるシナプトタグミンなどにはアイソフォームがあり、シナプス小胞とLDCVに存在するこれらのアイソフォームが異なる可能性が示唆されている [1][50]。
またCa2+感受性タンパク質であるCAPSはLDCVにのみ存在する。シナプス小胞とLDCVはこれらのタンパク質の違いによってCa2+イオンの感受性やエキソサイトーシス・エンドサイトーシスの速度に相違が生まれるのかもしれないが、今後の研究による更なる解明が期待される。
このようなシナプス活性帯からの距離的な差異や、活性化させる受容体の違い、またシナプス前膜と膜融合を起こすのに必要なカルシウムの応答性の相違などによって、LDCV内の伝達物質はシナプス小胞内の神経伝達物質よりも遅い速度でシナプス後部側に作用する。更に、シナプス小胞は伝達物質の放出後、エンドサイトーシスによって再取り込みされ、シナプス前部局所で伝達物質の再充填が行われるのに対し、LDCVは一度きりの放出で、新たなLDCVはトランスゴルジネットワークから生成される、というように生成過程においても違いがある。シナプス前部にシナプス小胞とLDCVの両方が存在するシナプスが脳の各部位で見つかっている。そのようなシナプスではひとつのシナプス前終末に神経伝達物質を2種類以上有することになるが、この伝達物質の組み合わせは脳の部位によって異なり、 これがそれぞれのシナプスにおけるシナプス伝達の多様性に寄与していると考えられる[51]。
関連項目
- シナプス前部
- アクティブゾーン
- SNARE複合体
- シナプトタグミン
- シンタキシン
- シナプトフィジン
- 小胞型アセチルコリントランスポーター
- 小胞型グルタミン酸トランスポーター
- 小胞型モノアミントランスポーター
- CAPS
- 有芯顆粒
- FM1-43
- ヘルドのカリックスシナプス
参考文献
- ↑ 1.0 1.1
Dean, C., Dunning, F.M., Liu, H., Bomba-Warczak, E., Martens, H., Bharat, V., ..., & Chapman, E.R. (2012).
Axonal and dendritic synaptotagmin isoforms revealed by a pHluorin-syt functional screen. Molecular biology of the cell, 23(9), 1715-27. [PubMed:22398727] [PMC] [WorldCat] [DOI] - ↑
DEL CASTILLO, J., & KATZ, B. (1954).
Quantal components of the end-plate potential. The Journal of physiology, 124(3), 560-73. [PubMed:13175199] [PMC] [WorldCat] [DOI] - ↑ Palade, G.E., Palay, S.L.,
Electron microscope observations of interneuronal and neuromuscular synapses.
Anat. Rec., 1954. 118: p. 335-336. - ↑
Heuser, J.E., & Reese, T.S. (1973).
Evidence for recycling of synaptic vesicle membrane during transmitter release at the frog neuromuscular junction. The Journal of cell biology, 57(2), 315-44. [PubMed:4348786] [PMC] [WorldCat] [DOI] - ↑ 5.0 5.1
Koenig, J.H., & Ikeda, K. (1989).
Disappearance and reformation of synaptic vesicle membrane upon transmitter release observed under reversible blockage of membrane retrieval. The Journal of neuroscience : the official journal of the Society for Neuroscience, 9(11), 3844-60. [PubMed:2573698] [WorldCat] - ↑ 6.0 6.1
Takamori, S., Holt, M., Stenius, K., Lemke, E.A., Grønborg, M., Riedel, D., ..., & Jahn, R. (2006).
Molecular anatomy of a trafficking organelle. Cell, 127(4), 831-46. [PubMed:17110340] [WorldCat] [DOI] - ↑
GRAY, E.G. (1959).
Axo-somatic and axo-dendritic synapses of the cerebral cortex: an electron microscope study. Journal of anatomy, 93, 420-33. [PubMed:13829103] [PMC] [WorldCat] - ↑
Zhai, R.G., Vardinon-Friedman, H., Cases-Langhoff, C., Becker, B., Gundelfinger, E.D., Ziv, N.E., & Garner, C.C. (2001).
Assembling the presynaptic active zone: a characterization of an active one precursor vesicle. Neuron, 29(1), 131-43. [PubMed:11182086] [WorldCat] [DOI] - ↑
Maeder, C.I., San-Miguel, A., Wu, E.Y., Lu, H., & Shen, K. (2014).
In vivo neuron-wide analysis of synaptic vesicle precursor trafficking. Traffic (Copenhagen, Denmark), 15(3), 273-91. [PubMed:24320232] [WorldCat] [DOI] - ↑
Moriyama, Y., & Futai, M. (1990).
H(+)-ATPase, a primary pump for accumulation of neurotransmitters, is a major constituent of brain synaptic vesicles. Biochemical and biophysical research communications, 173(1), 443-8. [PubMed:1979489] [WorldCat] [DOI] - ↑
Edwards, R.H. (2007).
The neurotransmitter cycle and quantal size. Neuron, 55(6), 835-58. [PubMed:17880890] [WorldCat] [DOI] - ↑
Sawada, K., Echigo, N., Juge, N., Miyaji, T., Otsuka, M., Omote, H., ..., & Moriyama, Y. (2008).
Identification of a vesicular nucleotide transporter. Proceedings of the National Academy of Sciences of the United States of America, 105(15), 5683-6. [PubMed:18375752] [PMC] [WorldCat] [DOI] - ↑
Hiasa, M., Togawa, N., & Moriyama, Y. (2014).
Vesicular nucleotide transport: a brief history and the vesicular nucleotide transporter as a target for drug development. Current pharmaceutical design, 20(16), 2745-9. [PubMed:23886392] [WorldCat] [DOI] - ↑
Wojcik, S.M., Rhee, J.S., Herzog, E., Sigler, A., Jahn, R., Takamori, S., ..., & Rosenmund, C. (2004).
An essential role for vesicular glutamate transporter 1 (VGLUT1) in postnatal development and control of quantal size. Proceedings of the National Academy of Sciences of the United States of America, 101(18), 7158-63. [PubMed:15103023] [PMC] [WorldCat] [DOI] - ↑
Wilson, N.R., Kang, J., Hueske, E.V., Leung, T., Varoqui, H., Murnick, J.G., ..., & Liu, G. (2005).
Presynaptic regulation of quantal size by the vesicular glutamate transporter VGLUT1. The Journal of neuroscience : the official journal of the Society for Neuroscience, 25(26), 6221-34. [PubMed:15987952] [PMC] [WorldCat] [DOI] - ↑
Schallier, A., Massie, A., Loyens, E., Moechars, D., Drinkenburg, W., Michotte, Y., & Smolders, I. (2009).
vGLUT2 heterozygous mice show more susceptibility to clonic seizures induced by pentylenetetrazol. Neurochemistry international, 55(1-3), 41-4. [PubMed:19171171] [WorldCat] [DOI] - ↑
Tordera, R.M., Totterdell, S., Wojcik, S.M., Brose, N., Elizalde, N., Lasheras, B., & Del Rio, J. (2007).
Enhanced anxiety, depressive-like behaviour and impaired recognition memory in mice with reduced expression of the vesicular glutamate transporter 1 (VGLUT1). The European journal of neuroscience, 25(1), 281-90. [PubMed:17241289] [WorldCat] [DOI] - ↑
Hata, Y., Slaughter, C.A., & Südhof, T.C. (1993).
Synaptic vesicle fusion complex contains unc-18 homologue bound to syntaxin. Nature, 366(6453), 347-51. [PubMed:8247129] [WorldCat] [DOI] - ↑
Verhage, M., Maia, A.S., Plomp, J.J., Brussaard, A.B., Heeroma, J.H., Vermeer, H., ..., & Südhof, T.C. (2000).
Synaptic assembly of the brain in the absence of neurotransmitter secretion. Science (New York, N.Y.), 287(5454), 864-9. [PubMed:10657302] [WorldCat] [DOI] - ↑
Mohrmann, R., de Wit, H., Connell, E., Pinheiro, P.S., Leese, C., Bruns, D., ..., & Sørensen, J.B. (2013).
Synaptotagmin interaction with SNAP-25 governs vesicle docking, priming, and fusion triggering. The Journal of neuroscience : the official journal of the Society for Neuroscience, 33(36), 14417-30. [PubMed:24005294] [PMC] [WorldCat] [DOI] - ↑
James, D.J., & Martin, T.F. (2013).
CAPS and Munc13: CATCHRs that SNARE Vesicles. Frontiers in endocrinology, 4, 187. [PubMed:24363652] [PMC] [WorldCat] [DOI] - ↑
Söllner, T., Whiteheart, S.W., Brunner, M., Erdjument-Bromage, H., Geromanos, S., Tempst, P., & Rothman, J.E. (1993).
SNAP receptors implicated in vesicle targeting and fusion. Nature, 362(6418), 318-24. [PubMed:8455717] [WorldCat] [DOI] - ↑
Swanton, E., Bishop, N., Sheehan, J., High, S., & Woodman, P. (2000).
Disassembly of membrane-associated NSF 20S complexes is slow relative to vesicle fusion and is Ca(2+)-independent. Journal of cell science, 113 ( Pt 10), 1783-91. [PubMed:10769209] [WorldCat] - ↑
Otto, H., Hanson, P.I., & Jahn, R. (1997).
Assembly and disassembly of a ternary complex of synaptobrevin, syntaxin, and SNAP-25 in the membrane of synaptic vesicles. Proceedings of the National Academy of Sciences of the United States of America, 94(12), 6197-201. [PubMed:9177194] [PMC] [WorldCat] [DOI] - ↑
Weber, T., Zemelman, B.V., McNew, J.A., Westermann, B., Gmachl, M., Parlati, F., ..., & Rothman, J.E. (1998).
SNAREpins: minimal machinery for membrane fusion. Cell, 92(6), 759-72. [PubMed:9529252] [WorldCat] [DOI] - ↑
Sutton, R.B., Fasshauer, D., Jahn, R., & Brunger, A.T. (1998).
Crystal structure of a SNARE complex involved in synaptic exocytosis at 2.4 A resolution. Nature, 395(6700), 347-53. [PubMed:9759724] [WorldCat] [DOI] - ↑
Brose, N., Petrenko, A.G., Südhof, T.C., & Jahn, R. (1992).
Synaptotagmin: a calcium sensor on the synaptic vesicle surface. Science (New York, N.Y.), 256(5059), 1021-5. [PubMed:1589771] [WorldCat] [DOI] - ↑ 28.0 28.1
Geppert, M., Goda, Y., Hammer, R.E., Li, C., Rosahl, T.W., Stevens, C.F., & Südhof, T.C. (1994).
Synaptotagmin I: a major Ca2+ sensor for transmitter release at a central synapse. Cell, 79(4), 717-27. [PubMed:7954835] [WorldCat] [DOI] - ↑ 29.0 29.1
Fernández-Chacón, R., Königstorfer, A., Gerber, S.H., García, J., Matos, M.F., Stevens, C.F., ..., & Südhof, T.C. (2001).
Synaptotagmin I functions as a calcium regulator of release probability. Nature, 410(6824), 41-9. [PubMed:11242035] [WorldCat] [DOI] - ↑
Bacaj, T., Wu, D., Yang, X., Morishita, W., Zhou, P., Xu, W., ..., & Südhof, T.C. (2013).
Synaptotagmin-1 and synaptotagmin-7 trigger synchronous and asynchronous phases of neurotransmitter release. Neuron, 80(4), 947-59. [PubMed:24267651] [PMC] [WorldCat] [DOI] - ↑
Yao, J., Gaffaney, J.D., Kwon, S.E., & Chapman, E.R. (2011).
Doc2 is a Ca2+ sensor required for asynchronous neurotransmitter release. Cell, 147(3), 666-77. [PubMed:22036572] [PMC] [WorldCat] [DOI] - ↑
Groffen, A.J., Martens, S., Díez Arazola, R., Cornelisse, L.N., Lozovaya, N., de Jong, A.P., ..., & Verhage, M. (2010).
Doc2b is a high-affinity Ca2+ sensor for spontaneous neurotransmitter release. Science (New York, N.Y.), 327(5973), 1614-8. [PubMed:20150444] [PMC] [WorldCat] [DOI] - ↑
McMahon, H.T., Missler, M., Li, C., & Südhof, T.C. (1995).
Complexins: cytosolic proteins that regulate SNAP receptor function. Cell, 83(1), 111-9. [PubMed:7553862] [WorldCat] [DOI] - ↑
Maximov, A., Tang, J., Yang, X., Pang, Z.P., & Südhof, T.C. (2009).
Complexin controls the force transfer from SNARE complexes to membranes in fusion. Science (New York, N.Y.), 323(5913), 516-21. [PubMed:19164751] [PMC] [WorldCat] [DOI] - ↑
Giraudo, C.G., Garcia-Diaz, A., Eng, W.S., Chen, Y., Hendrickson, W.A., Melia, T.J., & Rothman, J.E. (2009).
Alternative zippering as an on-off switch for SNARE-mediated fusion. Science (New York, N.Y.), 323(5913), 512-6. [PubMed:19164750] [PMC] [WorldCat] [DOI] - ↑ 36.0 36.1
Saheki, Y., & De Camilli, P. (2012).
Synaptic vesicle endocytosis. Cold Spring Harbor perspectives in biology, 4(9), a005645. [PubMed:22763746] [PMC] [WorldCat] [DOI] - ↑
Ferguson, S.M., Brasnjo, G., Hayashi, M., Wölfel, M., Collesi, C., Giovedi, S., ..., & De Camilli, P. (2007).
A selective activity-dependent requirement for dynamin 1 in synaptic vesicle endocytosis. Science (New York, N.Y.), 316(5824), 570-4. [PubMed:17463283] [WorldCat] [DOI] - ↑
Ferguson, S.M., Ferguson, S., Raimondi, A., Paradise, S., Shen, H., Mesaki, K., ..., & De Camilli, P. (2009).
Coordinated actions of actin and BAR proteins upstream of dynamin at endocytic clathrin-coated pits. Developmental cell, 17(6), 811-22. [PubMed:20059951] [PMC] [WorldCat] [DOI] - ↑
Milosevic, I., Giovedi, S., Lou, X., Raimondi, A., Collesi, C., Shen, H., ..., & De Camilli, P. (2011).
Recruitment of endophilin to clathrin-coated pit necks is required for efficient vesicle uncoating after fission. Neuron, 72(4), 587-601. [PubMed:22099461] [PMC] [WorldCat] [DOI] - ↑
Ikeda, K., & Bekkers, J.M. (2006).
Autapses. Current biology : CB, 16(9), R308. [PubMed:16682332] [WorldCat] [DOI] - ↑
Schneggenburger, R., & Forsythe, I.D. (2006).
The calyx of Held. Cell and tissue research, 326(2), 311-37. [PubMed:16896951] [WorldCat] [DOI] - ↑
Young, S.M., & Neher, E. (2009).
Synaptotagmin has an essential function in synaptic vesicle positioning for synchronous release in addition to its role as a calcium sensor. Neuron, 63(4), 482-96. [PubMed:19709630] [WorldCat] [DOI] - ↑
Betz, W.J., & Bewick, G.S. (1992).
Optical analysis of synaptic vesicle recycling at the frog neuromuscular junction. Science (New York, N.Y.), 255(5041), 200-3. [PubMed:1553547] [WorldCat] [DOI] - ↑
Hoopmann, P., Rizzoli, S.O., & Betz, W.J. (2012).
Imaging synaptic vesicle recycling by staining and destaining vesicles with FM dyes. Cold Spring Harbor protocols, 2012(1), 77-83. [PubMed:22194270] [WorldCat] [DOI] - ↑
Miesenböck, G., De Angelis, D.A., & Rothman, J.E. (1998).
Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature, 394(6689), 192-5. [PubMed:9671304] [WorldCat] [DOI] - ↑
Granseth, B., Odermatt, B., Royle, S.J., & Lagnado, L. (2006).
Clathrin-mediated endocytosis is the dominant mechanism of vesicle retrieval at hippocampal synapses. Neuron, 51(6), 773-86. [PubMed:16982422] [WorldCat] [DOI] - ↑
Voglmaier, S.M., Kam, K., Yang, H., Fortin, D.L., Hua, Z., Nicoll, R.A., & Edwards, R.H. (2006).
Distinct endocytic pathways control the rate and extent of synaptic vesicle protein recycling. Neuron, 51(1), 71-84. [PubMed:16815333] [WorldCat] [DOI] - ↑
Balaji, J., & Ryan, T.A. (2007).
Single-vesicle imaging reveals that synaptic vesicle exocytosis and endocytosis are coupled by a single stochastic mode. Proceedings of the National Academy of Sciences of the United States of America, 104(51), 20576-81. [PubMed:18077369] [PMC] [WorldCat] [DOI] - ↑
Torrealba, F., & Carrasco, M.A. (2004).
A review on electron microscopy and neurotransmitter systems. Brain research. Brain research reviews, 47(1-3), 5-17. [PubMed:15572159] [DOI] - ↑
Zhang, Z., Wu, Y., Wang, Z., Dunning, F.M., Rehfuss, J., Ramanan, D., ..., & Jackson, M.B. (2011).
Release mode of large and small dense-core vesicles specified by different synaptotagmin isoforms in PC12 cells. Molecular biology of the cell, 22(13), 2324-36. [PubMed:21551071] [PMC] [WorldCat] [DOI] - ↑
Salio, C., Lossi, L., Ferrini, F., & Merighi, A. (2006).
Neuropeptides as synaptic transmitters. Cell and tissue research, 326(2), 583-98. [PubMed:16847638] [WorldCat] [DOI]