「ゲフィリン」の版間の差分
細編集の要約なし |
|||
| (3人の利用者による、間の27版が非表示) | |||
| 6行目: | 6行目: | ||
<font size="+1">鍋倉 淳一</font><br> | <font size="+1">鍋倉 淳一</font><br> | ||
''大学共同利用機関法人 自然科学研究機構 生理学研究所''<br> | ''大学共同利用機関法人 自然科学研究機構 生理学研究所''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2015年2月26日 原稿完成日:2015年月日<br> | ||
担当編集委員:[http://researchmap.jp/michisukeyuzaki 柚崎 通介](慶應義塾大学 医学部生理学)<br> | 担当編集委員:[http://researchmap.jp/michisukeyuzaki 柚崎 通介](慶應義塾大学 医学部生理学)<br> | ||
</div> | </div> | ||
英語名:Gephyrin 英略称:GPHN | |||
{{box|text= ゲフィリンは、抑制性シナプス後膜における足場タンパク質であり、グリシン受容体および一部のGABA<sub>A</sub> | {{box|text= | ||
ゲフィリンは、抑制性シナプス後膜における足場タンパク質であり、グリシン受容体および一部のGABA<sub>A</sub>受容体のシナプス局在に関わっている(図1)。ゲフィリンの機能や局在は翻訳後修飾、関連タンパク質との結合、神経活動、受容体の活性など様々な要因によって制御される。この他、尿酸生成や造血作用に関わるMoCo(モリブデン補因子)の生合成における触媒作用も知られている<ref name=ref1><pubmed></pubmed></ref>。 | |||
}} | }} | ||
{{PBB|geneid=10243}} | |||
==基本構造== | |||
[[image:ゲフィリン1.png|thumb|400px|'''図1.抑制性[[シナプス]]後膜におけるゲフィリン'''<br>Gドメインの三量体形成とEドメインの二量体形成による六方格子(hexagonal lattice)モデルが仮定されている<ref name=ref6><pubmed></pubmed></ref> <ref name=ref7><pubmed></pubmed></ref>。<br> | |||
注: [[グリシン]]受容体のサブユニット構成比(3つのαサブユニットと2つのβサブユニット、もしくは2つのαサブユニットと3つのβサブユニット)については、まだ明確になっていない<ref name=ref19><pubmed></pubmed></ref>。]] | |||
=== | 93 kDaの表在性[[膜タンパク質]]として同定されたゲフィリンは<ref name=ref2><pubmed></pubmed></ref> <ref name=ref3><pubmed></pubmed></ref>、自己オリゴマー化によって凝集体を形成する<ref name=ref1 />。G、C、Eの3ドメインから成り、GドメインN末端(20 kDa)とEドメインC末端(43 kDa)がCドメイン(リンカー領域: 18-21 kDa)に結合している<ref name=ref4><pubmed></pubmed></ref>。Gドメインは安定した三量体を形成する一方、Eドメインは二量体を形成し、グリシン受容体βサブユニットの細胞内ループ(M3-M4)に高親和性を示す。グリシン受容体βサブユニットにおける[[セリン]]残基403がプロテインキナーゼC (PKC)によってリン酸化されると、ゲフィリンとの結合が減少する<ref name=ref5><pubmed></pubmed></ref>。また、結晶構造解析の結果から、ゲフィリンの二量体形成面におけるフェニルアラニン残基330、チロシン残基673、[[プロリン]]残基713残基がゲフィリンとの高い親和性に重要であると考えられる<ref name=ref4 />。「リンカー領域」とも呼ばれるCドメインにはゲフィリン結合タンパクの作用部位があり、Pin1(peptidyl-prolyl isomerase NIMA interacting protein 1)は188-201配列に、[[Dynein]] light chain 1(Dlc1)およびDynein light chain 2(Dlc2)は203-212配列に、[[アクチン]]重合に関与する[[Cdc42]]に選択的なコリビスチン(collybistin)は319-329配列に作用する。また、タンパク分解をされやすいのもCドメインである。 | ||
組み換えゲフィリンの過剰発現実験の結果から、様々な[[細胞株]]において凝集体を形成することが確認されており、現在はGドメインの三量体化とEドメインの二量体化による六方格子(hexagonal lattice)モデルが仮定されている<ref name=ref6 /> <ref name=ref7 />(図1)。 | |||
==グリシン受容体/AGAB<sub>A</sub>受容体の固定化== | |||
[[image:ゲフィリン2.png|thumb|400px|'''図2.シナプス後膜におけるゲフィリンの局在(小矢印)'''<br>DAB染色による電子顕微鏡画像 (スケールバー 0.3 μm)Giustetto et al., (1998) 使用許諾 未取得]] | |||
グリシン受容体が集積するマイクロドメインは、グリシン作動性[[シナプス前終末]]と対応したシナプス後膜に認められる<ref name=ref8><pubmed></pubmed></ref>(図2)。その際、グリシン受容体βサブユニットの細胞質ループに存在する18のアミノ酸モチーフにゲフィリンが結合することで、シナプス後膜におけるグリシン受容体の係留に関与している<ref name=ref9><pubmed></pubmed></ref>。そのため、[[免疫組織化学法]]においては、しばしば(グリシン受容体βサブユニットとヘテロマーを形成する)グリシン受容体α1サブユニット特異的抗体を用い、ゲフィリン抗体と二重染色することでシナプス後膜に局在するグリシン受容体が標識される。 | |||
[[ | |||
但し、ゲフィリンはグリシン受容体α2サブユニットにも低親和性結合を示すことから、α2ホモメリックグリシン受容体がシナプスに係留される可能性も示唆されている<ref name=ref10><pubmed></pubmed></ref> <ref name=ref11><pubmed></pubmed></ref>。 | |||
= | 実際にアンチセンスオリゴヌクレオチドによってゲフィリンの発現を阻害すると、シナプスにおけるグリシン受容体の局在が減少する<ref name=ref12><pubmed></pubmed></ref>。更に、相同組み換えによって全てのゲフィリンアイソフォームをノックアウトした[[マウス]]では、シナプスにおけるグリシン受容体の局在が減少する<ref name=ref13><pubmed></pubmed></ref>。こうしたことから、グリシン受容体はゲフィリンと結合することで凝集体を形成し、解離することで拡散することが知られている<ref name=ref14><pubmed></pubmed></ref> <ref name=ref15><pubmed></pubmed></ref>。 | ||
GABA<sub>A</sub>受容体については、ゲフィリンとGABA<sub>A</sub>受容体α2サブユニット、γ2サブユニットの結合が示唆されている<ref name=ref16><pubmed></pubmed></ref> <ref name=ref17><pubmed></pubmed></ref>。また、GABARAPはゲフィリンCドメインと結合するものの、GABA<sub>A</sub>受容体とゲフィリンの輸送に必須ではない<ref name=ref18><pubmed></pubmed></ref>。グリシン受容体に比べGABA<sub>A</sub>受容体のサブユニットは多様であり、GABA<sub>A</sub>受容体に対するゲフィリンの役割は未だ十分明らかになっていない。 | |||
= | また、ゲフィリンはシナプス後膜における[[細胞接着分子]]であるニューロリギンとの結合が知られている<ref name=ref19><pubmed></pubmed></ref>。ニューロリギン2欠損マウスでは、ゲフィリンのシナプス局在が減少し、[[GABA]]およびグリシン作動性の微小シナプス後膜電流(mIPSC)の大きさと頻度が減少することから、ニューロリギンがゲフィリンのシナプス局在に関わることが示唆されている<ref name=ref20><pubmed></pubmed></ref>。また、マウスの網膜、上丘、視床、脳幹、脊髄においては、ニューロリギン4がゲフィリンと共局在するという報告がある<ref name=ref21><pubmed></pubmed></ref>。 | ||
[[ | |||
==細胞におけるゲフィリン局在== | |||
これまで、ゲフィリンはグリシン受容体に先行して[[抑制性]]シナプス後膜の細胞質側に凝集すると考えられてきた<ref name=ref12 /> <ref name=ref22><pubmed></pubmed></ref>。そのため、抑制性シナプスの指標として用いられることも多い。[[超解像顕微鏡]]を用いた報告によれば、抑制性シナプス後膜領域にはゲフィリン分子が約5,000-10,000/μm<sup>2</sup>の密度で凝集している<ref name=ref29><pubmed></pubmed></ref>。しかし、ライブセルイメージングによってマイクロメートルのスケールでみると、ゲフィリンはダイナミックに動いており、樹状突起の微小管に沿った移動も報告されている<ref name=ref23><pubmed></pubmed></ref> <ref name=ref24><pubmed></pubmed></ref> <ref name=ref25><pubmed></pubmed></ref>。このことから、実際には動的平衡状態を維持していると考えられる。また、ゲフィリンの運動性は神経活動に応じて変化することが報告されており<ref name=ref26 /> <ref name=ref27><pubmed></pubmed></ref>、これは細胞骨格であるFアクチンや微小管とゲフィリンとの結合がCA<sup>2+</sup>依存的に変化するためであると考えられる<ref name=ref26 />。 | |||
加えて、ゲフィリンが輸送カーゴ補助タンパク質として、グリシン受容体の細胞内輸送に関与することも示唆されている<ref name=ref25 />。rER―[[ゴルジ体]]を経て[[分泌]]小胞に包まれたグリシン受容体は、ゲフィリンを介して順行性輸送タンパク質である[[KIF5]](KIF1A)に結合し、微小管に沿って輸送されることが報告されている<ref name=ref25 />。また、逆行性輸送タンパク質である[[ダイニン]]を構成する[[ダイニン軽鎖]](Dlc1/2)とゲフィリンが結合することも報告されている<ref name=ref28><pubmed></pubmed></ref>。 | |||
==発現部位とアイソフォーム== | |||
ゲフィリンは脊髄や脳幹のグリシン作動性シナプスのみならず、中枢神経で広く発現が認められ、網膜、嗅球、海馬、大脳皮質の[[GABA作動性]]シナプスにおいても確認されている<ref name=ref1 />。また、中枢神経系以外に肝臓、[[心臓]]、筋肉といった末梢組織でも多様なアイソフォームが確認されている<ref name=ref3><pubmed></pubmed></ref>。 | |||
転写産物は複数のエクソンから選択的スプライシングされるため、多様なアイソフォームが存在すると考えられる。但し、ゲフィリンの各スプライシング変異体とそれらの名称は文献によって混在しており、異なるスプライシング変異体が同一の名称で呼ばれている場合があるので注意が必要である。こうしたことから、変異体の名称を統一することも提唱されている<ref name=ref4 />。また、変異体の組織特異性と生物種特異性が報告されているが、後者については検討(検証)が不十分との指摘もある<ref name=ref4 />。 | |||
なお、[[哺乳類]]と[[鳥類]]では1つのゲフィリン遺伝子が存在するが、[[ゼブラフィッシュ]]では2つの遺伝子(gphnaとgphnb)が存在する<ref name=ref31><pubmed></pubmed></ref> <ref name=ref32><pubmed></pubmed></ref>。 | |||
== | ==翻訳後修飾== | ||
[[image:ゲフィリン3.png|thumb|400px|'''図3.ゲフィリン関連分子'''<br>(GABAAR:GABA<sub>A</sub>受容体、GlyR:グリシン受容体、HSC70:HSP70熱ショックタンパク質、KIF5:キネシンスーパーファミリータンパク質5、Dlc1/2:ダイニン軽鎖1/2、GABARAP:GABA<sub>A</sub> receptor-associated protein)]] | |||
ゲフィリンはリン酸化、パルミトイル化、アセチル化によってその機能と局在が変化する。例えば、ゲフィリンのシナプス局在は細胞[[接着分子]]であるβ1インテグリンの活性化により増加する一方、β3インテグリンの活性化によって減少する<ref name=ref33><pubmed></pubmed></ref>。また、ゲフィリンのセリン残基268が[[分裂促進因子活性化タンパク質キナーゼ]]であるERK1/2によって<ref name=ref34><pubmed></pubmed></ref>、セリン残基270がグリコーゲン合成酵素キナーゼである[[GSK3β]]によって<ref name=ref35><pubmed></pubmed></ref>リン酸化されると、ゲフィリンのシナプス局在が減少する。これはCa<sup>2+</sup>/ERK依存性セリンプロテアーゼであるカルパイン1によるゲフィリンの分解によると考えられる<ref name=ref19 />。この他、[[Cdk5]]によるセリン残基270のリン酸化(Kuhse et al., 2012)や[[熱ショックタンパク]]質であるHsc70<ref name=ref36><pubmed></pubmed></ref>、アクチン結合タンパク質のProfilin1/2、mammalian Ena/VASP (enabled/vasodilator stimulated phosphoprotein)、Raft 1、[[チューブリン]]などの因子が報告されている<ref name=ref4 /> <ref name=ref19 />(図3)。 | |||
==関連項目== | ==関連項目== | ||
*[[抑制性シナプス]] | *[[抑制性シナプス]] | ||
*[[グリシン受容体]] | *[[グリシン受容体]] | ||
*[[GABAA受容体|GABA<sub>A</sub>受容体]] | *[[GABAA受容体|GABA<sub>A</sub>受容体]] | ||
*[[翻訳後修飾]] | |||
*[[ニューロリギン]] | *[[ニューロリギン]] | ||
*[[GABARAP]] | *[[GABARAP]] | ||
*[[シナプス後膜電流]] | |||
*[[Fアクチン]] | |||
*[[微小管]] | *[[微小管]] | ||
*[[細胞骨格]] | |||
*[[脊髄]] | |||
*[[脳幹]] | |||
*[[網膜]] | |||
*[[嗅球]] | |||
*[[海馬]] | |||
*[[大脳皮質]] | |||
*[[リン酸化]] | |||
*[[パルミトイル化]] | |||
*[[アセチル化]] | |||
*[[インテグリン]] | |||
*[[カルパイン]] | |||
*[[熱ショックタンパク質]] | |||
==参考文献== | ==参考文献== | ||
<references /> | <references /> | ||
2015年2月27日 (金) 10:31時点における版
中畑 義久
大学共同利用機関法人 自然科学研究機構 生理学研究所
石橋 仁
北里大学 医療衛生学部 生理学教室
鍋倉 淳一
大学共同利用機関法人 自然科学研究機構 生理学研究所
DOI:10.14931/bsd.5595 原稿受付日:2015年2月26日 原稿完成日:2015年月日
担当編集委員:柚崎 通介(慶應義塾大学 医学部生理学)
英語名:Gephyrin 英略称:GPHN
ゲフィリンは、抑制性シナプス後膜における足場タンパク質であり、グリシン受容体および一部のGABAA受容体のシナプス局在に関わっている(図1)。ゲフィリンの機能や局在は翻訳後修飾、関連タンパク質との結合、神経活動、受容体の活性など様々な要因によって制御される。この他、尿酸生成や造血作用に関わるMoCo(モリブデン補因子)の生合成における触媒作用も知られている[1]。
基本構造
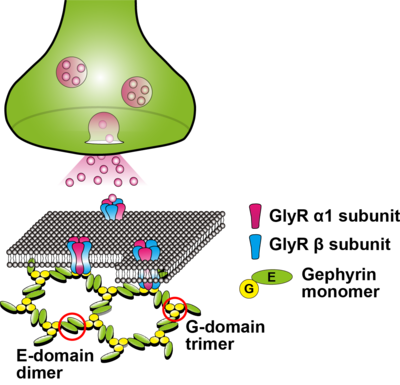
Gドメインの三量体形成とEドメインの二量体形成による六方格子(hexagonal lattice)モデルが仮定されている[2] [3]。
注: グリシン受容体のサブユニット構成比(3つのαサブユニットと2つのβサブユニット、もしくは2つのαサブユニットと3つのβサブユニット)については、まだ明確になっていない[4]。
93 kDaの表在性膜タンパク質として同定されたゲフィリンは[5] [6]、自己オリゴマー化によって凝集体を形成する[1]。G、C、Eの3ドメインから成り、GドメインN末端(20 kDa)とEドメインC末端(43 kDa)がCドメイン(リンカー領域: 18-21 kDa)に結合している[7]。Gドメインは安定した三量体を形成する一方、Eドメインは二量体を形成し、グリシン受容体βサブユニットの細胞内ループ(M3-M4)に高親和性を示す。グリシン受容体βサブユニットにおけるセリン残基403がプロテインキナーゼC (PKC)によってリン酸化されると、ゲフィリンとの結合が減少する[8]。また、結晶構造解析の結果から、ゲフィリンの二量体形成面におけるフェニルアラニン残基330、チロシン残基673、プロリン残基713残基がゲフィリンとの高い親和性に重要であると考えられる[7]。「リンカー領域」とも呼ばれるCドメインにはゲフィリン結合タンパクの作用部位があり、Pin1(peptidyl-prolyl isomerase NIMA interacting protein 1)は188-201配列に、Dynein light chain 1(Dlc1)およびDynein light chain 2(Dlc2)は203-212配列に、アクチン重合に関与するCdc42に選択的なコリビスチン(collybistin)は319-329配列に作用する。また、タンパク分解をされやすいのもCドメインである。
組み換えゲフィリンの過剰発現実験の結果から、様々な細胞株において凝集体を形成することが確認されており、現在はGドメインの三量体化とEドメインの二量体化による六方格子(hexagonal lattice)モデルが仮定されている[2] [3](図1)。
グリシン受容体/AGABA受容体の固定化
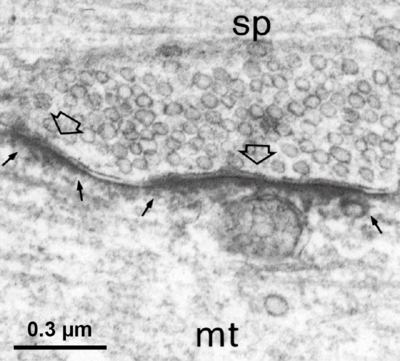
DAB染色による電子顕微鏡画像 (スケールバー 0.3 μm)Giustetto et al., (1998) 使用許諾 未取得
グリシン受容体が集積するマイクロドメインは、グリシン作動性シナプス前終末と対応したシナプス後膜に認められる[9](図2)。その際、グリシン受容体βサブユニットの細胞質ループに存在する18のアミノ酸モチーフにゲフィリンが結合することで、シナプス後膜におけるグリシン受容体の係留に関与している[10]。そのため、免疫組織化学法においては、しばしば(グリシン受容体βサブユニットとヘテロマーを形成する)グリシン受容体α1サブユニット特異的抗体を用い、ゲフィリン抗体と二重染色することでシナプス後膜に局在するグリシン受容体が標識される。
但し、ゲフィリンはグリシン受容体α2サブユニットにも低親和性結合を示すことから、α2ホモメリックグリシン受容体がシナプスに係留される可能性も示唆されている[11] [12]。
実際にアンチセンスオリゴヌクレオチドによってゲフィリンの発現を阻害すると、シナプスにおけるグリシン受容体の局在が減少する[13]。更に、相同組み換えによって全てのゲフィリンアイソフォームをノックアウトしたマウスでは、シナプスにおけるグリシン受容体の局在が減少する[14]。こうしたことから、グリシン受容体はゲフィリンと結合することで凝集体を形成し、解離することで拡散することが知られている[15] [16]。
GABAA受容体については、ゲフィリンとGABAA受容体α2サブユニット、γ2サブユニットの結合が示唆されている[17] [18]。また、GABARAPはゲフィリンCドメインと結合するものの、GABAA受容体とゲフィリンの輸送に必須ではない[19]。グリシン受容体に比べGABAA受容体のサブユニットは多様であり、GABAA受容体に対するゲフィリンの役割は未だ十分明らかになっていない。
また、ゲフィリンはシナプス後膜における細胞接着分子であるニューロリギンとの結合が知られている[4]。ニューロリギン2欠損マウスでは、ゲフィリンのシナプス局在が減少し、GABAおよびグリシン作動性の微小シナプス後膜電流(mIPSC)の大きさと頻度が減少することから、ニューロリギンがゲフィリンのシナプス局在に関わることが示唆されている[20]。また、マウスの網膜、上丘、視床、脳幹、脊髄においては、ニューロリギン4がゲフィリンと共局在するという報告がある[21]。
細胞におけるゲフィリン局在
これまで、ゲフィリンはグリシン受容体に先行して抑制性シナプス後膜の細胞質側に凝集すると考えられてきた[13] [22]。そのため、抑制性シナプスの指標として用いられることも多い。超解像顕微鏡を用いた報告によれば、抑制性シナプス後膜領域にはゲフィリン分子が約5,000-10,000/μm2の密度で凝集している[23]。しかし、ライブセルイメージングによってマイクロメートルのスケールでみると、ゲフィリンはダイナミックに動いており、樹状突起の微小管に沿った移動も報告されている[24] [25] [26]。このことから、実際には動的平衡状態を維持していると考えられる。また、ゲフィリンの運動性は神経活動に応じて変化することが報告されており[27] [28]、これは細胞骨格であるFアクチンや微小管とゲフィリンとの結合がCA2+依存的に変化するためであると考えられる[27]。
加えて、ゲフィリンが輸送カーゴ補助タンパク質として、グリシン受容体の細胞内輸送に関与することも示唆されている[26]。rER―ゴルジ体を経て分泌小胞に包まれたグリシン受容体は、ゲフィリンを介して順行性輸送タンパク質であるKIF5(KIF1A)に結合し、微小管に沿って輸送されることが報告されている[26]。また、逆行性輸送タンパク質であるダイニンを構成するダイニン軽鎖(Dlc1/2)とゲフィリンが結合することも報告されている[29]。
発現部位とアイソフォーム
ゲフィリンは脊髄や脳幹のグリシン作動性シナプスのみならず、中枢神経で広く発現が認められ、網膜、嗅球、海馬、大脳皮質のGABA作動性シナプスにおいても確認されている[1]。また、中枢神経系以外に肝臓、心臓、筋肉といった末梢組織でも多様なアイソフォームが確認されている[6]。
転写産物は複数のエクソンから選択的スプライシングされるため、多様なアイソフォームが存在すると考えられる。但し、ゲフィリンの各スプライシング変異体とそれらの名称は文献によって混在しており、異なるスプライシング変異体が同一の名称で呼ばれている場合があるので注意が必要である。こうしたことから、変異体の名称を統一することも提唱されている[7]。また、変異体の組織特異性と生物種特異性が報告されているが、後者については検討(検証)が不十分との指摘もある[7]。
なお、哺乳類と鳥類では1つのゲフィリン遺伝子が存在するが、ゼブラフィッシュでは2つの遺伝子(gphnaとgphnb)が存在する[30] [31]。
翻訳後修飾
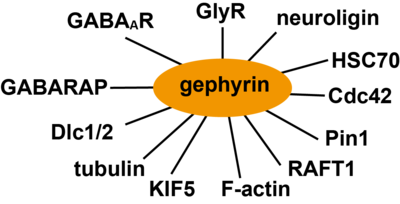
(GABAAR:GABAA受容体、GlyR:グリシン受容体、HSC70:HSP70熱ショックタンパク質、KIF5:キネシンスーパーファミリータンパク質5、Dlc1/2:ダイニン軽鎖1/2、GABARAP:GABAA receptor-associated protein)
ゲフィリンはリン酸化、パルミトイル化、アセチル化によってその機能と局在が変化する。例えば、ゲフィリンのシナプス局在は細胞接着分子であるβ1インテグリンの活性化により増加する一方、β3インテグリンの活性化によって減少する[32]。また、ゲフィリンのセリン残基268が分裂促進因子活性化タンパク質キナーゼであるERK1/2によって[33]、セリン残基270がグリコーゲン合成酵素キナーゼであるGSK3βによって[34]リン酸化されると、ゲフィリンのシナプス局在が減少する。これはCa2+/ERK依存性セリンプロテアーゼであるカルパイン1によるゲフィリンの分解によると考えられる[4]。この他、Cdk5によるセリン残基270のリン酸化(Kuhse et al., 2012)や熱ショックタンパク質であるHsc70[35]、アクチン結合タンパク質のProfilin1/2、mammalian Ena/VASP (enabled/vasodilator stimulated phosphoprotein)、Raft 1、チューブリンなどの因子が報告されている[7] [4](図3)。
関連項目
- 抑制性シナプス
- グリシン受容体
- GABAA受容体
- 翻訳後修飾
- ニューロリギン
- GABARAP
- シナプス後膜電流
- Fアクチン
- 微小管
- 細胞骨格
- 脊髄
- 脳幹
- 網膜
- 嗅球
- 海馬
- 大脳皮質
- リン酸化
- パルミトイル化
- アセチル化
- インテグリン
- カルパイン
- 熱ショックタンパク質
参考文献
- ↑ 1.0 1.1 1.2 Resource not found in PubMed.
- ↑ 2.0 2.1 Resource not found in PubMed.
- ↑ 3.0 3.1 Resource not found in PubMed.
- ↑ 4.0 4.1 4.2 4.3 Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ 6.0 6.1 Resource not found in PubMed.
- ↑ 7.0 7.1 7.2 7.3 7.4 Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ 13.0 13.1 Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ 26.0 26.1 26.2 Resource not found in PubMed.
- ↑ 27.0 27.1 引用エラー: 無効な
<ref>タグです。「ref26」という名前の注釈に対するテキストが指定されていません - ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.