「記憶痕跡」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (2人の利用者による、間の17版が非表示) | |||
| 1行目: | 1行目: | ||
[[ | <div align="right"> | ||
<font size="+1">鈴木章円、[http://researchmap.jp/ohkawa_noriaki 大川 宜昭]、[http://researchmap.jp/nomoto 野本 真順]、[http://researchmap.jp/kaoruinokuchi 井ノ口 馨]</font><br> | |||
''富山大学 大学院医学薬学研究部''<br> | |||
DOI:<selfdoi /> 原稿受付日:2013年4月24日 原稿完成日:2014年4月10日<br> | |||
担当編集委員:[http://researchmap.jp/haruokasai 河西 春郎](東京大学 大学院医学系研究科)<br> | |||
</div> | |||
英語名:memory engram 独:Gedächtnis Engramm 仏:mémoire engramme | |||
[[ | 同義語:[[エングラム]] | ||
]] | |||
{{box|text= 記憶痕跡とは、学習時に活動した特定のニューロン集団([[セルアセンブリ]])という形で脳内に残った物理的な痕跡のことである。学習時に同期活動をしたニューロン同士は強い[[シナプス]]結合で結ばれるため([[シナプス可塑性]])、何らかのきっかけで一部のニューロンが活動すると、このニューロン集団全体が活動し、その結果として記憶が想起される。[[シナプス可塑性]]は、シナプスレベルの記憶痕跡と言うこともできる。}} | |||
[[image:記憶痕跡1.jpg|thumb|300px|'''図1.セルアセンブリ仮説に基づく記憶痕跡の概要'''<br>記憶がセルアセンブリとして符号化されて脳内に蓄えられる様子を表す。学習時に活動したニューロン(オレンジ)の間のシナプスではLTPが起こり、ニューロン活動が収まった通常時でも伝達効率が増強されている。そのため、なんらかのきっかけでこれらのニューロンの一部が活動すると、強いシナプス伝達で連絡されたニューロンセット(オレンジ)が同時に活動する。これが、記憶の想起である。]] | |||
[[image:記憶痕跡2.jpg|thumb|300px|'''図2.Lashleyにより示された大脳皮質を除去した割合と迷路達成率の相関図'''<br>大脳皮質を除去した割合が高いほど迷路を抜け出す困難さが増加する。<ref name=ref2>'''Lashley K.'''<br> In search of the engram. <br>Society of Experimental Biology Symposium 4:454–82. (1950) </ref>より引用・改変。]] | |||
[[image:記憶痕跡3.jpg|thumb|300px|'''図3.記憶痕跡の実体を探るための実験系'''<br> | |||
A.TetTagマウスはc-fos[[プロモーター]]制御下でtTA(テトラサイクリン制御性トランス活性化因子)を発現するトランスジーンとTetO(テトラサイクリン依存性オペレーター)制御下で、tTA*(ドキシサイクリン非感受性tTA)とレポーター遺伝子であるTau-LacZを発現するトランスジーンを持つダブルトランスジェニックマウスである。tTAはドキシサイクリン存在下ではTetO(テトラサイクリン応答配列)に結合することができない。しかし、ドキシサイクリン非存在下ではtTAはTetOに結合し、tTA*とtau-LacZの発現誘導が可能となる。また、tTA*はドキシサイクリン非感受性であるため、一度発現されればtTA*とtau-LacZを恒常的に発現させることができ、刺激に応答して活性化されたニューロンをtau-LacZの発現を指標に可視化することが可能である。<br> | |||
B.Cre recombinase活性依存的にDTR(ジフテリア毒素受容体)を発現するiDTRマウスはHSVによりCREB-cre vectorを注入するとloxPで挟まれたSTOP配列が抜き出されCREBを過剰発現したニューロンでDTRを発現する。そしてDT(ジフテリア毒素)を投与することで細胞死が誘導され、CREBを過剰発現したニューロン群の選択的除去が可能となる。<br> | |||
C.HSVによりCREBとAlstR(アラトスタチン受容体)を扁桃体に注入し、両者をニューロンに発現させる。その後、AL(アラトスタチン)投与により、CREB過剰発現ニューロン群を特異的に不活性化させることが可能となる。CMV, CMVプロモーター;IE4/5, CIE4/5プロモーター。]] | |||
[[image:記憶痕跡4.jpg|thumb|300px|'''図4.記憶痕跡の物理的存在を示した実験法'''<br>c-fosプロモーター活性依存的にチャネルロドプシンを発現するトランスジェニックマウス(cFos-pro-tTA x TRE ChR2-YFPマウス)にtrainingとして電気ショック(稲妻印)を与え、恐怖記憶を形成させた。学習時に活性化されたニューロンでチャネルロドプシンを発現する。その後、マウスをまったく別の環境に暴露し、海馬歯状回(DG)への光照射(最上段右の図)により学習時に活性化されたニューロン群を再活性化状態にすると、マウスが恐怖を感じた時に示すフリージングを引き起こさせることに成功した(Test)。下段の図は、training, test時におけるDGニューロンの状態を表す。用いたマウスのトランスジーンの構造を最下段に示した。黄色はチャネルロドプシンを発現するニューロン、青色は光刺激により活性化されたニューロンを示す。]] | |||
[[image:記憶痕跡5.jpg|thumb|300px|'''図5.長期増強(LTP)'''<br>経験に応じてニューロン間の伝達効率が変化すること(シナプス間のLTP等の現象)が細胞レベルでの学習・記憶の基礎過程であると考えられている。]] | |||
==記憶痕跡とは== | ==記憶痕跡とは== | ||
記憶痕跡とは、20世紀初頭にドイツの生物学者[[w:Richard Semon|Richard Semon]]により唱えられた言葉である。[[wj:ドナルド・ヘッブ|Donald Hebb]]の[[細胞集成体]]([[セルアセンブリ]]、cell assembly)仮説によると、[[記憶]]は脳内にある特定のニューロン集団(セルアセンブリ)として[[符号化]]されて蓄えられる([[アンサンブル・コーディング]]、ensemble coding)と想定している<ref name=ref1>'''Hebb DO'''<br>The Organization of Behavior<br>''John Wiley & Sons Inc'' (1949)<br>本書は1966年以来絶版になっていたが、2002年にLawrence Erlbaumから再刊され、現在はTaylor & Francisから刊行されている。最近、邦訳も出た。<br>'''D.O.ヘッブ'''<br>行動の機構<br>''岩波文庫''、2011年</ref>。すなわち、学習時に活性化した特定のニューロンのセットという形で脳のなかに残った物理的な痕跡が「記憶痕跡」であると提唱した(図1)。現在ではこの仮説が大枠で正しいことが明らかとなっている。すなわち、学習時に同期活動をしたニューロン間の[[シナプス伝達]]は増強するため、これらのニューロン同士は強いシナプス結合で結ばれる(後述の[[記憶痕跡#シナプス可塑性と記憶痕跡|シナプス可塑性と記憶痕跡]]を参照)。何らかのきっかけでこのニューロン集団に属する一部のニューロンが活動すると、強いシナプス結合で結ばれたニューロン集団全体が活動し、その結果として記憶が[[想起]]される。特定の細胞集団から形成されるニューロンネットワークが「記憶痕跡」の物理的な実体である。また、シナプスにおいて生じるシナプス可塑的な変化は、シナプスレベルの記憶痕跡であると言うこともできる。 | |||
==記憶痕跡を巡る議論== | ==記憶痕跡を巡る議論== | ||
記憶痕跡の物理的実体が明らかになるまでには紆余曲折があった。米国の心理学者[[wj:カール・ラシュレー|Karl Lashley]]は[[wikipedia:ja:ラット|ラット]]を使った実験で、記憶痕跡の存在について異議を唱えた<ref name=ref2>'''Lashley K.'''<br> In search of the engram. <br>Society of Experimental Biology Symposium 4:454–82. (1950) </ref>。Lashleyはまず[[ラット]]に[[迷路]]を学習させた後、ラットの[[大脳皮質]]の様々な領域を異なる大きさで取り除いた。するとラットは大脳皮質を取り除かれた分だけ、迷路から抜け出すことが困難になり、大脳皮質の取り除いた領域ではなく、取り除いた割合と迷路の課題を達成する困難さが相関することを示した(図2)。これらの結果を基にLashleyは、「記憶は特定の脳領域に局在して蓄えられるのではなく、大脳皮質全体に分散して蓄えられる。大脳皮質の領域は、お互いに代用可能である。」と述べ、記憶痕跡が本当に存在するのか?という疑問を生じさせた。しかし、Lashleyの行った研究は、その実験系の複雑さゆえに記憶痕跡を発見できなかったと考えられ、Lashleyの実験以降、多くの科学者が記憶痕跡の存在を求め、精力的に研究を行ってきた。 | |||
1999年、John Guzowskiのグループは、[[CatFISH]] (cellular compartment analysis of temporal activity by fluorescent in situ hybridization)法を用い、神経活動時に発現が誘導される[[Arc]] ([[activity-regulated cytoskeleton-associated protein]]) [[wikipedia:ja:mRNA|mRNA]] | ===記憶痕跡の存在=== | ||
1999年、John Guzowskiのグループは、[[CatFISH]] (cellular compartment analysis of temporal activity by fluorescent in situ hybridization)法を用い、神経活動時に発現が誘導される[[Arc]] ([[activity-regulated cytoskeleton-associated protein]]) [[wikipedia:ja:mRNA|mRNA]]の時間的な細胞内局在変化を指標として、記憶痕跡の存在を探索した<ref name=ref3><pubmed>10570490</pubmed></ref>。彼らはまずラットを新規環境に暴露し、その後、再度同じ環境(Context A)もしくは異なる環境(Context B)に暴露した後に、海馬におけるArcの発現およびその細胞内局在を調べた。その結果、新規環境に暴露された時にArcを発現したニューロンは、異なった環境(Context B)ではArcを発現せず、同じ環境(Context A)に再暴露されたときのみ再度Arcを発現することを見出した。すなわち、一度経験した事柄に再度暴露すると、初期の経験依存的に活性化されたニューロンが再活性化することが示された。 | |||
また2007年、Mark Mayfordらのグループは学習に応答して活性化されたニューロンを継続的に標識することが可能な[[トランスジェニックマウス]](TetTagマウス)を作製した( | また2007年、Mark Mayfordらのグループは学習に応答して活性化されたニューロンを継続的に標識することが可能な[[トランスジェニックマウス]](TetTagマウス)を作製した(図[[3a|3A]])<ref name=ref4><pubmed>17761885</pubmed></ref>。このマウスを用いて、恐怖経験時に活性化された[[扁桃体]]ニューロンが[[恐怖記憶]]想起時にも再活性化されること、さらに再活性化されたニューロンの数は想起された記憶の強さと相関していることを示した。以上のCatFISHとTetTagマウスの2つの実験は、記憶の形成時に活性化したニューロン群(セルアセンブリ)が、記憶想起時において再活性化することを示しており、記憶獲得時に活性化したニューロン群(あるいはその一部)が記憶痕跡として存在することを間接的に示唆している。 | ||
===記憶痕跡の抑制=== | |||
[[恐怖記憶]]獲得時に活性化するニューロン群では、[[転写調節因子]]である[[CREB]] ([[cAMP response element-binding protein]])活性が高い。さらに、通常恐怖記憶が成立しにくいCREB欠損マウスの扁桃体ニューロンへのCREB過剰発現が、恐怖記憶獲得を回復させるとともに、記憶想起時にCREB過剰発現ニューロンが選択的に再活性化する<ref name=ref5><pubmed>17446403</pubmed></ref>。これらのことを基にして、Sheena JosselynおよびAlcino Silvaのグループは、CREBを過剰発現したニューロンを特異的に不活性化させた後の記憶変化を見ることで、これらのニューロン集団が記憶想起に必要かどうかを検証した<ref name=ref6><pubmed>19286560</pubmed></ref> <ref name=ref7><pubmed>19783993</pubmed></ref>。 | [[恐怖記憶]]獲得時に活性化するニューロン群では、[[転写調節因子]]である[[CREB]] ([[cAMP response element-binding protein]])活性が高い。さらに、通常恐怖記憶が成立しにくいCREB欠損マウスの扁桃体ニューロンへのCREB過剰発現が、恐怖記憶獲得を回復させるとともに、記憶想起時にCREB過剰発現ニューロンが選択的に再活性化する<ref name=ref5><pubmed>17446403</pubmed></ref>。これらのことを基にして、Sheena JosselynおよびAlcino Silvaのグループは、CREBを過剰発現したニューロンを特異的に不活性化させた後の記憶変化を見ることで、これらのニューロン集団が記憶想起に必要かどうかを検証した<ref name=ref6><pubmed>19286560</pubmed></ref> <ref name=ref7><pubmed>19783993</pubmed></ref>。 | ||
まず、Josselynらは、CREBを過剰発現したニューロンを不活性化させるため、“[[iDTR]] (inducible diphtheria toxin receptor) | まず、Josselynらは、CREBを過剰発現したニューロンを不活性化させるため、“[[iDTR]] (inducible diphtheria toxin receptor)マウス”と名づけられた[[トランスジェニックマウス]]の扁桃体に[[wikipedia:ja:単純ヘルペスウィルス|単純ヘルペスウィルス]]([[wikipedia:ja:単純ヘルペスウイルス|herpes simplex virus]]: HSV)ベクターによりCREB-creを発現し、[[cre]]活性により[[loxP]]で挟まれたSTOP配列を抜き出すことでCREBが過剰発現したニューロン内にDTR(ジフテリア毒素受容体)を発現させた。その後、[[wikipedia:ja:ジフテリア毒素|ジフテリア毒素]]を投与することで細胞死を誘導し、CREBを過剰発現したニューロン群の選択的除去を行った(図3B)<ref name=ref6 />。同様に、Silvaらは、HSVによりCREBと[[AlstR]]([[アラトスタチン受容体]])を注入し、両者をニューロンに発現させた。そして、アラトスタチンを投与することで、CREBを発現する神経細胞を不活性化させた(図3C)<ref name=ref7 />。どちらの場合においても、ジフテリア毒素またはアラトスタチン投与により扁桃体依存的な恐怖記憶の想起が阻害された。これらにより、恐怖記憶の発現時に活性化される扁桃体ニューロン群(セルアセンブリ)が、記憶痕跡に重要な役割を担っていることが示唆された。 | ||
2012年、[[wikipedia:ja:利根川進|利根川進]]のグループは、[[オプトジェネティックス]]([[光遺伝学]])法を用いて、特定のニューロン群の活性を制御することで記憶痕跡の物理的存在を示した<ref name=ref8><pubmed>22441246</pubmed></ref> (図4)。彼らはまず[[海馬]]の[[歯状回]]のニューロンが活性化状態になると[[チャネルロドプシン]] | ===仮説から物理的実体へ=== | ||
2012年、[[wikipedia:ja:利根川進|利根川進]]のグループは、[[オプトジェネティックス]]([[光遺伝学]])法を用いて、特定のニューロン群の活性を制御することで記憶痕跡の物理的存在を示した<ref name=ref8><pubmed>22441246</pubmed></ref> (図4)。彼らはまず[[海馬]]の[[歯状回]]のニューロンが活性化状態になると[[チャネルロドプシン]](ChR)を発現するトランスジェニックマウスを作製した。光照射するとチャネル[[ロドプシン]]のチャネルが開き、[[wikipedia:ja:カチオン|カチオン]]を細胞内に流入させる。光照射という人為的な操作でニューロンを[[脱分極]](活動)させることができる。彼らは、[[マウス]]に[[恐怖条件づけ]]を行って恐怖記憶を形成させた時に活性化したニューロン群特異的にチャネルロドプシンを発現させた。次にマウスをまったく別の環境に暴露し、光照射によりチャネルロドプシンを発現しているニューロン群のみを選択的に活性化すると、マウスが恐怖を感じた時に示す、すくみ行動(フリージング)を引き起こさせることができることを発見した。すなわち、人為的な操作によって恐怖記憶を想起させることに成功し、記憶が学習時に活性化した特定のニューロン群(セルアセンブリ)に割りづけられて符号化されていることが示された。 | |||
このように、多くのニューロンの中から、一部のニューロン群が各記憶イベントに対応し活性化することで記憶痕跡が形成される(アンサンブル・コーディング)ことが示される一方で、どのようにしてこれらのニューロン群が選択されたのかについては、不明の点が多い。扁桃体の多くのニューロンが感覚入力を受け得るにもかかわらず、一部のニューロンのみが恐怖記憶獲得に依存した質的変化を示す。前述したように、恐怖記憶獲得に関わるニューロン群の選択性とCREB活性は正相関する<ref name=ref5 />。CREBを過剰発現したニューロンでは、興奮性や、記憶獲得時のシナプス伝達効率の変化率が大きいことが報告されている<ref name=ref7 />。これらのことは、学習時にCREB活性が高いニューロンが選択的にその記憶に関するセルアセンブリに取り込まれることを示唆している。 | このように、多くのニューロンの中から、一部のニューロン群が各記憶イベントに対応し活性化することで記憶痕跡が形成される(アンサンブル・コーディング)ことが示される一方で、どのようにしてこれらのニューロン群が選択されたのかについては、不明の点が多い。扁桃体の多くのニューロンが感覚入力を受け得るにもかかわらず、一部のニューロンのみが恐怖記憶獲得に依存した質的変化を示す。前述したように、恐怖記憶獲得に関わるニューロン群の選択性とCREB活性は正相関する<ref name=ref5 />。CREBを過剰発現したニューロンでは、興奮性や、記憶獲得時のシナプス伝達効率の変化率が大きいことが報告されている<ref name=ref7 />。これらのことは、学習時にCREB活性が高いニューロンが選択的にその記憶に関するセルアセンブリに取り込まれることを示唆している。 | ||
== シナプス可塑性と記憶痕跡 == | |||
記憶痕跡の形成には、シナプス可塑性が重要な役割を果たしていると考えられている。外界から情報(刺激)を得たときに、脳内ではさまざまな組み合わせのニューロンが活動する。同期活動したニューロン間のシナプスではシナプス伝達効率の上昇現象である長期増強(long-term potentiation; LTP,図5)が起きていると考えられている。 | |||
LTPはニューロン間の信号の受け渡しの場であるシナプスで観察される経験依存的な神経可塑性の代表例であり、ニューロンにおける[[AMPA型グルタミン酸受容体|α-アミノ-3-ヒドロキシ-5-メチル-4-イソオキサゾールプロピオン酸型グルタミン酸受容体]](AMPA型受容体)の新規タンパク質合成依存的な発現量の上昇を伴う<ref><pubmed>9716131</pubmed></ref>。実際に、げっ歯類を用いた[[恐怖音条件づけ]]学習の際に外側扁桃体のニューロンにおいて学習依存的に機能的なAMPA型受容体がシナプスへ組み込まれ、このAMPA型受容体の組み込みを阻害すると[[LTP]]だけでなく恐怖記憶の獲得および保持が阻害される<ref><pubmed>15746389</pubmed></ref>。加えて、LTPおよび記憶の保持はともに新規タンパク質合成が必要である<ref><pubmed>3401749</pubmed></ref> <ref><pubmed>2874497</pubmed></ref>。さらに、記憶形成時に実際にLTPが観察されたことから、LTPは記憶のシナプスレベルでの素過程であると考えられている。 | |||
これらのことより、学習時に活動したニューロン同士は強いシナプス結合で結ばれた回路を形成しており、ニューロン間のシナプスにおいて生じる神経可塑的変化(シナプス可塑性)がシナプスレベルでの記憶痕跡となりうること、さらに、記憶が経験依存的に活動したニューロン間でのシナプス可塑性を介して脳内に保存されることが示唆された。このようにしてシナプス伝達が増強したニューロンセットが活動することにより記憶の想起が行われる(図1)。 | |||
==神経細胞集成体のプレプレイ== | ==神経細胞集成体のプレプレイ== | ||
利根川らは2010年に、海馬ニューロン群の時間的発火順序が、実際の空間体験以前の休息時または[[睡眠]]時に先行し観察されることを報告した<ref name=ref9><pubmed>21179088</pubmed></ref>。この現象は、[[予演]]([[preplay]])と名づけられ、休息中ないし睡眠中の脳内では、さまざまな海馬ニューロン集団を時間的順列にあらかじめ組織化しており、類似した新しい空間的体験が将来起こった際の符号化に役立っていることを示唆している。これらの報告は、アンサンブル・コーディングにおける記憶痕跡ニューロン群の選択機構を知るためのヒントを与えるものであるが、どのニューロン群が次なる記憶痕跡となるかを予測できるようになるには、今後、さらなる多くの角度からの研究が必要である。 | |||
==将来展望== | ==将来展望== | ||
| 52行目: | 61行目: | ||
*[[長期増強現象]] | *[[長期増強現象]] | ||
*[[ヘブ則]] | *[[ヘブ則]] | ||
*[[セルアセンブリ]] | |||
== 参考文献 == | == 参考文献 == | ||
<references /> | <references /> | ||
2015年12月5日 (土) 16:46時点における最新版
鈴木章円、大川 宜昭、野本 真順、井ノ口 馨
富山大学 大学院医学薬学研究部
DOI:10.14931/bsd.3737 原稿受付日:2013年4月24日 原稿完成日:2014年4月10日
担当編集委員:河西 春郎(東京大学 大学院医学系研究科)
英語名:memory engram 独:Gedächtnis Engramm 仏:mémoire engramme
同義語:エングラム
記憶痕跡とは、学習時に活動した特定のニューロン集団(セルアセンブリ)という形で脳内に残った物理的な痕跡のことである。学習時に同期活動をしたニューロン同士は強いシナプス結合で結ばれるため(シナプス可塑性)、何らかのきっかけで一部のニューロンが活動すると、このニューロン集団全体が活動し、その結果として記憶が想起される。シナプス可塑性は、シナプスレベルの記憶痕跡と言うこともできる。
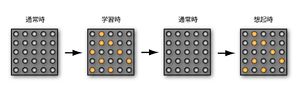
記憶がセルアセンブリとして符号化されて脳内に蓄えられる様子を表す。学習時に活動したニューロン(オレンジ)の間のシナプスではLTPが起こり、ニューロン活動が収まった通常時でも伝達効率が増強されている。そのため、なんらかのきっかけでこれらのニューロンの一部が活動すると、強いシナプス伝達で連絡されたニューロンセット(オレンジ)が同時に活動する。これが、記憶の想起である。
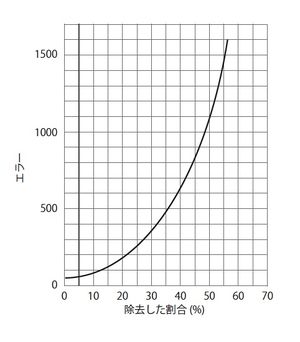
大脳皮質を除去した割合が高いほど迷路を抜け出す困難さが増加する。[1]より引用・改変。
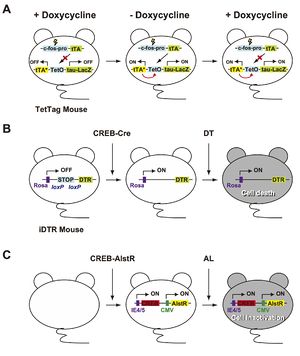
A.TetTagマウスはc-fosプロモーター制御下でtTA(テトラサイクリン制御性トランス活性化因子)を発現するトランスジーンとTetO(テトラサイクリン依存性オペレーター)制御下で、tTA*(ドキシサイクリン非感受性tTA)とレポーター遺伝子であるTau-LacZを発現するトランスジーンを持つダブルトランスジェニックマウスである。tTAはドキシサイクリン存在下ではTetO(テトラサイクリン応答配列)に結合することができない。しかし、ドキシサイクリン非存在下ではtTAはTetOに結合し、tTA*とtau-LacZの発現誘導が可能となる。また、tTA*はドキシサイクリン非感受性であるため、一度発現されればtTA*とtau-LacZを恒常的に発現させることができ、刺激に応答して活性化されたニューロンをtau-LacZの発現を指標に可視化することが可能である。
B.Cre recombinase活性依存的にDTR(ジフテリア毒素受容体)を発現するiDTRマウスはHSVによりCREB-cre vectorを注入するとloxPで挟まれたSTOP配列が抜き出されCREBを過剰発現したニューロンでDTRを発現する。そしてDT(ジフテリア毒素)を投与することで細胞死が誘導され、CREBを過剰発現したニューロン群の選択的除去が可能となる。
C.HSVによりCREBとAlstR(アラトスタチン受容体)を扁桃体に注入し、両者をニューロンに発現させる。その後、AL(アラトスタチン)投与により、CREB過剰発現ニューロン群を特異的に不活性化させることが可能となる。CMV, CMVプロモーター;IE4/5, CIE4/5プロモーター。
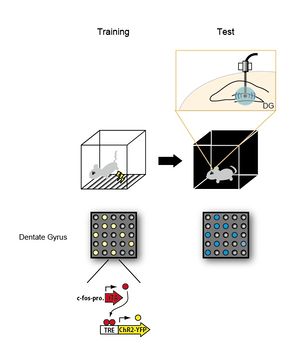
c-fosプロモーター活性依存的にチャネルロドプシンを発現するトランスジェニックマウス(cFos-pro-tTA x TRE ChR2-YFPマウス)にtrainingとして電気ショック(稲妻印)を与え、恐怖記憶を形成させた。学習時に活性化されたニューロンでチャネルロドプシンを発現する。その後、マウスをまったく別の環境に暴露し、海馬歯状回(DG)への光照射(最上段右の図)により学習時に活性化されたニューロン群を再活性化状態にすると、マウスが恐怖を感じた時に示すフリージングを引き起こさせることに成功した(Test)。下段の図は、training, test時におけるDGニューロンの状態を表す。用いたマウスのトランスジーンの構造を最下段に示した。黄色はチャネルロドプシンを発現するニューロン、青色は光刺激により活性化されたニューロンを示す。
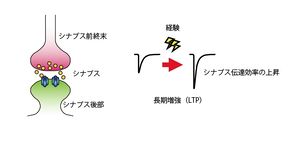
経験に応じてニューロン間の伝達効率が変化すること(シナプス間のLTP等の現象)が細胞レベルでの学習・記憶の基礎過程であると考えられている。
記憶痕跡とは
記憶痕跡とは、20世紀初頭にドイツの生物学者Richard Semonにより唱えられた言葉である。Donald Hebbの細胞集成体(セルアセンブリ、cell assembly)仮説によると、記憶は脳内にある特定のニューロン集団(セルアセンブリ)として符号化されて蓄えられる(アンサンブル・コーディング、ensemble coding)と想定している[2]。すなわち、学習時に活性化した特定のニューロンのセットという形で脳のなかに残った物理的な痕跡が「記憶痕跡」であると提唱した(図1)。現在ではこの仮説が大枠で正しいことが明らかとなっている。すなわち、学習時に同期活動をしたニューロン間のシナプス伝達は増強するため、これらのニューロン同士は強いシナプス結合で結ばれる(後述のシナプス可塑性と記憶痕跡を参照)。何らかのきっかけでこのニューロン集団に属する一部のニューロンが活動すると、強いシナプス結合で結ばれたニューロン集団全体が活動し、その結果として記憶が想起される。特定の細胞集団から形成されるニューロンネットワークが「記憶痕跡」の物理的な実体である。また、シナプスにおいて生じるシナプス可塑的な変化は、シナプスレベルの記憶痕跡であると言うこともできる。
記憶痕跡を巡る議論
記憶痕跡の物理的実体が明らかになるまでには紆余曲折があった。米国の心理学者Karl Lashleyはラットを使った実験で、記憶痕跡の存在について異議を唱えた[1]。Lashleyはまずラットに迷路を学習させた後、ラットの大脳皮質の様々な領域を異なる大きさで取り除いた。するとラットは大脳皮質を取り除かれた分だけ、迷路から抜け出すことが困難になり、大脳皮質の取り除いた領域ではなく、取り除いた割合と迷路の課題を達成する困難さが相関することを示した(図2)。これらの結果を基にLashleyは、「記憶は特定の脳領域に局在して蓄えられるのではなく、大脳皮質全体に分散して蓄えられる。大脳皮質の領域は、お互いに代用可能である。」と述べ、記憶痕跡が本当に存在するのか?という疑問を生じさせた。しかし、Lashleyの行った研究は、その実験系の複雑さゆえに記憶痕跡を発見できなかったと考えられ、Lashleyの実験以降、多くの科学者が記憶痕跡の存在を求め、精力的に研究を行ってきた。
記憶痕跡の存在
1999年、John Guzowskiのグループは、CatFISH (cellular compartment analysis of temporal activity by fluorescent in situ hybridization)法を用い、神経活動時に発現が誘導されるArc (activity-regulated cytoskeleton-associated protein) mRNAの時間的な細胞内局在変化を指標として、記憶痕跡の存在を探索した[3]。彼らはまずラットを新規環境に暴露し、その後、再度同じ環境(Context A)もしくは異なる環境(Context B)に暴露した後に、海馬におけるArcの発現およびその細胞内局在を調べた。その結果、新規環境に暴露された時にArcを発現したニューロンは、異なった環境(Context B)ではArcを発現せず、同じ環境(Context A)に再暴露されたときのみ再度Arcを発現することを見出した。すなわち、一度経験した事柄に再度暴露すると、初期の経験依存的に活性化されたニューロンが再活性化することが示された。
また2007年、Mark Mayfordらのグループは学習に応答して活性化されたニューロンを継続的に標識することが可能なトランスジェニックマウス(TetTagマウス)を作製した(図3A)[4]。このマウスを用いて、恐怖経験時に活性化された扁桃体ニューロンが恐怖記憶想起時にも再活性化されること、さらに再活性化されたニューロンの数は想起された記憶の強さと相関していることを示した。以上のCatFISHとTetTagマウスの2つの実験は、記憶の形成時に活性化したニューロン群(セルアセンブリ)が、記憶想起時において再活性化することを示しており、記憶獲得時に活性化したニューロン群(あるいはその一部)が記憶痕跡として存在することを間接的に示唆している。
記憶痕跡の抑制
恐怖記憶獲得時に活性化するニューロン群では、転写調節因子であるCREB (cAMP response element-binding protein)活性が高い。さらに、通常恐怖記憶が成立しにくいCREB欠損マウスの扁桃体ニューロンへのCREB過剰発現が、恐怖記憶獲得を回復させるとともに、記憶想起時にCREB過剰発現ニューロンが選択的に再活性化する[5]。これらのことを基にして、Sheena JosselynおよびAlcino Silvaのグループは、CREBを過剰発現したニューロンを特異的に不活性化させた後の記憶変化を見ることで、これらのニューロン集団が記憶想起に必要かどうかを検証した[6] [7]。
まず、Josselynらは、CREBを過剰発現したニューロンを不活性化させるため、“iDTR (inducible diphtheria toxin receptor)マウス”と名づけられたトランスジェニックマウスの扁桃体に単純ヘルペスウィルス(herpes simplex virus: HSV)ベクターによりCREB-creを発現し、cre活性によりloxPで挟まれたSTOP配列を抜き出すことでCREBが過剰発現したニューロン内にDTR(ジフテリア毒素受容体)を発現させた。その後、ジフテリア毒素を投与することで細胞死を誘導し、CREBを過剰発現したニューロン群の選択的除去を行った(図3B)[6]。同様に、Silvaらは、HSVによりCREBとAlstR(アラトスタチン受容体)を注入し、両者をニューロンに発現させた。そして、アラトスタチンを投与することで、CREBを発現する神経細胞を不活性化させた(図3C)[7]。どちらの場合においても、ジフテリア毒素またはアラトスタチン投与により扁桃体依存的な恐怖記憶の想起が阻害された。これらにより、恐怖記憶の発現時に活性化される扁桃体ニューロン群(セルアセンブリ)が、記憶痕跡に重要な役割を担っていることが示唆された。
仮説から物理的実体へ
2012年、利根川進のグループは、オプトジェネティックス(光遺伝学)法を用いて、特定のニューロン群の活性を制御することで記憶痕跡の物理的存在を示した[8] (図4)。彼らはまず海馬の歯状回のニューロンが活性化状態になるとチャネルロドプシン(ChR)を発現するトランスジェニックマウスを作製した。光照射するとチャネルロドプシンのチャネルが開き、カチオンを細胞内に流入させる。光照射という人為的な操作でニューロンを脱分極(活動)させることができる。彼らは、マウスに恐怖条件づけを行って恐怖記憶を形成させた時に活性化したニューロン群特異的にチャネルロドプシンを発現させた。次にマウスをまったく別の環境に暴露し、光照射によりチャネルロドプシンを発現しているニューロン群のみを選択的に活性化すると、マウスが恐怖を感じた時に示す、すくみ行動(フリージング)を引き起こさせることができることを発見した。すなわち、人為的な操作によって恐怖記憶を想起させることに成功し、記憶が学習時に活性化した特定のニューロン群(セルアセンブリ)に割りづけられて符号化されていることが示された。
このように、多くのニューロンの中から、一部のニューロン群が各記憶イベントに対応し活性化することで記憶痕跡が形成される(アンサンブル・コーディング)ことが示される一方で、どのようにしてこれらのニューロン群が選択されたのかについては、不明の点が多い。扁桃体の多くのニューロンが感覚入力を受け得るにもかかわらず、一部のニューロンのみが恐怖記憶獲得に依存した質的変化を示す。前述したように、恐怖記憶獲得に関わるニューロン群の選択性とCREB活性は正相関する[5]。CREBを過剰発現したニューロンでは、興奮性や、記憶獲得時のシナプス伝達効率の変化率が大きいことが報告されている[7]。これらのことは、学習時にCREB活性が高いニューロンが選択的にその記憶に関するセルアセンブリに取り込まれることを示唆している。
シナプス可塑性と記憶痕跡
記憶痕跡の形成には、シナプス可塑性が重要な役割を果たしていると考えられている。外界から情報(刺激)を得たときに、脳内ではさまざまな組み合わせのニューロンが活動する。同期活動したニューロン間のシナプスではシナプス伝達効率の上昇現象である長期増強(long-term potentiation; LTP,図5)が起きていると考えられている。
LTPはニューロン間の信号の受け渡しの場であるシナプスで観察される経験依存的な神経可塑性の代表例であり、ニューロンにおけるα-アミノ-3-ヒドロキシ-5-メチル-4-イソオキサゾールプロピオン酸型グルタミン酸受容体(AMPA型受容体)の新規タンパク質合成依存的な発現量の上昇を伴う[9]。実際に、げっ歯類を用いた恐怖音条件づけ学習の際に外側扁桃体のニューロンにおいて学習依存的に機能的なAMPA型受容体がシナプスへ組み込まれ、このAMPA型受容体の組み込みを阻害するとLTPだけでなく恐怖記憶の獲得および保持が阻害される[10]。加えて、LTPおよび記憶の保持はともに新規タンパク質合成が必要である[11] [12]。さらに、記憶形成時に実際にLTPが観察されたことから、LTPは記憶のシナプスレベルでの素過程であると考えられている。
これらのことより、学習時に活動したニューロン同士は強いシナプス結合で結ばれた回路を形成しており、ニューロン間のシナプスにおいて生じる神経可塑的変化(シナプス可塑性)がシナプスレベルでの記憶痕跡となりうること、さらに、記憶が経験依存的に活動したニューロン間でのシナプス可塑性を介して脳内に保存されることが示唆された。このようにしてシナプス伝達が増強したニューロンセットが活動することにより記憶の想起が行われる(図1)。
神経細胞集成体のプレプレイ
利根川らは2010年に、海馬ニューロン群の時間的発火順序が、実際の空間体験以前の休息時または睡眠時に先行し観察されることを報告した[13]。この現象は、予演(preplay)と名づけられ、休息中ないし睡眠中の脳内では、さまざまな海馬ニューロン集団を時間的順列にあらかじめ組織化しており、類似した新しい空間的体験が将来起こった際の符号化に役立っていることを示唆している。これらの報告は、アンサンブル・コーディングにおける記憶痕跡ニューロン群の選択機構を知るためのヒントを与えるものであるが、どのニューロン群が次なる記憶痕跡となるかを予測できるようになるには、今後、さらなる多くの角度からの研究が必要である。
将来展望
最後に、何十年にわたり研究対象とされてきた記憶痕跡は、上記のように近年の研究によって、その実体が明らかにされつつある。今後は、神経活動やニューロンの機能変化を可視化する技術、そして、in vivo live imagingなどの生体内シグナルを検出する技術の進歩により、直接、そして、タイムリーに脳内の記憶痕跡の形成から消失までを観察できる日が来るだろう。同時に、記憶の質的変化との相関を検証することで、記憶というダイナミックでとらえようのないものと思われていたものを、物理科学的な実体としてより深く検証することが出来るようになると考える。
関連項目
参考文献
- ↑ 1.0 1.1 Lashley K.
In search of the engram.
Society of Experimental Biology Symposium 4:454–82. (1950) - ↑ Hebb DO
The Organization of Behavior
John Wiley & Sons Inc (1949)
本書は1966年以来絶版になっていたが、2002年にLawrence Erlbaumから再刊され、現在はTaylor & Francisから刊行されている。最近、邦訳も出た。
D.O.ヘッブ
行動の機構
岩波文庫、2011年 - ↑
Guzowski, J.F., McNaughton, B.L., Barnes, C.A., & Worley, P.F. (1999).
Environment-specific expression of the immediate-early gene Arc in hippocampal neuronal ensembles. Nature neuroscience, 2(12), 1120-4. [PubMed:10570490] [WorldCat] [DOI] - ↑
Reijmers, L.G., Perkins, B.L., Matsuo, N., & Mayford, M. (2007).
Localization of a stable neural correlate of associative memory. Science (New York, N.Y.), 317(5842), 1230-3. [PubMed:17761885] [WorldCat] [DOI] - ↑ 5.0 5.1
Han, J.H., Kushner, S.A., Yiu, A.P., Cole, C.J., Matynia, A., Brown, R.A., ..., & Josselyn, S.A. (2007).
Neuronal competition and selection during memory formation. Science (New York, N.Y.), 316(5823), 457-60. [PubMed:17446403] [WorldCat] [DOI] - ↑ 6.0 6.1
Han, J.H., Kushner, S.A., Yiu, A.P., Hsiang, H.L., Buch, T., Waisman, A., ..., & Josselyn, S.A. (2009).
Selective erasure of a fear memory. Science (New York, N.Y.), 323(5920), 1492-6. [PubMed:19286560] [WorldCat] [DOI] - ↑ 7.0 7.1 7.2
Zhou, Y., Won, J., Karlsson, M.G., Zhou, M., Rogerson, T., Balaji, J., ..., & Silva, A.J. (2009).
CREB regulates excitability and the allocation of memory to subsets of neurons in the amygdala. Nature neuroscience, 12(11), 1438-43. [PubMed:19783993] [PMC] [WorldCat] [DOI] - ↑
Liu, X., Ramirez, S., Pang, P.T., Puryear, C.B., Govindarajan, A., Deisseroth, K., & Tonegawa, S. (2012).
Optogenetic stimulation of a hippocampal engram activates fear memory recall. Nature, 484(7394), 381-5. [PubMed:22441246] [PMC] [WorldCat] [DOI] - ↑
Nayak, A., Zastrow, D.J., Lickteig, R., Zahniser, N.R., & Browning, M.D. (1998).
Maintenance of late-phase LTP is accompanied by PKA-dependent increase in AMPA receptor synthesis. Nature, 394(6694), 680-3. [PubMed:9716131] [WorldCat] [DOI] - ↑
Rumpel, S., LeDoux, J., Zador, A., & Malinow, R. (2005).
Postsynaptic receptor trafficking underlying a form of associative learning. Science (New York, N.Y.), 308(5718), 83-8. [PubMed:15746389] [WorldCat] [DOI] - ↑
Frey, U., Krug, M., Reymann, K.G., & Matthies, H. (1988).
Anisomycin, an inhibitor of protein synthesis, blocks late phases of LTP phenomena in the hippocampal CA1 region in vitro. Brain research, 452(1-2), 57-65. [PubMed:3401749] [WorldCat] [DOI] - ↑
Goelet, P., Castellucci, V.F., Schacher, S., & Kandel, E.R. (1986).
The long and the short of long-term memory--a molecular framework. Nature, 322(6078), 419-22. [PubMed:2874497] [WorldCat] [DOI] - ↑
Dragoi, G., & Tonegawa, S. (2011).
Preplay of future place cell sequences by hippocampal cellular assemblies. Nature, 469(7330), 397-401. [PubMed:21179088] [PMC] [WorldCat] [DOI]