「シナプス刈り込み」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (2人の利用者による、間の6版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">[http://researchmap.jp/keichan3sai 上阪 直史]、[http://researchmap.jp/masanobukano 狩野 方伸]</font><br> | <font size="+1">[http://researchmap.jp/keichan3sai 上阪 直史]、[http://researchmap.jp/masanobukano 狩野 方伸]</font><br> | ||
''東京大学大学院医学系研究科医学部''<br> | ''東京大学大学院医学系研究科医学部''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2016年1月14日 原稿完成日:2016年月日<br> | ||
担当編集委員:[http://researchmap.jp/noriko1128 大隅 典子](東北大学 大学院医学系研究科 附属創生応用医学研究センター 脳神経科学コアセンター 発生発達神経科学分野)<br> | 担当編集委員:[http://researchmap.jp/noriko1128 大隅 典子](東北大学 大学院医学系研究科 附属創生応用医学研究センター [脳神経科学コアセンター 発生発達神経科学分野)<br> | ||
</div> | </div> | ||
英語名: synapse elimination, synapse pruning 独:Synapse Beseitigung 仏:élimination de la synapse | 英語名: synapse elimination, synapse pruning 独:Synapse Beseitigung 仏:élimination de la synapse | ||
{{box|text= シナプス刈り込みとは、必要なシナプス結合だけが強められ、不要なシナプス結合は除去される現象である。発生、発達期の動物の脳内ではある段階になると神経結合(シナプス)が形成され始める。生後間もない時期の動物の脳では、過剰にシナプスが形成され、その密度は成熟動物でみられるよりもずっと高い。生後の発達過程において、このうち必要な結合だけが強められ、不要な結合は除去されて、成熟した機能的な神経回路が完成する。この過程は「シナプス刈り込み」と呼ばれており、生後発達期の神経回路に見られる普遍的な現象であると考えられている。}} | {{box|text= | ||
シナプス刈り込みとは、必要なシナプス結合だけが強められ、不要なシナプス結合は除去される現象である。発生、発達期の動物の脳内ではある段階になると神経結合(シナプス)が形成され始める。生後間もない時期の動物の脳では、過剰にシナプスが形成され、その密度は成熟動物でみられるよりもずっと高い。生後の発達過程において、このうち必要な結合だけが強められ、不要な結合は除去されて、成熟した機能的な神経回路が完成する。この過程は「シナプス刈り込み」と呼ばれており、生後発達期の神経回路に見られる普遍的な現象であると考えられている。 | |||
}} | |||
==様々な神経系でのシナプス刈り込み== | ==様々な神経系でのシナプス刈り込み== | ||
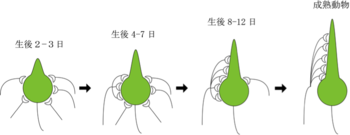
[[image:シナプス刈り込み1.png|thumb|350px|''' | [[image:シナプス刈り込み1.png|thumb|350px|'''図1.マウスの登上線維—プルキンエ細胞シナプスの刈り込み''']] | ||
[[シナプス]]刈り込みは、様々な[[動物]]種や神経系で見られ、[[興奮性シナプス]]、[[抑制性シナプス]]の両方で観察されている。以下にシナプス刈り込みが観察される代表的なシナプスについて概説する。 | |||
=== | ===興奮性シナプスの刈り込み=== | ||
==== | ====小脳の登上線維—プルキンエ細胞シナプス==== | ||
中枢神経系において、シナプス刈り込みが観察される代表例として、延髄の下オリーブ核からの[[軸索]]である登上線維とその投射先である[[小脳]][[プルキンエ細胞]]の間のシナプス結合がある<ref name=ref1><pubmed></pubmed></ref>。生まれたばかりの動物のプルキンエ細胞では、5本以上の弱い登上線維がプルキンエ細胞の細胞体にシナプスを形成しているが(図1)、大人の動物ではわずか一本の強力な登上線維が、細胞体から張り出した樹状突起にシナプスを形成している(図1)。登上線維は、最初プルキンエ細胞の細胞体にシナプスを形成する。登上線維がプルキンエ細胞体上にある間に、登上線維間で入力強度(プルキンエ細胞にどれだけ大きなシナプス応答を引き起こすことができるか)に差が生じてくる<ref name=ref2><pubmed></pubmed></ref>。すなわち強い登上線維(勝者)と弱い登上線維(敗者)の選別はシナプスが細胞体にある間に始まる。この入力強度の違いは、各々の登上線維がどれだけ多くのシナプスをプルキンエ細胞に形成しているかという、量的な違いだけでなく、[[シナプス前終末]]からの[[グルタミン酸]]放出の特性という質的な違いも含んでいる。即ち、伝達物質の素量サイズや伝達物質の放出確率に違いはないが、「勝者」の登上線維では、複数の[[シナプス小胞]]が同時に放出される(multivesicular release)確率が、「敗者」の登上線維に比べて高いことが知られている<ref name=ref2 />。勝者と敗者の選別の後、勝者の登上線維のみが樹状突起に移動することができ、それ以外の敗者の登上線維は細胞体に取り残され、[[マウス]]では生後3週目までにそのほとんどが除去される<ref name=ref3><pubmed></pubmed></ref>。 | |||
====網膜—外側膝状体シナプス==== | |||
網膜[[神経節]]細胞は視床の外側膝状体の神経細胞にシナプスを形成する。このシナプスにおいて発達期にシナプス刈り込みがおこる<ref name=ref4><pubmed></pubmed></ref>。マウスにおいて、眼が開く時期である生後14日目頃には、20本以上の網膜神経節細胞の線維が外側膝状体の神経細胞にシナプス結合している。その後、網膜神経節細胞線維の線維間でシナプス入力量に違いが生じてくる<ref name=ref4 />。この違いは、登上線維—プルキンエ細胞シナプスと似て、放出確率の変化によるものでは無く、伝達物質の放出部位が増加することによる。また、伝達物質の素量サイズにもわずかながら変化が見られる。その後、生後4週目頃までに多くの網膜神経節細胞線維のシナプスが除去され、最終的に強力なシナプス入力を持つ1-3本の神経節細胞線維が外側膝状体の神経細胞にシナプス結合する。 | |||
==== | |||
====三叉神経核-後内側腹側核シナプス==== | ====三叉神経核-後内側腹側核シナプス==== | ||
[[ | [[三叉神経]]核細胞から視床の後内側腹側核の神経細胞へのシナプス入力は動物の髭からの感覚入力を伝えている。このシナプスにおいて発達期にシナプス刈り込みがおこる<ref name=ref5><pubmed></pubmed></ref> <ref name=ref6><pubmed></pubmed></ref>。生後1週目のマウスでは、多くの三叉神経核細胞の軸索(内側毛帯線維)が後内側腹側核細胞にシナプス入力しているが、生後16日目までに1本の線維からの入力のみが強化され、他の線維は刈り込まれる。 | ||
====末梢神経系神経筋接合部シナプス==== | ====末梢神経系神経筋接合部シナプス==== | ||
脊髄腹側にある運動神経細胞の軸索は、筋細胞に投射しており、[[神経筋接合部]]と呼ばれるシナプスを形成している。このシナプスにおいて刈り込みが起こる<ref name=ref7><pubmed></pubmed></ref>。例えば、マウスの頸部の[[筋肉]]に関して、生直後には、複数の運動神経細胞からの線維が個々の筋細胞にシナプス入力している。その後、神経線維間で放出確率に差が生じ、シナプス入力の強度に線維間で差が生じる<ref name=ref8><pubmed></pubmed></ref>。すなわち、高い放出確率を持つ線維は入力強度が大きくなり、低い放出確率を持つ線維は入力強度が小さくなる。その後の生後発達期に1本の線維以外の線維はすべて除去され、一つの運動神経細胞からの一本の線維が1つの筋細胞にシナプス入力をするようになる。 | |||
====皮質—脊髄シナプス==== | |||
大脳運動感覚皮質5層の細胞からの軸索はその投射先である脊髄の神経細胞にシナプス結合しており、このシナプスにおいてシナプス刈り込みが起こる<ref name=ref9><pubmed></pubmed></ref>。[[ラット]]の生後7日目頃には、[[大脳皮質]]からの軸索は脊髄全体にシナプスを形成しているが、その後脊髄腹側にあるシナプスが刈り込まれ、背側にあるシナプスのみが残存する。 | |||
==== | ====視床—皮質シナプス==== | ||
視床神経細胞の軸索はその投射先である大脳皮質の神経細胞とシナプス結合をしており、このシナプスにおいてシナプス刈り込みがおこると考えられている<ref name=ref10><pubmed></pubmed></ref> <ref name=ref11><pubmed></pubmed></ref> <ref name=ref12><pubmed></pubmed></ref>。幼若動物の脳においては左右の目に対応する視床軸索が投射先である大脳皮質視覚野全般に広範に過剰投射し、それぞれの投射領域が混在している。しかし、この幼若脳で見られる広範な過剰投射の状態から、シナプス刈り込みを経て、左右の目に対応する視床軸索の投射領域が縞状に分離した状態になると考えられている。 | |||
==== | ====副交感神経の節前線維—節後神経細胞シナプス==== | ||
自律神経系の一部を構成する副交感神経において、生まれたばかりの動物では多くの節前線維が神経節細胞(節後神経細胞)にシナプスを形成しているが、その後シナプス刈り込みが起こり、1本の節前線維が1つの神経節細胞にシナプス入力をするようになる<ref name=ref13><pubmed></pubmed></ref>。 | |||
===抑制性シナプスの刈り込み=== | ===抑制性シナプスの刈り込み=== | ||
====台形体内側核-外側上オリーブ核シナプス==== | ====台形体内側核-外側上オリーブ核シナプス==== | ||
聴覚系の中継核である台形体内側核からの軸索は外側上オリーブ核細胞に[[抑制性伝達物質]]であるγアミノ酪酸([[GABA]])/グリシン作動性のシナプスを形成している。このシナプスにおいて刈り込みが起こる<ref name=ref14><pubmed></pubmed></ref>。生直後のラットにおいて、多数の弱い台形体内側核からの軸索が個々の外側上オリーブ核細胞にシナプス入力している。その後、耳が聞こえ始める生後2週目までに、シナプス刈り込みが起こり、外側上オリーブ核細胞にシナプス入力している線維数が除去されるとともに、残っている線維からの入力は強くなる。 | |||
====大脳皮質内抑制性シナプス==== | ====大脳皮質内抑制性シナプス==== | ||
大脳皮質の[[抑制性]]細胞である[[バスケット細胞]]の線維は、大脳皮質の[[錐体細胞]]に[[GABA作動性]]シナプスを形成している。このシナプスにおいて形態学的解析によりシナプス刈り込みが起こることが報告されている<ref name=ref15><pubmed></pubmed></ref>。 | |||
==シナプス刈り込みに関わる因子== | ==シナプス刈り込みに関わる因子== | ||
シナプスを構成する[[シナプス前部]]細胞とシナプス後部細胞以外に他の神経細胞やシナプス、アストロサイトやマイクロ[[グリア]]などのグリアの関与が報告されている。さらに、それらの神経活動の重要性も明らかにされてきた。また関与する分子に関しても、登上線維—プルキンエ細胞を中心に明らかにされてきた。以下にそれぞれのシナプスに関して、その刈り込みに関わる因子について概説する。 | |||
===シナプス刈り込みに関わる細胞、シナプス、神経活動=== | ===シナプス刈り込みに関わる細胞、シナプス、神経活動=== | ||
==== | ====登上線維—プルキンエ細胞シナプス==== | ||
シナプス後部のプルキンエ細胞の神経活動がシナプス刈り込みに必須であることが明らかになっている<ref name=ref16><pubmed> | シナプス後部のプルキンエ細胞の神経活動がシナプス刈り込みに必須であることが明らかになっている<ref name=ref16><pubmed></pubmed></ref> <ref name=ref17><pubmed></pubmed></ref>。さらに、登上線維シナプスにおける長期増強や[[長期抑圧]]により登上線維間で入力強度に差が生じる可能性が報告されている<ref name=ref18><pubmed></pubmed></ref>。 | ||
また、プルキンエ細胞と[[興奮性]]のシナプス結合をする平行線維シナプスや抑制性のGABA作動性シナプスがシナプス刈り込みに重要であることが明らかになっている<ref name=ref19><pubmed></pubmed></ref> <ref name=ref20><pubmed></pubmed></ref>。また、アストロサイトである[[バーグマングリア]]が関係するという報告もある<ref name=ref21><pubmed></pubmed></ref> <ref name=ref22><pubmed></pubmed></ref>。 | |||
==== | ====網膜—外側膝状体シナプス==== | ||
開眼時期の数日間、網膜神経節細胞の自発的な神経活動が一部のシナプスの強化とそれ以外のシナプスの除去を行うために必要であり、開眼後約1週を経過した生後20日目からの視覚入力がシナプスの維持に必要であることが報告されている<ref name=ref23><pubmed> | 開眼時期の数日間、網膜神経節細胞の自発的な神経活動が一部のシナプスの強化とそれ以外のシナプスの除去を行うために必要であり、開眼後約1週を経過した生後20日目からの視覚入力がシナプスの維持に必要であることが報告されている<ref name=ref23><pubmed></pubmed></ref>。また、網膜—外側膝状体シナプスが刈り込まれている時期に、ミクログリアはこのシナプスを神経活動依存的に取り囲んでいる<ref name=ref24><pubmed></pubmed></ref>。ミクログリアにより取り囲まれたシナプスは、その後[[リソソーム]]などにより分解、除去されると考えられている。また、アストロサイトもこのシナプスを取り囲み、シナプス刈り込みを制御することが報告されている<ref name=ref25><pubmed></pubmed></ref>。 | ||
====神経筋接合部シナプスの刈り込み==== | ====神経筋接合部シナプスの刈り込み==== | ||
末梢神経系で[[髄鞘]]を構成する[[グリア細胞]]である[[シュワン細胞]]は、シナプスやその線維が除去される時にそれらを取り囲み、おそらくリソソームなどによりそれらを分解することで線維やシナプスを除去していると考えられている<ref name=ref26><pubmed></pubmed></ref> <ref name=ref27><pubmed></pubmed></ref>。 | |||
この[[シナプスの刈り込み]]に関わる神経活動として、[[シナプス前]]部の運動神経線維とシナプス後部の筋細胞の両方の神経活動が必要であることが報告されている<ref name=ref7 /> <ref name=ref28><pubmed></pubmed></ref>。また、複数の運動神経線維間の活動のタイミングが同期した場合より、非同期の場合の方がシナプス刈り込みは促進されることも報告されている<ref name=ref29><pubmed></pubmed></ref>。さらに、一部の運動神経線維のみでシナプス伝達を遮断すると、その遮断された神経線維からのシナプスは除去される確率が高く、遮断されていない神経線維は維持される確率が高い<ref name=ref30><pubmed></pubmed></ref>。すなわち、神経線維間での入力強度の差が、強化される線維と除去される線維を決定していると考えられる。これらのことから、線維間でシナプス入力量に差が生じることに加えて、線維間で活動のタイミングが異なるようになり、シナプス刈り込みが行われると考えられる。 | |||
===シナプス刈り込みに関与する分子=== | ===シナプス刈り込みに関与する分子=== | ||
==== | ====登上線維—プルキンエ細胞シナプス==== | ||
'''代謝型グルタミン酸受容体1型を介するシグナリング'''<br> | '''代謝型グルタミン酸受容体1型を介するシグナリング'''<br> | ||
[[グルタミン酸受容体]]である代謝型グルタミン酸受容体1型<ref name=ref31><pubmed></pubmed></ref>は、生後12日頃から17日頃に、弱いシナプスをプルキンエ細胞の細胞体から除去する因子として機能する<ref name=ref32><pubmed></pubmed></ref>。さらにmGluR1の下流の細胞内シグナル分子として、guanine nucleotide binding protein、alpha q polypeptide<ref name=ref33><pubmed></pubmed></ref>、 phospholipase Cβ4 (PLCβ4<ref name=ref34><pubmed></pubmed></ref>、protein kinase Cγ(PKCγ)<ref name=ref35><pubmed></pubmed></ref>が関与する。mGluR1は、平行線維のシナプス入力により、平行線維-プルキンエ細胞シナプス後部で活性化され、そこからプルキンエ細胞内でGαq、PLCβ4、PKCγの順でシグナルが伝わり、弱いシナプスが刈り込まれると考えられている。 | |||
'''P/Q型カルシウムチャネル'''<br> | '''P/Q型カルシウムチャネル'''<br> | ||
[[P/Q型カルシウムチャネル]]は、プルキンエ細胞の主要な[[電位依存性カルシウムチャネル]]である。P/Q型[[カルシウムチャネル]]は、登上線維間のシナプス入力量に差を生じさせ、1本の登上線維の支配を強化し、その「勝者」のみが樹状突起へ進展してシナプスを形成できるようにし、生後7日頃から11日頃に弱い登上線維シナプスを除去する役割を担っている<ref name=ref16 /> <ref name=ref36><pubmed></pubmed></ref>。さらに、P/Q VDCCは後期過程においてもシナプス刈り込みに関与しており、その活性化により[[最初期遺伝子]]activity regulated cytoskeleton associated protein(Arc/Arg3.1)の発現を増加させ、シナプス刈り込みを促進している<ref name=ref37><pubmed></pubmed></ref>。 | |||
''' | '''GluRδ2、Cbln1'''<br> | ||
[[イオンチャネル]]型グルタミン酸受容体の構造を持つGlutamate receptor delta 2<ref name=ref31 />とC1qファミリー分子であるCerebellin-1<ref name=ref38><pubmed></pubmed></ref>は、平行線維-プルキンエ細胞シナプスの形成と維持に必須の分子であることが明らかにされた<ref name=ref38 /> <ref name=ref39><pubmed></pubmed></ref>。また、GluD2とCbln1はneurexinsを介したその相互作用により平行線維-プルキンエ細胞シナプスの形成と維持に必須の分子であることが明らかにされた<ref name=ref39 /> <ref name=ref40><pubmed></pubmed></ref> <ref name=ref41><pubmed></pubmed></ref> <ref name=ref42><pubmed></pubmed></ref>。平行線維シナプスは、プルキンエ細胞上の支配領域をめぐって登上線維シナプスと競合していると考えられており、GluRδ2とCbln1は平行線維シナプスを強化することで、登上線維シナプスが遠位樹状突起へ進展することを制限していると考えられている<ref name=ref41 />。 | |||
'''Semaphorin7A、Semaphorin3A'''<br> | |||
シナプス刈り込みにはシナプス後部の神経細胞の活動やシグナル伝達分子が重要であることがわかっていたことから、シナプス後部神経細胞からシナプス前部へと伝えられる逆行性シグナル分子が想定されてきた。最近の研究により、Semaphorin7AとSemaphorin3Aがこの役割を担うことが示された<ref name=ref43><pubmed></pubmed></ref>。Semaphorin7Aは生後15日以降におこる後期シナプス除去過程においてmGluR1の下流で働き、弱い登上線維シナプスを除去する。一方、Semaphorin3Aは生後8日目以降に登上線維シナプスを強化および維持する。 | |||
'''C1ql1'''<br> | '''C1ql1'''<br> | ||
Cbln1の関連分子であるC1q-like protein 1は下オリーブ核細胞に選択的に発現し、登上線維—プルキンエ細胞シナプスで機能することで登上線維シナプスの選択的強化や除去に関わることが報告されている<ref name=ref44><pubmed></pubmed></ref>。さらに、プルキンエ細胞で発現するbrain-specific angiogenesis inhibitor 3(BAI3)が下オリーブ核からのC1ql1を受け取り、登上線維シナプスの強化や除去を制御することも明らかとなっている。 | |||
'''NMDA型グルタミン酸受容体'''<br> | '''NMDA型グルタミン酸受容体'''<br> | ||
NMDA型グルタミン酸受容体は、シナプス刈り込みが起こる時期にプルキンエ細胞には存在しないが、苔状線維-顆粒細胞シナプスに豊富に存在している。苔状線維からの興奮性入力を顆粒細胞の軸索である平行線維を通じて、プルキンエ細胞に伝え、mGluR1-Gαq-PLCβ4-PKCγのカスケードを駆動することにより、弱いプルキンエ細胞のシナプス除去を促進すると考えられている<ref name=ref45><pubmed></pubmed></ref> <ref name=ref46><pubmed></pubmed></ref>。 | |||
'''その他'''<br> | '''その他'''<br> | ||
その他、インシュリン様成長因子1(IGF1)<ref name=ref47><pubmed></pubmed></ref>、脳由来神経栄養因子受容体(TrkB)<ref name=ref48><pubmed></pubmed></ref> <ref name=ref49><pubmed></pubmed></ref>、細胞内の輸送タンパクのミオシンVa<ref name=ref50><pubmed></pubmed></ref>、アストロサイト特異的なグルタミン酸トランスポーターのGLAST22)、脳で特異的に発現する受容体様膜蛋自質BSRP(Sez6)<ref name=ref51><pubmed></pubmed></ref>の関与が報告されているが、機能する場所やそのシグナリングの実体はよく分かっていない。 | |||
====神経筋接合部のシナプス==== | ====神経筋接合部のシナプス==== | ||
ペプチド結合加水分解酵素プロテアーゼ<ref name=ref52><pubmed></pubmed></ref>、グリア由来神経栄養因子GDNF<ref name=ref53><pubmed></pubmed></ref>、細胞外シグナル分子の[[リーリン]]<ref name=ref54><pubmed></pubmed></ref>の関与が報告されている。プロテアーゼや[[GDNF]]は、シナプス後部細胞である筋細胞からシナプス前部細胞である[[運動ニューロン]]の神経線維シナプスに働きかける逆行性シグナル分子として機能すると考えられている。 | |||
==== | ====網膜—外側膝状体シナプス==== | ||
補体のC1qと C3の関与が報告されている<ref name=ref55><pubmed></pubmed></ref>。これらの分子は、おそらくミクログリアを介して機能し、弱いシナプスを除去すると考えられている。また、トランスフォーミング増殖因子βによるシグナルが、網膜神経節細胞やその軸索でのC1qの発現を増加させ、シナプス刈り込みを促進する可能性が示されている<ref name=ref56><pubmed></pubmed></ref>。さらに、アストロサイトに存在し、食作用に関係した受容体分子MEGF10とMERTKが、シナプス刈り込みに必要であることが報告された<ref name=ref25 />。 また、[[レット症候群]]の原因遺伝子であるMECP2の[[ノックアウトマウス]]では、視覚経験依存的なシナプス刈り込みが選択的に阻害されていることが報告されている<ref name=ref57><pubmed></pubmed></ref>。 | |||
====台形体内側核-外側上オリーブ核シナプス==== | ====台形体内側核-外側上オリーブ核シナプス==== | ||
グルタミン酸トランスポーターであるvGluT3が関与することが報告されている<ref name=ref58><pubmed></pubmed></ref>。台形体内側核由来のシナプスであるGABA/glycinergicシナプスが特定の時期にグルタミン酸も放出することがこのシナプス刈り込みに重要であると考えられている。 | |||
====大脳皮質内抑制性シナプス==== | ====大脳皮質内抑制性シナプス==== | ||
2016年1月14日 (木) 13:13時点における版
上阪 直史、狩野 方伸
東京大学大学院医学系研究科医学部
DOI:10.14931/bsd.6690 原稿受付日:2016年1月14日 原稿完成日:2016年月日
担当編集委員:大隅 典子(東北大学 大学院医学系研究科 附属創生応用医学研究センター [脳神経科学コアセンター 発生発達神経科学分野)
英語名: synapse elimination, synapse pruning 独:Synapse Beseitigung 仏:élimination de la synapse
シナプス刈り込みとは、必要なシナプス結合だけが強められ、不要なシナプス結合は除去される現象である。発生、発達期の動物の脳内ではある段階になると神経結合(シナプス)が形成され始める。生後間もない時期の動物の脳では、過剰にシナプスが形成され、その密度は成熟動物でみられるよりもずっと高い。生後の発達過程において、このうち必要な結合だけが強められ、不要な結合は除去されて、成熟した機能的な神経回路が完成する。この過程は「シナプス刈り込み」と呼ばれており、生後発達期の神経回路に見られる普遍的な現象であると考えられている。
様々な神経系でのシナプス刈り込み
シナプス刈り込みは、様々な動物種や神経系で見られ、興奮性シナプス、抑制性シナプスの両方で観察されている。以下にシナプス刈り込みが観察される代表的なシナプスについて概説する。
興奮性シナプスの刈り込み
小脳の登上線維—プルキンエ細胞シナプス
中枢神経系において、シナプス刈り込みが観察される代表例として、延髄の下オリーブ核からの軸索である登上線維とその投射先である小脳プルキンエ細胞の間のシナプス結合がある[1]。生まれたばかりの動物のプルキンエ細胞では、5本以上の弱い登上線維がプルキンエ細胞の細胞体にシナプスを形成しているが(図1)、大人の動物ではわずか一本の強力な登上線維が、細胞体から張り出した樹状突起にシナプスを形成している(図1)。登上線維は、最初プルキンエ細胞の細胞体にシナプスを形成する。登上線維がプルキンエ細胞体上にある間に、登上線維間で入力強度(プルキンエ細胞にどれだけ大きなシナプス応答を引き起こすことができるか)に差が生じてくる[2]。すなわち強い登上線維(勝者)と弱い登上線維(敗者)の選別はシナプスが細胞体にある間に始まる。この入力強度の違いは、各々の登上線維がどれだけ多くのシナプスをプルキンエ細胞に形成しているかという、量的な違いだけでなく、シナプス前終末からのグルタミン酸放出の特性という質的な違いも含んでいる。即ち、伝達物質の素量サイズや伝達物質の放出確率に違いはないが、「勝者」の登上線維では、複数のシナプス小胞が同時に放出される(multivesicular release)確率が、「敗者」の登上線維に比べて高いことが知られている[2]。勝者と敗者の選別の後、勝者の登上線維のみが樹状突起に移動することができ、それ以外の敗者の登上線維は細胞体に取り残され、マウスでは生後3週目までにそのほとんどが除去される[3]。
網膜—外側膝状体シナプス
網膜神経節細胞は視床の外側膝状体の神経細胞にシナプスを形成する。このシナプスにおいて発達期にシナプス刈り込みがおこる[4]。マウスにおいて、眼が開く時期である生後14日目頃には、20本以上の網膜神経節細胞の線維が外側膝状体の神経細胞にシナプス結合している。その後、網膜神経節細胞線維の線維間でシナプス入力量に違いが生じてくる[4]。この違いは、登上線維—プルキンエ細胞シナプスと似て、放出確率の変化によるものでは無く、伝達物質の放出部位が増加することによる。また、伝達物質の素量サイズにもわずかながら変化が見られる。その後、生後4週目頃までに多くの網膜神経節細胞線維のシナプスが除去され、最終的に強力なシナプス入力を持つ1-3本の神経節細胞線維が外側膝状体の神経細胞にシナプス結合する。
三叉神経核-後内側腹側核シナプス
三叉神経核細胞から視床の後内側腹側核の神経細胞へのシナプス入力は動物の髭からの感覚入力を伝えている。このシナプスにおいて発達期にシナプス刈り込みがおこる[5] [6]。生後1週目のマウスでは、多くの三叉神経核細胞の軸索(内側毛帯線維)が後内側腹側核細胞にシナプス入力しているが、生後16日目までに1本の線維からの入力のみが強化され、他の線維は刈り込まれる。
末梢神経系神経筋接合部シナプス
脊髄腹側にある運動神経細胞の軸索は、筋細胞に投射しており、神経筋接合部と呼ばれるシナプスを形成している。このシナプスにおいて刈り込みが起こる[7]。例えば、マウスの頸部の筋肉に関して、生直後には、複数の運動神経細胞からの線維が個々の筋細胞にシナプス入力している。その後、神経線維間で放出確率に差が生じ、シナプス入力の強度に線維間で差が生じる[8]。すなわち、高い放出確率を持つ線維は入力強度が大きくなり、低い放出確率を持つ線維は入力強度が小さくなる。その後の生後発達期に1本の線維以外の線維はすべて除去され、一つの運動神経細胞からの一本の線維が1つの筋細胞にシナプス入力をするようになる。
皮質—脊髄シナプス
大脳運動感覚皮質5層の細胞からの軸索はその投射先である脊髄の神経細胞にシナプス結合しており、このシナプスにおいてシナプス刈り込みが起こる[9]。ラットの生後7日目頃には、大脳皮質からの軸索は脊髄全体にシナプスを形成しているが、その後脊髄腹側にあるシナプスが刈り込まれ、背側にあるシナプスのみが残存する。
視床—皮質シナプス
視床神経細胞の軸索はその投射先である大脳皮質の神経細胞とシナプス結合をしており、このシナプスにおいてシナプス刈り込みがおこると考えられている[10] [11] [12]。幼若動物の脳においては左右の目に対応する視床軸索が投射先である大脳皮質視覚野全般に広範に過剰投射し、それぞれの投射領域が混在している。しかし、この幼若脳で見られる広範な過剰投射の状態から、シナプス刈り込みを経て、左右の目に対応する視床軸索の投射領域が縞状に分離した状態になると考えられている。
副交感神経の節前線維—節後神経細胞シナプス
自律神経系の一部を構成する副交感神経において、生まれたばかりの動物では多くの節前線維が神経節細胞(節後神経細胞)にシナプスを形成しているが、その後シナプス刈り込みが起こり、1本の節前線維が1つの神経節細胞にシナプス入力をするようになる[13]。
抑制性シナプスの刈り込み
台形体内側核-外側上オリーブ核シナプス
聴覚系の中継核である台形体内側核からの軸索は外側上オリーブ核細胞に抑制性伝達物質であるγアミノ酪酸(GABA)/グリシン作動性のシナプスを形成している。このシナプスにおいて刈り込みが起こる[14]。生直後のラットにおいて、多数の弱い台形体内側核からの軸索が個々の外側上オリーブ核細胞にシナプス入力している。その後、耳が聞こえ始める生後2週目までに、シナプス刈り込みが起こり、外側上オリーブ核細胞にシナプス入力している線維数が除去されるとともに、残っている線維からの入力は強くなる。
大脳皮質内抑制性シナプス
大脳皮質の抑制性細胞であるバスケット細胞の線維は、大脳皮質の錐体細胞にGABA作動性シナプスを形成している。このシナプスにおいて形態学的解析によりシナプス刈り込みが起こることが報告されている[15]。
シナプス刈り込みに関わる因子
シナプスを構成するシナプス前部細胞とシナプス後部細胞以外に他の神経細胞やシナプス、アストロサイトやマイクログリアなどのグリアの関与が報告されている。さらに、それらの神経活動の重要性も明らかにされてきた。また関与する分子に関しても、登上線維—プルキンエ細胞を中心に明らかにされてきた。以下にそれぞれのシナプスに関して、その刈り込みに関わる因子について概説する。
シナプス刈り込みに関わる細胞、シナプス、神経活動
登上線維—プルキンエ細胞シナプス
シナプス後部のプルキンエ細胞の神経活動がシナプス刈り込みに必須であることが明らかになっている[16] [17]。さらに、登上線維シナプスにおける長期増強や長期抑圧により登上線維間で入力強度に差が生じる可能性が報告されている[18]。
また、プルキンエ細胞と興奮性のシナプス結合をする平行線維シナプスや抑制性のGABA作動性シナプスがシナプス刈り込みに重要であることが明らかになっている[19] [20]。また、アストロサイトであるバーグマングリアが関係するという報告もある[21] [22]。
網膜—外側膝状体シナプス
開眼時期の数日間、網膜神経節細胞の自発的な神経活動が一部のシナプスの強化とそれ以外のシナプスの除去を行うために必要であり、開眼後約1週を経過した生後20日目からの視覚入力がシナプスの維持に必要であることが報告されている[23]。また、網膜—外側膝状体シナプスが刈り込まれている時期に、ミクログリアはこのシナプスを神経活動依存的に取り囲んでいる[24]。ミクログリアにより取り囲まれたシナプスは、その後リソソームなどにより分解、除去されると考えられている。また、アストロサイトもこのシナプスを取り囲み、シナプス刈り込みを制御することが報告されている[25]。
神経筋接合部シナプスの刈り込み
末梢神経系で髄鞘を構成するグリア細胞であるシュワン細胞は、シナプスやその線維が除去される時にそれらを取り囲み、おそらくリソソームなどによりそれらを分解することで線維やシナプスを除去していると考えられている[26] [27]。
このシナプスの刈り込みに関わる神経活動として、シナプス前部の運動神経線維とシナプス後部の筋細胞の両方の神経活動が必要であることが報告されている[7] [28]。また、複数の運動神経線維間の活動のタイミングが同期した場合より、非同期の場合の方がシナプス刈り込みは促進されることも報告されている[29]。さらに、一部の運動神経線維のみでシナプス伝達を遮断すると、その遮断された神経線維からのシナプスは除去される確率が高く、遮断されていない神経線維は維持される確率が高い[30]。すなわち、神経線維間での入力強度の差が、強化される線維と除去される線維を決定していると考えられる。これらのことから、線維間でシナプス入力量に差が生じることに加えて、線維間で活動のタイミングが異なるようになり、シナプス刈り込みが行われると考えられる。
シナプス刈り込みに関与する分子
登上線維—プルキンエ細胞シナプス
代謝型グルタミン酸受容体1型を介するシグナリング
グルタミン酸受容体である代謝型グルタミン酸受容体1型[31]は、生後12日頃から17日頃に、弱いシナプスをプルキンエ細胞の細胞体から除去する因子として機能する[32]。さらにmGluR1の下流の細胞内シグナル分子として、guanine nucleotide binding protein、alpha q polypeptide[33]、 phospholipase Cβ4 (PLCβ4[34]、protein kinase Cγ(PKCγ)[35]が関与する。mGluR1は、平行線維のシナプス入力により、平行線維-プルキンエ細胞シナプス後部で活性化され、そこからプルキンエ細胞内でGαq、PLCβ4、PKCγの順でシグナルが伝わり、弱いシナプスが刈り込まれると考えられている。
P/Q型カルシウムチャネル
P/Q型カルシウムチャネルは、プルキンエ細胞の主要な電位依存性カルシウムチャネルである。P/Q型カルシウムチャネルは、登上線維間のシナプス入力量に差を生じさせ、1本の登上線維の支配を強化し、その「勝者」のみが樹状突起へ進展してシナプスを形成できるようにし、生後7日頃から11日頃に弱い登上線維シナプスを除去する役割を担っている[16] [36]。さらに、P/Q VDCCは後期過程においてもシナプス刈り込みに関与しており、その活性化により最初期遺伝子activity regulated cytoskeleton associated protein(Arc/Arg3.1)の発現を増加させ、シナプス刈り込みを促進している[37]。
GluRδ2、Cbln1
イオンチャネル型グルタミン酸受容体の構造を持つGlutamate receptor delta 2[31]とC1qファミリー分子であるCerebellin-1[38]は、平行線維-プルキンエ細胞シナプスの形成と維持に必須の分子であることが明らかにされた[38] [39]。また、GluD2とCbln1はneurexinsを介したその相互作用により平行線維-プルキンエ細胞シナプスの形成と維持に必須の分子であることが明らかにされた[39] [40] [41] [42]。平行線維シナプスは、プルキンエ細胞上の支配領域をめぐって登上線維シナプスと競合していると考えられており、GluRδ2とCbln1は平行線維シナプスを強化することで、登上線維シナプスが遠位樹状突起へ進展することを制限していると考えられている[41]。
Semaphorin7A、Semaphorin3A
シナプス刈り込みにはシナプス後部の神経細胞の活動やシグナル伝達分子が重要であることがわかっていたことから、シナプス後部神経細胞からシナプス前部へと伝えられる逆行性シグナル分子が想定されてきた。最近の研究により、Semaphorin7AとSemaphorin3Aがこの役割を担うことが示された[43]。Semaphorin7Aは生後15日以降におこる後期シナプス除去過程においてmGluR1の下流で働き、弱い登上線維シナプスを除去する。一方、Semaphorin3Aは生後8日目以降に登上線維シナプスを強化および維持する。
C1ql1
Cbln1の関連分子であるC1q-like protein 1は下オリーブ核細胞に選択的に発現し、登上線維—プルキンエ細胞シナプスで機能することで登上線維シナプスの選択的強化や除去に関わることが報告されている[44]。さらに、プルキンエ細胞で発現するbrain-specific angiogenesis inhibitor 3(BAI3)が下オリーブ核からのC1ql1を受け取り、登上線維シナプスの強化や除去を制御することも明らかとなっている。
NMDA型グルタミン酸受容体
NMDA型グルタミン酸受容体は、シナプス刈り込みが起こる時期にプルキンエ細胞には存在しないが、苔状線維-顆粒細胞シナプスに豊富に存在している。苔状線維からの興奮性入力を顆粒細胞の軸索である平行線維を通じて、プルキンエ細胞に伝え、mGluR1-Gαq-PLCβ4-PKCγのカスケードを駆動することにより、弱いプルキンエ細胞のシナプス除去を促進すると考えられている[45] [46]。
その他
その他、インシュリン様成長因子1(IGF1)[47]、脳由来神経栄養因子受容体(TrkB)[48] [49]、細胞内の輸送タンパクのミオシンVa[50]、アストロサイト特異的なグルタミン酸トランスポーターのGLAST22)、脳で特異的に発現する受容体様膜蛋自質BSRP(Sez6)[51]の関与が報告されているが、機能する場所やそのシグナリングの実体はよく分かっていない。
神経筋接合部のシナプス
ペプチド結合加水分解酵素プロテアーゼ[52]、グリア由来神経栄養因子GDNF[53]、細胞外シグナル分子のリーリン[54]の関与が報告されている。プロテアーゼやGDNFは、シナプス後部細胞である筋細胞からシナプス前部細胞である運動ニューロンの神経線維シナプスに働きかける逆行性シグナル分子として機能すると考えられている。
網膜—外側膝状体シナプス
補体のC1qと C3の関与が報告されている[55]。これらの分子は、おそらくミクログリアを介して機能し、弱いシナプスを除去すると考えられている。また、トランスフォーミング増殖因子βによるシグナルが、網膜神経節細胞やその軸索でのC1qの発現を増加させ、シナプス刈り込みを促進する可能性が示されている[56]。さらに、アストロサイトに存在し、食作用に関係した受容体分子MEGF10とMERTKが、シナプス刈り込みに必要であることが報告された[25]。 また、レット症候群の原因遺伝子であるMECP2のノックアウトマウスでは、視覚経験依存的なシナプス刈り込みが選択的に阻害されていることが報告されている[57]。
台形体内側核-外側上オリーブ核シナプス
グルタミン酸トランスポーターであるvGluT3が関与することが報告されている[58]。台形体内側核由来のシナプスであるGABA/glycinergicシナプスが特定の時期にグルタミン酸も放出することがこのシナプス刈り込みに重要であると考えられている。
大脳皮質内抑制性シナプス
大脳皮質の抑制性シナプスでは、抑制性伝達自体がシナプス刈り込みに重要であると報告されている[15]。
関連項目
参考文献
- ↑ Resource not found in PubMed.
- ↑ 2.0 2.1 Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ 4.0 4.1 Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ 7.0 7.1 Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ 15.0 15.1 Resource not found in PubMed.
- ↑ 16.0 16.1 Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ 25.0 25.1 Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ 31.0 31.1 Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ 38.0 38.1 Resource not found in PubMed.
- ↑ 39.0 39.1 Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ 41.0 41.1 Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.