「ニューロブラスト」の版間の差分
細編集の要約なし |
Yoichikosodo (トーク | 投稿記録) 細 Neurod1を修正しました。新しく追加した (Fitzgerald et al., 2006 Neuroscience 703-716) (Iulianella et al, 2008, Development 135, 729-741)文献について、refの入れ方が不明です。 |
||
| (2人の利用者による、間の2版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">[http://researchmap.jp/kosodo 小曽戸 陽一]</font><br> | <font size="+1">[http://researchmap.jp/kosodo 小曽戸 陽一]</font><br> | ||
''Korea Brain Research Institute(韓国)Mechanoneuroscience Lab''<br> | ''Korea Brain Research Institute(韓国)Mechanoneuroscience Lab''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2016年3月21日 原稿完成日:2016年月日<br> | ||
担当編集委員:[http://researchmap.jp/fujiomurakami 村上 富士夫](大阪大学 大学院生命機能研究科)<br> | 担当編集委員:[http://researchmap.jp/fujiomurakami 村上 富士夫](大阪大学 大学院生命機能研究科)<br> | ||
</div> | </div> | ||
| 26行目: | 26行目: | ||
===胎生期=== | ===胎生期=== | ||
上記で述べたとおり、ショウジョウバエの場合においてニューロブラストは自己複製的分裂能があり、非対称細胞分裂を起こすことで再びニューロブラストおよび分化した娘細胞を生み出すことができる。哺乳類の神経発生の研究が進むにつれ、自己複製能を持ち更に分化細胞を産生できる能力を持つ「ショウジョウバエにおけるニューロブラスト」にあたる細胞は脳室(アピカル)側に存在する[[神経上皮細胞]]もしくは[[放射状グリア細胞]]、および基底膜側に存在する[[OSVZ(Outer SubVentricularZone)前駆細胞]]といった「[[神経前駆細胞]](neural progenitor cells)」であることが明らかになってきている。近年の用例では、古くからの呼称であるニューロブラストは既に分裂能を喪失している(post-mitotic)細胞を指しており、これらはむしろnew-born | 上記で述べたとおり、ショウジョウバエの場合においてニューロブラストは自己複製的分裂能があり、非対称細胞分裂を起こすことで再びニューロブラストおよび分化した娘細胞を生み出すことができる。哺乳類の神経発生の研究が進むにつれ、自己複製能を持ち更に分化細胞を産生できる能力を持つ「ショウジョウバエにおけるニューロブラスト」にあたる細胞は脳室(アピカル)側に存在する[[神経上皮細胞]]もしくは[[放射状グリア細胞]]、および基底膜側に存在する[[OSVZ(Outer SubVentricularZone)前駆細胞]]といった「[[神経前駆細胞]](neural progenitor cells)」であることが明らかになってきている。近年の用例では、古くからの呼称であるニューロブラストは既に分裂能を喪失している(post-mitotic)細胞を指しており、これらはむしろnew-born neuronという呼称が適切と考えられる'''(日本語では「新生ニューロン」?)'''。例として、"asymmetric divisions generate one new RG (=Radial Glia) and either a postmitotic neuroblast, or a basal progenitor." 「非対称分裂により、一つのラジアルグリア細胞と、一つの増殖停止したニューロブラストもしくはbasal progenitor(=中間前駆細胞)が生み出される」(Fitzgerald et al., 2006 Neuroscience 703-716) 等が挙げられる。解釈の相違を避けるため、著者自身により論文中でその定義を記載している場合もある。例; "Here we define neuroblasts as migratory immature neuronal descendants of progenitor cells that express basic helix-loop-helix (bHLH) proteins such as Neurod1"「ここで我々(=著者)は、Neurod1などのbasic helix-loop-helixタンパク質を発現している未成熟な神経細胞(前駆細胞を由来とする)をニューロブラストと定義する」(Iulianella et al, 2008, Development 135, 729-741)。 | ||
発生期大脳皮質においては、new-born neuronは上記に挙げた自己複製能を持ち非対称細胞分裂を行う神経前駆細胞(代表的マーカー分子として[[Pax6]]を発現<ref name=ref8><pubmed>9856459</pubmed></ref> <ref name=ref22><pubmed>18467663</pubmed></ref>、また自己複製能は持たないが対称的分裂によりニューロンを産生する[[intermediate progenitor]](もしくは[[basal progenitor]])<ref name=ref9><pubmed>14963232</pubmed></ref> <ref name=ref20><pubmed>15175243</pubmed></ref> <ref name=ref21><pubmed>14703572</pubmed></ref>(代表的マーカー分子として[[Tbr2]]を発現<ref name=ref6><pubmed>15634788</pubmed></ref>)からの細胞分裂直後に生じた細胞のことを指すと言える。 | 発生期大脳皮質においては、new-born neuronは上記に挙げた自己複製能を持ち非対称細胞分裂を行う神経前駆細胞(代表的マーカー分子として[[Pax6]]を発現<ref name=ref8><pubmed>9856459</pubmed></ref> <ref name=ref22><pubmed>18467663</pubmed></ref>、また自己複製能は持たないが対称的分裂によりニューロンを産生する[[intermediate progenitor]](もしくは[[basal progenitor]])<ref name=ref9><pubmed>14963232</pubmed></ref> <ref name=ref20><pubmed>15175243</pubmed></ref> <ref name=ref21><pubmed>14703572</pubmed></ref>(代表的マーカー分子として[[Tbr2]]を発現<ref name=ref6><pubmed>15634788</pubmed></ref>)からの細胞分裂直後に生じた細胞のことを指すと言える。 | ||
2016年6月10日 (金) 14:06時点における版
小曽戸 陽一
Korea Brain Research Institute(韓国)Mechanoneuroscience Lab
DOI:10.14931/bsd.3749 原稿受付日:2016年3月21日 原稿完成日:2016年月日
担当編集委員:村上 富士夫(大阪大学 大学院生命機能研究科)
英:neuroblast 独:Neuroblast 仏:neuroblaste
同義語:神経芽細胞
「ニューロブラスト」は直訳すると「神経芽細胞」であるが、その意味する細胞種は、生物種および対象組織の違いにより、分化状態や細胞分裂の有無などの主要な性質がそれぞれ全く異なるものである。現段階では、ニューロブラストを統一的に定義することは困難であるが、本稿では最初に教科書的な用例を示した上で、特に研究が進んでいる「ショウジョウバエ」、「哺乳類(胎生期および成体脳)」、更に近年研究が進みつつある「哺乳類以外の脊椎動物」に分類し、各生物種・組織における「ニューロブラスト」にあたる細胞種を概説する。
教科書的理解
ニューロブラストに関して、医学部学生が学ぶ標準的な発生学の教科書の一つには下記のような紹介がある。
「いったん神経管が閉じると、神経上皮細胞は他の型の細胞を生じはじめる。その細胞の特徴は、淡染する核形質と濃染する核小体をもった大きな丸い核である。これらの細胞は原始神経細胞、すなわち神経芽細胞(Neuroblast)である([1]より抜粋)」。この記述については間違いがあるものではないが、下記の項目(2〜4)で見ていくように、ニューロブラストの意味する細胞種は、幹細胞的性質といった分化状態や細胞分裂の有無など、生物種、また対象組織の違いにより大きく異なり、その用法については各分野の研究者間で誤解を生じる可能性があるものであることを留意すべきである。とくに、最近の原著論文・総説を読む限り、教科書的理解に挙げたような解釈で「ニューロブラスト」を使用している例は多くないと言える(胎生期を参照)。
ショウジョウバエ
ショウジョウバエの中枢神経系では、「ニューロブラスト」と呼ばれる神経幹細胞が、発生プログラムに従ってニューロンを産生していく。ショウジョウバエのニューロブラストは、幹細胞の特徴である「自己複製能」および「多分化能」をもち、その細胞分裂は一対の娘細胞同士が異なる細胞運命を持つ、いわゆる「非対称細胞分裂」を行うことが知られている。非対称細胞分裂が進行する際、細胞分裂軸は組織表面に対して平行となる方向に90度回転し、組織表層(アピカル)側の娘細胞がニューロブラストに、もう片側(基底膜側)の娘細胞がGanglion Mother Cell(GMC)となる。GMCはその後更にもう一度対称的な細胞分裂を行い、ニューロンを産生する。ニューロブラストの非対称細胞分裂の際には細胞分裂軸と平行したアピカル−基底膜極性(apicobasal polarity)に沿って様々なタンパク質およびmRNAが配置し、非対称に分配される[2]。
ショウジョウバエのニューロブラストの非対称細胞分裂に関しては多くの優れた報告がなされ、非常に研究が進んできた。しかしながら、当初は哺乳類の神経発生との高い共通性が想定されたものの[3] 、哺乳類の神経前駆細胞では細胞分裂軸の回転が見られない非対称細胞分裂が見出されたこと[4]をはじめ、多くの点でショウジョウバエと哺乳類の神経新生メカニズムが異なることが明らかになってきている[5] 。
哺乳類脳
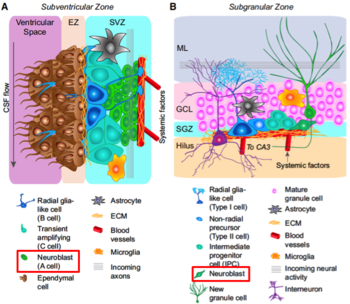
成体脳のうち、(A)側脳室の脳室下帯および(B)海馬歯状回の顆粒細胞下帯における神経新生を示す模式図。赤四角の細胞種が、それぞれの領域におけるニューロブラスト。
胎生期
上記で述べたとおり、ショウジョウバエの場合においてニューロブラストは自己複製的分裂能があり、非対称細胞分裂を起こすことで再びニューロブラストおよび分化した娘細胞を生み出すことができる。哺乳類の神経発生の研究が進むにつれ、自己複製能を持ち更に分化細胞を産生できる能力を持つ「ショウジョウバエにおけるニューロブラスト」にあたる細胞は脳室(アピカル)側に存在する神経上皮細胞もしくは放射状グリア細胞、および基底膜側に存在するOSVZ(Outer SubVentricularZone)前駆細胞といった「神経前駆細胞(neural progenitor cells)」であることが明らかになってきている。近年の用例では、古くからの呼称であるニューロブラストは既に分裂能を喪失している(post-mitotic)細胞を指しており、これらはむしろnew-born neuronという呼称が適切と考えられる(日本語では「新生ニューロン」?)。例として、"asymmetric divisions generate one new RG (=Radial Glia) and either a postmitotic neuroblast, or a basal progenitor." 「非対称分裂により、一つのラジアルグリア細胞と、一つの増殖停止したニューロブラストもしくはbasal progenitor(=中間前駆細胞)が生み出される」(Fitzgerald et al., 2006 Neuroscience 703-716) 等が挙げられる。解釈の相違を避けるため、著者自身により論文中でその定義を記載している場合もある。例; "Here we define neuroblasts as migratory immature neuronal descendants of progenitor cells that express basic helix-loop-helix (bHLH) proteins such as Neurod1"「ここで我々(=著者)は、Neurod1などのbasic helix-loop-helixタンパク質を発現している未成熟な神経細胞(前駆細胞を由来とする)をニューロブラストと定義する」(Iulianella et al, 2008, Development 135, 729-741)。
発生期大脳皮質においては、new-born neuronは上記に挙げた自己複製能を持ち非対称細胞分裂を行う神経前駆細胞(代表的マーカー分子としてPax6を発現[7] [8]、また自己複製能は持たないが対称的分裂によりニューロンを産生するintermediate progenitor(もしくはbasal progenitor)[9] [10] [11](代表的マーカー分子としてTbr2を発現[12])からの細胞分裂直後に生じた細胞のことを指すと言える。
ただし、神経前駆細胞およびintermediate progenitorについては、タイムラプス研究を通じた新規的分裂パターンの発見、また動物種による差違もあり、哺乳類大脳皮質の範疇内においても各細胞種の体系的な呼称については未だ確定していないといえる[13]。
成体脳
側脳室の脳室下帯
成体脳の側脳室脳室下帯では、神経新生が観察される(図1A)。この経路に関わる細胞種の同定が進んできている。自己複製能・多分化能を持つ神経幹細胞(Neural Stem Cell, NSC)であり放射状グリア細胞に類似した突起構造を持つB細胞[14]から、Transiently Amplifying Progenitor(TAP)と呼ばれるC細胞が生じ[15]、さらにC細胞から数度の分裂を経てA細胞が生じる。本領域において、ニューロブラストと呼ばれる細胞はA細胞である。
ニューロブラスト(A細胞)はchain migrationと呼ばれる細胞同士が互いに密接して移動する特殊な細胞移動様式をとり、吻側移動経路(radial migratory stream, RMS)と呼ばれる経路内を高速度で移動し嗅球へ達したのち、嗅覚に関与するニューロンとなる。発生期のニューロブラストとは異なり、A細胞は、分裂能を有する。RMSを移動中のA細胞の増殖能は嗅球に近づくに従い低下する[16]。
A細胞はRMSでの移動過程で分化が進行するため、同一名称の細胞でありながら遺伝子発現プロファイルが大きく異なることがわかっている。例として、doublecortin(DCX)もしくはBIIIチューブリンといった遺伝子は、A細胞新生の初期段階から成熟ニューロンに分化するまでの全期間において発現が維持されている[17]。マイクロダイセクションを用いてRMSを複数箇所に分断したのちトランスクリプトーム解析を行った結果、脳室下帯に近い初期のA細胞では細胞増殖に関連した細胞周期制御因子および分裂制御遺伝子が、RMS経路上においては細胞移動に関わる遺伝子群が、そして嗅球に近い領域ではニューロンの成熟・分化に関与する遺伝子群の発現が特に上昇していることが示されている[18]。
海馬歯状回の顆粒細胞下帯
subgranular zone (SGZ) of the dentate gyrus
成体脳の海馬歯状回の顆粒細胞下帯においても、神経新生が観察される(図1B)。
この領域に置いて自己複製能・多分化能を持つ神経幹細胞(NSC)はType 1細胞と呼ばれる。Type 1細胞は、やはり放射状グリア細胞に似た突起構造を持つ。Type 1細胞からTAPであるType 2細胞が生じ、Type 2細胞が数度の分裂を経てニューロブラストであるType 3細胞を生じる[19]。
ニューロブラストは顆粒細胞下帯に沿って接線方向に移動した後に未熟なニューロンとなり、その後顆粒細胞層を放線方向に移動、歯状回ニューロンへと分化するとされるが、他の神経細胞種に分化する能力を有する可能性も報告されている[20] [21]。
Type3細胞はマーカーとしてDCX、PSA-NCAM、NeuroD、Prox1を発現しており、Type2細胞で見られるネスチンの発現は押さえられている[19]。DCXの発現はPSA-NCAMとほぼ重なっている。通常条件下で、Type 3細胞の増殖は限られているが、カイニン酸により実験的に脳に障害を与えた場合、ネスチン陽性のType1およびType2細胞の増殖能は変わらないものの、Type3細胞の増殖が増加することが示されている[22]。
哺乳類以外の脊椎動物種のニューロブラスト
近年、哺乳類(特にマウス)以外の脊椎動物についても、成体脳での神経新生研究が盛んに進められてきている。興味深いことに、動物種の違いにより神経新生がおこる領域に大きな違いがあることがわかってきた。例えば、ゼブラフィッシュ脳においては、脳室全周に沿った領域で哺乳類のTAPあるいはニューロブラストに類する一過的に増殖する神経前駆細胞(Non-glial progenitor)が散在している[23]。上記のような恒常的な神経新生に加え、特に両生類および魚類では、旺盛な体組織の再生能力を反映して脳損傷に対応する形で生じる神経新生が多く報告されている[24]。これら生物種での神経新生において観察される神経前駆細胞と、哺乳類脳のニューロブラストとの相関性を明らかにすることは、将来的に脳組織再生への展開につながる可能性を開くものであり、今後のさらなる体系的研究の進展が期待される。
関連語
- 神経管
- 神経上皮細胞
- 神経幹細胞
- 自己複製能
- 多分化能
- 非対称細胞分裂
- Ganglion Mother Cell
- アピカル
- 基底膜
- 極性
- 脳室
- 放射状グリア細胞
- OSVZ前駆細胞
- 神経前駆細胞
- Pax6
- intermediate progenitor (もしくはbasal progenitor)
- Tbr2
- 脳室下帯
- Transiently Amplifying Progenitor
- chain migration
- Rostral Migratory Stream(RMS)
- 嗅球
- 顆粒細胞下帯
参考文献
- ↑ T.W.Sadler (著)、 安田峯生 (翻訳)
ラングマン人体発生学第10版 第17章中枢神経系
メディカルサイエンスインターナショナル - ↑
Matsuzaki, F. (2000).
Asymmetric division of Drosophila neural stem cells: a basis for neural diversity. Current opinion in neurobiology, 10(1), 38-44. [PubMed:10679433] [WorldCat] [DOI] - ↑
Chenn, A., & McConnell, S.K. (1995).
Cleavage orientation and the asymmetric inheritance of Notch1 immunoreactivity in mammalian neurogenesis. Cell, 82(4), 631-41. [PubMed:7664342] [WorldCat] [DOI] - ↑
Kosodo, Y., Röper, K., Haubensak, W., Marzesco, A.M., Corbeil, D., & Huttner, W.B. (2004).
Asymmetric distribution of the apical plasma membrane during neurogenic divisions of mammalian neuroepithelial cells. The EMBO journal, 23(11), 2314-24. [PubMed:15141162] [PMC] [WorldCat] [DOI] - ↑
Knoblich, J.A. (2008).
Mechanisms of asymmetric stem cell division. Cell, 132(4), 583-97. [PubMed:18295577] [WorldCat] [DOI] - ↑
Bond, A.M., Ming, G.L., & Song, H. (2015).
Adult Mammalian Neural Stem Cells and Neurogenesis: Five Decades Later. Cell stem cell, 17(4), 385-95. [PubMed:26431181] [PMC] [WorldCat] [DOI] - ↑
Götz, M., Stoykova, A., & Gruss, P. (1998).
Pax6 controls radial glia differentiation in the cerebral cortex. Neuron, 21(5), 1031-44. [PubMed:9856459] [WorldCat] [DOI] - ↑
Osumi, N., Shinohara, H., Numayama-Tsuruta, K., & Maekawa, M. (2008).
Concise review: Pax6 transcription factor contributes to both embryonic and adult neurogenesis as a multifunctional regulator. Stem cells (Dayton, Ohio), 26(7), 1663-72. [PubMed:18467663] [WorldCat] [DOI] - ↑
Haubensak, W., Attardo, A., Denk, W., & Huttner, W.B. (2004).
Neurons arise in the basal neuroepithelium of the early mammalian telencephalon: a major site of neurogenesis. Proceedings of the National Academy of Sciences of the United States of America, 101(9), 3196-201. [PubMed:14963232] [PMC] [WorldCat] [DOI] - ↑
Miyata, T., Kawaguchi, A., Saito, K., Kawano, M., Muto, T., & Ogawa, M. (2004).
Asymmetric production of surface-dividing and non-surface-dividing cortical progenitor cells. Development (Cambridge, England), 131(13), 3133-45. [PubMed:15175243] [WorldCat] [DOI] - ↑
Noctor, S.C., Martínez-Cerdeño, V., Ivic, L., & Kriegstein, A.R. (2004).
Cortical neurons arise in symmetric and asymmetric division zones and migrate through specific phases. Nature neuroscience, 7(2), 136-44. [PubMed:14703572] [WorldCat] [DOI] - ↑
Englund, C., Fink, A., Lau, C., Pham, D., Daza, R.A., Bulfone, A., ..., & Hevner, R.F. (2005).
Pax6, Tbr2, and Tbr1 are expressed sequentially by radial glia, intermediate progenitor cells, and postmitotic neurons in developing neocortex. The Journal of neuroscience : the official journal of the Society for Neuroscience, 25(1), 247-51. [PubMed:15634788] [PMC] [WorldCat] [DOI] - ↑
Florio, M., & Huttner, W.B. (2014).
Neural progenitors, neurogenesis and the evolution of the neocortex. Development (Cambridge, England), 141(11), 2182-94. [PubMed:24866113] [WorldCat] [DOI] - ↑
Mirzadeh, Z., Merkle, F.T., Soriano-Navarro, M., Garcia-Verdugo, J.M., & Alvarez-Buylla, A. (2008).
Neural stem cells confer unique pinwheel architecture to the ventricular surface in neurogenic regions of the adult brain. Cell stem cell, 3(3), 265-78. [PubMed:18786414] [PMC] [WorldCat] [DOI] - ↑
Doetsch, F., Caillé, I., Lim, D.A., García-Verdugo, J.M., & Alvarez-Buylla, A. (1999).
Subventricular zone astrocytes are neural stem cells in the adult mammalian brain. Cell, 97(6), 703-16. [PubMed:10380923] [WorldCat] [DOI] - ↑
Khodosevich, K., Alfonso, J., & Monyer, H. (2012).
Dynamic changes in the transcriptional profile of subventricular zone-derived postnatally born neuroblasts. Mechanisms of development, 130(6-8), 424-32. [PubMed:23220001] [WorldCat] [DOI] - ↑
Abrous, D.N., Koehl, M., & Le Moal, M. (2005).
Adult neurogenesis: from precursors to network and physiology. Physiological reviews, 85(2), 523-69. [PubMed:15788705] [WorldCat] [DOI] - ↑
Khodosevich, K., Seeburg, P.H., & Monyer, H. (2009).
Major signaling pathways in migrating neuroblasts. Frontiers in molecular neuroscience, 2, 7. [PubMed:19668709] [PMC] [WorldCat] [DOI] - ↑ 19.0 19.1 Resource not found in PubMed.
- ↑
Rietze, R., Poulin, P., & Weiss, S. (2000).
Mitotically active cells that generate neurons and astrocytes are present in multiple regions of the adult mouse hippocampus. The Journal of comparative neurology, 424(3), 397-408. [PubMed:10906710] [WorldCat] - ↑
Liu, S., Wang, J., Zhu, D., Fu, Y., Lukowiak, K., & Lu, Y.M. (2003).
Generation of functional inhibitory neurons in the adult rat hippocampus. The Journal of neuroscience : the official journal of the Society for Neuroscience, 23(3), 732-6. [PubMed:12574400] [PMC] [WorldCat] - ↑
Jessberger, S., Römer, B., Babu, H., & Kempermann, G. (2005).
Seizures induce proliferation and dispersion of doublecortin-positive hippocampal progenitor cells. Experimental neurology, 196(2), 342-51. [PubMed:16168988] [WorldCat] [DOI] - ↑
März, M., Chapouton, P., Diotel, N., Vaillant, C., Hesl, B., Takamiya, M., ..., & Strähle, U. (2010).
Heterogeneity in progenitor cell subtypes in the ventricular zone of the zebrafish adult telencephalon. Glia, 58(7), 870-88. [PubMed:20155821] [WorldCat] [DOI] - ↑
Alunni, A., & Bally-Cuif, L. (2016).
A comparative view of regenerative neurogenesis in vertebrates. Development (Cambridge, England), 143(5), 741-53. [PubMed:26932669] [PMC] [WorldCat] [DOI]