「記憶固定化」の版間の差分
細編集の要約なし |
|||
| (同じ利用者による、間の3版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">[http://researchmap.jp/ohkawa_noriaki 大川 宜昭]、[http://researchmap.jp/nomoto/ 野本 真順]、[http://researchmap.jp/kaoruinokuchi 井ノ口 馨]</font><br> | <font size="+1">[http://researchmap.jp/ohkawa_noriaki 大川 宜昭]、[http://researchmap.jp/nomoto/ 野本 真順]、[http://researchmap.jp/kaoruinokuchi 井ノ口 馨]</font><br> | ||
''富山大学大学院医学薬学研究部(医学)生化学講座''<br> | ''富山大学大学院医学薬学研究部(医学)生化学講座''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2017年4月13日 原稿完成日:2017年月日<br> | ||
担当編集委員:[http://researchmap.jp/read0048432 定藤 規弘](自然科学研究機構生理学研究所 [[大脳皮質]]機能研究系)<br> | 担当編集委員:[http://researchmap.jp/read0048432 定藤 規弘](自然科学研究機構生理学研究所 [[大脳皮質]]機能研究系)<br> | ||
</div> | </div> | ||
| 8行目: | 8行目: | ||
英語名:memory consolidation、独:Gedächtniskonsolidierung、仏:consolidation de la mémoire | 英語名:memory consolidation、独:Gedächtniskonsolidierung、仏:consolidation de la mémoire | ||
{{box|text= | {{box|text= 記憶の固定化は、学習後~数時間ほど維持される短期記憶から、数日以上の間維持される長期記憶へと変わる過程である。新規遺伝子発現とそれに引き続き誘導される新規タンパク質合成が必要であり、新たに合成された分子によって、記憶を獲得した細胞における情報伝達の効率が変化することで長期間維持される記憶回路が形成されると考えられる。固定化された長期記憶は、脳内で更なる貯蔵の処理過程を経ることで、数ヶ月から場合によっては一生続く遠隔記憶にその形体を変化させる。近年、記憶の固定化のメカニズムが、固定化の最中に起こった他の経験に関する記憶の獲得に影響を与えることで、多様な記憶獲得の形体が誘導されることが明らかになってきている。}} | ||
== 短期記憶から長期記憶へ == | == 短期記憶から長期記憶へ == | ||
[[記憶]]は、その保持される時間によって2つの形態に分けることができる。学習成立後から数時間ほど続く[[短期記憶]]と、1日から場合によっては生涯保持される[[長期記憶]]である。 | [[記憶]]は、その保持される時間によって2つの形態に分けることができる。学習成立後から数時間ほど続く[[短期記憶]]と、1日から場合によっては生涯保持される[[長期記憶]]である。 | ||
| 32行目: | 30行目: | ||
=== 長期増強(LTP)の誘導 === | === 長期増強(LTP)の誘導 === | ||
神経細胞間の伝達を行う[[シナプス]]の構造や機能が変化することで特定神経回路で長期増強が誘導され、長期記憶の回路ができると考えられる('''図3''')。 | 神経細胞間の伝達を行う[[シナプス]]の構造や機能が変化することで特定神経回路で長期増強が誘導され、長期記憶の回路ができると考えられる('''図3''')。 | ||
| 60行目: | 57行目: | ||
== 記憶の固定化・再固定化・強化 == | == 記憶の固定化・再固定化・強化 == | ||
[[ファイル:Ohkawa Fig1.png|サムネイル|'''図1:長期記憶の形成過程'''<br>記憶は、学習時に一部の細胞が活性化し、細胞内の分子機構のスイッチがオンになることで遺伝子発現やタンパク質合成を誘導することで短期記憶から長期記憶へと質を変える(固定化)。長期記憶は、想起にともない不安定化と再固定化を経ることで強化されると考えられている。また、長期間のCS暴露は、恐怖記憶の減弱化を誘導する(消去学習)。]] | |||
2000年にNaderらによって、固定化された記憶を想起した際に、脳にタンパク質合成阻害剤を注入すると記憶が壊れて消えることが報告され<ref name=ref25><pubmed>10963596</pubmed></ref> 、固定化された記憶は思い出すと(想起すると)、一旦不安定になり、その後再びタンパク質合成依存的な「[[再固定化]]」という過程を通して再度安定的に脳内に定着するという概念が提唱された('''図1''')。 | 2000年にNaderらによって、固定化された記憶を想起した際に、脳にタンパク質合成阻害剤を注入すると記憶が壊れて消えることが報告され<ref name=ref25><pubmed>10963596</pubmed></ref> 、固定化された記憶は思い出すと(想起すると)、一旦不安定になり、その後再びタンパク質合成依存的な「[[再固定化]]」という過程を通して再度安定的に脳内に定着するという概念が提唱された('''図1''')。 | ||
| 95行目: | 93行目: | ||
些細な出来事と鮮烈な出来事が短い間隔で生じた場合、本来忘却される些細な経験(短期記憶)が長期記憶へと固定化されることがある<ref name=ref36><pubmed>23840541</pubmed></ref><ref name=ref37><pubmed>9020352</pubmed></ref><ref name=ref38><pubmed>25607357</pubmed></ref> 。これは「[[行動タグ]]」と呼ばれ、動物に備わる記憶固定化の変法である。行動タグは「[[シナプスタグ]]」機構を行動レベルで模倣する現象として発見された。 | 些細な出来事と鮮烈な出来事が短い間隔で生じた場合、本来忘却される些細な経験(短期記憶)が長期記憶へと固定化されることがある<ref name=ref36><pubmed>23840541</pubmed></ref><ref name=ref37><pubmed>9020352</pubmed></ref><ref name=ref38><pubmed>25607357</pubmed></ref> 。これは「[[行動タグ]]」と呼ばれ、動物に備わる記憶固定化の変法である。行動タグは「[[シナプスタグ]]」機構を行動レベルで模倣する現象として発見された。 | ||
=== シナプスタグ === | === シナプスタグ === | ||
[[ファイル:Ohkawa Fig3.png|サムネイル|'''図3: シナプスタグ現象の説明'''<br>急性海馬スライスを用いた2経路実験の概要とシナプスタグの説明。CA1の独立した2つのシェーファー側枝(経路1および経路2)を刺激した場合、両者の入力は「異なる神経細胞の異なるシナプス」を刺激する場合もあれば、「同一の神経細胞の異なるシナプス」を刺激する場合もある。同一神経細胞の異なるシナプスに短い時間間隔でE-LTPとL-LTPがそれぞれ誘導された場合、E-LTPがL-LTPへと変換(固定化)される。]] | |||
1997年、Freyと[[w:Richard G. Morris|Morris]]は[[急性海馬スライス]]を用いて、[[CA1]]の独立した2つの[[Schaffer側枝]]を刺激する[[2経路実験]](two-pathway protocol)によって、独立した2つの入力が同じ神経細胞の異なるシナプスに収束した場合の各経路に誘導されたLTPに対する効果を検討した <ref name=ref37 /><ref name=ref39><pubmed> 9020359 </pubmed></ref> 。 | 1997年、Freyと[[w:Richard G. Morris|Morris]]は[[急性海馬スライス]]を用いて、[[CA1]]の独立した2つの[[Schaffer側枝]]を刺激する[[2経路実験]](two-pathway protocol)によって、独立した2つの入力が同じ神経細胞の異なるシナプスに収束した場合の各経路に誘導されたLTPに対する効果を検討した <ref name=ref37 /><ref name=ref39><pubmed> 9020359 </pubmed></ref> 。 | ||
彼らは、弱いテタヌス刺激によって誘導され数時間で減退する[[early-phase LTP]] ([[E-LTP]])は、異なる経路から同じ神経細胞集団に短い時間間隔(1時間以内)で[[late-phase LTP]] ([[L-LTP]])を誘導する強い入力が入ることで、新規タンパク質合成依存的に数時間から一日以上持続するL-LTPに固定化されることを示した。この結果から、弱いテタヌス刺激によって、タグがセッティングされたシナプスは、時間限定的かつ新規タンパク質合成依存的な神経可塑性関連遺伝子群(plasticity-related proteins; PRPs)のリクルート(ハイジャック)を経て安定化するという「シナプスタグ仮説」が提唱された('''図3''')。シナプスタグ機構は、L-LTPの入力特異性を保証すると共に、記憶を正確に脳内に保存する仕組みであると考えられる<ref name=ref40><pubmed>19443779</pubmed></ref> <ref name=ref41>'''Okada D, Inokuchi K'''<br>Activity-Dependent Protein Transport as a Synaptic Tag.<br>In ''Synaptic Tagging and Capture From Synapses to Behavior'' | 彼らは、弱いテタヌス刺激によって誘導され数時間で減退する[[early-phase LTP]] ([[E-LTP]])は、異なる経路から同じ神経細胞集団に短い時間間隔(1時間以内)で[[late-phase LTP]] ([[L-LTP]])を誘導する強い入力が入ることで、新規タンパク質合成依存的に数時間から一日以上持続するL-LTPに固定化されることを示した。この結果から、弱いテタヌス刺激によって、タグがセッティングされたシナプスは、時間限定的かつ新規タンパク質合成依存的な神経可塑性関連遺伝子群(plasticity-related proteins; PRPs)のリクルート(ハイジャック)を経て安定化するという「シナプスタグ仮説」が提唱された('''図3''')。シナプスタグ機構は、L-LTPの入力特異性を保証すると共に、記憶を正確に脳内に保存する仕組みであると考えられる<ref name=ref40><pubmed>19443779</pubmed></ref> <ref name=ref41><pubmed>'''Okada D, Inokuchi K'''<br>Activity-Dependent Protein Transport as a Synaptic Tag.<br>In ''Synaptic Tagging and Capture From Synapses to Behavior'' | ||
Edited by Sajikumar, Sreedharan: Springer; 2015:79-98.</ref>。 | Edited by Sajikumar, Sreedharan: Springer; 2015:79-98.</pubmed></ref>。 | ||
=== 行動タグ === | === 行動タグ === | ||
| 120行目: | 118行目: | ||
==参考文献== | ==参考文献== | ||
<references /> | <references /> | ||
[[ファイル:Ohkawa Fig2.png|サムネイル|'''図2:記憶の固定化'''<br>文脈性恐怖条件付けでは、電線グリッドのある箱に入れられた状況や箱という空間を含む情報(文脈)がCS、電気ショックがUSとして使用され、これらが連合し恐怖記憶を形成する[46]。条件付けされたマウスやラットは、条件付け後に再度CSに曝されると再度電気ショックが来ることを恐れ身動きしなくなる“フリージング反応(すくみ行動)”を示す。このフリージングの割合を定量化したものが記憶の評価の指標として使用されている。トレーニング時のタンパク質合成阻害剤の投与は、動物のトレーニング1時間後までの短期記憶には影響を与えないが、24時間後の長期記憶形成を阻害する。これは、記憶の固定化にタンパク質合成が必要であることを示している(Cell 88: 615-626, 1997より抜粋改変)[4]。]] | |||
2017年4月13日 (木) 23:17時点における版
大川 宜昭、野本 真順、井ノ口 馨
富山大学大学院医学薬学研究部(医学)生化学講座
DOI:10.14931/bsd.7435 原稿受付日:2017年4月13日 原稿完成日:2017年月日
担当編集委員:定藤 規弘(自然科学研究機構生理学研究所 大脳皮質機能研究系)
英語名:memory consolidation、独:Gedächtniskonsolidierung、仏:consolidation de la mémoire
記憶の固定化は、学習後~数時間ほど維持される短期記憶から、数日以上の間維持される長期記憶へと変わる過程である。新規遺伝子発現とそれに引き続き誘導される新規タンパク質合成が必要であり、新たに合成された分子によって、記憶を獲得した細胞における情報伝達の効率が変化することで長期間維持される記憶回路が形成されると考えられる。固定化された長期記憶は、脳内で更なる貯蔵の処理過程を経ることで、数ヶ月から場合によっては一生続く遠隔記憶にその形体を変化させる。近年、記憶の固定化のメカニズムが、固定化の最中に起こった他の経験に関する記憶の獲得に影響を与えることで、多様な記憶獲得の形体が誘導されることが明らかになってきている。
短期記憶から長期記憶へ
記憶は、その保持される時間によって2つの形態に分けることができる。学習成立後から数時間ほど続く短期記憶と、1日から場合によっては生涯保持される長期記憶である。
1900年、MüllerとPilzeckerは、安定した記憶の形成が最初の学習直後の新しい経験によって阻害されると報告した[1]。これは、短期記憶は他の情報入力によって維持が妨害されてしまう不安定な状態にあることを意味している。長期記憶は不安定な状態から移相した安定化したものであると考えられることから、短期記憶から長期記憶への位相過程を、“記憶の固定化”と呼ぶ(図1)。
短期記憶の形成には、脳の神経細胞内の既存のタンパク質、特に神経伝達に関与する神経伝達物質のイオンチャネル型受容体型や情報伝達に関わる酵素群の修飾とそれにともなう“一過的な”活性の変化が重要であることが示されている[2] 。一方、短期から長期記憶への固定化には、学習後に脳内で誘導される新規の遺伝子発現とそれに引き続き起こるタンパク質合成が必要となる[3] 。
恐怖条件付け学習において、学習時にタンパク質合成阻害剤を投与した動物では短期記憶は観察されるのに対し、長期記憶の形成が阻害された[4](図2)。これは、長期記憶形成では、タンパク質合成を介した短期記憶から長期記憶への位相過程、つまり恐怖記憶の固定化の過程が存在することを実際に示すものであった。
タンパク質合成阻害剤の投与は、記憶の固定化の機構を明らかにしたとともに、局所投与の実験により各種の記憶が脳内のどの部位に蓄えられるのかを調べるのにも有用である。文脈性恐怖条件付けの場合条件刺激(CS、文脈=ショックを与えられる空間情報や空間へ入れられた経験)情報の獲得には海馬、無条件刺激(US、ショック)情報(またはCSとUSの連合の情報)の獲得には扁桃体基底外側核(basolatetral amygdala, BLA)でのタンパク質合成が必要であることが阻害剤の1つであるアニソマイシン(anisomycin)の局所投与により示されている[5] 。
メカニズム
遺伝子の発現誘導
タンパク質合成阻害剤と同様に、学習時のcAMP依存性タンパク質キナーゼ (PKA)やCa2+/カルモジュリン依存性タンパク質キナーゼIV (CaMKIV)などのリン酸化酵素の阻害も長期記憶形成を阻害することが示されている[4][6] 。
PKAやCaMKIVは、神経細胞の活性に呼応して活性化し、転写因子CREBに対しリン酸化修飾を施し活性化させることで、長期記憶形成に必要な遺伝子群の発現を誘導する[7][8] 。このCREBの活性によって誘導されるのは、引き続き起こる次の転写や神経細胞の可塑的変化に関わるc-fosやarcといった遺伝子(最初期遺伝子と呼ばれる)[6][9] である。c-fos遺伝子は転写因子をコードしており、中枢神経系におけるc-fos遺伝子の欠損マウスでは、海馬依存的な長期記憶の形成に異常が見られている[10] 。
最近の知見から、学習時に活性化してc-fosやarc遺伝子を発現した細胞に記憶が蓄えられることが示されてきている[11][12] 。これらの記憶を蓄えた一群の細胞は、記憶痕跡細胞(engram cells)と呼ばれている。これらの知見から、遺伝子発現やタンパク質合成の開始は長期記憶誘導の閾値となっており、学習時にこの閾値を超える入力が一部の細胞に入ることで記憶痕跡が形成され長期記憶が獲得されると想定される。
長期増強(LTP)の誘導
神経細胞間の伝達を行うシナプスの構造や機能が変化することで特定神経回路で長期増強が誘導され、長期記憶の回路ができると考えられる(図3)。
長期増強(long-term potentiation, LTP)は、神経細胞間のシナプスにおいて伝達効率が長期的に上昇する現象である。記憶形成時に実際にLTPの誘導が観察された[13] ことから、LTPは記憶のシナプスレベルの素過程であり、学習時の入力により活性化した一群の神経細胞間のシナプスでLTPが誘導されることが示唆されている。LTPの誘導には、N-メチル-D-アスパラギン酸(NMDA)型グルタミン酸受容体の活性が必要であるが[14] 、同様に長期記憶の形成もNMDA型グルタミン酸受容体の活性に依存している[15]。
NMDA型グルタミン酸受容体の活性化が、LTPの長期維持(L-LTPの誘導)や記憶の固定化に必要とされるCREBの活性化とそれにより誘導される一連の遺伝子発現に続く反応の引き金となる[16] 。L-LTPの誘導には、シナプスで実際に情報伝達を担っているα-アミノ-3-ヒドロキシ-5-メチル-4-イソオキサゾールプロピオン酸 (AMPA)型グルタミン酸受容体(AMPA型グルタミン酸受容体)も、新規タンパク質合成依存的に発現誘導されることが必要である[17]。AMPA型受容体の発現とシナプスへの組み込みは、学習にともなって出現する記憶痕跡細胞中でも新規タンパク質合成依存的に起こることが明らかとなった[18] 。
このことから、「記憶の固定化機構としての遺伝子発現やタンパク質合成が、長期記憶回路を細胞選択的に形成する」というアイデアは、仮説の域を超えた現実的な機構として捉えられつつある。
長期記憶の維持
通常の長期記憶のテストは、学習後1日目で評価されてきた。しかし、実際は長期記憶は数週間以上維持されるものである。このような固定化された長期記憶の長期間の維持には、学習後の複数回の遺伝子発現の上昇が必要であることが報告されている。
学習後のタンパク質合成阻害剤の長期記憶形成阻害の実験から、記憶の固定化のタイムウインドウは、学習後3時間位までが想定されていた。しかし、学習12時間後のタンパク質合成阻害剤の処理が、2日目の記憶には影響を及ぼさないが、学習後7日目の記憶テストに阻害を与えることが明らかになった[19] 。例えば学習12時間後の脳由来神経栄養因子(brain-derived neurotrophic factor, BDNF)遺伝子の発現を抑制すると、上述のタンパク質合成阻害と同じ結果が得られる。最初期遺伝子の一つであるarc遺伝子でも同様の現象が報告されている[20] 。
このような後期固定化段階が、記憶の想起無しに自発的に起こることによって記憶の長期安定化に繋がっていると示唆される。
記憶の固定化と睡眠
近年、学習後の睡眠が記憶の固定化に重要な役割を担っていることが明らかになってきている。
直線走路を歩いている動物の海馬内では、複数の場所細胞がそれぞれ対応する場所で順番に活動する様子が観察される。この順序を持った場所細胞の活動パターンは、レム睡眠(Rapid eye movement sleep, REM sleep)中にもノンレム(Non-REM)睡眠中にも再現されている[21] 。この結果から、「覚醒時に経験した情報が睡眠中に再生されている」という休息時リプレイという概念が提唱されている。
レム睡眠時には覚醒時と同様に、脳波は 4-8 Hz のシータ波が優先的に振動をしており、リプレイは覚醒時とほぼ同じタイムスケールを持って観察される[22] 。また、睡眠中のシータ波の発生を抑えると、睡眠前の学習で獲得した記憶が減弱する[23] 。
一方、ノンレム睡眠時には0-4 Hzのデルタ波が振動をしており、海馬においては鋭波と呼ばれる-100ミリ秒続く特徴的な波形に乗って100-200Hz程度のリップル波と呼ばれる振動が観察される。ノンレム睡眠時のリプレイは、リップル波に乗る形で実際のタイムスケールを数10分の1に圧縮した形で再現される[21] 。日々のトレーニングの後、海馬で発生するリップル波のパターンを乱すことによっても記憶の獲得レベルが低下する[24] 。
このように、学習後の安定的な睡眠は、記憶の固定化に重要な過程であることから徹夜することはテスト勉強として効率が悪い可能性が示唆される。
記憶の固定化・再固定化・強化
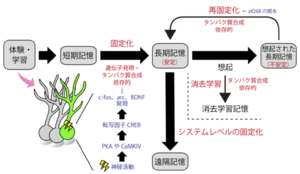
記憶は、学習時に一部の細胞が活性化し、細胞内の分子機構のスイッチがオンになることで遺伝子発現やタンパク質合成を誘導することで短期記憶から長期記憶へと質を変える(固定化)。長期記憶は、想起にともない不安定化と再固定化を経ることで強化されると考えられている。また、長期間のCS暴露は、恐怖記憶の減弱化を誘導する(消去学習)。
2000年にNaderらによって、固定化された記憶を想起した際に、脳にタンパク質合成阻害剤を注入すると記憶が壊れて消えることが報告され[25] 、固定化された記憶は思い出すと(想起すると)、一旦不安定になり、その後再びタンパク質合成依存的な「再固定化」という過程を通して再度安定的に脳内に定着するという概念が提唱された(図1)。
記憶が想起によって一旦不安定になる意義として2つの役割が挙げられている。
一つは、一旦不安定になることで、既存の記憶が新たに獲得した経験と相互作用できるようになり記憶が“修飾(アップデート)”される可能性である。
もう一つは、想起によって記憶が“強化”される可能性で、実際に、受動的回避学習の実験で、想起された記憶が強化されると報告されている[26] 。
記憶の固定化と再固定化は、ともにタンパク質の合成を必要とする点で共通の分子機構が想像される。しかし、恐怖条件付けの場合、BDNFは固定化に必要で再固定化に必要ではない。一方、転写因子zif268は、再固定化に必要で固定化に必要ではないというように、実際には同じ分子機構ではないことが示唆されている(図1)[27] 。
最近では、再固定化の前の記憶の不安定化は、神経細胞間のシナプス情報伝達を担うタンパク質の分解に起因することが報告されている[28] 。不安定化に引き続き新たなシナプスタンパク質が合成されることが再固定化に必要であり、この機構によって記憶回路の再編・更新が行われていると考えられる。
記憶の消去学習
固定化を経た恐怖条件付け長期記憶は、消去学習(extinction learning)により恐怖反応を抑制することができる。
消去学習では、CSの提示があってもUSが来ず、そのCSが安全であることを動物が新たに学習するまで繰り返し、あるいは長時間CSに曝すことで消去を誘導する[29] (図1)。この場合、記憶が消えるわけではなく、元の恐怖記憶そのものは残っているので、再び回復して恐怖反応を示すこともある。ヒトにおける心的外傷後ストレス障害(post-traumatic stress disorder, PTSD)の治療では、患者が安全だと認識する状況で繰り返し恐怖体験を想起することで、想起したトラウマ記憶の減弱化を導く持続エクスポージャー療法が用いられているが、これは消去学習を適用したものである。
長期記憶から遠隔記憶へ:システムレベルの固定化
てんかん治療のために海馬を含む両内側側頭葉の切除を受けた故Henry Gustav Molaison氏(手術当時は27歳、生前はH.M.氏と呼ばれた)の術後経過の観察から遠隔記憶の存在が示唆された[30] 。
彼は手術後、ある種の記憶で新しいことを覚えることのできない順行性健忘と、手術の数年前までの記憶の想起逆行性健忘の症状を示した。しかしながら、少年期の記憶は障害を受けなかった。このことから、海馬は記憶を一時的に保存する部位であり、時間経過とともに記憶の責任領域は海馬から他の脳領域に変遷することが明らかになった。
このような過程は“システムレベルの固定化”と呼ばれており、学習からの時間間隔が短い時点での記憶を“近時記憶”、システムレベルの固定化を経たような学習後長時間を経た記憶を“遠隔記憶(マウスでは数週間以上、ヒトでは数年から数十年以上を経たもの)”と呼ぶ[31] (図1)(注:遠隔記憶は長期記憶の一種である)。
実験動物においても、例えば恐怖条件付け文脈学習課題において、恐怖記憶自体は脳内に残っているにも関わらず、記憶の海馬依存性が時間とともに失われていく[32] 。すなわち、記憶が保存されている脳領域は海馬から大脳皮質に変遷する。
近年、成体の脳でも、特に海馬において、神経細胞の新生が起きていることが示されている。海馬の神経新生を促進したり抑制すると海馬からの記憶の移行がそれぞれ早くなったり遅くなったりすることが明らかとなった[33] 。海馬が常に新たな記憶獲得能を保持するために、古い記憶を他の脳領域に移行させるシステムレベルの固定化が必要なのではないかと考えられている。
海馬の神経新生は、加齢やストレスで減少する[34] とともに、その減少は物覚えを悪くする要因にもなりうる。一方で、ストレスフリーの環境やエクササイズ等は神経新生を促進する[35] 。これらの知見から、神経新生を促進することで海馬の記憶容量保持機構の効率を上昇させ記憶形成を良くすることができる可能性が考えられる。
鮮烈な体験による些細な出来事の記憶の固定化:シナプスタグ・行動タグ
記憶は、固定化の間に損なわれたり強化されたりする可能性があるが、この不安定な状態の存在は、記憶を新しい経験と統合する方法として進化させてきた可能性を示唆している[3] 。
些細な出来事と鮮烈な出来事が短い間隔で生じた場合、本来忘却される些細な経験(短期記憶)が長期記憶へと固定化されることがある[36][37][38] 。これは「行動タグ」と呼ばれ、動物に備わる記憶固定化の変法である。行動タグは「シナプスタグ」機構を行動レベルで模倣する現象として発見された。
シナプスタグ
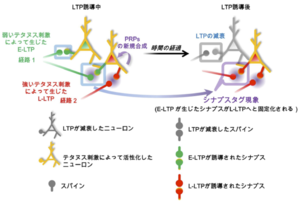
急性海馬スライスを用いた2経路実験の概要とシナプスタグの説明。CA1の独立した2つのシェーファー側枝(経路1および経路2)を刺激した場合、両者の入力は「異なる神経細胞の異なるシナプス」を刺激する場合もあれば、「同一の神経細胞の異なるシナプス」を刺激する場合もある。同一神経細胞の異なるシナプスに短い時間間隔でE-LTPとL-LTPがそれぞれ誘導された場合、E-LTPがL-LTPへと変換(固定化)される。
1997年、FreyとMorrisは急性海馬スライスを用いて、CA1の独立した2つのSchaffer側枝を刺激する2経路実験(two-pathway protocol)によって、独立した2つの入力が同じ神経細胞の異なるシナプスに収束した場合の各経路に誘導されたLTPに対する効果を検討した [37][39] 。
彼らは、弱いテタヌス刺激によって誘導され数時間で減退するearly-phase LTP (E-LTP)は、異なる経路から同じ神経細胞集団に短い時間間隔(1時間以内)でlate-phase LTP (L-LTP)を誘導する強い入力が入ることで、新規タンパク質合成依存的に数時間から一日以上持続するL-LTPに固定化されることを示した。この結果から、弱いテタヌス刺激によって、タグがセッティングされたシナプスは、時間限定的かつ新規タンパク質合成依存的な神経可塑性関連遺伝子群(plasticity-related proteins; PRPs)のリクルート(ハイジャック)を経て安定化するという「シナプスタグ仮説」が提唱された(図3)。シナプスタグ機構は、L-LTPの入力特異性を保証すると共に、記憶を正確に脳内に保存する仕組みであると考えられる[40] [41]。
行動タグ
2007年、Violaのグループは、ラットを用いてシナプスタグ機構を行動レベルで模倣する現象の存在を探索し、短期記憶のみが形成される学習と新規環境提示が短い時間間隔で生じた場合、短期記憶が長期記憶へと新規タンパク質合成依存的に固定化されることを示した[42]。
この結果は、行動レベルでシナプスタグ仮説を模倣する「行動タグ」の存在と新奇環境提示が記憶痕跡を安定化するための神経可塑性関連遺伝子群を提供すること示唆している。
さらに、行動タグは新規環境提示との組み合わせにより、抑制性回避学習課題の他にも海馬依存性課題である恐怖条件付け文脈記憶課題、新奇物体認知記憶課題、新奇物体位置課題においても観察されている[42][43][44][45] 。
また、行動タグはヒトにおいても観察されている[36][38]。
異なる脳領域に依存する学習課題同士の間では行動タグは成立しない[42] 。さらに、海馬依存的な二つの学習課題同士の間で行動タグが成立する場合、記憶痕跡細胞の重複が重要である[45]。すなわち、同一の神経細胞が些細な経験と新規環境の両方の記憶痕跡を担っている必要があり、このことは行動タグがシナプスタグ機構を用いていることを示唆している。
関連項目
参考文献
- ↑ Müller GE, Pilzecker A
Experimentelle Beiträge zur Lehre vom Gedächtnis [Experimental contributions to the science of memory]
Z. Psychol. Physiol. Sinnesorg. 1900, Ergänzungsband 1:1-300. - ↑
Johansen, J.P., Cain, C.K., Ostroff, L.E., & LeDoux, J.E. (2011).
Molecular mechanisms of fear learning and memory. Cell, 147(3), 509-24. [PubMed:22036561] [PMC] [WorldCat] [DOI] - ↑ 3.0 3.1
McGaugh, J.L. (2000).
Memory--a century of consolidation. Science (New York, N.Y.), 287(5451), 248-51. [PubMed:10634773] [WorldCat] [DOI] - ↑ 4.0 4.1
Abel, T., Nguyen, P.V., Barad, M., Deuel, T.A., Kandel, E.R., & Bourtchouladze, R. (1997).
Genetic demonstration of a role for PKA in the late phase of LTP and in hippocampus-based long-term memory. Cell, 88(5), 615-26. [PubMed:9054501] [WorldCat] [DOI] - ↑
Barrientos, R.M., O'Reilly, R.C., & Rudy, J.W. (2002).
Memory for context is impaired by injecting anisomycin into dorsal hippocampus following context exploration. Behavioural brain research, 134(1-2), 299-306. [PubMed:12191817] [WorldCat] [DOI] - ↑ 6.0 6.1
Kang, H., Sun, L.D., Atkins, C.M., Soderling, T.R., Wilson, M.A., & Tonegawa, S. (2001).
An important role of neural activity-dependent CaMKIV signaling in the consolidation of long-term memory. Cell, 106(6), 771-83. [PubMed:11572782] [WorldCat] [DOI] - ↑
Impey, S., Obrietan, K., Wong, S.T., Poser, S., Yano, S., Wayman, G., ..., & Storm, D.R. (1998).
Cross talk between ERK and PKA is required for Ca2+ stimulation of CREB-dependent transcription and ERK nuclear translocation. Neuron, 21(4), 869-83. [PubMed:9808472] [WorldCat] [DOI] - ↑
Bito, H., Deisseroth, K., & Tsien, R.W. (1996).
CREB phosphorylation and dephosphorylation: a Ca(2+)- and stimulus duration-dependent switch for hippocampal gene expression. Cell, 87(7), 1203-14. [PubMed:8980227] [WorldCat] [DOI] - ↑
Kawashima, T., Okuno, H., Nonaka, M., Adachi-Morishima, A., Kyo, N., Okamura, M., ..., & Bito, H. (2009).
Synaptic activity-responsive element in the Arc/Arg3.1 promoter essential for synapse-to-nucleus signaling in activated neurons. Proceedings of the National Academy of Sciences of the United States of America, 106(1), 316-21. [PubMed:19116276] [PMC] [WorldCat] [DOI] - ↑
Fleischmann, A., Hvalby, O., Jensen, V., Strekalova, T., Zacher, C., Layer, L.E., ..., & Gass, P. (2003).
Impaired long-term memory and NR2A-type NMDA receptor-dependent synaptic plasticity in mice lacking c-Fos in the CNS. The Journal of neuroscience : the official journal of the Society for Neuroscience, 23(27), 9116-22. [PubMed:14534245] [PMC] [WorldCat] - ↑
Liu, X., Ramirez, S., Pang, P.T., Puryear, C.B., Govindarajan, A., Deisseroth, K., & Tonegawa, S. (2012).
Optogenetic stimulation of a hippocampal engram activates fear memory recall. Nature, 484(7394), 381-5. [PubMed:22441246] [PMC] [WorldCat] [DOI] - ↑
Denny, C.A., Kheirbek, M.A., Alba, E.L., Tanaka, K.F., Brachman, R.A., Laughman, K.B., ..., & Hen, R. (2014).
Hippocampal memory traces are differentially modulated by experience, time, and adult neurogenesis. Neuron, 83(1), 189-201. [PubMed:24991962] [PMC] [WorldCat] [DOI] - ↑
Whitlock, J.R., Heynen, A.J., Shuler, M.G., & Bear, M.F. (2006).
Learning induces long-term potentiation in the hippocampus. Science (New York, N.Y.), 313(5790), 1093-7. [PubMed:16931756] [WorldCat] [DOI] - ↑
Collingridge, G.L., Kehl, S.J., & McLennan, H. (1983).
Excitatory amino acids in synaptic transmission in the Schaffer collateral-commissural pathway of the rat hippocampus. The Journal of physiology, 334, 33-46. [PubMed:6306230] [PMC] [WorldCat] [DOI] - ↑
Morris, R.G., Anderson, E., Lynch, G.S., & Baudry, M. (1986).
Selective impairment of learning and blockade of long-term potentiation by an N-methyl-D-aspartate receptor antagonist, AP5. Nature, 319(6056), 774-6. [PubMed:2869411] [WorldCat] [DOI] - ↑
Wang, H., Hu, Y., & Tsien, J.Z. (2006).
Molecular and systems mechanisms of memory consolidation and storage. Progress in neurobiology, 79(3), 123-35. [PubMed:16891050] [WorldCat] [DOI] - ↑
Nayak, A., Zastrow, D.J., Lickteig, R., Zahniser, N.R., & Browning, M.D. (1998).
Maintenance of late-phase LTP is accompanied by PKA-dependent increase in AMPA receptor synthesis. Nature, 394(6694), 680-3. [PubMed:9716131] [WorldCat] [DOI] - ↑
Ryan, T.J., Roy, D.S., Pignatelli, M., Arons, A., & Tonegawa, S. (2015).
Memory. Engram cells retain memory under retrograde amnesia. Science (New York, N.Y.), 348(6238), 1007-13. [PubMed:26023136] [PMC] [WorldCat] [DOI] - ↑
Bekinschtein, P., Cammarota, M., Igaz, L.M., Bevilaqua, L.R., Izquierdo, I., & Medina, J.H. (2007).
Persistence of long-term memory storage requires a late protein synthesis- and BDNF- dependent phase in the hippocampus. Neuron, 53(2), 261-77. [PubMed:17224407] [WorldCat] [DOI] - ↑
Nakayama, D., Iwata, H., Teshirogi, C., Ikegaya, Y., Matsuki, N., & Nomura, H. (2015).
Long-delayed expression of the immediate early gene Arc/Arg3.1 refines neuronal circuits to perpetuate fear memory. The Journal of neuroscience : the official journal of the Society for Neuroscience, 35(2), 819-30. [PubMed:25589774] [PMC] [WorldCat] [DOI] - ↑ 21.0 21.1
Lee, A.K., & Wilson, M.A. (2002).
Memory of sequential experience in the hippocampus during slow wave sleep. Neuron, 36(6), 1183-94. [PubMed:12495631] [WorldCat] [DOI] - ↑
Louie, K., & Wilson, M.A. (2001).
Temporally structured replay of awake hippocampal ensemble activity during rapid eye movement sleep. Neuron, 29(1), 145-56. [PubMed:11182087] [WorldCat] [DOI] - ↑
Boyce, R., Glasgow, S.D., Williams, S., & Adamantidis, A. (2016).
Causal evidence for the role of REM sleep theta rhythm in contextual memory consolidation. Science (New York, N.Y.), 352(6287), 812-6. [PubMed:27174984] [WorldCat] [DOI] - ↑
Girardeau, G., Benchenane, K., Wiener, S.I., Buzsáki, G., & Zugaro, M.B. (2009).
Selective suppression of hippocampal ripples impairs spatial memory. Nature neuroscience, 12(10), 1222-3. [PubMed:19749750] [WorldCat] [DOI] - ↑
Nader, K., Schafe, G.E., & Le Doux, J.E. (2000).
Fear memories require protein synthesis in the amygdala for reconsolidation after retrieval. Nature, 406(6797), 722-6. [PubMed:10963596] [WorldCat] [DOI] - ↑
Fukushima, H., Zhang, Y., Archbold, G., Ishikawa, R., Nader, K., & Kida, S. (2014).
Enhancement of fear memory by retrieval through reconsolidation. eLife, 3, e02736. [PubMed:24963141] [PMC] [WorldCat] [DOI] - ↑
Lee, J.L., & Hynds, R.E. (2013).
Divergent cellular pathways of hippocampal memory consolidation and reconsolidation. Hippocampus, 23(3), 233-44. [PubMed:23197404] [PMC] [WorldCat] [DOI] - ↑
Lee, S.H., Choi, J.H., Lee, N., Lee, H.R., Kim, J.I., Yu, N.K., ..., & Kaang, B.K. (2008).
Synaptic protein degradation underlies destabilization of retrieved fear memory. Science (New York, N.Y.), 319(5867), 1253-6. [PubMed:18258863] [WorldCat] [DOI] - ↑
Suzuki, A., Josselyn, S.A., Frankland, P.W., Masushige, S., Silva, A.J., & Kida, S. (2004).
Memory reconsolidation and extinction have distinct temporal and biochemical signatures. The Journal of neuroscience : the official journal of the Society for Neuroscience, 24(20), 4787-95. [PubMed:15152039] [PMC] [WorldCat] [DOI] - ↑
Schmolck, H., Kensinger, E.A., Corkin, S., & Squire, L.R. (2002).
Semantic knowledge in patient H.M. and other patients with bilateral medial and lateral temporal lobe lesions. Hippocampus, 12(4), 520-33. [PubMed:12201637] [WorldCat] [DOI] - ↑
Wiltgen, B.J., & Tanaka, K.Z. (2013).
Systems consolidation and the content of memory. Neurobiology of learning and memory, 106, 365-71. [PubMed:23770492] [WorldCat] [DOI] - ↑
Kim, J.J., & Fanselow, M.S. (1992).
Modality-specific retrograde amnesia of fear. Science (New York, N.Y.), 256(5057), 675-7. [PubMed:1585183] [WorldCat] [DOI] - ↑
Kitamura, T., Saitoh, Y., Takashima, N., Murayama, A., Niibori, Y., Ageta, H., ..., & Inokuchi, K. (2009).
Adult neurogenesis modulates the hippocampus-dependent period of associative fear memory. Cell, 139(4), 814-27. [PubMed:19914173] [WorldCat] [DOI] - ↑
Kitamura, T., & Inokuchi, K. (2014).
Role of adult neurogenesis in hippocampal-cortical memory consolidation. Molecular brain, 7, 13. [PubMed:24552281] [PMC] [WorldCat] [DOI] - ↑
Opendak, M., & Gould, E. (2015).
Adult neurogenesis: a substrate for experience-dependent change. Trends in cognitive sciences, 19(3), 151-61. [PubMed:25715908] [WorldCat] [DOI] - ↑ 36.0 36.1
Ballarini, F., Martínez, M.C., Díaz Perez, M., Moncada, D., & Viola, H. (2013).
Memory in Elementary School Children Is Improved by an Unrelated Novel Experience. PloS one, 8(6), e66875. [PubMed:23840541] [PMC] [WorldCat] [DOI] - ↑ 37.0 37.1
Bear, M.F. (1997).
How do memories leave their mark? Nature, 385(6616), 481-2. [PubMed:9020352] [WorldCat] [DOI] - ↑ 38.0 38.1
Dunsmoor, J.E., Murty, V.P., Davachi, L., & Phelps, E.A. (2015).
Emotional learning selectively and retroactively strengthens memories for related events. Nature, 520(7547), 345-8. [PubMed:25607357] [PMC] [WorldCat] [DOI] - ↑
Frey, U., & Morris, R.G. (1997).
Synaptic tagging and long-term potentiation. Nature, 385(6616), 533-6. [PubMed:9020359] [WorldCat] [DOI] - ↑
Okada, D., Ozawa, F., & Inokuchi, K. (2009).
Input-specific spine entry of soma-derived Vesl-1S protein conforms to synaptic tagging. Science (New York, N.Y.), 324(5929), 904-9. [PubMed:19443779] [WorldCat] [DOI] - ↑ Resource not found in PubMed.
- ↑ 42.0 42.1 42.2
Ballarini, F., Moncada, D., Martinez, M.C., Alen, N., & Viola, H. (2009).
Behavioral tagging is a general mechanism of long-term memory formation. Proceedings of the National Academy of Sciences of the United States of America, 106(34), 14599-604. [PubMed:19706547] [PMC] [WorldCat] [DOI] - ↑
Salvetti, B., Morris, R.G., & Wang, S.H. (2014).
The role of rewarding and novel events in facilitating memory persistence in a separate spatial memory task. Learning & memory (Cold Spring Harbor, N.Y.), 21(2), 61-72. [PubMed:24429424] [PMC] [WorldCat] [DOI] - ↑
Wang, S.H., Redondo, R.L., & Morris, R.G. (2010).
Relevance of synaptic tagging and capture to the persistence of long-term potentiation and everyday spatial memory. Proceedings of the National Academy of Sciences of the United States of America, 107(45), 19537-42. [PubMed:20962282] [PMC] [WorldCat] [DOI] - ↑ 45.0 45.1
Nomoto, M., Ohkawa, N., Nishizono, H., Yokose, J., Suzuki, A., Matsuo, M., ..., & Inokuchi, K. (2016).
Cellular tagging as a neural network mechanism for behavioural tagging. Nature communications, 7, 12319. [PubMed:27477539] [PMC] [WorldCat] [DOI]
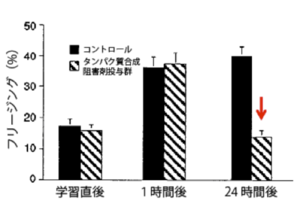
文脈性恐怖条件付けでは、電線グリッドのある箱に入れられた状況や箱という空間を含む情報(文脈)がCS、電気ショックがUSとして使用され、これらが連合し恐怖記憶を形成する[46]。条件付けされたマウスやラットは、条件付け後に再度CSに曝されると再度電気ショックが来ることを恐れ身動きしなくなる“フリージング反応(すくみ行動)”を示す。このフリージングの割合を定量化したものが記憶の評価の指標として使用されている。トレーニング時のタンパク質合成阻害剤の投与は、動物のトレーニング1時間後までの短期記憶には影響を与えないが、24時間後の長期記憶形成を阻害する。これは、記憶の固定化にタンパク質合成が必要であることを示している(Cell 88: 615-626, 1997より抜粋改変)[4]。