「視細胞」の版間の差分
細編集の要約なし |
|||
| (同じ利用者による、間の9版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">[http://researchmap.jp/read0054900 橘木修志]</font><br> | <font size="+1">[http://researchmap.jp/read0054900 橘木修志]</font><br> | ||
''大阪大学生命機能研究科''<br> | ''大阪大学生命機能研究科''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2018年5月25日 原稿完成日:201X年X月X日<br> | ||
担当編集委員:[https://researchmap.jp/masahikowatanabeo 渡辺 雅彦] (北海道大学大学院医学研究院 解剖学分野 解剖発生学教室)<br> | 担当編集委員:[https://researchmap.jp/masahikowatanabeo 渡辺 雅彦] (北海道大学大学院医学研究院 解剖学分野 解剖発生学教室)<br> | ||
</div> | </div> | ||
{{box|text= 光受容細胞の一種であり、動物が物を見るとき、光シグナルを神経情報へと変換する働きを担っている。脊椎動物の網膜には、桿体と錐体の二種類の視細胞が存在する。桿体は暗いところで物を見る際に働き、錐体は明るいところで物を見る際に働く。どちらの細胞も、光に対しては過分極性の応答をする。応答の際には活動電位を発生せず、刺激の強度に応じて連続的に膜電位が変化する。桿体、錐体の網膜内での量比は動物により異なる。夜行性の動物では桿体の比率が多い。また、網膜内での桿体、錐体の分布も動物により異なる。ヒトでは、網膜に中心窩と呼ばれる錐体だけが密集した部位があり、この部分での視覚が視野の中心部となる。一方、霊長類以外の哺乳類では中心窩がなく、桿体と錐体が比較的均一に分布した網膜である。}} | |||
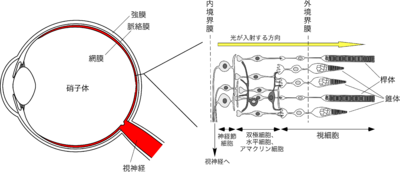
[[ファイル:Tachibanaki Fig1.png|400px|サムネイル|'''図1. 眼球(左)・網膜(右)の断面の模式図''']] | [[ファイル:Tachibanaki Fig1.png|400px|サムネイル|'''図1. 眼球(左)・網膜(右)の断面の模式図''']] | ||
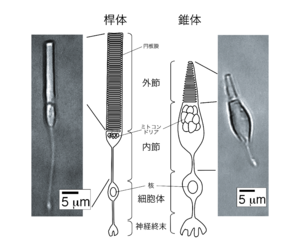
[[ファイル:Tachibanaki Fig2.png|サムネイル|'''図2. 桿体と錐体。魚類(コイ)の網膜から単離した桿体、錐体の写真と、それぞれの細胞の模式図'''<br>写真に示した単離細胞では、細胞体と神経終末が失われている。]] | [[ファイル:Tachibanaki Fig2.png|サムネイル|'''図2. 桿体と錐体。魚類(コイ)の網膜から単離した桿体、錐体の写真と、それぞれの細胞の模式図'''<br>写真に示した単離細胞では、細胞体と神経終末が失われている。]] | ||
==視細胞とは== | |||
[[脊椎動物]]の[[網膜]]には、5種類の[[神経細胞]](視細胞、[[双極細胞]]、[[水平細胞]]、[[アマクリン細胞]]、[[神経節細胞]])が3層の細胞層を形成している('''図1''')。瞳孔を通って眼球内に入射した光は、他の二つの細胞層を透過した後、もっとも外側の層にシート状に並んでいる視細胞層に到達する。視細胞は光受容細胞の一種であり、動物が物を見るとき、光シグナルを神経情報へと変換する働きを担っている。 | |||
脊椎動物の網膜には、[[桿体]]と[[錐体]]の二種類の視細胞が存在する('''図2''')<ref>'''Schultze M'''<br>Zur Anatomie und Physiologie der Retina.<br>''Archiv für mikroskopische anatomie'', 1866, Band 2, 175-286. [[ファイル:Schultze1866_Article_ZurAnatomieUndPhysiologieDerRe.pdf|PDF]]</ref><ref>''''''Stabell B, Stabell B''''''<br>Duplicity Theory of Vision: From Newton to the Present <br>''Cambridge University Press'', 2013, ISBN-13: 978-1107412842</ref><ref><pubmed> 18026166</pubmed></ref> | 脊椎動物の網膜には、[[桿体]]と[[錐体]]の二種類の視細胞が存在する('''図2''')<ref>'''Schultze M'''<br>Zur Anatomie und Physiologie der Retina.<br>''Archiv für mikroskopische anatomie'', 1866, Band 2, 175-286. [[ファイル:Schultze1866_Article_ZurAnatomieUndPhysiologieDerRe.pdf|PDF]]</ref><ref>''''''Stabell B, Stabell B''''''<br>Duplicity Theory of Vision: From Newton to the Present <br>''Cambridge University Press'', 2013, ISBN-13: 978-1107412842</ref><ref><pubmed> 18026166</pubmed></ref>[1][2][3]。 | ||
===桿体=== | ===桿体=== | ||
桿体は暗いところで物を見る際に働き、.... | |||
===錐体=== | ===錐体=== | ||
錐体は明るいところで物を見る際に働く。.... | |||
(編集部コメント:脳科学辞典には桿体と錐体に関する独立した記事はないので、このあたりでそれぞれに関して「桿体」「錐体」と小見出しを設けて、1段落程度で簡単にご解説いただけないでしょうか。錐体は色覚に関与することもここでご記述いただければと思います。下の「色覚と視細胞」の内容をこちらに持ってきてもよいのではないかと思います。) | |||
どちらの細胞も、光に対しては[[過分極]]性の応答をする。応答の際には[[活動電位]]を発生せず、刺激の強度に応じて連続的に[[膜電位]]が変化する(漸増的膜電位変化)。(この文章は、下の光応答形成の分子メカニズムにもって行ってもいいのではないかと思います)。 | |||
桿体、錐体の網膜内での量比は動物により異なる。夜行性の動物では桿体の比率が多い。また、網膜内での桿体、錐体の分布も動物により異なる。ヒトでは、網膜に[[中心窩]](fovea)と呼ばれる錐体だけが密集した部位があり、この部分での視覚が視野の中心部となる。一方、霊長類以外の哺乳類では中心窩がなく、桿体と錐体が比較的均一に分布した網膜である。 | |||
== 基本構造 == | == 基本構造 == | ||
| 30行目: | 35行目: | ||
外節は[[繊毛]]が発達した構造である。外節には視細胞が光を吸収すると膜電位の変化が生じる仕組みが存在している。桿体と錐体では外節の形状が異なる。桿体の外節は円筒形であり、錐体では円錐形である。それぞれの細胞の名称は、この外節部の形状に由来する。 | 外節は[[繊毛]]が発達した構造である。外節には視細胞が光を吸収すると膜電位の変化が生じる仕組みが存在している。桿体と錐体では外節の形状が異なる。桿体の外節は円筒形であり、錐体では円錐形である。それぞれの細胞の名称は、この外節部の形状に由来する。 | ||
光を効率的に吸収するために、外節内には大量の光受容タンパク質([[視物質]])が埋め込まれた膜がぎっしりと積み重なっている。桿体では、円筒状の外節の内部に円板膜と呼ばれる平たく潰れた袋状の構造が積み重なっている。錐体においては、繰り返し貫入した形質膜(細胞膜)がラメラ状に積み重なっている。この構造のため、外節内の視物質の濃度は非常に高い(約3mM)<ref><pubmed> 808586 </pubmed></ref>。光を吸収した視物質は、膜電位の変化(光応答)につながる連鎖的な酵素反応(細胞内情報伝達)を引き起こす。 | 光を効率的に吸収するために、外節内には大量の光受容タンパク質([[視物質]])が埋め込まれた膜がぎっしりと積み重なっている。桿体では、円筒状の外節の内部に円板膜と呼ばれる平たく潰れた袋状の構造が積み重なっている。錐体においては、繰り返し貫入した形質膜(細胞膜)がラメラ状に積み重なっている。この構造のため、外節内の視物質の濃度は非常に高い(約3mM)<ref><pubmed> 808586 </pubmed></ref>[4]。光を吸収した視物質は、膜電位の変化(光応答)につながる連鎖的な酵素反応(細胞内情報伝達)を引き起こす。 | ||
=== 内節 === | === 内節 === | ||
外節は、結合繊毛と呼ばれる部分を介して内節につながっている。内節には[[ミトコンドリア]]が高濃度で存在するほか、[[小胞体]]や[[ゴルジ体]]など、細胞の生存・機能維持に必須の[[ | 外節は、結合繊毛と呼ばれる部分を介して内節につながっている。内節には[[ミトコンドリア]]が高濃度で存在するほか、[[小胞体]]や[[ゴルジ体]]など、細胞の生存・機能維持に必須の[[細胞内小器官]]が存在する。 | ||
=== 細胞体、神経終末 === | === 細胞体、神経終末 === | ||
| 39行目: | 44行目: | ||
==光応答形成の分子メカニズム== | ==光応答形成の分子メカニズム== | ||
脊椎動物の視細胞が光に応答して膜電位が変わる仕組み(phototransduction mechanism) は、光情報伝達機構、あるいは光シグナル変換機構と呼ばれる('''図3''')<ref><pubmed> 8382952 </pubmed></ref><ref><pubmed> 17226052 </pubmed></ref><ref name=ref18514002 ><pubmed> 18514002 </pubmed></ref>。この機構は、複数の反応から成り立っている。 | 脊椎動物の視細胞が光に応答して膜電位が変わる仕組み(phototransduction mechanism) は、光情報伝達機構、あるいは光シグナル変換機構と呼ばれる('''図3''')<ref><pubmed> 8382952 </pubmed></ref><ref><pubmed> 17226052 </pubmed></ref><ref name=ref18514002 ><pubmed> 18514002 </pubmed></ref>[5][6][7]。この機構は、複数の反応から成り立っている。 | ||
応答形成に関わるこれら複数の反応は、光を受容した後に膜電位を過分極させ応答を引き起こす反応群と、過分極した膜電位をもとに戻して細胞の応答を停止させる反応群にわけられる。 | 応答形成に関わるこれら複数の反応は、光を受容した後に膜電位を過分極させ応答を引き起こす反応群と、過分極した膜電位をもとに戻して細胞の応答を停止させる反応群にわけられる。 | ||
| 54行目: | 59行目: | ||
外節の形質膜には、[[サイクリックヌクレオチド依存性カチオンチャネル]](CNGチャネル)の一種である[[cGMP依存性カチオンチャネル]]が存在する。光刺激による一連の反応で視細胞内のcGMP濃度が減少すると、cGMP依存性カチオンチャネルからcGMPが解離する反応が進む。このため閉鎖するチャネルの割合が増え、cGMP依存性カチオンチャネルを通って細胞に流入するNa<sup>+</sup>, Ca<sup>2+</sup>イオンの量が減少し、結果として細胞は光刺激を受ける前とくらべて過分極する。 | 外節の形質膜には、[[サイクリックヌクレオチド依存性カチオンチャネル]](CNGチャネル)の一種である[[cGMP依存性カチオンチャネル]]が存在する。光刺激による一連の反応で視細胞内のcGMP濃度が減少すると、cGMP依存性カチオンチャネルからcGMPが解離する反応が進む。このため閉鎖するチャネルの割合が増え、cGMP依存性カチオンチャネルを通って細胞に流入するNa<sup>+</sup>, Ca<sup>2+</sup>イオンの量が減少し、結果として細胞は光刺激を受ける前とくらべて過分極する。 | ||
cGMP依存性カチオンチャネルの50%が開くcGMPの濃度(k<sub>1/2</sub>)は10-30μMであり、光を受容する前の外節内のcGMP濃度はそれよりも大幅に低い(数μM)。このため、光を受容していないときにおいても開いているチャネルの割合はごくわずか(1%程度)であり、これが閉じることで光応答が生じる。このような仕組みにより、視細胞はcGMPの合成量を節約でき、また、cGMPの濃度変化に対する膜電位変化の割合一定に保てる、と考えられている<ref><pubmed> 2467600 </pubmed></ref>。 | cGMP依存性カチオンチャネルの50%が開くcGMPの濃度(k<sub>1/2</sub>)は10-30μMであり、光を受容する前の外節内のcGMP濃度はそれよりも大幅に低い(数μM)。このため、光を受容していないときにおいても開いているチャネルの割合はごくわずか(1%程度)であり、これが閉じることで光応答が生じる。このような仕組みにより、視細胞はcGMPの合成量を節約でき、また、cGMPの濃度変化に対する膜電位変化の割合一定に保てる、と考えられている<ref><pubmed> 2467600 </pubmed></ref>[8]。 | ||
===シグナルの増幅=== | ===シグナルの増幅=== | ||
| 73行目: | 78行目: | ||
視細胞などの刺激受容細胞には、刺激の強度に応じて感度を変える働きがある。これは、刺激の強度変化を的確に受容するための働きであり、順応機構と呼ばれる。視細胞では、明るいときには光に対する感度が低くなり、応答が簡単に飽和しないようになる([[明順応]])。暗いときには、感度が上昇し、弱い光に効率よく応答ができるようになる([[暗順応]])。 | 視細胞などの刺激受容細胞には、刺激の強度に応じて感度を変える働きがある。これは、刺激の強度変化を的確に受容するための働きであり、順応機構と呼ばれる。視細胞では、明るいときには光に対する感度が低くなり、応答が簡単に飽和しないようになる([[明順応]])。暗いときには、感度が上昇し、弱い光に効率よく応答ができるようになる([[暗順応]])。 | ||
視細胞の順応は、光を受容した際に外節で生じる細胞内Ca<sup>2+</sup> | 視細胞の順応は、光を受容した際に外節で生じる細胞内Ca<sup>2+</sup>濃度の変化によって主にもたらされていることが知られている<ref><pubmed> 11152756 </pubmed></ref>[9]。細胞内Ca<sup>2+</sup>濃度は、視細胞が光を受容していないとき(暗時)に最も高く、光を受容したとき(明時)に低くなる。 | ||
===視細胞外節におけるCa<sup>2+</sup>濃度の変化=== | ===視細胞外節におけるCa<sup>2+</sup>濃度の変化=== | ||
暗時には開いたcGMP依存性カチオンチャネルを通ってCa<sup>2+</sup>イオンが流入している。また、流入したCa<sup>2+</sup>イオンは外節形質膜に存在するNa<sup>+</sup>/K<sup>+</sup>-Ca<sup>2+</sup>交換ポンプにより細胞外へと汲み出される。このため、外節内のCa<sup>2+</sup>濃度は、流入と汲み出しの速度が釣り合う濃度になっている(約500 nM程度)。 | 暗時には開いたcGMP依存性カチオンチャネルを通ってCa<sup>2+</sup>イオンが流入している。また、流入したCa<sup>2+</sup>イオンは外節形質膜に存在するNa<sup>+</sup>/K<sup>+</sup>-Ca<sup>2+</sup>交換ポンプにより細胞外へと汲み出される。このため、外節内のCa<sup>2+</sup>濃度は、流入と汲み出しの速度が釣り合う濃度になっている(約500 nM程度)。 | ||
視細胞が光を受容すると、光情報伝達機構によりcGMP依存性カチオンチャネルが閉じるので、Ca<sup>2+</sup>イオンの流入量が減少する。その一方で、Na<sup>+</sup>/K<sup>+</sup>-Ca<sup>2+</sup>交換ポンプによる汲み出しは光に関係なく常に一定で働きつづける。したがって、光を受容する前と比べて外節内Ca<sup>2+</sup>濃度は低下する<ref><pubmed> 7524559 </pubmed></ref>。強い光を連続して受容した場合には数nMにまで低下する。 | 視細胞が光を受容すると、光情報伝達機構によりcGMP依存性カチオンチャネルが閉じるので、Ca<sup>2+</sup>イオンの流入量が減少する。その一方で、Na<sup>+</sup>/K<sup>+</sup>-Ca<sup>2+</sup>交換ポンプによる汲み出しは光に関係なく常に一定で働きつづける。したがって、光を受容する前と比べて外節内Ca<sup>2+</sup>濃度は低下する<ref><pubmed> 7524559 </pubmed></ref>[10]。強い光を連続して受容した場合には数nMにまで低下する。 | ||
===順応に関与するCa<sup>2+</sup>結合タンパク質=== | ===順応に関与するCa<sup>2+</sup>結合タンパク質=== | ||
外節内Ca<sup>2+</sup>濃度の変化を感度の変化に結びつける働きをするタンパク質として、3種類のCa<sup>2+</sup>タンパク質([[S-モジュリン]](リカバリン)、GCAP、[[カルモジュリン]])が同定されている。 | 外節内Ca<sup>2+</sup>濃度の変化を感度の変化に結びつける働きをするタンパク質として、3種類のCa<sup>2+</sup>タンパク質([[S-モジュリン]](リカバリン)、GCAP、[[カルモジュリン]])が同定されている。 | ||
=== | |||
=== S-モジュリン === | |||
S-モジュリン(リカバリン)は、Ca<sup>2+</sup>濃度が高い時(暗時)に受容体キナーゼの働きを阻害する。このため、活性型視物質をリン酸化により不活性化する反応が抑制される。その結果、暗時には光情報伝達過程の働きが長く続き、大量のcGMPが分解され、大きく長い細胞応答が生じる。一方、明時にはS-モジュリンはCa<sup>2+</sup>非結合型となり、受容体キナーゼから解離する。このため、受容体キナーゼは効率よく活性型視物質を不活性化することが出来、結果として応答は大きくならず速やかに終息する<ref><pubmed> 1846944 </pubmed></ref><ref><pubmed> 15882641 </pubmed></ref><ref><pubmed> 25673692 </pubmed></ref>[11][12][13]。 | |||
=== | === GCAP === | ||
Ca<sup>2+</sup> | Ca<sup>2+</sup>濃度が低いとき(明時)にグアニル酸シクラーゼを活性化する働きをする。この働きにより外節内のcGMPの濃度の回復が速やかに生じるので、暗時と比べて応答の持続時間は短く、応答も小さくなる<ref><pubmed> 7559656 </pubmed></ref><ref><pubmed> 11493703 </pubmed></ref>[14][15]。 | ||
=== | === カルモジュリン === | ||
Ca<sup>2+</sup>濃度が高い時(暗時)にcGMP依存性カチオンチャネルに結合し、cGMP依存性カチオンチャネルにcGMPが結合しにくくする働きがある<ref><pubmed> 7678445 </pubmed></ref>[16]。このため、暗時にはcGMP依存性カチオンチャネルからcGMPが外れてチャネルが閉じやすくなるので、明時より細胞の応答が生じやすくなる。 | |||
[[ファイル:Tachibanaki Fig4.png|サムネイル|'''図4. 桿体・錐体の光に対する応答の違い'''<br>'''上.''' | [[ファイル:Tachibanaki Fig4.png|サムネイル|'''図4. 桿体・錐体の光に対する応答の違い'''<br>'''上.''' 桿体と錐体(赤感受性錐体)の応答の記録。吸引電極法と呼ばれる方法により、外節の形質膜を横切って流入する電流を測定した。様々な強度の刺激光(フラッシュ光)に対する応答を重ね書きして示してある。刺激が強くなるにつれ、応答は大きくなる。錐体の応答は桿体より短い。応答が飽和すると、電流は0になる(Copyright (2008) Elsevier)<br>'''下.''' コイの桿体及び錐体に与えた光の強度と応答のピークの大きさの関係をプロットした(刺激応答曲線)。桿体の方が錐体よりも弱い光で応答できる(すなわち、感度が高い)。(Copyright (2001) National Academy of Sciences)]] | ||
==桿体と錐体の応答の違いと機能== | ==桿体と錐体の応答の違いと機能== | ||
桿体と錐体の光に対する応答の仕方は2つの点で異なる。一つは応答の感度、もう一つは応答の持続時間の違いである(図4)。 | |||
光に対する感度は桿体の方が数十倍から1000倍ほど高い。この違いのため、錐体は明るいところでものを見るとき(明所視)に働き、桿体は暗いところでものを見るときに働く(暗所視)。応答の持続時間は錐体の方が短い。このため、錐体が働く明るい光環境下では、高い時間分解能で光刺激の変化を検出できる。このように異なった応答特性の二種類の視細胞を使い分けることにより、動物は様々な光環境で物を見ることができる。 | 光に対する感度は桿体の方が数十倍から1000倍ほど高い。この違いのため、錐体は明るいところでものを見るとき(明所視)に働き、桿体は暗いところでものを見るときに働く(暗所視)。応答の持続時間は錐体の方が短い。このため、錐体が働く明るい光環境下では、高い時間分解能で光刺激の変化を検出できる。このように異なった応答特性の二種類の視細胞を使い分けることにより、動物は様々な光環境で物を見ることができる。 | ||
桿体と錐体の応答形成メカニズムは相同であるが、応答形成メカニズムに関わる酵素の多くについて、桿体では桿体型、錐体では錐体型の酵素が発現している。このため、錐体と桿体では応答形成に関わる酵素反応の速度・効率が異なる<ref name=ref18514002 ></ref>。たとえば、桿体では錐体よりも視物質によるトランスデューシンの活性化の効率が高い<ref><pubmed> 23045532 </pubmed></ref>。また、応答を停止させる反応の効率は、錐体の方が高い<ref>'''Kawamura S, Tachibanaki S.''' <br>Explaining the functional differences of rods versus cones <br>''WIREs Membr Transp Signal'' 2012, 1:675–683</ref>。このような違いにより、桿体と錐体の応答特性は異なってくると考えられる。 | 桿体と錐体の応答形成メカニズムは相同であるが、応答形成メカニズムに関わる酵素の多くについて、桿体では桿体型、錐体では錐体型の酵素が発現している。このため、錐体と桿体では応答形成に関わる酵素反応の速度・効率が異なる<ref name=ref18514002 ><pubmed> 18514002 </pubmed></ref>[7]。たとえば、桿体では錐体よりも視物質によるトランスデューシンの活性化の効率が高い<ref><pubmed> 23045532 </pubmed></ref>[17]。また、応答を停止させる反応の効率は、錐体の方が高い<ref>'''Kawamura S, Tachibanaki S.''' <br> | ||
Explaining the functional differences of rods versus cones <br> | |||
''WIREs Membr Transp Signal'' 2012, 1:675–683 | |||
</ref>[18]。このような違いにより、桿体と錐体の応答特性は異なってくると考えられる。 | |||
==色覚と視細胞== | |||
視細胞が吸収する光の波長は、その視細胞が持つ視物質の種類によって決まる。多くの生物では、桿体はすべて同一の視物質([[ロドプシン]]、500 nmの光を最もよく吸収する)しか発現していない。このため、暗いところで桿体を用いて物を見ているときには、光の波長を識別することはできず、色を感じることが出来ない。 | |||
これに対して、錐体には、異なる波長の光に選択的に応答する複数の種類が存在する。たとえば、ヒトでは、赤、緑、青の波長の光に対して選択的に応答する錐体が存在する。それぞれの錐体には、それぞれの色の波長の光をもっともよく吸収する視物質が発現している。明るい光環境下では、この3種類の錐体を使って光の波長を弁別することができる([[三色型色覚]])。 | |||
なお、哺乳類以外の脊椎動物では、4種類の錐体をもつ[[四色型色覚]]が一般的である。また、桿体にも波長感受性の異なる複数の種類が存在する場合があり、この場合は暗いところでも波長識別ができると考えられている。 | |||
==無脊椎動物の視細胞== | ==無脊椎動物の視細胞== | ||
2019年8月12日 (月) 17:56時点における版
橘木修志
大阪大学生命機能研究科
DOI:10.14931/bsd.7974 原稿受付日:2018年5月25日 原稿完成日:201X年X月X日
担当編集委員:渡辺 雅彦 (北海道大学大学院医学研究院 解剖学分野 解剖発生学教室)
光受容細胞の一種であり、動物が物を見るとき、光シグナルを神経情報へと変換する働きを担っている。脊椎動物の網膜には、桿体と錐体の二種類の視細胞が存在する。桿体は暗いところで物を見る際に働き、錐体は明るいところで物を見る際に働く。どちらの細胞も、光に対しては過分極性の応答をする。応答の際には活動電位を発生せず、刺激の強度に応じて連続的に膜電位が変化する。桿体、錐体の網膜内での量比は動物により異なる。夜行性の動物では桿体の比率が多い。また、網膜内での桿体、錐体の分布も動物により異なる。ヒトでは、網膜に中心窩と呼ばれる錐体だけが密集した部位があり、この部分での視覚が視野の中心部となる。一方、霊長類以外の哺乳類では中心窩がなく、桿体と錐体が比較的均一に分布した網膜である。
写真に示した単離細胞では、細胞体と神経終末が失われている。
視細胞とは
脊椎動物の網膜には、5種類の神経細胞(視細胞、双極細胞、水平細胞、アマクリン細胞、神経節細胞)が3層の細胞層を形成している(図1)。瞳孔を通って眼球内に入射した光は、他の二つの細胞層を透過した後、もっとも外側の層にシート状に並んでいる視細胞層に到達する。視細胞は光受容細胞の一種であり、動物が物を見るとき、光シグナルを神経情報へと変換する働きを担っている。
脊椎動物の網膜には、桿体と錐体の二種類の視細胞が存在する(図2)[1][2][3][1][2][3]。
桿体
桿体は暗いところで物を見る際に働き、....
錐体
錐体は明るいところで物を見る際に働く。....
(編集部コメント:脳科学辞典には桿体と錐体に関する独立した記事はないので、このあたりでそれぞれに関して「桿体」「錐体」と小見出しを設けて、1段落程度で簡単にご解説いただけないでしょうか。錐体は色覚に関与することもここでご記述いただければと思います。下の「色覚と視細胞」の内容をこちらに持ってきてもよいのではないかと思います。)
どちらの細胞も、光に対しては過分極性の応答をする。応答の際には活動電位を発生せず、刺激の強度に応じて連続的に膜電位が変化する(漸増的膜電位変化)。(この文章は、下の光応答形成の分子メカニズムにもって行ってもいいのではないかと思います)。
桿体、錐体の網膜内での量比は動物により異なる。夜行性の動物では桿体の比率が多い。また、網膜内での桿体、錐体の分布も動物により異なる。ヒトでは、網膜に中心窩(fovea)と呼ばれる錐体だけが密集した部位があり、この部分での視覚が視野の中心部となる。一方、霊長類以外の哺乳類では中心窩がなく、桿体と錐体が比較的均一に分布した網膜である。
基本構造
視細胞は、桿体・錐体いずれも、外節、内節、細胞体、神経終末の4つの部分から成り立っている(図2)。
外節
外節は繊毛が発達した構造である。外節には視細胞が光を吸収すると膜電位の変化が生じる仕組みが存在している。桿体と錐体では外節の形状が異なる。桿体の外節は円筒形であり、錐体では円錐形である。それぞれの細胞の名称は、この外節部の形状に由来する。
光を効率的に吸収するために、外節内には大量の光受容タンパク質(視物質)が埋め込まれた膜がぎっしりと積み重なっている。桿体では、円筒状の外節の内部に円板膜と呼ばれる平たく潰れた袋状の構造が積み重なっている。錐体においては、繰り返し貫入した形質膜(細胞膜)がラメラ状に積み重なっている。この構造のため、外節内の視物質の濃度は非常に高い(約3mM)[4][4]。光を吸収した視物質は、膜電位の変化(光応答)につながる連鎖的な酵素反応(細胞内情報伝達)を引き起こす。
内節
外節は、結合繊毛と呼ばれる部分を介して内節につながっている。内節にはミトコンドリアが高濃度で存在するほか、小胞体やゴルジ体など、細胞の生存・機能維持に必須の細胞内小器官が存在する。
細胞体、神経終末
細胞体には核が存在する。神経終末では二次ニューロン(水平細胞、双極細胞)とシナプスを形成する。視細胞は光を受容していない時(暗時)には軽く脱分極しているので神経伝達物質(グルタミン酸)をシナプスに放出し続けている。一方、光を受容した時(明時)には過分極し(光応答)、暗時よりグルタミン酸の放出速度が減少する。視細胞が受容した光の強度は、シナプスへのグルタミン酸の放出速度としてコード化されることになる。
光応答形成の分子メカニズム
脊椎動物の視細胞が光に応答して膜電位が変わる仕組み(phototransduction mechanism) は、光情報伝達機構、あるいは光シグナル変換機構と呼ばれる(図3)[5][6][7][5][6][7]。この機構は、複数の反応から成り立っている。
応答形成に関わるこれら複数の反応は、光を受容した後に膜電位を過分極させ応答を引き起こす反応群と、過分極した膜電位をもとに戻して細胞の応答を停止させる反応群にわけられる。
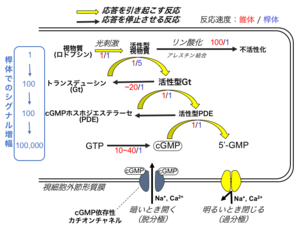
光を受容した後に膜電位を過分極させ応答を引き起こす反応群(黄矢印)と、過分極した膜電位をもとに戻して細胞の応答を停止させる反応群(黒矢印)にわけられる。この仕組みは、桿体・錐体で共通であるが、反応によっては反応速度・効率が異なる場合がある。
応答を引き起こす反応群
視細胞が光に応答する仕組みは、三量体GTP結合タンパク質介在性の細胞内情報伝達機構の一種である(図3)。
この仕組みでは、まず光によって視物質が活性化される。視物質は、三量体GTP結合タンパク質共役型受容体の一種であるので、活性型となると、視細胞に特異的に存在する三量体GTP結合タンパク質の一種であるトランスデューシン(Gt)を活性化する。Gtは、他の三量体GTP結合タンパク質と同様、不活性時には三量体(Gtαβγ)の構造を取っている。αサブユニットにはGDP/GTP結合部位が存在し、非活性型のときにはGDPが結合しているが、視物質により活性化される際には、GDPがGTPに置換される(GTP/GDP交換反応)。
活性化したGtはαサブユニット(Gtα)とβγサブユニット(Gtβγ)に解離する。このうち、Gtαが効果器タンパク質であるcGMPホスホジエステラーゼ(PDE)を活性化する。cGMPホスホジエステラーゼは、視細胞内のセカンドメッセンジャーであるcyclic GMP (cGMP)を5’-GMPに加水分解する酵素である。この酵素が活性化されることにより、細胞内のcGMP濃度が減少する。
cGMPホスホジエステラーゼは、cGMPをGMPに加水分解する触媒部位を持つ2分子の触媒サブユニット(cGMPホスホジエステラーゼαおよびβ)と、それぞれに結合して触媒活性を抑制する2分子の抑制サブユニット(cGMPホスホジエステラーゼγ)からなる4量体のタンパク質(αγβγ)である。GtαはcGMPホスホジエステラーゼγに結合することにより、cGMPホスホジエステラーゼの触媒サブユニットへの抑制効果を解除するので、結果としてcGMPの加水分解が生じる。
外節の形質膜には、サイクリックヌクレオチド依存性カチオンチャネル(CNGチャネル)の一種であるcGMP依存性カチオンチャネルが存在する。光刺激による一連の反応で視細胞内のcGMP濃度が減少すると、cGMP依存性カチオンチャネルからcGMPが解離する反応が進む。このため閉鎖するチャネルの割合が増え、cGMP依存性カチオンチャネルを通って細胞に流入するNa+, Ca2+イオンの量が減少し、結果として細胞は光刺激を受ける前とくらべて過分極する。
cGMP依存性カチオンチャネルの50%が開くcGMPの濃度(k1/2)は10-30μMであり、光を受容する前の外節内のcGMP濃度はそれよりも大幅に低い(数μM)。このため、光を受容していないときにおいても開いているチャネルの割合はごくわずか(1%程度)であり、これが閉じることで光応答が生じる。このような仕組みにより、視細胞はcGMPの合成量を節約でき、また、cGMPの濃度変化に対する膜電位変化の割合一定に保てる、と考えられている[8][8]。
シグナルの増幅
応答を引き起こす反応群のなかで、活性型視物質がGtを活性化する反応と、活性化されたcGMPホスホジエステラーゼがcGMPを5’-GMPに加水分解する反応では、反応を開始した段階での分子数よりも産物の分子数の方が多い。桿体視細胞では1個の活性型の視物質は一秒間に約100分子程度のGtを活性化する。また、活性化されたcGMPホスホジエステラーゼは、最大で一分子あたり毎秒1000分子のcGMPを加水分解できる。単純計算すると、一分子の視物質が活性化されることにより、桿体では毎秒十万個あまりのcGMPが加水分解されることになる。このような現象は、シグナルの増幅をもたらす。
実際の細胞内では、基質であるcGMPの濃度が視細胞内では低いことなどもあり、cGMPの分解量は毎秒1万分子程度に収まると推測されるが、1分子の視物質の活性化を引き起こす光シグナル(1光子)はいずれにせよ大幅なGMP分子の減少として増幅されることになる。この大きなシグナルの増幅効果により、桿体は一個の視物質が活性化されただけで光に対して応答ができる。
応答を停止させる反応群
視細胞が光に応答した後には、膜電位をもとに戻す必要がある。いつまでも細胞の応答が止まらないと、次の光刺激が来ても、それを前の刺激と区別して受容することが出来ない。視細胞がいかに短い時間間隔で2つの刺激を分けて受容できるか(応答の時間分解能)は、応答の終息の速さで決まる。
光によって生じた膜電位変化をもとに戻すためには、光刺激によって減少した細胞内cGMPの濃度を元のレベルに戻さなければならない。このためにまず、活性化された酵素(視物質、Gt、cGMPホスホジエステラーゼ)を不活性化することでcGMPの分解を止め、さらに、GTPから新たにcGMPを合成する必要がある。
活性化した視物質は、受容体キナーゼによるリン酸化やアレスチンの結合により不活性化される。活性型Gtは、他の三量体Gタンパク質と同様、活性化される際にαサブユニット(Gtα)に結合したGTPをGtα自身が加水分解し、ふたたびGtβγと三量体を形成して不活性型に戻る。なお、この反応は視細胞特異的GAP(GTPase activating protein)であるRGS9によって促進される。Gtが不活性化するのに伴い、Gtに活性化されていたcGMPホスホジエステラーゼは不活性化される。
cGMP濃度を元に戻す働きは、GTPからcGMPを合成するグアニル酸シクラーゼが担っている。この酵素の活性は、グアニル酸シクラーゼ活性化酵素(Guanylate cyclase activating protein, GCAP)によって制御されている。
視細胞の順応機構
視細胞などの刺激受容細胞には、刺激の強度に応じて感度を変える働きがある。これは、刺激の強度変化を的確に受容するための働きであり、順応機構と呼ばれる。視細胞では、明るいときには光に対する感度が低くなり、応答が簡単に飽和しないようになる(明順応)。暗いときには、感度が上昇し、弱い光に効率よく応答ができるようになる(暗順応)。
視細胞の順応は、光を受容した際に外節で生じる細胞内Ca2+濃度の変化によって主にもたらされていることが知られている[9][9]。細胞内Ca2+濃度は、視細胞が光を受容していないとき(暗時)に最も高く、光を受容したとき(明時)に低くなる。
視細胞外節におけるCa2+濃度の変化
暗時には開いたcGMP依存性カチオンチャネルを通ってCa2+イオンが流入している。また、流入したCa2+イオンは外節形質膜に存在するNa+/K+-Ca2+交換ポンプにより細胞外へと汲み出される。このため、外節内のCa2+濃度は、流入と汲み出しの速度が釣り合う濃度になっている(約500 nM程度)。
視細胞が光を受容すると、光情報伝達機構によりcGMP依存性カチオンチャネルが閉じるので、Ca2+イオンの流入量が減少する。その一方で、Na+/K+-Ca2+交換ポンプによる汲み出しは光に関係なく常に一定で働きつづける。したがって、光を受容する前と比べて外節内Ca2+濃度は低下する[10][10]。強い光を連続して受容した場合には数nMにまで低下する。
順応に関与するCa2+結合タンパク質
外節内Ca2+濃度の変化を感度の変化に結びつける働きをするタンパク質として、3種類のCa2+タンパク質(S-モジュリン(リカバリン)、GCAP、カルモジュリン)が同定されている。
S-モジュリン
S-モジュリン(リカバリン)は、Ca2+濃度が高い時(暗時)に受容体キナーゼの働きを阻害する。このため、活性型視物質をリン酸化により不活性化する反応が抑制される。その結果、暗時には光情報伝達過程の働きが長く続き、大量のcGMPが分解され、大きく長い細胞応答が生じる。一方、明時にはS-モジュリンはCa2+非結合型となり、受容体キナーゼから解離する。このため、受容体キナーゼは効率よく活性型視物質を不活性化することが出来、結果として応答は大きくならず速やかに終息する[11][12][13][11][12][13]。
GCAP
Ca2+濃度が低いとき(明時)にグアニル酸シクラーゼを活性化する働きをする。この働きにより外節内のcGMPの濃度の回復が速やかに生じるので、暗時と比べて応答の持続時間は短く、応答も小さくなる[14][15][14][15]。
カルモジュリン
Ca2+濃度が高い時(暗時)にcGMP依存性カチオンチャネルに結合し、cGMP依存性カチオンチャネルにcGMPが結合しにくくする働きがある[16][16]。このため、暗時にはcGMP依存性カチオンチャネルからcGMPが外れてチャネルが閉じやすくなるので、明時より細胞の応答が生じやすくなる。

上. 桿体と錐体(赤感受性錐体)の応答の記録。吸引電極法と呼ばれる方法により、外節の形質膜を横切って流入する電流を測定した。様々な強度の刺激光(フラッシュ光)に対する応答を重ね書きして示してある。刺激が強くなるにつれ、応答は大きくなる。錐体の応答は桿体より短い。応答が飽和すると、電流は0になる(Copyright (2008) Elsevier)
下. コイの桿体及び錐体に与えた光の強度と応答のピークの大きさの関係をプロットした(刺激応答曲線)。桿体の方が錐体よりも弱い光で応答できる(すなわち、感度が高い)。(Copyright (2001) National Academy of Sciences)
桿体と錐体の応答の違いと機能
桿体と錐体の光に対する応答の仕方は2つの点で異なる。一つは応答の感度、もう一つは応答の持続時間の違いである(図4)。
光に対する感度は桿体の方が数十倍から1000倍ほど高い。この違いのため、錐体は明るいところでものを見るとき(明所視)に働き、桿体は暗いところでものを見るときに働く(暗所視)。応答の持続時間は錐体の方が短い。このため、錐体が働く明るい光環境下では、高い時間分解能で光刺激の変化を検出できる。このように異なった応答特性の二種類の視細胞を使い分けることにより、動物は様々な光環境で物を見ることができる。
桿体と錐体の応答形成メカニズムは相同であるが、応答形成メカニズムに関わる酵素の多くについて、桿体では桿体型、錐体では錐体型の酵素が発現している。このため、錐体と桿体では応答形成に関わる酵素反応の速度・効率が異なる[7][7]。たとえば、桿体では錐体よりも視物質によるトランスデューシンの活性化の効率が高い[17][17]。また、応答を停止させる反応の効率は、錐体の方が高い[18][18]。このような違いにより、桿体と錐体の応答特性は異なってくると考えられる。
色覚と視細胞
視細胞が吸収する光の波長は、その視細胞が持つ視物質の種類によって決まる。多くの生物では、桿体はすべて同一の視物質(ロドプシン、500 nmの光を最もよく吸収する)しか発現していない。このため、暗いところで桿体を用いて物を見ているときには、光の波長を識別することはできず、色を感じることが出来ない。
これに対して、錐体には、異なる波長の光に選択的に応答する複数の種類が存在する。たとえば、ヒトでは、赤、緑、青の波長の光に対して選択的に応答する錐体が存在する。それぞれの錐体には、それぞれの色の波長の光をもっともよく吸収する視物質が発現している。明るい光環境下では、この3種類の錐体を使って光の波長を弁別することができる(三色型色覚)。
なお、哺乳類以外の脊椎動物では、4種類の錐体をもつ四色型色覚が一般的である。また、桿体にも波長感受性の異なる複数の種類が存在する場合があり、この場合は暗いところでも波長識別ができると考えられている。
無脊椎動物の視細胞
無脊椎動物は、脊椎動物がもつ視細胞とは異なったタイプの視細胞を持つ。節足動物などでは受光部(感桿)が微絨毛由来である感桿型視細胞が一般的である。感桿型視細胞は、脊椎動物の視細胞とは異なり、光に対して脱分極性の応答をする。この違いは、光刺激を膜電位変化に変換するメカニズム(細胞内情報伝達過程)の違いによる。
関連項目
参考文献
- ↑ Schultze M
Zur Anatomie und Physiologie der Retina.
Archiv für mikroskopische anatomie, 1866, Band 2, 175-286. ファイル:Schultze1866 Article ZurAnatomieUndPhysiologieDerRe.pdf - ↑ 'Stabell B, Stabell B'
Duplicity Theory of Vision: From Newton to the Present
Cambridge University Press, 2013, ISBN-13: 978-1107412842 - ↑
Lamb, T.D., Collin, S.P., & Pugh, E.N. (2007).
Evolution of the vertebrate eye: opsins, photoreceptors, retina and eye cup. Nature reviews. Neuroscience, 8(12), 960-76. [PubMed:18026166] [PMC] [WorldCat] [DOI] - ↑
Hárosi, F.I. (1975).
Absorption spectra and linear dichroism of some amphibian photoreceptors. The Journal of general physiology, 66(3), 357-82. [PubMed:808586] [PMC] [WorldCat] [DOI] - ↑
Pugh, E.N., & Lamb, T.D. (1993).
Amplification and kinetics of the activation steps in phototransduction. Biochimica et biophysica acta, 1141(2-3), 111-49. [PubMed:8382952] [WorldCat] [DOI] - ↑
Fu, Y., & Yau, K.W. (2007).
Phototransduction in mouse rods and cones. Pflugers Archiv : European journal of physiology, 454(5), 805-19. [PubMed:17226052] [PMC] [WorldCat] [DOI] - ↑ 7.0 7.1
Kawamura, S., & Tachibanaki, S. (2008).
Rod and cone photoreceptors: molecular basis of the difference in their physiology. Comparative biochemistry and physiology. Part A, Molecular & integrative physiology, 150(4), 369-77. [PubMed:18514002] [WorldCat] [DOI] - ↑
Yau, K.W., & Baylor, D.A. (1989).
Cyclic GMP-activated conductance of retinal photoreceptor cells. Annual review of neuroscience, 12, 289-327. [PubMed:2467600] [WorldCat] [DOI] - ↑
Fain, G.L., Matthews, H.R., Cornwall, M.C., & Koutalos, Y. (2001).
Adaptation in vertebrate photoreceptors. Physiological reviews, 81(1), 117-151. [PubMed:11152756] [WorldCat] [DOI] - ↑
Gray-Keller, M.P., & Detwiler, P.B. (1994).
The calcium feedback signal in the phototransduction cascade of vertebrate rods. Neuron, 13(4), 849-61. [PubMed:7524559] [WorldCat] [DOI] - ↑
Kawamura, S., & Murakami, M. (1991).
Calcium-dependent regulation of cyclic GMP phosphodiesterase by a protein from frog retinal rods. Nature, 349(6308), 420-3. [PubMed:1846944] [WorldCat] [DOI] - ↑
Sampath, A.P., Strissel, K.J., Elias, R., Arshavsky, V.Y., McGinnis, J.F., Chen, J., ..., & Hurley, J.B. (2005).
Recoverin improves rod-mediated vision by enhancing signal transmission in the mouse retina. Neuron, 46(3), 413-20. [PubMed:15882641] [WorldCat] [DOI] - ↑
Sakurai, K., Chen, J., Khani, S.C., & Kefalov, V.J. (2015).
Regulation of mammalian cone phototransduction by recoverin and rhodopsin kinase. The Journal of biological chemistry, 290(14), 9239-50. [PubMed:25673692] [PMC] [WorldCat] [DOI] - ↑
Dizhoor, A.M., Olshevskaya, E.V., Henzel, W.J., Wong, S.C., Stults, J.T., Ankoudinova, I., & Hurley, J.B. (1995).
Cloning, sequencing, and expression of a 24-kDa Ca(2+)-binding protein activating photoreceptor guanylyl cyclase. The Journal of biological chemistry, 270(42), 25200-6. [PubMed:7559656] [WorldCat] [DOI] - ↑
Mendez, A., Burns, M.E., Sokal, I., Dizhoor, A.M., Baehr, W., Palczewski, K., ..., & Chen, J. (2001).
Role of guanylate cyclase-activating proteins (GCAPs) in setting the flash sensitivity of rod photoreceptors. Proceedings of the National Academy of Sciences of the United States of America, 98(17), 9948-53. [PubMed:11493703] [PMC] [WorldCat] [DOI] - ↑
Hsu, Y.T., & Molday, R.S. (1993).
Modulation of the cGMP-gated channel of rod photoreceptor cells by calmodulin. Nature, 361(6407), 76-9. [PubMed:7678445] [WorldCat] [DOI] - ↑
Tachibanaki, S., Yonetsu, S., Fukaya, S., Koshitani, Y., & Kawamura, S. (2012).
Low activation and fast inactivation of transducin in carp cones. The Journal of biological chemistry, 287(49), 41186-94. [PubMed:23045532] [PMC] [WorldCat] [DOI] - ↑ Kawamura S, Tachibanaki S.
Explaining the functional differences of rods versus cones
WIREs Membr Transp Signal 2012, 1:675–683