「小脳」の版間の差分
細編集の要約なし |
細編集の要約なし |
(相違点なし)
| |
2021年9月10日 (金) 15:42時点における最新版
廣野 守俊
和歌山県立医科大学
永雄 総一
のぞみ病院
DOI:10.14931/bsd.5853 原稿受付日:2012年7月3日 原稿完成日:2015年4月15日 一部改訂:2021年9月10日
担当編集委員:一戸 紀孝(国立精神・神経医療研究センター 神経研究所)
英語名:cerebellum 独:Kleinhirn 仏:cervelet
小脳は小脳皮質とその深部にある小脳核からなる。発生学的に小脳は、原始小脳である片葉、垂と小節、古小脳である虫部、新小脳である半球に大別される。半球と虫部はさらに溝により複数の葉に分けられる。小脳の神経回路は学習機械と考えられる。小脳の唯の出力細胞であるプルキンエ細胞には、末梢感覚器や大脳皮質に起源をもつ情報が苔状線維―平行線維を介して入力する。それらが下オリーブ核に起源をもつ登上線維入力により修飾されることにより短期の学習が生じる。プルキンエ細胞は小脳核に出力し、そこでさらに長期の学習が生じる。小脳皮質にはプルキンエ細胞以外に4種類の主要な神経細胞が存在し、プルキンエ細胞の信号伝達の特性や可塑性を調節する。小脳の学習機構は、運動が正確かつ円滑に行われるようなフィードフォーワード制御に用いられる。小脳は運動だけでなく、情動や認知機能にも関与すると考えられている。
小脳とは
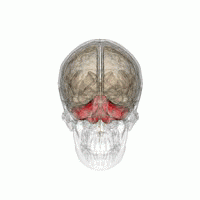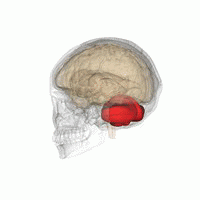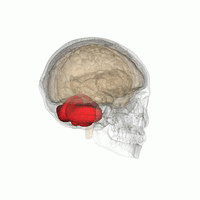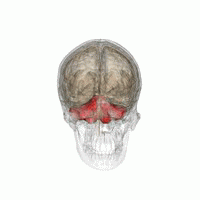
wより
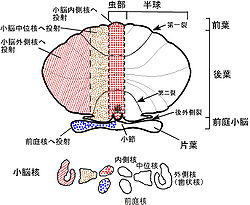
小脳を後方からみた模式
小脳は大脳の尾側、脳幹の背側にあり、ヒトでは脳全体の15%程度の容積しかないが、脳全体の神経細胞の約半分が存在する(図1)。小脳は小脳皮質と白質からなる。小脳皮質の深部には白質があり、白質の中に小脳核(内側(室頂)核、中位(球状と栓状)核と外側(歯状)核)がある。ヒトでは胎生2ヶ月位で後脳から発達した菱脳唇(rhombic lip)から小脳原基が生じ、その後方部からまず原始小脳である片葉(flocculus)、垂(uvula)と小節(nodulus)が、次に中央部から古小脳である虫部(vermis)、最後に外側から新小脳である半球(hemisphere)が発生する[1]。図2に小脳のマクロの構造を示す。小脳には9つの大きな内ー外側方向に走る溝があり、そのうちの第一裂(primary fissure)より前方を前葉、第一裂と後外側裂(posterolateral fissure)の間の部分を後葉、後外側裂より後部を片葉―小節葉と呼ぶ。虫部は小脳内側核に投射し、中間部と呼ばれる半球の内側部は中位核、半球の外側部は小脳外側核に投射する。一方、片葉―小節葉は前庭核の一部の神経細胞に投射する。このように系統発生的に一番古い片葉ー小節葉は前庭系と強い関係を持つことから、前庭小脳(vestibulo-cerebellum)と呼ばれ、身体の平衡調節に関係する。ついで古い虫部は脊髄と密接な関係を持ち、姿勢制御や血圧や循環調節など自律神経機能に関係し脊髄小脳(spino-cerebellum)と呼ばれる。半球の中間部や外側部は大脳皮質と密接な関係を持ち、随意運動制御や認知機能に関係し大脳小脳(cerebro-cerebellum)と呼ばれる。
小脳皮質ネットワーク
小脳皮質の神経回路の概要
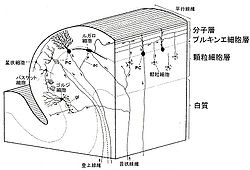
小脳皮質は、顆粒細胞、プルキンエ細胞(Purkinje cell)とその他の抑制性介在ニューロン、さらにはバーグマングリア細胞 (Bergmann glia)と呼ばれる神経膠細胞から構成される[2] [3] [4]。図3に小脳の顕微鏡構造を示す。小脳皮質は幾何学的に整然とした3つの層から成り立つ。顆粒細胞層には小さな細胞体と短い4本程度の樹状突起をもつ顆粒細胞が高密度に極めて多数存在する。顆粒細胞は小脳の主要な入力である苔状線維(mossy fiber)とシナプス結合するとともに、軸索を分子層向かって垂直に出す。この軸索は分子層の上部でT字型に分岐し平行線維(parallel fiber)となってプルキンエ細胞の樹状突起の棘突起と興奮性シナプス結合をする。
小脳の出力細胞であるプルキンエ細胞は、その大きな細胞体(直径 0.02-0.04 mm)をプルキンエ細胞層に持ち、良く発達した樹状突起を分子層に拡げ、前述のように平行線維とシナプス結合する。また下オリーブ核に起源をもつ登上線維は分子層に向かって上行し、プルキンエ細胞の近位樹状突起と通過型(en-passant)の興奮性シナプス結合をする。特徴的なのは、プルキンエ細胞は10~20万の平行線維とシナプスを作るのに対して、たった1~2本の登上線維が同じプルキンエ細胞の樹状突起で多数のシナプスを形成することである。一方、プルキンエ細胞はGABA作動性であり、長い軸索を小脳核や前庭核の神経細胞に投射し、そこで抑制性のシナプスを形成する。
分子層には前述の平行線維、登上線維やプルキンエ細胞の樹状突起の他に、星状細胞 (stellate cell)とバスケット細胞 (basket cell)と呼ばれる抑制性介在ニューロンがある。星状細胞は分子層の表層に細胞体を持ち、平行線維から興奮性入力を受け、軸索をプルキンエ細胞の遠位樹状突起に送り、そこで抑制性シナプス結合をする。一方、バスケット細胞は、細胞体をプルキンエ細胞層の近くに持ち、同じく平行線維から興奮性入力を受け、軸索をプルキンエ細胞近位樹状突起や細胞体に送り、そこで抑制性シナプス結合を形成する。
さらに分子層には、バーグマングリア細胞の細胞体が多数存在するが、その突起は分子層の上部まで達し、プルキンエ細胞の興奮性シナプスを覆うように分枝する。
顆粒細胞層にはゴルジ細胞 (Golgi cell)と呼ばれる大型の神経細胞が存在する。ゴルジ細胞は比較的良く発達した樹状突起を分子層に向かって出し、そこで平行線維と興奮性シナプスを形成する。ゴルジ細胞は基底部にも樹状突起を出し、そこで苔状線維と興奮性シナプスを形成する。一方、ゴルジ細胞は軸索を顆粒細胞の樹状突起に送りそこで抑制性のシナプス結合をする。いわゆる糸球体(glomerulus)とは、顆粒細胞の樹状突起の苔状突起との興奮性シナプスとゴルジ細胞との抑制性シナプスの複合体のことである。
ルガロ細胞(Lugaro cell)は、顆粒細胞層のプルキンエ細胞層寄りに細胞体を持ち、プルキンエ細胞の軸索側枝から抑制性入力、苔状線維からは興奮性入力を受け、軸索を平行線維と平行の方向に出し、他の抑制性ニューロンと抑制性のシナプス結合をする。
その他に小脳皮質には、縫線核からはセロトニンを伝達物質とする苔状線維、青斑核からはノルアドレナリンを含む苔状線維がそれぞれ投射する。表に小脳皮質の神経細胞の入出力の特徴と伝達物質をまとめる。
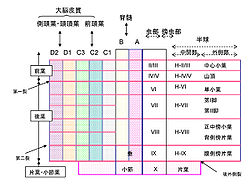
上に脊髄や大脳皮質との結合関係を示す
| 主な入力 | 主な出力先 | 神経伝達物質 | 密度(/mm2) | |
|---|---|---|---|---|
| 顆粒細胞 | 苔状線維 | プルキンエ細胞 | グルタミン酸 | 5×106 |
| プルキンエ細胞 | 平行線維 登上線維 バスケット細胞 星状細胞 |
小脳核 前庭核 ルガロ細胞 |
γ-アミノ酪酸 (GABA) |
500 |
| バスケット細胞 | 平行線維 (登上線維) |
プルキンエ細胞 | GABA | 600 |
| 星状細胞 | 平行線維 (登上線維) |
プルキンエ細胞 | GABA (タウリン) |
10,000 |
| ゴルジ細胞 | 平行線維 苔状線維 |
顆粒細胞 | GABA | 150 |
| ルガロ細胞 | 苔状線維 プルキンエ細胞 |
プルキンエ細胞 バスケット細胞 星状細胞 ゴルジ細胞 |
GABA グリシン |
30 |
下オリーブ核ー小脳皮質ー小脳核微小複合体
下オリーブ核は登上線維をプルキンエ細胞に投射するが、プルキンエ細胞が出力を送る小脳核の神経細胞にもその軸索側枝を投射する。さらに小脳核の神経細胞のうち抑制性細胞は下オリーブ核に直接投射し、興奮性の細胞の一部は赤核小細胞部を介して下オリーブ核に投射する。このように下オリーブからプルキンエ細胞と小脳核への登上線維投射とプルキンエ細胞から小脳核への投射には強い特異性が見られ、これを下オリーブ核ー小脳皮質―小脳核複合体と呼ぶ[3] [4]。図4にA, B (虫部と小節)、C1-3(半球中間部と片葉)、D1-2(半球外側部)の大まかな複合体を示す。1つの複合体はさらにいくつかの微小帯域(microzone)と呼ばれる機能の単位に分かれると考えられているが、その詳細は片葉以外の部位ではよく知られていない。片葉には少なくとも4~6個の微小帯域があると考えられており、それらは前庭3つの半規管系と6つの外眼筋からなる眼球反射の制御に対応する。
小脳皮質の神経回路のオペレーション
プルキンエ細胞のシナプス可塑性
小脳前核由来の苔状線維入力はすべてプルキンエ細胞に収束し、プルキンエ細胞から小脳核へ出力される。また苔状線維入力の反回側枝は小脳核へ投射する。従って、小脳皮質を通過する顆粒細胞―プルキンエ細胞―小脳核の経路は、小脳前核―小脳核の経路の側副路を構成する(図5)。小脳皮質の平行線維―プルキンエ細胞間のシナプス伝達効率は、同じプルキンエ細胞に入力する登上線維によって長期間にわたり調節を受けることがItoら [5]により実験的に示されている。平行線維―プルキンエ細胞間シナプスと、同時に登上線維入力が同期して活性化される状態が続くときには、平行線維―プルキンエ細胞間のシナプス伝達は減弱し(長期抑圧:long-term depression, LTD)、平行線維だけが持続的に活性化される状態が続くときには増強(長期増強: long-term potentiation, LTP)される[6]。Marr[7]とAlbus[8]の小脳学習仮説は、登上線維入力が教師信号となって、平行線維―プルキンエ細胞間シナプスの伝達効率に変化がおこり、それにより運動学習が生じることを示唆する。小脳片葉により前庭動眼反射のゲインの適応を用いた実験の結果は、プルキンエ細胞で運動学習と一致した活動が生じることと、登上線維入力が、学習に必要な誤差の信号を反映しており、Marr-Albusの仮説を支持する[4] [9]。このように、小脳皮質を経由する経路は、脳幹を経由する主経路に対して学習性の副側路を形成することになる。
抑制性介在ニューロンの役割
ゴルジ細胞
顆粒細胞と苔状線維から興奮性入力を受け、顆粒細胞を抑制する。即ち小脳皮質の入り口のところで、フィードバック機構を用いてプルキンエ細胞へ送る信号の時系列を調節していると考えられる(ゲートコントロール[10])。平行線維―プルキンエ細胞間のシナプス可塑性が小脳の学習の源と考えるならば、ゴルジ細胞を介したフイードバックループは、時系列の調節にメカニズムを通じて、プルキンエ細胞上での可塑性のおこるシナプスの空間的分布を調節する。いわば学習について、時間情報を空間情報に変換する役割を担うことになる[11]。
星状細胞とバスケット細胞
ともに平行線維から興奮性入力を受け、抑制性入力をプルキンエ細胞の樹状突起もしくは細胞体に送る。星状(バスケット)細胞とプルキンエ細胞間のシナプス伝達には可塑性[12] [13]があることが知られているが、その機能的な意味づけはよくされていない。両細胞とも、平行線維―プルキンエ細胞間のシナプス伝達の調節の役割を演じていると考えられる。
ルガロ細胞
苔状線維の興奮性入力とプルキンエ細胞の抑制性入力をともに受ける。いわば小脳皮質への入力信号と小脳皮質からの出力信号を直接比較することができるわけである。ルガロ細胞はセロトニンに高い感受性をもつのが特徴であり、その軸索は小脳内ー外側方向に長く伸び、出力を広範囲の抑制性介在ニューロンに送る。ルガロ細胞の役割として、微小帯域間の情報伝達に関与することが想定されるが、これからの研究課題である[14]。
小脳核ニューロンの役割
小脳皮質の平行線維―プルキンエ細胞間のシナプスに長期抑圧や増強で生じた運動学習の記憶痕跡(memory trace)は24時間程度で消去されるが、小脳皮質で生じる可塑性が繰り返されるような実験条件で作られる運動学習の記憶痕跡は、小脳核や前庭核に保持されていることを示唆する所見が提出されている。これは見かけ上は、小脳皮質のシナプスに作られた運動学習の記憶痕跡が、学習を繰り返すことにより、シナプスを超えて小脳核や前庭核に移動することになるので、記憶痕跡のシナプス間移動(trans-synaptic memory transfer)と呼ばれる[15] [16]。このためには小脳核や前庭核にシナプス可塑性があることが想定されるが、その具体的なメカニズムはよくわかっていない。苔状線維―小脳(前庭)核の神経細胞のシナプスには、苔状線維が持続的に活性化することにより生じる脱分極と、小脳皮質からの入力により生じる再分極の時間間隔により調節される可塑性[16]があり、記憶痕跡のシナプス間移動との関連が注目されている。
小脳核の神経細胞には興奮性と抑制性があり、抑制性の細胞は下オリーブ核に直接投射し、興奮性の細胞の一部は赤核小細胞部を介して同じく下オリーブ核に投射する(図4)。赤核小細胞部は、同時に大脳皮質の運動前野からの投射を受けるが、ここでどのような情報処理がなされているかは不明である。下オリーブ核の神経細胞は学習に必要な教師信号を、登上線維を介して送るが、小核核から下オリーブ核に伝えられる情報が学習にどのように関係しているかはよくわかっていない。小脳中位核と外側核の興奮性出力の多くは視床を介して大脳皮質に伝えられる。大脳皮質の出力は橋核を経て苔状線維により小脳皮質に伝えられ、いわゆる大脳―小脳ループを形成する。それらは随意運動の制御の役割を担っていることが示唆されているが、その詳細は今のところよくわかっていない[3] [4] [9]。
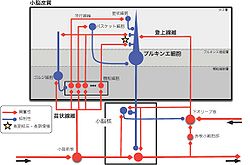
赤の経路は興奮性結合、青の経路は抑制性結合を示す。
小脳皮質の神経回路と小脳症状
小脳疾患の患者に様々な症状が出現することがより知られており小脳失調症状(ataxia)と呼ばれる。そのいくつかのものは小脳回路の異常に起因する。指―鼻試験で代表される推尺異常(dysmetria)は、運動学習によるフィードフォーワード制御の低下に起因する。日常生活の中では、指を身体にさわる動作が繰り返されているので、長期の記憶が既に小脳に形成されており、それにより、視覚によるフィードバックを用いずとも指を正確に素早く鼻の先に到達することができると考えられる。小脳の異常に伴い、運動の開始や運動そのものが遅くなることがしばしば観察される。これもフィードフォーワード制御で運動を行なうことが障害されたものと考えられる。協調運動の障害(incoordination)とは、反復拮抗運動不能(adiadochokinesis)のような多関節を含む速い運動の障害であるが、平行線維―プルキンエ細胞間シナプスによる多変数の学習制御の低下に起因する。皮質脊髄路(錐体路)の発達している霊長類では、小脳の障害に筋緊張の低下(hypotonia)がしばしば生じる。これは筋紡錘の感度を調節しているγ運動系の機能低下によるものと考えられる。γ運動ニューロンを制御する脳幹の部位が小脳の支配を受けていると考えられているが、その詳細なメカニズムは知られていない。企画振戦(intention tremor)とは、運動の終止に伴って生じる3〜5 Hzの振戦(手の震え)のことであり、正確な運動軌道の学習の障害を反映したものと考えられる。小脳外側核の冷却や破壊後に出現することから、小脳核から視床をへて大脳皮質に行く経路が遮断されたために生じると考えられているが、単なる脱落症状なのか、それとも脱落によって生じた神経回路の再編成によるものかは分かっていない。
本稿では小脳皮質の構造と神経回路の特徴、神経回路のもつ生理学的機能、神経回路の異常によって生じる臨床症状について論じた。小脳研究の詳細な文献についてはNIJC(Neuroinformatics Japan Center)の小脳プラットフォームを参照されたい。
関連項目
外部リンク
参考文献
- ↑ Larsell O, Janzen J
The comparative anatomy and histology of the cerebellum from monotremes through the apes.
Univ. of Minnesota Press, Minneapolis, 1972. - ↑ Eccles JC, Ito M, Szentàgothai J
The Cerebellum as a Neuronal Machine.
pp. 335. Springer, Berlin, 1967 - ↑ 3.0 3.1 3.2 Ito M
The Cerebellum and Neural Control.
pp. 589. Raven Press, New York, 1984. - ↑ 4.0 4.1 4.2 4.3 Ito M
The Cerebellum: Brain for an Implicit Self.
pp285, FT Press, 2011 - ↑
Ito, M., Sakurai, M., & Tongroach, P. (1982).
Climbing fibre induced depression of both mossy fibre responsiveness and glutamate sensitivity of cerebellar Purkinje cells. The Journal of physiology, 324, 113-34. [PubMed:7097592] [PMC] [WorldCat] [DOI] - ↑
Jörntell, H., & Hansel, C. (2006).
Synaptic memories upside down: bidirectional plasticity at cerebellar parallel fiber-Purkinje cell synapses. Neuron, 52(2), 227-38. [PubMed:17046686] [WorldCat] [DOI] - ↑
Marr, D. (1969).
A theory of cerebellar cortex. The Journal of physiology, 202(2), 437-70. [PubMed:5784296] [PMC] [WorldCat] [DOI] - ↑ Albus J
A theory of cerebellar function
Math Biosci 10: 25-61, 1971 - ↑ 9.0 9.1 永雄総一, 山崎匡
生体の科学 63: 3-10, 2012 - ↑
Watanabe, D., & Nakanishi, S. (2003).
mGluR2 postsynaptically senses granule cell inputs at Golgi cell synapses. Neuron, 39(5), 821-9. [PubMed:12948448] [WorldCat] [DOI] - ↑
Yamazaki, T., & Tanaka, S. (2005).
Neural modeling of an internal clock. Neural computation, 17(5), 1032-58. [PubMed:15829099] [WorldCat] [DOI] - ↑ 廣野守俊
生体の科学 62:292-297, 2011 - ↑
Kano, M., Rexhausen, U., Dreessen, J., & Konnerth, A. (1992).
Synaptic excitation produces a long-lasting rebound potentiation of inhibitory synaptic signals in cerebellar Purkinje cells. Nature, 356(6370), 601-4. [PubMed:1313949] [WorldCat] [DOI] - ↑ 永雄総一
生体の科学 63:34-41, 2012 - ↑
Kawaguchi, S.Y., & Hirano, T. (2002).
Signaling cascade regulating long-term potentiation of GABA(A) receptor responsiveness in cerebellar Purkinje neurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 22(10), 3969-76. [PubMed:12019316] [PMC] [WorldCat] [DOI] - ↑ 16.0 16.1
Shutoh, F., Ohki, M., Kitazawa, H., Itohara, S., & Nagao, S. (2006).
Memory trace of motor learning shifts transsynaptically from cerebellar cortex to nuclei for consolidation. Neuroscience, 139(2), 767-77. [PubMed:16458438] [WorldCat] [DOI]