「Mediator of cell motility 1」の版間の差分
細 →機能 |
細編集の要約なし |
||
| (同じ利用者による、間の8版が非表示) | |||
| 1行目: | 1行目: | ||
同義語:Mediator of cell motility 1 | <div align="right"> | ||
<font size="+1">[https://researchmap.jp/NaokiNakagawa 中川 直樹]</font><br> | |||
''京都大学 大学院医学研究科 人間健康科学系専攻 分子生命基礎医療科学分野''<br> | |||
DOI:<selfdoi /> 原稿受付日:2025年4月9日 原稿完成日:2025年5月8日<br> | |||
担当編集委員:[http://researchmap.jp/wadancnp 和田 圭司](国立研究開発法人国立精神・神経医療研究センター) | |||
</div> | |||
同義語:Mediator of ERBB2-driven cell motility 1<br> | |||
略称:MEMO1 | 略称:MEMO1 | ||
{{box|text= Mediator of | {{box|text= Mediator of cell motility 1(MEMO1)は、MEMO1遺伝子によりコードされ、297アミノ酸から成る分子量約33kDaのタンパク質である。細胞質に局在し、シグナル伝達制御、細胞骨格系の制御、レドックス制御など多様な機能を発揮する。がんの悪性化に関わる分子として同定された経緯から、がん細胞での役割を中心に研究が進んできた。その一方で、中枢神経系の発生過程で重要な役割を担うことが明らかとなってきている。例えば、MEMO1は胎生期大脳皮質において放射状グリア細胞の形態形成と神経細胞層の構築に寄与する。小脳では、顆粒細胞の前駆細胞やバーグマングリア細胞に発現し、顆粒細胞の産生や移動の制御に関わる。この他にも骨や血管などの発生に関与することが明らかとなっている。}} | ||
== 歴史的背景 == | == 歴史的背景 == | ||
[[ファイル:Nakagawa MEMO1 Fig1.png|サムネイル|'''図1. MEMO1タンパク質の構造'''<br>ヒトMEMO1タンパク質の立体構造(Protein Data Bank {{PDB|2arv.pdb}}より引用)。推定される金属イオン結合ポケットを構成するアミノ酸残基である49、81、192番目のヒスチジン(赤)、189番目のアスパラギン酸(黄)、244番目のシステイン(青)が表示されている。]] | |||
[[ファイル:Nakagawa MEMO1 Fig2.png|サムネイル|'''図2. MEMO1とジオキシゲナーゼとの類似性'''<br>ヒトMEMO1(上)とSphingomonas paucimobilisの非ヘム鉄依存性ジオキシゲナーゼLigB(下)との1次構造比較。MEMO1とLigBはアミノ酸配列の相同性は高くない(<15%)が、立体構造には類似性が認められる<ref name=Qiu2008><pubmed>18045866</pubmed></ref>。LigBにおいて鉄イオンとの結合に重要な12番目と61番目のヒスチジン(H12、H61)および242番目のグルタミン酸(E242)、そして触媒活性に必要な195番目のヒスチジン(H195)は、一部異なるもののそれぞれMEMO1で保存されている(H49、H81、H192、およびC244)。]] | |||
Mediator of ERBB2-driven cell motility 1 (MEMO1)は、MEMO1遺伝子によりコードされ、[[ヒト]]では297アミノ酸から成る分子量約33kDaのタンパク質である。[[乳がん]]の[[転移]]メカニズムの研究において、がん悪性化に関わる[[受容体型チロシンキナーゼ]][[Erb-b2 receptor tyrosine kinase 2]]([[ERBB2]]、[[HER2]]としても知られる)の細胞内[[アダプタータンパク質]]として2004年に同定された<ref name=Marone2004><pubmed>15156151</pubmed></ref>。 | Mediator of ERBB2-driven cell motility 1 (MEMO1)は、MEMO1遺伝子によりコードされ、[[ヒト]]では297アミノ酸から成る分子量約33kDaのタンパク質である。[[乳がん]]の[[転移]]メカニズムの研究において、がん悪性化に関わる[[受容体型チロシンキナーゼ]][[Erb-b2 receptor tyrosine kinase 2]]([[ERBB2]]、[[HER2]]としても知られる)の細胞内[[アダプタータンパク質]]として2004年に同定された<ref name=Marone2004><pubmed>15156151</pubmed></ref>。 | ||
MEMO1の遺伝子は[[アーキア]]、[[バクテリア]]から[[真核生物]]まで保存されており、タンパク質はバクテリアの非ヘム鉄依存性[[ジオキシゲナーゼ]] | MEMO1の遺伝子は[[アーキア]]、[[バクテリア]]から[[真核生物]]まで保存されており、タンパク質はバクテリアの非ヘム鉄依存性[[ジオキシゲナーゼ]]と構造的類似性がある('''図1、2''')<ref name=Qiu2008><pubmed>18045866</pubmed></ref>。[[銅]]イオンと結合し細胞内[[レドックス制御]]に関わることが示され、MEMO1機能の多面性が明らかとなってきた<ref name=MacDonald2014><pubmed>24917593</pubmed></ref><ref name=Zhang2022><pubmed>36067318</pubmed></ref>。 | ||
これまでに報告されているMEMO1の主な細胞内機能は[[シグナル伝達]]制御、[[細胞骨格]]系の制御、細胞内レドックス制御であり、これらの機能によって生体における様々な生理的・病理的現象に関与することがわかってきている。MEMO1は神経系組織にも発現しており、[[大脳皮質]]や[[小脳]]において組織の発生に関わることが示されている。 | これまでに報告されているMEMO1の主な細胞内機能は[[シグナル伝達]]制御、[[細胞骨格]]系の制御、細胞内レドックス制御であり、これらの機能によって生体における様々な生理的・病理的現象に関与することがわかってきている。MEMO1は神経系組織にも発現しており、[[大脳皮質]]や[[小脳]]において組織の発生に関わることが示されている。 | ||
| 19行目: | 28行目: | ||
== 発現分布 == | == 発現分布 == | ||
=== 組織分布 === | === 組織分布 === | ||
成体[[マウス]]臓器を用いた[[ | 成体[[マウス]]臓器を用いた[[ウェスタンブロット]]解析では、[[肝臓]]や[[腎臓]]をはじめ解析された全ての臓器でMEMO1タンパク質の発現がみられる<ref name=Haenzi2014><pubmed>24056085</pubmed></ref>。マウス胎仔(E11.5およびE13.5)の[[in situハイブリダイゼーション]]解析では、ほぼ全身の組織にMEMO1の発現がみられる<ref name=Kondo2014><pubmed>24714781</pubmed></ref>。マウス胎仔脳の大脳皮質では、mRNA、タンパク質ともに[[皮質板]]と[[脳室帯]]に高い発現を示す<ref name=Nakagawa2019><pubmed>31277925</pubmed></ref>。このように、MEMO1は胎児期から成体にいたるまで全身の組織に広く発現すると考えられている。 | ||
=== 細胞内分布 === | === 細胞内分布 === | ||
細胞内では、MEMO1は[[細胞質]]に存在する<ref name=Marone2004><pubmed>15156151</pubmed></ref>。 | 細胞内では、MEMO1は[[細胞質]]に存在する<ref name=Marone2004><pubmed>15156151</pubmed></ref>。 | ||
[[ファイル:Nakagawa MEMO1 Fig3.png|サムネイル|'''図3. MEMO1タンパク質の機能'''<br>MEMO1の主要な細胞内機能は、シグナル伝達の制御(A)、細胞骨格系の制御(B)、レドックス制御(C)である。]] | |||
== 機能 == | == 機能 == | ||
=== タンパク質レベルでの機能 === | === タンパク質レベルでの機能 === | ||
これまでに報告されているMEMO1タンパク質の主な機能は、シグナル伝達制御、細胞骨格系の制御、細胞内レドックス制御である('''図3''')。 | |||
==== シグナル伝達制御 ==== | ==== シグナル伝達制御 ==== | ||
MEMO1は受容体型チロシンキナーゼの細胞内アダプタータンパク質として、シグナル伝達経路の一端を担っている。ERBB2の細胞内領域に存在する複数の[[リン酸化]]部位のうち、1227番目のリン酸化[[チロシン]]を含む配列に特異的に結合し<ref name=Marone2004><pubmed>15156151</pubmed></ref>、ERBB2リガンド([[Heregulin β1]]([[HRG]])など)に対する細胞応答を調節する。MEMO1の下流では、[[ras homolog family member A]]([[RhoA]])や[[mammalian diaphanous-related formin 1]]([[mDia]])、[[actin cross-linking factor 7]]([[ACF7]])といった細胞骨格系の制御分子が働き、[[微小管]]のリモデリングを介してがん細胞の[[遊走能]]を促進する(後述の「[[Mediator of ERBB2-driven cell motility 1#細胞骨格系の制御|細胞骨格系の制御]]」を参照)<ref name=Zaoui2010><pubmed>20937854</pubmed></ref><ref name=Zaoui2008><pubmed>18955552</pubmed></ref>。同定された当初は、MEMO1が既知のリン酸化チロシン結合ドメインを持たないことから、ERBB2との結合は[[SHC adaptor protein]] | MEMO1は受容体型チロシンキナーゼの細胞内アダプタータンパク質として、シグナル伝達経路の一端を担っている。ERBB2の細胞内領域に存在する複数の[[リン酸化]]部位のうち、1227番目のリン酸化[[チロシン]]を含む配列に特異的に結合し<ref name=Marone2004><pubmed>15156151</pubmed></ref>、ERBB2リガンド([[Heregulin β1]]([[HRG]])など)に対する細胞応答を調節する。MEMO1の下流では、[[ras homolog family member A]]([[RhoA]])や[[mammalian diaphanous-related formin 1]]([[mDia]])、[[actin cross-linking factor 7]]([[ACF7]])といった細胞骨格系の制御分子が働き、[[微小管]]のリモデリングを介してがん細胞の[[遊走能]]を促進する(後述の「[[Mediator of ERBB2-driven cell motility 1#細胞骨格系の制御|細胞骨格系の制御]]」を参照)<ref name=Zaoui2010><pubmed>20937854</pubmed></ref><ref name=Zaoui2008><pubmed>18955552</pubmed></ref>。同定された当初は、MEMO1が既知のリン酸化チロシン結合ドメインを持たないことから、ERBB2との結合は[[SHC adaptor protein]]などを介した間接的な相互作用だと考えられた。しかし、その後のQiuらによるX線結晶構造解析の結果、MEMO1は自身のジオキシゲナーゼ酵素活性部位に相当するアミノ酸領域(putativeな金属イオン結合ポケット)を介してERBB2と直接結合することが示された('''図1、2''')<ref name=Qiu2008><pubmed>18045866</pubmed></ref>。 | ||
ERBB2以外にも、MEMO1は[[Fibroblast growth factor receptor 1]]([[FGFR1]])の細胞内領域と結合し、その下流の[[phosphatidylinositol-3 kinase]] ([[PI3K]])-[[Akt]]経路を正に制御する<ref name=Haenzi2014><pubmed>24056085</pubmed></ref>。また、[[insulin like growth factor 1 receptor]]([[IGF1R]])を介したシグナル伝達では、IGF1Rの細胞内アダプタータンパク質である[[insulin receptor substrate 1]] ([[IRS1]])とMEMO1が相互作用することで、PI3K-Akt経路の活性化と、その下流の[[Snail]]活性化および[[上皮間葉転換]]の誘導が生じ、がん細胞の転移能獲得につながることが示されている<ref name=Sorokin2013><pubmed>22824790</pubmed></ref>。受容体型チロシンキナーゼ以外にも、[[エストロゲン]]受容体やSphingosine-1-phosphate receptor 1(S1PR1)を介したシグナルの調節に関与することも報告されている<ref name=Frei2016><pubmed>27472465</pubmed></ref><ref name=Kondo2014><pubmed>24714781</pubmed></ref>。 | ERBB2以外にも、MEMO1は[[Fibroblast growth factor receptor 1]]([[FGFR1]])の細胞内領域と結合し、その下流の[[phosphatidylinositol-3 kinase]] ([[PI3K]])-[[Akt]]経路を正に制御する<ref name=Haenzi2014><pubmed>24056085</pubmed></ref>。また、[[insulin like growth factor 1 receptor]]([[IGF1R]])を介したシグナル伝達では、IGF1Rの細胞内アダプタータンパク質である[[insulin receptor substrate 1]] ([[IRS1]])とMEMO1が相互作用することで、PI3K-Akt経路の活性化と、その下流の[[Snail]]活性化および[[上皮間葉転換]]の誘導が生じ、がん細胞の転移能獲得につながることが示されている<ref name=Sorokin2013><pubmed>22824790</pubmed></ref>。受容体型チロシンキナーゼ以外にも、[[エストロゲン]]受容体やSphingosine-1-phosphate receptor 1(S1PR1)を介したシグナルの調節に関与することも報告されている<ref name=Frei2016><pubmed>27472465</pubmed></ref><ref name=Kondo2014><pubmed>24714781</pubmed></ref>。 | ||
| 47行目: | 56行目: | ||
==== 小脳の発生 ==== | ==== 小脳の発生 ==== | ||
小脳発生における選択的ポリA付加反応の役割に着目した研究で、小脳[[顆粒細胞]]において、MEMO1のmRNAに3'側非翻訳領域の長さが異なる2種類のアイソフォームが存在することが明らかとなった<ref name=Jereb2018><pubmed>29578408</pubmed></ref>。顆粒細胞の前駆細胞には3'側非翻訳領域の短いmRNAが多く、分化の進んだ顆粒細胞には3'側非翻訳領域の長いmRNAが多い。長いMEMO1アイソフォームは[[miR-124]]の標的配列を含んでいるため、分化した顆粒細胞ではMEMO1のタンパク質発現がmiR-124依存的に抑制される。MEMO1遺伝子欠損マウスでは、小脳顆粒細胞前駆細胞の増殖能低下と小脳の低形成が生じる。すなわち、MEMO1は顆粒細胞の増殖を正に制御しており、この機能が必要な前駆細胞の期間中、短いmRNAアイソフォームを発現することによってmiR-124依存的な抑制を回避し、MEMO1の発現を維持していると想定される。したがって、小脳顆粒細胞の発生において、選択的ポリA付加によってMEMO1は時期特異的な役割を発揮していると考えられる<ref name=Jereb2018><pubmed>29578408</pubmed></ref>。 | 小脳発生における選択的ポリA付加反応の役割に着目した研究で、小脳[[顆粒細胞]]において、MEMO1のmRNAに3'側非翻訳領域の長さが異なる2種類のアイソフォームが存在することが明らかとなった<ref name=Jereb2018><pubmed>29578408</pubmed></ref>。顆粒細胞の前駆細胞には3'側非翻訳領域の短いmRNAが多く、分化の進んだ顆粒細胞には3'側非翻訳領域の長いmRNAが多い。長いMEMO1アイソフォームは[[miR-124]]の標的配列を含んでいるため、分化した顆粒細胞ではMEMO1のタンパク質発現がmiR-124依存的に抑制される。MEMO1遺伝子欠損マウスでは、小脳顆粒細胞前駆細胞の増殖能低下と小脳の低形成が生じる。すなわち、MEMO1は顆粒細胞の増殖を正に制御しており、この機能が必要な前駆細胞の期間中、短いmRNAアイソフォームを発現することによってmiR-124依存的な抑制を回避し、MEMO1の発現を維持していると想定される。したがって、小脳顆粒細胞の発生において、選択的ポリA付加によってMEMO1は時期特異的な役割を発揮していると考えられる<ref name=Jereb2018><pubmed>29578408</pubmed></ref>。 | ||
MEMO1は[[バーグマングリア細胞]]にも発現している。MEMO1遺伝子の欠損によってバーグマングリアの組織内分布の乱れと放射状線維の低形成が生じる<ref name=Nakagawa2019><pubmed>31277925</pubmed></ref>。バーグマングリアの放射状線維は、生後発達期の小脳[[顆粒細胞]]の[[外顆粒層]]から[[内顆粒層]]への細胞移動の足場として重要であり、実際にMEMO1遺伝子欠損マウスでは顆粒細胞の移動が障害され外顆粒層に異所的な残存が認められる<ref name=Nakagawa2019><pubmed>31277925</pubmed></ref>。 | MEMO1は[[バーグマングリア細胞]]にも発現している。MEMO1遺伝子の欠損によってバーグマングリアの組織内分布の乱れと放射状線維の低形成が生じる<ref name=Nakagawa2019><pubmed>31277925</pubmed></ref>。バーグマングリアの放射状線維は、生後発達期の小脳[[顆粒細胞]]の[[外顆粒層]]から[[内顆粒層]]への細胞移動の足場として重要であり、実際にMEMO1遺伝子欠損マウスでは顆粒細胞の移動が障害され外顆粒層に異所的な残存が認められる<ref name=Nakagawa2019><pubmed>31277925</pubmed></ref>。 | ||
==== 骨形成 ==== | ==== 骨形成 ==== | ||
MEMO1は骨組織の形成にも重要な役割を担う。MEMO1遺伝子欠損マウスでは、頭蓋顔面骨格の形成(特に2次口蓋骨の形成)および[[大腿骨]]の[[骨梁]]形成に異常が認められる<ref name=Moor2018><pubmed>30038965</pubmed></ref><ref name= | MEMO1は骨組織の形成にも重要な役割を担う。MEMO1遺伝子欠損マウスでは、頭蓋顔面骨格の形成(特に2次口蓋骨の形成)および[[大腿骨]]の[[骨梁]]形成に異常が認められる<ref name=Moor2018><pubmed>30038965</pubmed></ref><ref name=VanOtterloo2016><pubmed>26746790</pubmed></ref>。MEMO1を欠損した骨芽細胞ではEpidermal growth factor(EGF)やFibroblast growth factor 2(FGF2)への応答性が低下しており、これが骨形成異常の原因だと考えられている<ref name=Moor2018><pubmed>30038965</pubmed></ref>。 | ||
==== 血管形成 ==== | ==== 血管形成 ==== | ||
| 57行目: | 67行目: | ||
== 疾患との関わり == | == 疾患との関わり == | ||
=== がん === | === がん === | ||
がん細胞株を用いた一連の研究で、MEMO1が、細胞骨格系のリモデリングや細胞内レドックス機構の制御を介して、がん細胞の[[遊走]]、転移、[[浸潤]]能を亢進させることが明らかとなった<ref name=MacDonald2014><pubmed>24917593</pubmed></ref><ref name=Marone2004><pubmed>15156151</pubmed></ref><ref name=Zaoui2010><pubmed>20937854</pubmed></ref><ref name=Zaoui2008><pubmed>18955552</pubmed></ref>。これらの知見と一致して、乳がん・[[大腸がん]]患者の腫瘍組織でMEMO1が高発現すること、MEMO1発現レベルとがん悪性度や患者生存率に相関があることがわかっている<ref name=Bogoevska2017><pubmed>27941874</pubmed></ref><ref name=MacDonald2014><pubmed>24917593</pubmed></ref>。 | |||
=== 自閉スペクトラム症 === | === 自閉スペクトラム症 === | ||
[[自閉スペクトラム症]]は[[神経発達症]]の一つであり、社会的コミュニケーションの障害と反復常同的な行動を特徴とする(「[[自閉スペクトラム症]]」参照)。自閉スペクトラム症患者の全[[エクソームシーケンス解析]]によって、1例の患者でMEMO1遺伝子のスプライシングドナー配列に変異が同定された<ref name=Iossifov2014><pubmed>25363768</pubmed></ref>。この変異によってMEMO1のスプライシング異常が生じ、その結果48アミノ酸の短いMEMO1が生じるが、この自閉スペクトラム症型MEMO1は、上述のMEMO1遺伝子欠損マウスにおける放射状グリア細胞の表現型(basal processの過剰分岐)をレスキューできないことから、少なくとも放射状グリア細胞では本来の機能を喪失していると考えられる<ref name=Nakagawa2019><pubmed>31277925</pubmed></ref>。また、一部の自閉スペクトラム症例で、大脳皮質の層構造異常が観察されることから<ref name=Stoner2014><pubmed>24670167</pubmed></ref>、放射状グリア細胞の形態的異常とそれに起因する神経細胞層の形成異常が自閉スペクトラム症の病態に関与することが示唆される。 | |||
== 関連語 == | == 関連語 == | ||
| 74行目: | 84行目: | ||
== 参考文献 == | == 参考文献 == | ||
2025年5月10日 (土) 00:11時点における最新版
中川 直樹
京都大学 大学院医学研究科 人間健康科学系専攻 分子生命基礎医療科学分野
DOI:10.14931/bsd.11043 原稿受付日:2025年4月9日 原稿完成日:2025年5月8日
担当編集委員:和田 圭司(国立研究開発法人国立精神・神経医療研究センター)
同義語:Mediator of ERBB2-driven cell motility 1
略称:MEMO1
Mediator of cell motility 1(MEMO1)は、MEMO1遺伝子によりコードされ、297アミノ酸から成る分子量約33kDaのタンパク質である。細胞質に局在し、シグナル伝達制御、細胞骨格系の制御、レドックス制御など多様な機能を発揮する。がんの悪性化に関わる分子として同定された経緯から、がん細胞での役割を中心に研究が進んできた。その一方で、中枢神経系の発生過程で重要な役割を担うことが明らかとなってきている。例えば、MEMO1は胎生期大脳皮質において放射状グリア細胞の形態形成と神経細胞層の構築に寄与する。小脳では、顆粒細胞の前駆細胞やバーグマングリア細胞に発現し、顆粒細胞の産生や移動の制御に関わる。この他にも骨や血管などの発生に関与することが明らかとなっている。
歴史的背景
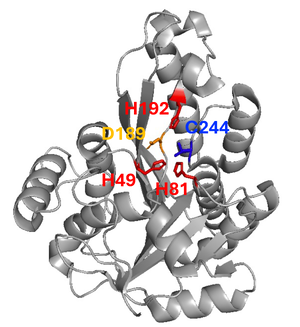
ヒトMEMO1タンパク質の立体構造(Protein Data Bank PDB: 2arv.pdbより引用)。推定される金属イオン結合ポケットを構成するアミノ酸残基である49、81、192番目のヒスチジン(赤)、189番目のアスパラギン酸(黄)、244番目のシステイン(青)が表示されている。
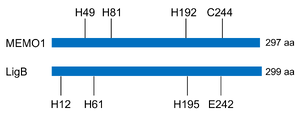
ヒトMEMO1(上)とSphingomonas paucimobilisの非ヘム鉄依存性ジオキシゲナーゼLigB(下)との1次構造比較。MEMO1とLigBはアミノ酸配列の相同性は高くない(<15%)が、立体構造には類似性が認められる[1]。LigBにおいて鉄イオンとの結合に重要な12番目と61番目のヒスチジン(H12、H61)および242番目のグルタミン酸(E242)、そして触媒活性に必要な195番目のヒスチジン(H195)は、一部異なるもののそれぞれMEMO1で保存されている(H49、H81、H192、およびC244)。
Mediator of ERBB2-driven cell motility 1 (MEMO1)は、MEMO1遺伝子によりコードされ、ヒトでは297アミノ酸から成る分子量約33kDaのタンパク質である。乳がんの転移メカニズムの研究において、がん悪性化に関わる受容体型チロシンキナーゼErb-b2 receptor tyrosine kinase 2(ERBB2、HER2としても知られる)の細胞内アダプタータンパク質として2004年に同定された[2]。
MEMO1の遺伝子はアーキア、バクテリアから真核生物まで保存されており、タンパク質はバクテリアの非ヘム鉄依存性ジオキシゲナーゼと構造的類似性がある(図1、2)[1]。銅イオンと結合し細胞内レドックス制御に関わることが示され、MEMO1機能の多面性が明らかとなってきた[3][4]。
これまでに報告されているMEMO1の主な細胞内機能はシグナル伝達制御、細胞骨格系の制御、細胞内レドックス制御であり、これらの機能によって生体における様々な生理的・病理的現象に関与することがわかってきている。MEMO1は神経系組織にも発現しており、大脳皮質や小脳において組織の発生に関わることが示されている。
構造
ヒトMEMO1タンパク質は297アミノ酸から成り、バクテリアの非ヘム鉄依存性ジオキシゲナーゼと構造的に類似している(図1、2)[1]。最初のX線結晶構造解析では、精製されたMEMO1には金属イオン結合性は認められなかったが[1]、その後、別のグループによって、MEMO1の金属イオン結合ポケットに銅イオン、さらには鉄イオンが結合することが示された[5][4]。
アイソフォーム
MEMO1のmRNAには、選択的ポリA付加反応(alternative polyadenylation)によって3'側非翻訳領域の長さが異なる2種類のアイソフォームが存在することがわかっている[6]。どちらも同じアミノ酸配列のMEMO1をコードすると考えられている。
発現分布
組織分布
成体マウス臓器を用いたウェスタンブロット解析では、肝臓や腎臓をはじめ解析された全ての臓器でMEMO1タンパク質の発現がみられる[7]。マウス胎仔(E11.5およびE13.5)のin situハイブリダイゼーション解析では、ほぼ全身の組織にMEMO1の発現がみられる[8]。マウス胎仔脳の大脳皮質では、mRNA、タンパク質ともに皮質板と脳室帯に高い発現を示す[9]。このように、MEMO1は胎児期から成体にいたるまで全身の組織に広く発現すると考えられている。
細胞内分布
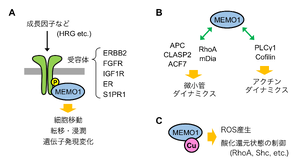
MEMO1の主要な細胞内機能は、シグナル伝達の制御(A)、細胞骨格系の制御(B)、レドックス制御(C)である。
機能
タンパク質レベルでの機能
これまでに報告されているMEMO1タンパク質の主な機能は、シグナル伝達制御、細胞骨格系の制御、細胞内レドックス制御である(図3)。
シグナル伝達制御
MEMO1は受容体型チロシンキナーゼの細胞内アダプタータンパク質として、シグナル伝達経路の一端を担っている。ERBB2の細胞内領域に存在する複数のリン酸化部位のうち、1227番目のリン酸化チロシンを含む配列に特異的に結合し[2]、ERBB2リガンド(Heregulin β1(HRG)など)に対する細胞応答を調節する。MEMO1の下流では、ras homolog family member A(RhoA)やmammalian diaphanous-related formin 1(mDia)、actin cross-linking factor 7(ACF7)といった細胞骨格系の制御分子が働き、微小管のリモデリングを介してがん細胞の遊走能を促進する(後述の「細胞骨格系の制御」を参照)[10][11]。同定された当初は、MEMO1が既知のリン酸化チロシン結合ドメインを持たないことから、ERBB2との結合はSHC adaptor proteinなどを介した間接的な相互作用だと考えられた。しかし、その後のQiuらによるX線結晶構造解析の結果、MEMO1は自身のジオキシゲナーゼ酵素活性部位に相当するアミノ酸領域(putativeな金属イオン結合ポケット)を介してERBB2と直接結合することが示された(図1、2)[1]。
ERBB2以外にも、MEMO1はFibroblast growth factor receptor 1(FGFR1)の細胞内領域と結合し、その下流のphosphatidylinositol-3 kinase (PI3K)-Akt経路を正に制御する[7]。また、insulin like growth factor 1 receptor(IGF1R)を介したシグナル伝達では、IGF1Rの細胞内アダプタータンパク質であるinsulin receptor substrate 1 (IRS1)とMEMO1が相互作用することで、PI3K-Akt経路の活性化と、その下流のSnail活性化および上皮間葉転換の誘導が生じ、がん細胞の転移能獲得につながることが示されている[12]。受容体型チロシンキナーゼ以外にも、エストロゲン受容体やSphingosine-1-phosphate receptor 1(S1PR1)を介したシグナルの調節に関与することも報告されている[13][8]。
細胞骨格系の制御
MEMO1は微小管線維のラメリポディアへの伸展に重要な役割を果たしている。がん細胞株を用いた研究で、ERBB2リガンドの添加によってMEMO1がラメリポディアにリクルートされることが示されている[2]。この際、RhoA、mDia、adenomatous polyposis coli(APC)、cytoplasmic linker associated protein 2(CLASP2)、ACF7といった細胞骨格制御タンパク質がMEMO1依存的にラメリポディアにリクルートされ、ラメリポディアにおいて微小管線維を捕捉し安定化させる[10][11]。また、MEMO1は、ERBB2の下流でphospholipase Cγ1(PLCγ1)と協調してcofilinの活性を制御し、アクチンダイナミクスの制御にも関わる[14]。
細胞内レドックス制御
精製タンパク質を用いた実験でMEMO1が銅(II)イオンを還元する活性を示すことが明らかとなった[3]。バクテリアのジオキシゲナーゼにおいて酵素活性に重要なヒスチジン残基に相当する、192番目のヒスチジン(図1、2)を変異させたMEMO1では、この銅イオン還元活性が大きく低下する。乳がん細胞株を用いた研究で、MEMO1がRhoAやShcの酸化還元状態(システイン残基のチオール基の修飾状態)を調節すること、およびラメリポディアにおいて局所的に活性酸素種(reactive oxygen species)を増加させることがわかっている[3]。
細胞、個体レベルでの機能
MEMO1の全身性遺伝子欠損マウスでは、胎生期のE13.5以降から浮腫や出血を呈し、胎性致死となる[7][8]。タモキシフェン誘導性Creを有するトランスジェニックマウスとMEMO1のfloxマウスを掛け合わせ、生後にタモキシフェンを投与することで胎性致死を回避した条件的MEMO1全身性遺伝子欠損マウスでは、低身長、低体重、脊柱後湾、精子形成不全、脱毛、寿命短縮などの全身症状が生じる[7]。各組織に着目した次のような研究によって、MEMO1の多様な役割が細胞レベル、個体レベルで明らかとなってきている。
大脳皮質の発生
哺乳類の大脳皮質の形成過程では、放射状グリア細胞と呼ばれる神経幹細胞が脳室帯に存在し、脳表面の基底膜側に向けて伸びる一本の長い突起(basal process、基底膜側突起)によって基底膜と接着している(「放射状グリア細胞」参照)。放射状グリア細胞は、神経細胞の産生だけでなく、神経細胞の移動の足場としても働いている。放射状グリア細胞においてMEMO1は、微小管線維の束状化を介して基底膜側突起の形態維持に寄与している[9]。マウスにおいて、放射状グリア細胞でMEMO1遺伝子を欠損させると、基底膜側突起の過剰な枝分かれが生じ、興奮性神経細胞の放射状移動(皮質板に向けた移動)と大脳皮質層構造の形成に異常が生じることが明らかとなった[9]。MEMO1を欠損した放射状グリア細胞では、微小管のマイナス端結合タンパク質であるCalmodulin-regulated spectrin-associated protein 2(CAMSAP2)の基底膜側突起内存在量が増加することによって非中心体性の微小管形成が亢進し、これが基底膜側突起自体の枝分かれにつながる[9]。ヒト胎児由来の培養神経幹細胞でMEMO1をノックダウンした場合でも突起の過剰分岐が生じることから[9]、放射状グリア細胞におけるMEMO1の機能はヒトでも保存されていると考えられる。
小脳の発生
小脳発生における選択的ポリA付加反応の役割に着目した研究で、小脳顆粒細胞において、MEMO1のmRNAに3'側非翻訳領域の長さが異なる2種類のアイソフォームが存在することが明らかとなった[6]。顆粒細胞の前駆細胞には3'側非翻訳領域の短いmRNAが多く、分化の進んだ顆粒細胞には3'側非翻訳領域の長いmRNAが多い。長いMEMO1アイソフォームはmiR-124の標的配列を含んでいるため、分化した顆粒細胞ではMEMO1のタンパク質発現がmiR-124依存的に抑制される。MEMO1遺伝子欠損マウスでは、小脳顆粒細胞前駆細胞の増殖能低下と小脳の低形成が生じる。すなわち、MEMO1は顆粒細胞の増殖を正に制御しており、この機能が必要な前駆細胞の期間中、短いmRNAアイソフォームを発現することによってmiR-124依存的な抑制を回避し、MEMO1の発現を維持していると想定される。したがって、小脳顆粒細胞の発生において、選択的ポリA付加によってMEMO1は時期特異的な役割を発揮していると考えられる[6]。
MEMO1はバーグマングリア細胞にも発現している。MEMO1遺伝子の欠損によってバーグマングリアの組織内分布の乱れと放射状線維の低形成が生じる[9]。バーグマングリアの放射状線維は、生後発達期の小脳顆粒細胞の外顆粒層から内顆粒層への細胞移動の足場として重要であり、実際にMEMO1遺伝子欠損マウスでは顆粒細胞の移動が障害され外顆粒層に異所的な残存が認められる[9]。
骨形成
MEMO1は骨組織の形成にも重要な役割を担う。MEMO1遺伝子欠損マウスでは、頭蓋顔面骨格の形成(特に2次口蓋骨の形成)および大腿骨の骨梁形成に異常が認められる[15][16]。MEMO1を欠損した骨芽細胞ではEpidermal growth factor(EGF)やFibroblast growth factor 2(FGF2)への応答性が低下しており、これが骨形成異常の原因だと考えられている[15]。
血管形成
MEMO1の全身性遺伝子欠損マウスは胎性致死となるが、重度の出血がその要因の一つだと考えられており、MEMO1機能と血管形成との関連が示唆される[7][8]。その一方で、MEMO1遺伝子欠損マウス胎仔において血管の形態的異常は認められない[8]。血管内皮細胞特異的にMEMO1遺伝子を欠損させたマウスの胎仔でも同様の出血がみられることから、血管内皮細胞におけるMEMO1の機能が血管形成に重要であると考えられている[8]。
疾患との関わり
がん
がん細胞株を用いた一連の研究で、MEMO1が、細胞骨格系のリモデリングや細胞内レドックス機構の制御を介して、がん細胞の遊走、転移、浸潤能を亢進させることが明らかとなった[3][2][10][11]。これらの知見と一致して、乳がん・大腸がん患者の腫瘍組織でMEMO1が高発現すること、MEMO1発現レベルとがん悪性度や患者生存率に相関があることがわかっている[17][3]。
自閉スペクトラム症
自閉スペクトラム症は神経発達症の一つであり、社会的コミュニケーションの障害と反復常同的な行動を特徴とする(「自閉スペクトラム症」参照)。自閉スペクトラム症患者の全エクソームシーケンス解析によって、1例の患者でMEMO1遺伝子のスプライシングドナー配列に変異が同定された[18]。この変異によってMEMO1のスプライシング異常が生じ、その結果48アミノ酸の短いMEMO1が生じるが、この自閉スペクトラム症型MEMO1は、上述のMEMO1遺伝子欠損マウスにおける放射状グリア細胞の表現型(basal processの過剰分岐)をレスキューできないことから、少なくとも放射状グリア細胞では本来の機能を喪失していると考えられる[9]。また、一部の自閉スペクトラム症例で、大脳皮質の層構造異常が観察されることから[19]、放射状グリア細胞の形態的異常とそれに起因する神経細胞層の形成異常が自閉スペクトラム症の病態に関与することが示唆される。
関連語
参考文献
- ↑ 1.0 1.1 1.2 1.3 1.4
Qiu, C., Lienhard, S., Hynes, N.E., Badache, A., & Leahy, D.J. (2008).
Memo is homologous to nonheme iron dioxygenases and binds an ErbB2-derived phosphopeptide in its vestigial active site. The Journal of biological chemistry, 283(5), 2734-40. [PubMed:18045866] [WorldCat] [DOI] - ↑ 2.0 2.1 2.2 2.3 2.4
Marone, R., Hess, D., Dankort, D., Muller, W.J., Hynes, N.E., & Badache, A. (2004).
Memo mediates ErbB2-driven cell motility. Nature cell biology, 6(6), 515-22. [PubMed:15156151] [WorldCat] [DOI] - ↑ 3.0 3.1 3.2 3.3 3.4
MacDonald, G., Nalvarte, I., Smirnova, T., Vecchi, M., Aceto, N., Dolemeyer, A., ..., & Hynes, N.E. (2014).
Memo is a copper-dependent redox protein with an essential role in migration and metastasis. Science signaling, 7(329), ra56. [PubMed:24917593] [WorldCat] [DOI] - ↑ 4.0 4.1
Zhang, X., Walke, G.R., Horvath, I., Kumar, R., Blockhuys, S., Holgersson, S., ..., & Wittung-Stafshede, P. (2022).
Memo1 binds reduced copper ions, interacts with copper chaperone Atox1, and protects against copper-mediated redox activity in vitro. Proceedings of the National Academy of Sciences of the United States of America, 119(37), e2206905119. [PubMed:36067318] [PMC] [WorldCat] [DOI] - ↑
Dolgova, N., Uhlemann, E.E., Boniecki, M.T., Vizeacoumar, F.S., Ara, A., Nouri, P., ..., & Dmitriev, O.Y. (2024).
MEMO1 binds iron and modulates iron homeostasis in cancer cells. eLife, 13. [PubMed:38640016] [PMC] [WorldCat] [DOI] - ↑ 6.0 6.1 6.2
Jereb, S., Hwang, H.W., Van Otterloo, E., Govek, E.E., Fak, J.J., Yuan, Y., ..., & Darnell, R.B. (2018).
Differential 3' Processing of Specific Transcripts Expands Regulatory and Protein Diversity Across Neuronal Cell Types. eLife, 7. [PubMed:29578408] [PMC] [WorldCat] [DOI] - ↑ 7.0 7.1 7.2 7.3 7.4
Haenzi, B., Bonny, O., Masson, R., Lienhard, S., Dey, J.H., Kuro-o, M., & Hynes, N.E. (2014).
Loss of Memo, a novel FGFR regulator, results in reduced lifespan. FASEB journal : official publication of the Federation of American Societies for Experimental Biology, 28(1), 327-36. [PubMed:24056085] [WorldCat] [DOI] - ↑ 8.0 8.1 8.2 8.3 8.4 8.5
Kondo, S., Bottos, A., Allegood, J.C., Masson, R., Maurer, F.G., Genoud, C., ..., & Hynes, N.E. (2014).
Memo has a novel role in S1P signaling and is [corrected] crucial for vascular development. PloS one, 9(4), e94114. [PubMed:24714781] [PMC] [WorldCat] [DOI] - ↑ 9.0 9.1 9.2 9.3 9.4 9.5 9.6 9.7
Nakagawa, N., Plestant, C., Yabuno-Nakagawa, K., Li, J., Lee, J., Huang, C.W., ..., & Anton, E.S. (2019).
Memo1-Mediated Tiling of Radial Glial Cells Facilitates Cerebral Cortical Development. Neuron, 103(5), 836-852.e5. [PubMed:31277925] [PMC] [WorldCat] [DOI] - ↑ 10.0 10.1 10.2
Zaoui, K., Benseddik, K., Daou, P., Salaün, D., & Badache, A. (2010).
ErbB2 receptor controls microtubule capture by recruiting ACF7 to the plasma membrane of migrating cells. Proceedings of the National Academy of Sciences of the United States of America, 107(43), 18517-22. [PubMed:20937854] [PMC] [WorldCat] [DOI] - ↑ 11.0 11.1 11.2
Zaoui, K., Honoré, S., Isnardon, D., Braguer, D., & Badache, A. (2008).
Memo-RhoA-mDia1 signaling controls microtubules, the actin network, and adhesion site formation in migrating cells. The Journal of cell biology, 183(3), 401-8. [PubMed:18955552] [PMC] [WorldCat] [DOI] - ↑
Sorokin, A.V., & Chen, J. (2013).
MEMO1, a new IRS1-interacting protein, induces epithelial-mesenchymal transition in mammary epithelial cells. Oncogene, 32(26), 3130-8. [PubMed:22824790] [WorldCat] [DOI] - ↑
Frei, A., MacDonald, G., Lund, I., Gustafsson, J.Å., Hynes, N.E., & Nalvarte, I. (2016).
Memo interacts with c-Src to control Estrogen Receptor alpha sub-cellular localization. Oncotarget, 7(35), 56170-56182. [PubMed:27472465] [PMC] [WorldCat] [DOI] - ↑
Meira, M., Masson, R., Stagljar, I., Lienhard, S., Maurer, F., Boulay, A., & Hynes, N.E. (2009).
Memo is a cofilin-interacting protein that influences PLCgamma1 and cofilin activities, and is essential for maintaining directionality during ErbB2-induced tumor-cell migration. Journal of cell science, 122(Pt 6), 787-97. [PubMed:19223396] [WorldCat] [DOI] - ↑ 15.0 15.1
Moor, M.B., Ramakrishnan, S.K., Legrand, F., Dolder, S., Siegrist, M., Durussel, F., ..., & Bonny, O. (2018).
Redox-Dependent Bone Alkaline Phosphatase Dysfunction Drives Part of the Complex Bone Phenotype in Mice Deficient for Memo1. JBMR plus, 2(4), 195-205. [PubMed:30038965] [PMC] [WorldCat] [DOI] - ↑
Van Otterloo, E., Feng, W., Jones, K.L., Hynes, N.E., Clouthier, D.E., Niswander, L., & Williams, T. (2016).
MEMO1 drives cranial endochondral ossification and palatogenesis. Developmental biology, 415(2), 278-295. [PubMed:26746790] [PMC] [WorldCat] [DOI] - ↑
Bogoevska, V., Wolters-Eisfeld, G., Hofmann, B.T., El Gammal, A.T., Mercanoglu, B., Gebauer, F., ..., & Güngör, C. (2017).
HRG/HER2/HER3 signaling promotes AhR-mediated Memo-1 expression and migration in colorectal cancer. Oncogene, 36(17), 2394-2404. [PubMed:27941874] [WorldCat] [DOI] - ↑
Iossifov, I., O'Roak, B.J., Sanders, S.J., Ronemus, M., Krumm, N., Levy, D., ..., & Wigler, M. (2014).
The contribution of de novo coding mutations to autism spectrum disorder. Nature, 515(7526), 216-21. [PubMed:25363768] [PMC] [WorldCat] [DOI] - ↑
Stoner, R., Chow, M.L., Boyle, M.P., Sunkin, S.M., Mouton, P.R., Roy, S., ..., & Courchesne, E. (2014).
Patches of disorganization in the neocortex of children with autism. The New England journal of medicine, 370(13), 1209-1219. [PubMed:24670167] [PMC] [WorldCat] [DOI]