「グリコシルホスファチジルイノシトールアンカー」の版間の差分
細 WikiSysop がページ「グリコシルホスファホスファチジルイノシトールアンカー」を「グリコシルホスファチジルイノシトールアンカー」に移動しました |
細編集の要約なし |
||
| (同じ利用者による、間の7版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">[https://researchmap.jp/read0014310 木下 タロウ]</font><br> | <font size="+1">[https://researchmap.jp/read0014310 木下 タロウ]</font><br> | ||
''大阪大学 感染症総合教育研究拠点''<br> | ''大阪大学 感染症総合教育研究拠点''<br> | ||
DOI:<selfdoi /> 原稿受付日:2025年7月3日 原稿完成日: | DOI:<selfdoi /> 原稿受付日:2025年7月3日 原稿完成日:2025年7月4日<br> | ||
担当編集委員:[https://researchmap.jp/yamagatm 山形 方人](ハーバード大学・脳科学センター)<br> | 担当編集委員:[https://researchmap.jp/yamagatm 山形 方人](ハーバード大学・脳科学センター)<br> | ||
</div> | </div> | ||
英: | |||
英: glycosylphosphatidylinositol anchor<br> | |||
英略語:GPI anchor | |||
{{box|text= 細胞表面の膜タンパク質の中には、タンパク質自体は膜に挿入されず、カルボキシ末端に結合したグリコシルホスファチジルイノシトールアンカー(GPIアンカー)と呼ばれる糖脂質によって細胞膜に係留されている一群があり、GPIアンカー型タンパク質と呼ばれる。ヒトではアルカリホスファターゼ、ecto-5'-nucleotidase、ネトリンG2など160種余りが知られている。脂質部分はホスファチジルイノシトールであり、グルコサミンと3残基のマンノースからなる糖鎖をはさみ、リン酸エタノールアミンを介してタンパク質のカルボキシ末端にアミド結合している。GPIアンカーが結合しないとタンパク質部分は細胞内で分解されるため、細胞表面でGPIアンカー型タンパク質が欠損する。GPIの生合成には20以上の遺伝子が関与しており、これらの遺伝子の機能低下変異による、知的障害、てんかん、発達遅滞などを伴う先天性GPI欠損症が知られている。また、造血幹細胞における後天性GPI欠損によって起こる発作性夜間ヘモグロビン尿症がある。}} | {{box|text= 細胞表面の膜タンパク質の中には、タンパク質自体は膜に挿入されず、カルボキシ末端に結合したグリコシルホスファチジルイノシトールアンカー(GPIアンカー)と呼ばれる糖脂質によって細胞膜に係留されている一群があり、GPIアンカー型タンパク質と呼ばれる。ヒトではアルカリホスファターゼ、ecto-5'-nucleotidase、ネトリンG2など160種余りが知られている。脂質部分はホスファチジルイノシトールであり、グルコサミンと3残基のマンノースからなる糖鎖をはさみ、リン酸エタノールアミンを介してタンパク質のカルボキシ末端にアミド結合している。GPIアンカーが結合しないとタンパク質部分は細胞内で分解されるため、細胞表面でGPIアンカー型タンパク質が欠損する。GPIの生合成には20以上の遺伝子が関与しており、これらの遺伝子の機能低下変異による、知的障害、てんかん、発達遅滞などを伴う先天性GPI欠損症が知られている。また、造血幹細胞における後天性GPI欠損によって起こる発作性夜間ヘモグロビン尿症がある。}} | ||
| 26行目: | 26行目: | ||
従来すべてのGPIアンカー型タンパク質はタンパク質がエタノールアミンリン酸を介して第3マンノースに結合していると考えられていたが、最近ecto-5'-nucleotidase (CD73)やnetrinG2など一部のものはエタノールアミンリン酸を介して第2マンノースに結合していることがわかった<ref name=Ishida2022><pubmed>35603428</pubmed></ref> ('''図1''')。 | 従来すべてのGPIアンカー型タンパク質はタンパク質がエタノールアミンリン酸を介して第3マンノースに結合していると考えられていたが、最近ecto-5'-nucleotidase (CD73)やnetrinG2など一部のものはエタノールアミンリン酸を介して第2マンノースに結合していることがわかった<ref name=Ishida2022><pubmed>35603428</pubmed></ref> ('''図1''')。 | ||
[[ファイル:Kinoshita GPI-anchor Fig2.png|400px|サムネイル|'''図2. 新生GPIアンカー型タンパク質ができるまで''' | [[ファイル:Kinoshita GPI-anchor Fig2.png|400px|サムネイル|'''図2. 新生GPIアンカー型タンパク質ができるまで''']] | ||
== 生合成 == | == 生合成 == | ||
=== 新生GPIアンカー型タンパク質ができるまで === | === 新生GPIアンカー型タンパク質ができるまで === | ||
GPIアンカー型タンパク質の生合成は[[小胞体]]膜上で前駆体タンパク質とGPIが別々に合成され、小胞体内腔側でGPIがタンパク質に[[翻訳後修飾]]の形で付加される<ref name=Kinoshita2020><pubmed>32156170</pubmed></ref><ref name=Kinoshita2024><pubmed>39129667</pubmed></ref> ('''図2''')。前駆体タンパク質はカルボキシ末端におおよそ30〜40残基からなるGPIアンカー付加シグナル配列を持ち、この配列が特定の部位で切断されることで、新たに露出したC末端にGPIアンカーが付加される。GPIは、[[エタノールアミンリン酸]]を介してタンパク質のカルボキシ末端と[[アミド結合]]する。反応は[[トランスアミデーション]]であり、触媒部位に[[システイン]]を持つ[[ホスファチジルイノシトール糖鎖アンカー生合成クラスKタンパク質|ホスファチジルイノシトール糖鎖アンカー生合成クラスK]]([[phosphatidylinositol glycan anchor biosynthesis class K]], [[PIGK]])タンパク質を含む5つのタンパク質からなる[[GPIトランスアミダーゼ]]([[GPI-TA]]) | GPIアンカー型タンパク質の生合成は[[小胞体]]膜上で前駆体タンパク質とGPIが別々に合成され、小胞体内腔側でGPIがタンパク質に[[翻訳後修飾]]の形で付加される<ref name=Kinoshita2020><pubmed>32156170</pubmed></ref><ref name=Kinoshita2024><pubmed>39129667</pubmed></ref> ('''図2''')。前駆体タンパク質はカルボキシ末端におおよそ30〜40残基からなるGPIアンカー付加シグナル配列を持ち、この配列が特定の部位で切断されることで、新たに露出したC末端にGPIアンカーが付加される。GPIは、[[エタノールアミンリン酸]]を介してタンパク質のカルボキシ末端と[[アミド結合]]する。反応は[[トランスアミデーション]]であり、触媒部位に[[システイン]]を持つ[[ホスファチジルイノシトール糖鎖アンカー生合成クラスKタンパク質|ホスファチジルイノシトール糖鎖アンカー生合成クラスK]]([[phosphatidylinositol glycan anchor biosynthesis class K]], [[PIGK]])タンパク質を含む5つのタンパク質からなる[[GPIトランスアミダーゼ]]([[GPI-TA]])によって行われる。最近、GPIトランスアミダーゼ複合体の構造が[[クライオ電顕]]で解かれ、酵素の構造と反応の詳細がかなり明らかになった<ref name=Xu2023><pubmed>37684232</pubmed></ref>。 | ||
GPI部分はPIに構成成分が順に結合していく10段階の連鎖反応によって合成される。最初の2段階は小胞体膜の細胞質側で行われ、イノシトールの6位に[[UDP-Nアセチルグルコサミン]]([[UDP-GlcNAc]])から[[GlcNAc]]が転移して[[GlcNAc-PI]]ができ、それが[[脱アセチル]]され[[GlcN-PI]]になる。GlcN-PIは内腔側へフリップし、その後の反応はタンパク質への付加まで小胞体内腔側で行われる('''図2''')。まず[[イノシトール]]の2位に[[脂肪酸]](主として[[パルミチン酸]])が付加され[[GlcN-(acyl)PI]]になり、その後3つの[[マンノース]]と3つの[[トランスアミダーゼ]]が順に付加され、[[GPIトランスアミダーゼ]] ([[GPI-TA]])の基質となり得る完成型のGPI前駆体となる。脂肪酸、マンノース、トランスアミダーゼは、それぞれ[[アシル-CoA]]、[[ドリコール-リン酸-マンノース]] ([[Dol-P-Man]])、[[ホスファチジルエタノールアミン]]から供与される。哺乳動物細胞の完成型GPI前駆体の構造は、EtN-P-Man3-(EtN-P-)Man2-(EtN-P-)Man1-GlcN-(acyl)PIであり、3つすべてのマンノースにEtN-Pが付いている。 | |||
GPIの生合成とタンパク質への付加には[[PIGA]]など24個の遺伝子が関わっており、それらは[[phosphatidyl inositol glycan]] ([[PIG]])遺伝子群と総称される<ref name=Miyata1993><pubmed>7680492</pubmed></ref><ref name=Takahashi1996><pubmed>8861954</pubmed></ref>('''図2'''上部)。 | GPIの生合成とタンパク質への付加には[[PIGA]]など24個の遺伝子が関わっており、それらは[[phosphatidyl inositol glycan]] ([[PIG]])遺伝子群と総称される<ref name=Miyata1993><pubmed>7680492</pubmed></ref><ref name=Takahashi1996><pubmed>8861954</pubmed></ref>('''図2'''上部)。 | ||
| 38行目: | 38行目: | ||
GlcNAc-PIの脱アセチル化は[[デアセチラーゼ]]であるPIGLによって、イノシトールのアシル化は[[アシル転移酵素]]であるPIGWによって行われる。3つのマンノースは[[Dol-P-Man-dependent Man転移酵素]]であるPIGM/PIGX複合体、PIGV、PIGBによって、3つのEtN-Pは[[EtN-P転移酵素]]であるPIGN、PIGO/PIGF複合体、PIGG/PIGF複合体によって付加される。 | GlcNAc-PIの脱アセチル化は[[デアセチラーゼ]]であるPIGLによって、イノシトールのアシル化は[[アシル転移酵素]]であるPIGWによって行われる。3つのマンノースは[[Dol-P-Man-dependent Man転移酵素]]であるPIGM/PIGX複合体、PIGV、PIGBによって、3つのEtN-Pは[[EtN-P転移酵素]]であるPIGN、PIGO/PIGF複合体、PIGG/PIGF複合体によって付加される。 | ||
[[ファイル:Kinoshita GPI-anchor Fig3.png|400px|サムネイル|'''図3. GPIアンカー型タンパク質の成熟化''' | [[ファイル:Kinoshita GPI-anchor Fig3.png|400px|サムネイル|'''図3. GPIアンカー型タンパク質の成熟化''']] | ||
=== GPIアンカー型タンパク質の成熟化 === | === GPIアンカー型タンパク質の成熟化 === | ||
GPI-TAの働きでできた新生GPIアンカー型タンパク質のGPIの構造はまだ未成熟であり、その後[[小胞体]]と[[ゴルジ体]]において成熟化反応を受ける<ref name=Kinoshita2020><pubmed>32156170</pubmed></ref> <ref name=Kinoshita2024><pubmed>39129667</pubmed></ref>''' | GPI-TAの働きでできた新生GPIアンカー型タンパク質のGPIの構造はまだ未成熟であり、その後[[小胞体]]と[[ゴルジ体]]において成熟化反応を受ける<ref name=Kinoshita2020><pubmed>32156170</pubmed></ref> <ref name=Kinoshita2024><pubmed>39129667</pubmed></ref>('''図3''')。小胞体では、イノシトールからのアシル基の除去、第2マンノースからのEtN-Pの除去が行われ、その後[[COPII輸送体]]によってゴルジ体へと輸送される。ゴルジ体では、PIのsn-2位に存在する[[不飽和脂肪酸]]が[[飽和脂肪酸]]([[ステアリン酸]])に置き換わる脂肪酸リモデリングによって[[脂質マイクロドメイン]]([[ラフト]])に局在できる脂質構造となる。その後、タンパク質によっては第1マンノースに[[GalNAc]]側鎖が付加、伸長され、最終的に細胞表面に輸送され主として脂質マイクロドメインに局在する。なお、第4マンノースの付加はタンパク質への付加前にPIGZにより小胞体で行われる。GPIの成熟化には7つの遺伝子が関与し、他の糖鎖と共通の遺伝子を除き[[post GPI attachment to proteins|post GPI attachment to proteins (PGAP)遺伝子]]群と呼ばれる<ref name=Tanaka2004><pubmed>14734546</pubmed></ref><ref name=Tashima2006><pubmed>16407401</pubmed></ref>('''図3'''上部)。 | ||
==機能的特徴 == | ==機能的特徴 == | ||
| 58行目: | 57行目: | ||
=== 発作性夜間ヘモグロビン尿症 === | === 発作性夜間ヘモグロビン尿症 === | ||
指定難病62。[[造血幹細胞]]におけるPIGA遺伝子の体細胞突然変異によってGPI生合成が完全あるいは大きく欠損した細胞が生じ<ref name=Miyata1993><pubmed>7680492</pubmed></ref>、その細胞のクローンが拡大することによって大量の異常血液細胞ができる<ref name=Luzzatto2025><pubmed>40089995</pubmed></ref>。異常赤血球は補体の作用から自己細胞を保護するGPIアンカー型の[[補体]]制御因子([[CD55]]と[[CD59]])を欠損するため活性化した補体によって[[溶血]]が起こる<ref name=Hill2017><pubmed>28516949</pubmed></ref>。また補体依存性の[[血栓症]]が本疾患における主要な死因のひとつとなる<ref name=Hill2013><pubmed>23610373</pubmed></ref>。治療には、補体の[[膜侵襲複合体]]形成を阻害する[[ヒト化抗C5抗体医薬]]([[エクリズマブ]]など)が用いられ、溶血の抑制に有効である<ref name=Hillmen2006><pubmed>16990386</pubmed></ref><ref name=Rother2007><pubmed>17989688</pubmed></ref>。 | 指定難病62。[[造血幹細胞]]におけるPIGA遺伝子の体細胞突然変異によってGPI生合成が完全あるいは大きく欠損した細胞が生じ<ref name=Miyata1993><pubmed>7680492</pubmed></ref>、その細胞のクローンが拡大することによって大量の異常血液細胞ができる<ref name=Luzzatto2025><pubmed>40089995</pubmed></ref>。異常赤血球は補体の作用から自己細胞を保護するGPIアンカー型の[[補体]]制御因子([[CD55]]と[[CD59]])を欠損するため活性化した補体によって[[溶血]]が起こる<ref name=Hill2017><pubmed>28516949</pubmed></ref>。また補体依存性の[[血栓症]]が本疾患における主要な死因のひとつとなる<ref name=Hill2013><pubmed>23610373</pubmed></ref>。治療には、補体の[[膜侵襲複合体]]形成を阻害する[[ヒト化抗C5抗体医薬]]([[エクリズマブ]]など)が用いられ、溶血の抑制に有効である<ref name=Hillmen2006><pubmed>16990386</pubmed></ref><ref name=Rother2007><pubmed>17989688</pubmed></ref>。 | ||
== 参考文献 == | == 参考文献 == | ||
2025年7月29日 (火) 09:31時点における版
木下 タロウ
大阪大学 感染症総合教育研究拠点
DOI:10.14931/bsd.11102 原稿受付日:2025年7月3日 原稿完成日:2025年7月4日
担当編集委員:山形 方人(ハーバード大学・脳科学センター)
英:
英: glycosylphosphatidylinositol anchor
英略語:GPI anchor
細胞表面の膜タンパク質の中には、タンパク質自体は膜に挿入されず、カルボキシ末端に結合したグリコシルホスファチジルイノシトールアンカー(GPIアンカー)と呼ばれる糖脂質によって細胞膜に係留されている一群があり、GPIアンカー型タンパク質と呼ばれる。ヒトではアルカリホスファターゼ、ecto-5'-nucleotidase、ネトリンG2など160種余りが知られている。脂質部分はホスファチジルイノシトールであり、グルコサミンと3残基のマンノースからなる糖鎖をはさみ、リン酸エタノールアミンを介してタンパク質のカルボキシ末端にアミド結合している。GPIアンカーが結合しないとタンパク質部分は細胞内で分解されるため、細胞表面でGPIアンカー型タンパク質が欠損する。GPIの生合成には20以上の遺伝子が関与しており、これらの遺伝子の機能低下変異による、知的障害、てんかん、発達遅滞などを伴う先天性GPI欠損症が知られている。また、造血幹細胞における後天性GPI欠損によって起こる発作性夜間ヘモグロビン尿症がある。
GPIアンカーとは
細胞表面の膜タンパク質の中には、タンパク質自体は膜に挿入されず、カルボキシ末端に共有結合したGPIアンカーと呼ばれる糖脂質によって細胞膜に係留されている一群があり、GPIアンカー型タンパク質(GPI-anchored protein, GPI-AP)と呼ばれる。脂質部分はホスファチジルイノシトールであり、それが糖鎖を介してタンパク質に結合し、タンパク質を膜に係留する役目を果たしていることからグリコシルホスファホスファチジルイノシトールアンカー(glycosylphosphatidylinositol anchor, GPI-anchor)と呼ばれる[1][2]。
GPIアンカー型タンパク質は真核生物に広く存在し、トリパノソーマ、マラリア原虫、トキソプラズマなど原生動物には特に多量に存在する。ヒトでは、アルカリホスファターゼ、ecto-5'-nucleotidase (CD73)など細胞表面の様々な加水分解酵素、葉酸受容体などの受容体、コンタクチンなどの接着分子、補体制御因子、プリオンタンパク質など160種以上が知られている[1]。
GPIアンカー型タンパク質は、ホスファチジルイノシトールを切断する細菌由来のホスファチジルイノシトール特異的ホスホリパーゼC(PI-PLC)によって、一部の加水分解酵素が動物細胞表面から遊離する現象の観察などをきっかけに1970年代後半に発見された[3]。1980年代後半には睡眠病トリパノソーマのvariant surface glycoproteinとラット脳のThy-1でGPIアンカーの化学構造が決定され[4][5]、さらにGPI生合成活性が著しく高い睡眠病トリパノソーマの細胞破砕液を用いて生合成経路のあらましがわかった[6]。その後、生合成に働く遺伝子群の解明[7]、後天性および先天性欠損症の発見[8][9]、GPIアンカー型タンパク質の機能的特徴[10]などが明らかにされた。
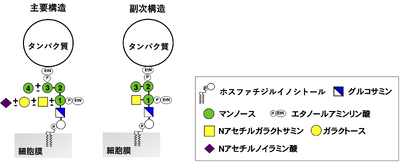
構造
GPIアンカーは、その末端にあるエタノールアミン(EtN)のアミノ基がタンパク質のカルボキシ末端とアミド結合を形成して付加している。GPIアンカーの基本骨格は全ての生物で保存されており、構造は、エタノールアミンリン酸(EtN-P)―マンノース(Man)3残基―グルコサミン(GlcN)―イノシトールリン脂質である[2](図1)。ここで、GlcNはアセチル化されていないことがGPIアンカーの特徴である。これは生合成の過程で付加されたN-アセチルグルコサミン(GlcNAc)が脱アセチル化されてGlcNになることによる(図2のステップ2)。
哺乳動物細胞のGPIではイノシトールリン脂質はホスファチジルイノシトールで、第1マンノースに結合したエタノールアミンリン酸が保存された側鎖として含まれる。さらにタンパク質によって、また細胞種によって第4マンノース側鎖、そして第1マンノースに結合したN-アセチルガラクトサミン(GalNAc)から始まる側鎖を持っている。N-アセチルガラクトサミン鎖は、ガラクトースそしてシアル酸(N-アセチルノイラミン酸など)まで伸長することが知られている。特にプリオンタンパク質では、シアル酸まで伸びたN-アセチルガラクトサミン側鎖を持っており、脳内での増殖や神経細胞変性に関わっていることが知られている[11]。
従来すべてのGPIアンカー型タンパク質はタンパク質がエタノールアミンリン酸を介して第3マンノースに結合していると考えられていたが、最近ecto-5'-nucleotidase (CD73)やnetrinG2など一部のものはエタノールアミンリン酸を介して第2マンノースに結合していることがわかった[12] (図1)。
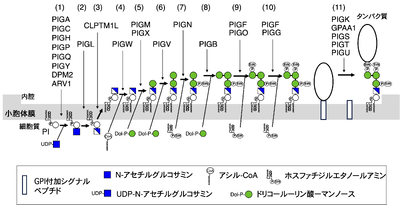
生合成
新生GPIアンカー型タンパク質ができるまで
GPIアンカー型タンパク質の生合成は小胞体膜上で前駆体タンパク質とGPIが別々に合成され、小胞体内腔側でGPIがタンパク質に翻訳後修飾の形で付加される[1][2] (図2)。前駆体タンパク質はカルボキシ末端におおよそ30〜40残基からなるGPIアンカー付加シグナル配列を持ち、この配列が特定の部位で切断されることで、新たに露出したC末端にGPIアンカーが付加される。GPIは、エタノールアミンリン酸を介してタンパク質のカルボキシ末端とアミド結合する。反応はトランスアミデーションであり、触媒部位にシステインを持つホスファチジルイノシトール糖鎖アンカー生合成クラスK(phosphatidylinositol glycan anchor biosynthesis class K, PIGK)タンパク質を含む5つのタンパク質からなるGPIトランスアミダーゼ(GPI-TA)によって行われる。最近、GPIトランスアミダーゼ複合体の構造がクライオ電顕で解かれ、酵素の構造と反応の詳細がかなり明らかになった[13]。
GPI部分はPIに構成成分が順に結合していく10段階の連鎖反応によって合成される。最初の2段階は小胞体膜の細胞質側で行われ、イノシトールの6位にUDP-Nアセチルグルコサミン(UDP-GlcNAc)からGlcNAcが転移してGlcNAc-PIができ、それが脱アセチルされGlcN-PIになる。GlcN-PIは内腔側へフリップし、その後の反応はタンパク質への付加まで小胞体内腔側で行われる(図2)。まずイノシトールの2位に脂肪酸(主としてパルミチン酸)が付加されGlcN-(acyl)PIになり、その後3つのマンノースと3つのトランスアミダーゼが順に付加され、GPIトランスアミダーゼ (GPI-TA)の基質となり得る完成型のGPI前駆体となる。脂肪酸、マンノース、トランスアミダーゼは、それぞれアシル-CoA、ドリコール-リン酸-マンノース (Dol-P-Man)、ホスファチジルエタノールアミンから供与される。哺乳動物細胞の完成型GPI前駆体の構造は、EtN-P-Man3-(EtN-P-)Man2-(EtN-P-)Man1-GlcN-(acyl)PIであり、3つすべてのマンノースにEtN-Pが付いている。
GPIの生合成とタンパク質への付加にはPIGAなど24個の遺伝子が関わっており、それらはphosphatidyl inositol glycan (PIG)遺伝子群と総称される[7][14](図2上部)。
PIにGlcNAcを転移するGPI-GlcNAc転移酵素 (GPI-GnT)は従来7つのタンパク質(PIGA、PIGC、PIGH、PIGQ、PIGP、PIGY、DPM2)の複合体である考えられていたが[15][16]、最近脂質の制御に関わることが知られていたARV1タンパク質が8つ目のサブユニットであることがわかってきた[17]。GPI生合成の開始反応が極めて大きな酵素複合体によって担われていることは、生合成経路が精緻に制御されているであろうことをうかがわせるが、PIGAが触媒成分であること以外それぞれのサブユニットの機能の詳細は未だ不明である。
GlcNAc-PIの脱アセチル化はデアセチラーゼであるPIGLによって、イノシトールのアシル化はアシル転移酵素であるPIGWによって行われる。3つのマンノースはDol-P-Man-dependent Man転移酵素であるPIGM/PIGX複合体、PIGV、PIGBによって、3つのEtN-PはEtN-P転移酵素であるPIGN、PIGO/PIGF複合体、PIGG/PIGF複合体によって付加される。
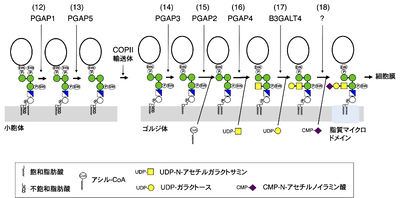
GPIアンカー型タンパク質の成熟化
GPI-TAの働きでできた新生GPIアンカー型タンパク質のGPIの構造はまだ未成熟であり、その後小胞体とゴルジ体において成熟化反応を受ける[1] [2](図3)。小胞体では、イノシトールからのアシル基の除去、第2マンノースからのEtN-Pの除去が行われ、その後COPII輸送体によってゴルジ体へと輸送される。ゴルジ体では、PIのsn-2位に存在する不飽和脂肪酸が飽和脂肪酸(ステアリン酸)に置き換わる脂肪酸リモデリングによって脂質マイクロドメイン(ラフト)に局在できる脂質構造となる。その後、タンパク質によっては第1マンノースにGalNAc側鎖が付加、伸長され、最終的に細胞表面に輸送され主として脂質マイクロドメインに局在する。なお、第4マンノースの付加はタンパク質への付加前にPIGZにより小胞体で行われる。GPIの成熟化には7つの遺伝子が関与し、他の糖鎖と共通の遺伝子を除きpost GPI attachment to proteins (PGAP)遺伝子群と呼ばれる[18][19](図3上部)。
機能的特徴
GPIアンカー型タンパク質はGPIによって機能的な特徴を有する。
- 脂質マイクロドメインへの局在
細胞膜の脂質マイクロドメインは、スフィンゴ糖脂質とコレステロールに富んだ直径数十ナノメートルのダイナミックなドメインで、シグナル伝達に関わる受容体やキナーゼを含む。GPIアンカー型タンパク質は通常2本の脂肪鎖が飽和鎖であり、脂質マイクロドメインに局在しやすい[20]。多くのGPIアンカー型タンパク質は脂質マイクロドメイン内で機能していると考えられる。 - 極性細胞における頂端側への選択的局在
上皮細胞のように細胞膜が頂端側と基底膜側に別れている場合、多くのGPIアンカー型タンパク質は頂端側に局在している。これは、GPIアンカーがゴルジ体から頂端側細胞膜への輸送シグナルとして機能していることによる[21]。 - GPI切断による細胞表面からの遊離
特定のGPIアンカー型タンパク質のアンカー部分を切断し、細胞表面から遊離させる酵素(GPIase)がいくつか知られている。遊離後別の場所で作用するGPIアンカー型タンパク質や、また他のタンパク質の活性を抑制していたGPIアンカー型タンパク質が切断・遊離されることによって、その抑制が解除され活性が発現する例も知られている[22][23][24]。 - GPIアンカー型受容体のトランスサイトーシス
いくつかのGPI-アンカー型受容体は、細胞の一方の膜からリガンドを取り込み、別の膜から放出するトランスサイトーシスを行うことが知られている。葉酸のGPI-アンカー型受容体である葉酸受容体1 (folate receptor 1)は、5メチルテトラヒドロ葉酸(5MHF)をトランスサイトーシスによって脈絡叢の上皮細胞の血管側から脳脊髄液側へ輸送する[25]。また、リポプロテインリパーゼのGPIアンカー型受容体であるGPI HBP1は、毛細血管内皮細胞の基底膜側でリポプロテインリパーゼを結合し、トランスサイトーシスによって頂端側へ輸送する[26]。
欠損症
GPI生合成が完全に欠損すると胚性致死になる。部分欠損によって起こる2つの疾患が知られている。ひとつは生合成遺伝子の先天性変異によって生合成が低下すること、あるいは構造が異常なGPIアンカーとなることによって起こる先天性GPI欠損症である。もうひとつは、後天性GPI欠損症として発作性夜間ヘモグロビン尿症(paroxysmal nocturnal hemoglobinuria、PNH)がある。
先天性グリコシルホスファチジルイノシトール欠損症
指定難病320。2006年にPIGM遺伝子変異による家系が発見されて以来、現在ではGPIアンカーの生合成、タンパク質への付加、あるいは成熟化に関わる遺伝子群のうち24遺伝子の変異による先天性GPI欠損症が報告されている[8]。GPI生合成量の低下により様々なGPIアンカー型タンパク質の発現レベルが低下する。なかでも血液中の顆粒球に発現するGPIアンカー型タンパク質であるCD16の発現低下は診断における簡便な指標となる。主たる症状は、てんかん、知的障害、発達の遅れ、筋緊張低下、視力低下、難聴など中枢神経の異常によるもので、神経細胞におけるGPIアンカー型タンパク質の重要性が示唆される。変異によるGPI生合成の低下が強い場合には心臓、腎臓、骨、皮膚などにも異常が現れる。PIGOやPIGAの変異モデルマウスではアデノ随伴ウイルスAAV9ベクターによる遺伝子治療が効果を示し、臨床応用に向けた開発が進行している[27][28]。
発作性夜間ヘモグロビン尿症
指定難病62。造血幹細胞におけるPIGA遺伝子の体細胞突然変異によってGPI生合成が完全あるいは大きく欠損した細胞が生じ[7]、その細胞のクローンが拡大することによって大量の異常血液細胞ができる[29]。異常赤血球は補体の作用から自己細胞を保護するGPIアンカー型の補体制御因子(CD55とCD59)を欠損するため活性化した補体によって溶血が起こる[30]。また補体依存性の血栓症が本疾患における主要な死因のひとつとなる[31]。治療には、補体の膜侵襲複合体形成を阻害するヒト化抗C5抗体医薬(エクリズマブなど)が用いられ、溶血の抑制に有効である[32][33]。
参考文献
- ↑ 1.0 1.1 1.2 1.3
Kinoshita, T. (2020).
Biosynthesis and biology of mammalian GPI-anchored proteins. Open biology, 10(3), 190290. [PubMed:32156170] [PMC] [WorldCat] [DOI] - ↑ 2.0 2.1 2.2 2.3
Kinoshita, T. (2024).
Towards a thorough understanding of mammalian glycosylphosphatidylinositol-anchored protein biosynthesis. Glycobiology, 34(11). [PubMed:39129667] [WorldCat] [DOI] - ↑
Ikezawa, H. (2002).
Glycosylphosphatidylinositol (GPI)-anchored proteins. Biological & pharmaceutical bulletin, 25(4), 409-17. [PubMed:11995915] [WorldCat] [DOI] - ↑
Ferguson, M.A., Homans, S.W., Dwek, R.A., & Rademacher, T.W. (1988).
Glycosyl-phosphatidylinositol moiety that anchors Trypanosoma brucei variant surface glycoprotein to the membrane. Science (New York, N.Y.), 239(4841 Pt 1), 753-9. [PubMed:3340856] [WorldCat] [DOI] - ↑
Homans, S.W., Ferguson, M.A., Dwek, R.A., Rademacher, T.W., Anand, R., & Williams, A.F. (1988).
Complete structure of the glycosyl phosphatidylinositol membrane anchor of rat brain Thy-1 glycoprotein. Nature, 333(6170), 269-72. [PubMed:2897081] [WorldCat] [DOI] - ↑
Masterson, W.J., Doering, T.L., Hart, G.W., & Englund, P.T. (1989).
A novel pathway for glycan assembly: biosynthesis of the glycosyl-phosphatidylinositol anchor of the trypanosome variant surface glycoprotein. Cell, 56(5), 793-800. [PubMed:2924349] [WorldCat] [DOI] - ↑ 7.0 7.1 7.2
Miyata, T., Takeda, J., Iida, Y., Yamada, N., Inoue, N., Takahashi, M., ..., & Kinoshita, T. (1993).
The cloning of PIG-A, a component in the early step of GPI-anchor biosynthesis. Science (New York, N.Y.), 259(5099), 1318-20. [PubMed:7680492] [WorldCat] [DOI] - ↑ 8.0 8.1
Almeida, A.M., Murakami, Y., Layton, D.M., Hillmen, P., Sellick, G.S., Maeda, Y., ..., & Karadimitris, A. (2006).
Hypomorphic promoter mutation in PIGM causes inherited glycosylphosphatidylinositol deficiency. Nature medicine, 12(7), 846-51. [PubMed:16767100] [WorldCat] [DOI] - ↑
Takeda, J., Miyata, T., Kawagoe, K., Iida, Y., Endo, Y., Fujita, T., ..., & Kinoshita, T. (1993).
Deficiency of the GPI anchor caused by a somatic mutation of the PIG-A gene in paroxysmal nocturnal hemoglobinuria. Cell, 73(4), 703-11. [PubMed:8500164] [WorldCat] [DOI] - ↑
Brown, D.A., & Rose, J.K. (1992).
Sorting of GPI-anchored proteins to glycolipid-enriched membrane subdomains during transport to the apical cell surface. Cell, 68(3), 533-44. [PubMed:1531449] [WorldCat] [DOI] - ↑
Hirata, T., Kobayashi, A., Furuse, T., Yamada, I., Tamura, M., Tomita, H., ..., & Kinoshita, T. (2022).
Loss of the N-acetylgalactosamine side chain of the GPI-anchor impairs bone formation and brain functions and accelerates the prion disease pathology. The Journal of biological chemistry, 298(3), 101720. [PubMed:35151686] [PMC] [WorldCat] [DOI] - ↑
Ishida, M., Maki, Y., Ninomiya, A., Takada, Y., Campeau, P., Kinoshita, T., & Murakami, Y. (2022).
Ethanolamine-phosphate on the second mannose is a preferential bridge for some GPI-anchored proteins. EMBO reports, 23(7), e54352. [PubMed:35603428] [PMC] [WorldCat] [DOI] - ↑
Xu, Y., Li, T., Zhou, Z., Hong, J., Chao, Y., Zhu, Z., ..., & Li, D. (2023).
Structures of liganded glycosylphosphatidylinositol transamidase illuminate GPI-AP biogenesis. Nature communications, 14(1), 5520. [PubMed:37684232] [PMC] [WorldCat] [DOI] - ↑
Takahashi, M., Inoue, N., Ohishi, K., Maeda, Y., Nakamura, N., Endo, Y., ..., & Kinoshita, T. (1996).
PIG-B, a membrane protein of the endoplasmic reticulum with a large lumenal domain, is involved in transferring the third mannose of the GPI anchor. The EMBO journal, 15(16), 4254-61. [PubMed:8861954] [PMC] [WorldCat] - ↑
Murakami, Y., Siripanyaphinyo, U., Hong, Y., Tashima, Y., Maeda, Y., & Kinoshita, T. (2005).
The initial enzyme for glycosylphosphatidylinositol biosynthesis requires PIG-Y, a seventh component. Molecular biology of the cell, 16(11), 5236-46. [PubMed:16162815] [PMC] [WorldCat] [DOI] - ↑
Watanabe, R., Murakami, Y., Marmor, M.D., Inoue, N., Maeda, Y., Hino, J., ..., & Kinoshita, T. (2000).
Initial enzyme for glycosylphosphatidylinositol biosynthesis requires PIG-P and is regulated by DPM2. The EMBO journal, 19(16), 4402-11. [PubMed:10944123] [PMC] [WorldCat] [DOI] - ↑
Lu, T., Umeshita, S., Imanishi, K., Wang, Y., Liu, Y.S., Nagae, M., ..., & Murakami, Y. (2025).
ARV1 is a component of the enzyme initiating glycosylphosphatidylinositol biosynthesis. The Journal of biological chemistry, 301(6), 110236. [PubMed:40378954] [PMC] [WorldCat] [DOI] - ↑
Tanaka, S., Maeda, Y., Tashima, Y., & Kinoshita, T. (2004).
Inositol deacylation of glycosylphosphatidylinositol-anchored proteins is mediated by mammalian PGAP1 and yeast Bst1p. The Journal of biological chemistry, 279(14), 14256-63. [PubMed:14734546] [WorldCat] [DOI] - ↑
Tashima, Y., Taguchi, R., Murata, C., Ashida, H., Kinoshita, T., & Maeda, Y. (2006).
PGAP2 is essential for correct processing and stable expression of GPI-anchored proteins. Molecular biology of the cell, 17(3), 1410-20. [PubMed:16407401] [PMC] [WorldCat] [DOI] - ↑
Maeda, Y., Tashima, Y., Houjou, T., Fujita, M., Yoko-o, T., Jigami, Y., ..., & Kinoshita, T. (2007).
Fatty acid remodeling of GPI-anchored proteins is required for their raft association. Molecular biology of the cell, 18(4), 1497-506. [PubMed:17314402] [PMC] [WorldCat] [DOI] - ↑
Zurzolo, C., & Simons, K. (2016).
Glycosylphosphatidylinositol-anchored proteins: Membrane organization and transport. Biochimica et biophysica acta, 1858(4), 632-9. [PubMed:26706096] [WorldCat] [DOI] - ↑
Kondoh, G., Tojo, H., Nakatani, Y., Komazawa, N., Murata, C., Yamagata, K., ..., & Takeda, J. (2005).
Angiotensin-converting enzyme is a GPI-anchored protein releasing factor crucial for fertilization. Nature medicine, 11(2), 160-6. [PubMed:15665832] [PMC] [WorldCat] [DOI] - ↑
Lee, G.H., Fujita, M., Takaoka, K., Murakami, Y., Fujihara, Y., Kanzawa, N., ..., & Kinoshita, T. (2016).
A GPI processing phospholipase A2, PGAP6, modulates Nodal signaling in embryos by shedding CRIPTO. The Journal of cell biology, 215(5), 705-718. [PubMed:27881714] [PMC] [WorldCat] [DOI] - ↑
Park, S., Lee, C., Sabharwal, P., Zhang, M., Meyers, C.L., & Sockanathan, S. (2013).
GDE2 promotes neurogenesis by glycosylphosphatidylinositol-anchor cleavage of RECK. Science (New York, N.Y.), 339(6117), 324-8. [PubMed:23329048] [PMC] [WorldCat] [DOI] - ↑
Grapp, M., Wrede, A., Schweizer, M., Hüwel, S., Galla, H.J., Snaidero, N., ..., & Steinfeld, R. (2013).
Choroid plexus transcytosis and exosome shuttling deliver folate into brain parenchyma. Nature communications, 4, 2123. [PubMed:23828504] [WorldCat] [DOI] - ↑
Davies, B.S., Beigneux, A.P., Barnes, R.H., Tu, Y., Gin, P., Weinstein, M.M., ..., & Fong, L.G. (2010).
GPIHBP1 is responsible for the entry of lipoprotein lipase into capillaries. Cell metabolism, 12(1), 42-52. [PubMed:20620994] [PMC] [WorldCat] [DOI] - ↑
Kuwayama, R., Suzuki, K., Nakamura, J., Aizawa, E., Yoshioka, Y., Ikawa, M., ..., & Murakami, Y. (2022).
Establishment of mouse model of inherited PIGO deficiency and therapeutic potential of AAV-based gene therapy. Nature communications, 13(1), 3107. [PubMed:35661110] [PMC] [WorldCat] [DOI] - ↑
Murakami, Y., Umeshita, S., Imanishi, K., Yoshioka, Y., Ninomiya, A., Sunabori, T., ..., & Kinoshita, T. (2024).
AAV-based gene therapy ameliorated CNS-specific GPI defect in mouse models. Molecular therapy. Methods & clinical development, 32(1), 101176. [PubMed:38225934] [PMC] [WorldCat] [DOI] - ↑
Luzzatto, L., & Nakao, S. (2025).
Pathogenesis of paroxysmal nocturnal hemoglobinuria. Blood, 145(26), 3077-3088. [PubMed:40089995] [WorldCat] [DOI] - ↑
Hill, A., DeZern, A.E., Kinoshita, T., & Brodsky, R.A. (2017).
Paroxysmal nocturnal haemoglobinuria. Nature reviews. Disease primers, 3, 17028. [PubMed:28516949] [PMC] [WorldCat] [DOI] - ↑
Hill, A., Kelly, R.J., & Hillmen, P. (2013).
Thrombosis in paroxysmal nocturnal hemoglobinuria. Blood, 121(25), 4985-96; quiz 5105. [PubMed:23610373] [WorldCat] [DOI] - ↑
Hillmen, P., Young, N.S., Schubert, J., Brodsky, R.A., Socié, G., Muus, P., ..., & Luzzatto, L. (2006).
The complement inhibitor eculizumab in paroxysmal nocturnal hemoglobinuria. The New England journal of medicine, 355(12), 1233-43. [PubMed:16990386] [WorldCat] [DOI] - ↑
Rother, R.P., Rollins, S.A., Mojcik, C.F., Brodsky, R.A., & Bell, L. (2007).
Discovery and development of the complement inhibitor eculizumab for the treatment of paroxysmal nocturnal hemoglobinuria. Nature biotechnology, 25(11), 1256-64. [PubMed:17989688] [WorldCat] [DOI]