「ERMタンパク質」の版間の差分
細編集の要約なし |
細 →脳、神経系組織 |
||
| (同じ利用者による、間の5版が非表示) | |||
| 40行目: | 40行目: | ||
|- | |- | ||
| rowspan="6" | in vivo (成体) | | rowspan="6" | in vivo (成体) | ||
| アストロサイト || エズリン, ラディキシン, マーリン || <ref name= | | アストロサイト || エズリン, ラディキシン, マーリン || <ref name=Derouiche2001><pubmed>11746770</pubmed></ref><ref name=Toledo2018><pubmed>29715273</pubmed></ref> | ||
|- | |- | ||
| ミクログリア || ラディキシン, モエシン || <ref name= | | ミクログリア || ラディキシン, モエシン || <ref name=Persson2013a><pubmed>23440885</pubmed></ref><ref name=Johnson2002><pubmed>12111362</pubmed></ref> | ||
|- | |- | ||
| オリゴデンドロサイト || マーリン || <ref name= | | オリゴデンドロサイト || マーリン ||<ref name=Toledo2018><pubmed>29715273</pubmed></ref> | ||
|- | |- | ||
| 神経細胞 || マーリン || <ref name= | | 神経細胞 || マーリン || <ref name=Gronholm2003><pubmed>12896975</pubmed></ref> | ||
|- | |- | ||
| 上衣細胞 || エズリン || <ref name= | | 上衣細胞 || エズリン || <ref name=Derouiche2001><pubmed>11746770</pubmed></ref> | ||
|- | |- | ||
| 血管内皮細胞 || モエシン || <ref name= | | 血管内皮細胞 || モエシン || <ref name=Johnson2002><pubmed>12111362</pubmed></ref> | ||
|- | |- | ||
| rowspan="3" | in vivo (分化過程) | | rowspan="3" | in vivo (分化過程) | ||
| 神経芽細胞 (吻側移動経路) || ラディキシン || <ref name= | | 神経芽細胞 (吻側移動経路) || ラディキシン || <ref name=Persson2010><pubmed>20109539</pubmed></ref><ref name=Persson2013b><pubmed>24065889</pubmed></ref> | ||
|- | |- | ||
| オリゴデンドロサイト前駆細胞 (吻側移動経路) || ラディキシン || <ref name= | | オリゴデンドロサイト前駆細胞 (吻側移動経路) || ラディキシン || <ref name=Persson2010><pubmed>20109539</pubmed></ref> | ||
|- | |- | ||
| アストロサイト || エズリン || <ref name= | | アストロサイト || エズリン || <ref name=Cleary2006><pubmed>16996217</pubmed></ref> | ||
|- | |- | ||
| in vitro||海馬錐体初代培養神経細胞 || エズリン, ラディキシン, モエシン || <ref name= | | in vitro||海馬錐体初代培養神経細胞 || エズリン, ラディキシン, モエシン || <ref name=Paglini1998><pubmed>9786954</pubmed></ref> | ||
|} | |} | ||
===その他の組織=== | ===その他の組織=== | ||
エズリンは、[[胃]]の[[壁細胞]]の[[管腔側膜]]や、[[小腸]]、[[大腸]]の刷子縁膜で高発現しており、[[腎臓]]の[[近位尿細管]]の刷子縁膜や[[糸球体]]、[[肺]]や[[気管支]]などの[[呼吸上皮]]にも発現する<ref name=Bretscher1983 /><ref name=Hanzel1991><pubmed>1831124</pubmed></ref><ref name=Yoshida2016><pubmed>27108882</pubmed></ref><ref name=Hugo1998><pubmed>9853258</pubmed></ref><ref name=Hatano2013><pubmed>22895514</pubmed></ref><ref name=Laoukili2001><pubmed>11748265</pubmed></ref>。 | エズリンは、[[胃]]の[[壁細胞]]の[[管腔側膜]]や、[[小腸]]、[[大腸]]の刷子縁膜で高発現しており、[[腎臓]]の[[近位尿細管]]の刷子縁膜や[[糸球体]]、[[肺]]や[[気管支]]などの[[呼吸上皮]]にも発現する<ref name=Bretscher1983 /><ref name=Hanzel1991><pubmed>1831124</pubmed></ref><ref name=Yoshida2016><pubmed>27108882</pubmed></ref><ref name=Hugo1998><pubmed>9853258</pubmed></ref><ref name=Hatano2013><pubmed>22895514</pubmed></ref><ref name=Laoukili2001><pubmed>11748265</pubmed></ref>。 | ||
| 80行目: | 81行目: | ||
[[膜輸送体]]とも直接に結合し、アクチン細胞骨格との相互作用を介して、頂端膜で安定に発現させる。たとえば、エズリンは、FERM ドメインで[[Na+/H+交換輸送体1|Na<sup>+</sup>/H<sup>+</sup>交換輸送体1]] ([[NHE1]]) のC末端の細胞質領域と結合する<ref name=Denker2000><pubmed>11163215</pubmed></ref>。また、がんにおける[[多剤耐性]]機構に重要な因子となる[[P糖タンパク質]] ([[P-gp]]) とも同様に結合し、P-gpの細胞膜発現と基質輸送能を高める<ref name=Luciani2002><pubmed>11781249</pubmed></ref>。ラディキシンは、[[multi-drug resistance protein 2]] ([[MRP2]])のC末端の細胞質ドメインに直接結合し、[[胆管]]への[[抱合型ビリルビン]]の分泌に関与する<ref name=Kikuchi2002><pubmed>12068294</pubmed></ref>。 モエシンは、FERMドメインで、[[Na+/K+/2Cl-共輸送体2|Na<sup>+</sup>/K<sup>+</sup>/2Cl<sup>-</sup>共輸送体2]] ([[NKCC2]]) のC末端領域と結合することで、NKCC2を頂端膜で安定に発現させる<ref name=Carmosino2012><pubmed>22708623</pubmed></ref>。 | [[膜輸送体]]とも直接に結合し、アクチン細胞骨格との相互作用を介して、頂端膜で安定に発現させる。たとえば、エズリンは、FERM ドメインで[[Na+/H+交換輸送体1|Na<sup>+</sup>/H<sup>+</sup>交換輸送体1]] ([[NHE1]]) のC末端の細胞質領域と結合する<ref name=Denker2000><pubmed>11163215</pubmed></ref>。また、がんにおける[[多剤耐性]]機構に重要な因子となる[[P糖タンパク質]] ([[P-gp]]) とも同様に結合し、P-gpの細胞膜発現と基質輸送能を高める<ref name=Luciani2002><pubmed>11781249</pubmed></ref>。ラディキシンは、[[multi-drug resistance protein 2]] ([[MRP2]])のC末端の細胞質ドメインに直接結合し、[[胆管]]への[[抱合型ビリルビン]]の分泌に関与する<ref name=Kikuchi2002><pubmed>12068294</pubmed></ref>。 モエシンは、FERMドメインで、[[Na+/K+/2Cl-共輸送体2|Na<sup>+</sup>/K<sup>+</sup>/2Cl<sup>-</sup>共輸送体2]] ([[NKCC2]]) のC末端領域と結合することで、NKCC2を頂端膜で安定に発現させる<ref name=Carmosino2012><pubmed>22708623</pubmed></ref>。 | ||
また、エズリンは、足場タンパク質を介して膜輸送体や受容体と間接的に複合体を形成する。足場タンパク質である[[Na+/H+交換輸送体制御因子1|Na<sup>+</sup>/H<sup>+</sup>交換輸送体制御因子1]] ([[NHERF1]]) および2は、2つの[[PDZドメイン|PDZ]] ([[PSD-95]]、[[Discs-large]]、[[ZO-1]]) ドメインをもつ一方、C末端でERMタンパク質のFERMドメインに結合する<ref name=Reczek1997 ./><ref name=Takeda2003 /> | また、エズリンは、足場タンパク質を介して膜輸送体や受容体と間接的に複合体を形成する。足場タンパク質である[[Na+/H+交換輸送体制御因子1|Na<sup>+</sup>/H<sup>+</sup>交換輸送体制御因子1]] ([[NHERF1]]) および2は、2つの[[PDZドメイン|PDZ]] ([[PSD-95]]、[[Discs-large]]、[[ZO-1]]) ドメインをもつ一方、C末端でERMタンパク質のFERMドメインに結合する<ref name=Reczek1997 ./><ref name=Takeda2003 />。NHERF1のPDZドメインは、[[クロライドチャネル]]である[[嚢胞性線維症膜コンダクタンス制御因子]] ([[CFTR]])、[[Na+/H+交換輸送体3|Na<sup>+</sup>/H<sup>+</sup>交換輸送体3]] ([[NHE3]]) 、[[Na+/リン酸共輸送体2a|Na<sup>+</sup>/リン酸共輸送体2a]] ([[Npt2a]])、[[グルタミン酸輸送体]][[GLAST]]などの膜輸送体のほか、[[β2アドレナリン受容体|β<sub>2</sub>アドレナリン受容体]]([[β2AR|β<sub>2</sub>AR]])のC末端に存在するPDZ結合モチーフと結合する。その結果、膜輸送体や受容体がアクチン細胞骨格に結合して細胞膜で安定に発現する<ref name=Hatano2013 /><ref name=Short1998><pubmed>9677412</pubmed></ref><ref name=Lamprecht1998><pubmed>9792717</pubmed></ref><ref name=Lee2007><pubmed>17048262</pubmed></ref><ref name=Kawaguchi2022b><pubmed>35132996</pubmed></ref>('''図2''')。 | ||
[[ファイル:Asano ERM proteins Fig3.png|サムネイル|'''図3. ERMタンパク質によるRhoファミリー低分子量Gタンパク質活性の制御'''<br>GTP結合型のRhoファミリー低分子量Gタンパク質は活性型であり、下流のエフェクターと相互作用する。GDP結合型のRhoファミリー低分子量Gタンパク質は不活性型であり、下流のエフェクターとの親和性が大幅に低下している。Rho-GEFは、結合したGDPからGTPへの交換を誘導し、Rhoファミリー低分子量Gタンパク質を活性化する。Rho-GDIは、不活性型のGDP結合型Rhoファミリー低分子量Gタンパク質と結合し、安定化させることで活性型への変換を妨げる。ERMタンパク質はRho-GEFとFERMドメインで結合し、Rhoファミリー低分子量Gタンパク質においてGDPからGTPへの交換を促進することで活性化する (図中(a))。また、Rho-GDIともFERMドメインで結合し、Rhoファミリー低分子量Gタンパク質からのRho-GDIの解離を促進することで活性化する (図中(b))。]] | [[ファイル:Asano ERM proteins Fig3.png|サムネイル|'''図3. ERMタンパク質によるRhoファミリー低分子量Gタンパク質活性の制御'''<br>GTP結合型のRhoファミリー低分子量Gタンパク質は活性型であり、下流のエフェクターと相互作用する。GDP結合型のRhoファミリー低分子量Gタンパク質は不活性型であり、下流のエフェクターとの親和性が大幅に低下している。Rho-GEFは、結合したGDPからGTPへの交換を誘導し、Rhoファミリー低分子量Gタンパク質を活性化する。Rho-GDIは、不活性型のGDP結合型Rhoファミリー低分子量Gタンパク質と結合し、安定化させることで活性型への変換を妨げる。ERMタンパク質はRho-GEFとFERMドメインで結合し、Rhoファミリー低分子量Gタンパク質においてGDPからGTPへの交換を促進することで活性化する (図中(a))。また、Rho-GDIともFERMドメインで結合し、Rhoファミリー低分子量Gタンパク質からのRho-GDIの解離を促進することで活性化する (図中(b))。]] | ||
=== ADPリボシル化因子ファミリーGTPaseの調節 === | === ADPリボシル化因子ファミリーGTPaseの調節 === | ||
エズリンは[[胃壁細胞]]の管腔側膜に発現する。胃壁細胞を[[ヒスタミン]]処理すると、[[ | エズリンは[[胃壁細胞]]の管腔側膜に発現する。胃壁細胞を[[ヒスタミン]]処理すると、[[cAMP依存性タンパク質リン酸化酵素]] ([[PKA]]) によってエズリンのN末端側のSer66がリン酸化を受ける。この際にエズリンは[[ADPリボシル化因子6]] ([[ADP ribosylation factor-6]], [[ARF6]]) GTPaseおよび[[ARF GTPase活性化タンパク質]]である[[ACAP4]]と結合し、胃酸分泌細胞内の[[プロトンポンプ]]を含む細管小胞と管腔側膜との融合を促して酸分泌を開始する<ref name=Ding2010><pubmed>20360010</pubmed></ref>。実際にエズリンを[[ノックダウン]]した[[マウス]]では、細管小胞と管腔側膜との融合はおこらず、胃酸の分泌が傷害される<ref name=Tamura2005><pubmed>15809309</pubmed></ref>。 | ||
=== Rhoファミリー低分子量Gタンパク質の調節 === | === Rhoファミリー低分子量Gタンパク質の調節 === | ||
| 119行目: | 120行目: | ||
ラディキシンは神経細胞の[[成長円錐]]の形成において重要な役割を担う。たとえばニワトリの神経培養細胞の培地から[[神経成長因子]] (NGF)を除くと、成長円錐の急速な崩壊と同時にラディキシンの発現は大幅に低下する。一方、神経成長因子を再添加すると成長円錐が再形成されると同時にラディキシンの成長円錐での再局在化が引き起こされる<ref name=GonzalezAgosti1996><pubmed>8769724</pubmed></ref>。 | ラディキシンは神経細胞の[[成長円錐]]の形成において重要な役割を担う。たとえばニワトリの神経培養細胞の培地から[[神経成長因子]] (NGF)を除くと、成長円錐の急速な崩壊と同時にラディキシンの発現は大幅に低下する。一方、神経成長因子を再添加すると成長円錐が再形成されると同時にラディキシンの成長円錐での再局在化が引き起こされる<ref name=GonzalezAgosti1996><pubmed>8769724</pubmed></ref>。 | ||
また、海馬神経細胞の初代培養における[[アンチセンスオリゴヌクレオチド]]を用いたERMファミリーの発現抑制実験では、ラディキシンとモエシンを二重発現抑制すると、成長円錐の劇的な減少や放射状条線の消失、糸状仮足数の減少および長さの増加など、成長円錐の形成異常が認められる。他方、エズリンとラディキシン、エズリンとモエシンを二重発現抑制しても、成長円錐の形態や大きさや糸状仮足の数、細胞骨格に変化は見られない<ref name=Paglini1998 /> | また、海馬神経細胞の初代培養における[[アンチセンスオリゴヌクレオチド]]を用いたERMファミリーの発現抑制実験では、ラディキシンとモエシンを二重発現抑制すると、成長円錐の劇的な減少や放射状条線の消失、糸状仮足数の減少および長さの増加など、成長円錐の形成異常が認められる。他方、エズリンとラディキシン、エズリンとモエシンを二重発現抑制しても、成長円錐の形態や大きさや糸状仮足の数、細胞骨格に変化は見られない<ref name=Paglini1998 />。タイムラプス[[Video Enhanced Contrast-微分干渉顕微鏡]] ([[VEC-DIC顕微鏡]])で成長円錐の拡大を解析すると、ラディキシンとモエシンを二重発現抑制すると、軸索伸長速度の劇的な遅延が見られ、成長円錐の拡大が傷害される<ref name=Paglini1998 />。 | ||
また、神経軸索の誘因/反発因子として働く分泌性タンパク質Netrin-1は、受容体である[[deleted in colorectal cancer]] ([[DCC]]) に結合して、[[cAMP依存性タンパク質リン酸化酵素]] ([[cAMP-dependent protein kinase]], [[protein kinase A]], [[PKA]])依存的に神経細胞発達に関与する。PKAの足場となるAキナーゼアンカータンパク質 (AKAP)機能を欠損したラディキシン、エズリンとモエシンの変異体を導入すると、成長円錐において特徴的なラメラ構造やラメリポディアが消失する。これにラディキシンを発現させると成長円錐の形態を回復させる<ref name=Deming2015><pubmed>25575591</pubmed></ref>('''図4''')。 | また、神経軸索の誘因/反発因子として働く分泌性タンパク質Netrin-1は、受容体である[[deleted in colorectal cancer]] ([[DCC]]) に結合して、[[cAMP依存性タンパク質リン酸化酵素]] ([[cAMP-dependent protein kinase]], [[protein kinase A]], [[PKA]])依存的に神経細胞発達に関与する。PKAの足場となるAキナーゼアンカータンパク質 (AKAP)機能を欠損したラディキシン、エズリンとモエシンの変異体を導入すると、成長円錐において特徴的なラメラ構造やラメリポディアが消失する。これにラディキシンを発現させると成長円錐の形態を回復させる<ref name=Deming2015><pubmed>25575591</pubmed></ref>('''図4''')。 | ||
| 126行目: | 127行目: | ||
エズリンは[[ネトリン-1]]依存的にDCCと結合し、自らがRhoキナーゼによってリン酸化を受けて、軸索の伸長を活性化する ('''図4''')。初代培養神経細胞においてエズリンの機能を欠損させると、突起伸長は阻害を受ける<ref name=AntoineBertrand2011><pubmed>21849478</pubmed></ref>。 | エズリンは[[ネトリン-1]]依存的にDCCと結合し、自らがRhoキナーゼによってリン酸化を受けて、軸索の伸長を活性化する ('''図4''')。初代培養神経細胞においてエズリンの機能を欠損させると、突起伸長は阻害を受ける<ref name=AntoineBertrand2011><pubmed>21849478</pubmed></ref>。 | ||
また、エズリンの発現が野生型マウスの5%以下まで抑制されたノックダウンマウス ( | また、エズリンの発現が野生型マウスの5%以下まで抑制されたノックダウンマウス (Vil2<sup>kd/kd</sup> マウス) 胚由来の初代培養神経細胞では、野生型マウスと比較して神経突起の形成障害が見られる。Vil2<sup>kd/kd</sup> マウス神経細胞では、RhoA活性の上昇およびミオシン軽鎖2 (MLC2)のリン酸化が認められ、[[ミオシンII]]や[[Rho関連コイルドコイル含有キナーゼ]]を阻害すると神経細胞の神経突起形成が回復する<ref name=Matsumoto2014><pubmed>25144196</pubmed></ref>。 | ||
=== アストロサイトPAP構造とグルタミン酸輸送 === | === アストロサイトPAP構造とグルタミン酸輸送 === | ||
| 148行目: | 149行目: | ||
エズリンはがん細胞の浸潤や転移に関連し、一方、マーリンは腫瘍増殖抑制に関わる。 | エズリンはがん細胞の浸潤や転移に関連し、一方、マーリンは腫瘍増殖抑制に関わる。 | ||
==== エズリンと癌 ==== | ==== エズリンと癌 ==== | ||
一般にエズリンの発現が高い程、予後が悪く生存率は低下する。その原因の一つとしてがんの転移能が上昇することがある。エズリンが転移に関わるメカニズムの例として、CD44とアクチン細胞骨格とのクロスリンクや、EGF/EGFRを介した上皮間葉転換が挙げられる。CD44v6 (変異型エクソンv6配列を含むCD44アイソフォーム) はHGF/c-Metの共受容体としてエズリンと結合し、アクチン細胞骨格に繋留されることでがん細胞の浸潤を促進する<ref name=OrianRousseau2002><pubmed>12464636</pubmed></ref>。上皮間葉転換には、EGF/EGFRシグナル伝達が関与する。舌[[扁平上皮癌]]において、EGFがエズリンのTyr353をリン酸化し、Aktおよび[[NF-κB]]の活性化を介して上皮間葉転換とがん転移を誘導する<ref name=Wang2014 /> | 一般にエズリンの発現が高い程、予後が悪く生存率は低下する。その原因の一つとしてがんの転移能が上昇することがある。エズリンが転移に関わるメカニズムの例として、CD44とアクチン細胞骨格とのクロスリンクや、EGF/EGFRを介した上皮間葉転換が挙げられる。CD44v6 (変異型エクソンv6配列を含むCD44アイソフォーム) はHGF/c-Metの共受容体としてエズリンと結合し、アクチン細胞骨格に繋留されることでがん細胞の浸潤を促進する<ref name=OrianRousseau2002><pubmed>12464636</pubmed></ref>。上皮間葉転換には、EGF/EGFRシグナル伝達が関与する。舌[[扁平上皮癌]]において、EGFがエズリンのTyr353をリン酸化し、Aktおよび[[NF-κB]]の活性化を介して上皮間葉転換とがん転移を誘導する<ref name=Wang2014 />。 | ||
==== マーリンの抗腫瘍作用 ==== | ==== マーリンの抗腫瘍作用 ==== | ||
がん抑制遺伝子である''nf2''はマーリンをコードする。''nf2''の不活化は、両側性に発生する前庭神経鞘腫および髄膜腫や脳室上衣腫などの脳腫瘍を特徴とする優性遺伝疾患である神経線維腫症II型を引き起こす<ref name=Asthagiri2009><pubmed>19476995</pubmed></ref>。神経線維腫症II型は、特有の疾患として両側性[[前庭神経鞘腫]] ([[第VIII脳神経]]に発生する腫瘍) を、一般的には脳神経や[[後根神経節]]、末梢神経にも神経鞘種を引き起こす。マーリンは、PI3Kや[[Raf]]/[[ERK]]、[[Wnt]]/[[β-カテニン]]、受容体型チロシンキナーゼ、[[mTOR]]、[[Hippo経路]]などさまざまなシグナル伝達経路を阻害することで腫瘍抑制効果を示す<ref name=Vlashi2024><pubmed>38967126</pubmed></ref>。 | |||
==関連項目== | ==関連項目== | ||
2025年9月4日 (木) 22:38時点における最新版
川口 高徳
明海大学歯学部 病態診断治療学講座薬理学分野
浅野 真司
立命館大学薬学部 分子生理学研究室
DOI:10.14931/bsd.11171 原稿受付日:2025年6月18日 原稿完成日:2025年8月29日
担当編集委員:和田 圭司(国立研究開発法人国立精神・神経医療研究センター)
英:ERM proteins
ERMタンパク質は、エズリン、ラディキシン、モエシンおよびマーリンで構成される分子量70~75 kDaのアクチン細胞骨格関連タンパク質群である。N末端領域に約300アミノ酸残基から構成されるFERMドメインを、C末端領域にアクチン細胞骨格との結合ドメインをもつ。主に細胞の頂端領域に局在し、細胞膜のタンパク質とアクチン細胞骨格との間でのクロスリンカーとして、また、細胞骨格ダイナミクスを制御するRhoファミリー低分子量Gタンパク質の調節因子として、さらにシグナル伝達タンパク質の足場タンパク質としての機能を担う。さまざまながん細胞種の浸潤や転移にも関与する。どのERMタンパク質が発現するかは細胞、組織によって異なるが、神経組織では、神経細胞の神経突起の成長円錐の形成や、アストロサイトのシナプス近傍の微細な突起であるperisynaptic astrocyte process (PAP) 構造の形成、ミクログリアの細胞遊走や貪食、シュワン細胞の髄鞘の形成など、広く神経組織の構造形成や機能に関わる。
ERMタンパク質とは
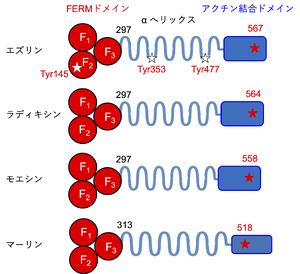
N末端に3つのサブドメイン (F1-F3) からなるFERMドメイン、C末端にアクチン結合ドメイン、中央にαヘリックス構造をもつ。アクチン結合ドメイン内に示した赤い星印は、活性化に重要なリン酸化部位であるエズリン, ラディキシン, モエシンのThr残基およびマーリンのSer残基を表す (表記した数字は、マウスERMタンパク質のアミノ酸番号を示す)。本文中で紹介したシグナル伝達に関わるTyr145, Tyr353, Tyr477を白い星印で示す。
ERMタンパク質は、エズリン、ラディキシン、モエシンおよびマーリンからなる細胞骨格関連タンパク質群である。細胞膜のタンパク質とアクチン細胞骨格との間でクロスリンカーとして細胞の頂端膜の構造を維持し、膜タンパク質の機能発現に関与するタンパク質として見出された。エズリンはニワトリの腸管上皮の刷子縁に存在する微絨毛中のタンパク質として[1]、モエシンはウシの子宮のミクロソームからヘパリンと結合するタンパク質として[2]、ラディキシンはラットの肝細胞の接着結合から単離された[3]。また、マーリンは神経線維腫症II型 (neurofibromatosis type 2)の原因遺伝子産物(NF2)として見出された[4][5]。
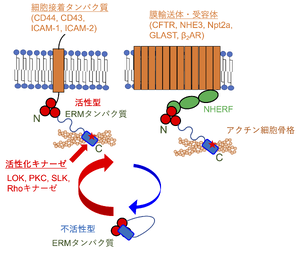
N末端のFERMドメイン(赤〇)とC末端領域(青色)が相互作用し、アクチン細胞骨格と結合不能な「閉じた」不活性型構造をとる。FERMドメインのF3部位がPIP2に結合し、PKCやLOK、SLK、RhoキナーゼによってC末端ドメインのThr残基 (マーリンはSer残基) がリン酸化され (赤い星印)、「開いた」活性型構造となる。ERMタンパク質は単一の膜貫通領域をもつ細胞接着タンパク質と直接に (図左)、あるいは膜輸送体や受容体と直接または間接的に結合する (図右では足場タンパク質であるNHERFを介した間接的結合を示す)。
構造
N末端およびC末端領域で高いアミノ酸配列相同性を示す。N末端には約300アミノ酸残基から構成されるFERMドメインをもち、3つのサブドメイン (F1, F2, F3) からなる[6][7]。FERMドメインは、膜タンパク質[8]や足場タンパク質[9][10]、Rhoファミリー低分子量Gタンパク質調節に関わるタンパク質[11][12]や、膜リン脂質に含まれるホスファチジルイノシトール4,5-二リン酸 (PIP2) [13][14]などと結合する。一方、エズリン、ラディキシン、モエシン のC末端領域では、特に34アミノ酸残基がファミリー間で高度に保存されており、アクチン細胞骨格と結合する。マーリンではこの部分での相同性が低い[15]。これらN末端とC末端のドメインはαヘリックス構造によって接続されている[16] (図1)。
おもにC末端ドメインのリン酸化によって活性が制御される。脱リン酸化状態では、N末端のFERMドメインとC末端ドメインとが相互作用し、C末端ドメインに存在するアクチン結合部位がマスクされ、アクチン線維と結合できない「閉じた」不活性型となる[8]。FERMドメインにPIP2が結合し[14] [14]、続いてC末端ドメインに存在するトレオニンあるいはセリン残基 (マウスでエズリンのThr567、ラディキシンのThr564、モエシンのThr558、マーリンのSer518) がLymphocyte-Oriented Kinase (LOK) やタンパク質リン酸化酵素C (protein kinase C, PKC)、STE20様タンパク質リン酸化酵素 (SLK)、Rhoキナーゼによってリン酸化されることでFERMドメインとC末端ドメインの間の結合が解離し、「開かれた」活性型構造となる[8][17][18][19] (図2)。後述するように、ERMタンパク質には、これ以外にも多数のリン酸化部位が存在し、リン酸化を受けてシグナル伝達などにかかわる。
発現
脳、神経系組織
どのERMタンパク質が発現するかは細胞種や発生段階によって異なる。部位や発生過程における発現の違いが、各ERMタンパク質の生体内での役割の違いに繋がると考えられる。
成体脳ではエズリンはおもにアストロサイトや上衣細胞に発現が見られ、アストロサイトでは主にシナプス周囲アストロサイト突起(perisynaptic astrocytic process, PAP)構造に集積する[20]。
ラディキシンは、脳全体でOlig2陽性細胞に発現する[21]。アストロサイトのPAP構造にも見られる[20]。また、脳卒中の梗塞周辺組織に見られる活性化ミクログリアにはラディキシンが高発現する[21]。
モエシンはおもにミクログリアや血管内皮細胞に発現が見られる[22]。
マーリンは、シュワン細胞のほか、神経細胞[23]、アストロサイトやオリゴデンドロサイトで発現が見られる[24]。
海馬歯状回の顆粒細胞層下帯と側脳室周囲の脳室下帯 (SVZ) は、成体における神経新生部位である。このうち脳室下帯で産生された前駆細胞は神経芽細胞に分化して、吻側移動経路 (rostral migration stream, RMS)を嗅球まで移動して神経回路に編入される。ここではラディキシンは、吻側移動経路の神経芽細胞とオリゴデンドロサイト前駆細胞に発現する[25]。ラディキシンを特異的に阻害すると、細胞骨格との相互作用が失われて神経芽細胞の移動は傷害される[21][26]。一方、エズリンは神経芽細胞には見られず、吻側移動経路を取り囲むアストロサイトに発現する[27]。
成体脳とは異なり、培養海馬錐体神経細胞には、エズリン、ラディキシン、モエシンが発現する。後述するようにラディキシンおよびモエシンは、成長円錐の形成や伸長に関わる[28]。
| 発現部位 | タンパク質 | 文献 | |
|---|---|---|---|
| in vivo (成体) | アストロサイト | エズリン, ラディキシン, マーリン | [20][24] |
| ミクログリア | ラディキシン, モエシン | [21][22] | |
| オリゴデンドロサイト | マーリン | [24] | |
| 神経細胞 | マーリン | [23] | |
| 上衣細胞 | エズリン | [20] | |
| 血管内皮細胞 | モエシン | [22] | |
| in vivo (分化過程) | 神経芽細胞 (吻側移動経路) | ラディキシン | [25][26] |
| オリゴデンドロサイト前駆細胞 (吻側移動経路) | ラディキシン | [25] | |
| アストロサイト | エズリン | [27] | |
| in vitro | 海馬錐体初代培養神経細胞 | エズリン, ラディキシン, モエシン | [28] |
その他の組織
エズリンは、胃の壁細胞の管腔側膜や、小腸、大腸の刷子縁膜で高発現しており、腎臓の近位尿細管の刷子縁膜や糸球体、肺や気管支などの呼吸上皮にも発現する[1][29][30][31][32][33]。
ラディキシンは、肝臓の管腔側膜で高発現しており、腎臓の糸球体にも発現が見られる[3][34]。
モエシンは、血管内皮細胞、リンパ球、T細胞、B細胞やマスト細胞などで高発現するほか、肺や脾臓、腎臓のヘンレループの太い上行脚および糸球体内皮細胞にも発現が見られる[35][36][37][38]。
ERMタンパク質は微絨毛や糸状仮足における皮質アクチン線維と結合することで、これらの構造を維持し、細胞内において極性をもって分布する。特に、上皮細胞の頂端部に局在することで、後述する膜タンパク質の局在制御やRhoファミリー低分子量Gタンパク質の活性調節を行うほか、シグナル伝達関連タンパク質の制御をはじめとする生理機能を実現する。
分子機能
さまざまな細胞膜タンパク質とアクチン細胞骨格間のクロスリンカーとして、Rhoファミリー低分子量Gタンパク質の調節因子として、またPI3キナーゼ (PI3K)-Akt経路などのシグナル伝達に関連するタンパク質の足場タンパク質として働く。これらの機能はがんの浸潤・転移にも密接に関わる。
細胞膜タンパク質とアクチン細胞骨格間のクロスリンカー
細胞接着タンパク質との結合
単一の膜貫通領域をもつ細胞接着タンパク質とFERMドメインで直接に結合し、アクチン細胞骨格へのクロスリンカータンパク質として働く。すべてのERMタンパク質が、細胞表面でヒアルロン酸の受容体として機能するCD44の細胞質ドメインと結合し、アクチン細胞骨格との間でクロスリンカーとして働き、がん細胞の遊走や浸潤に関連する[39][40]。また、エズリンは細胞間接着分子ICAM-1およびICAM-2の細胞質ドメインに結合する[41]。モエシンはCD44のほか細胞接着タンパク質であるCD43、細胞間接着分子ICAM-2とも直接に結合する[40] (図2)。
膜輸送体や受容体との結合
膜輸送体とも直接に結合し、アクチン細胞骨格との相互作用を介して、頂端膜で安定に発現させる。たとえば、エズリンは、FERM ドメインでNa+/H+交換輸送体1 (NHE1) のC末端の細胞質領域と結合する[42]。また、がんにおける多剤耐性機構に重要な因子となるP糖タンパク質 (P-gp) とも同様に結合し、P-gpの細胞膜発現と基質輸送能を高める[43]。ラディキシンは、multi-drug resistance protein 2 (MRP2)のC末端の細胞質ドメインに直接結合し、胆管への抱合型ビリルビンの分泌に関与する[44]。 モエシンは、FERMドメインで、Na+/K+/2Cl-共輸送体2 (NKCC2) のC末端領域と結合することで、NKCC2を頂端膜で安定に発現させる[45]。
また、エズリンは、足場タンパク質を介して膜輸送体や受容体と間接的に複合体を形成する。足場タンパク質であるNa+/H+交換輸送体制御因子1 (NHERF1) および2は、2つのPDZ (PSD-95、Discs-large、ZO-1) ドメインをもつ一方、C末端でERMタンパク質のFERMドメインに結合する[9][10]。NHERF1のPDZドメインは、クロライドチャネルである嚢胞性線維症膜コンダクタンス制御因子 (CFTR)、Na+/H+交換輸送体3 (NHE3) 、Na+/リン酸共輸送体2a (Npt2a)、グルタミン酸輸送体GLASTなどの膜輸送体のほか、β2アドレナリン受容体(β2AR)のC末端に存在するPDZ結合モチーフと結合する。その結果、膜輸送体や受容体がアクチン細胞骨格に結合して細胞膜で安定に発現する[32][46][47][48][49](図2)。
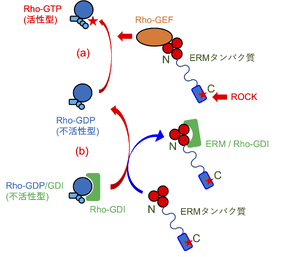
GTP結合型のRhoファミリー低分子量Gタンパク質は活性型であり、下流のエフェクターと相互作用する。GDP結合型のRhoファミリー低分子量Gタンパク質は不活性型であり、下流のエフェクターとの親和性が大幅に低下している。Rho-GEFは、結合したGDPからGTPへの交換を誘導し、Rhoファミリー低分子量Gタンパク質を活性化する。Rho-GDIは、不活性型のGDP結合型Rhoファミリー低分子量Gタンパク質と結合し、安定化させることで活性型への変換を妨げる。ERMタンパク質はRho-GEFとFERMドメインで結合し、Rhoファミリー低分子量Gタンパク質においてGDPからGTPへの交換を促進することで活性化する (図中(a))。また、Rho-GDIともFERMドメインで結合し、Rhoファミリー低分子量Gタンパク質からのRho-GDIの解離を促進することで活性化する (図中(b))。
ADPリボシル化因子ファミリーGTPaseの調節
エズリンは胃壁細胞の管腔側膜に発現する。胃壁細胞をヒスタミン処理すると、cAMP依存性タンパク質リン酸化酵素 (PKA) によってエズリンのN末端側のSer66がリン酸化を受ける。この際にエズリンはADPリボシル化因子6 (ADP ribosylation factor-6, ARF6) GTPaseおよびARF GTPase活性化タンパク質であるACAP4と結合し、胃酸分泌細胞内のプロトンポンプを含む細管小胞と管腔側膜との融合を促して酸分泌を開始する[50]。実際にエズリンをノックダウンしたマウスでは、細管小胞と管腔側膜との融合はおこらず、胃酸の分泌が傷害される[51]。
Rhoファミリー低分子量Gタンパク質の調節
エズリンは、細胞骨格のダイナミクスを制御するRhoファミリー低分子量Gタンパク質の上流および下流のエフェクターとして機能する[52]。Rhoファミリー低分子量Gタンパク質は皮質アクチンの再構築を誘導し、フィロポディア、ラメリポディアといった細胞の形態変化や、遊走などの細胞運動を引き起こす。エズリンはRho関連タンパク質などに結合してRhoファミリー低分子量Gタンパク質活性を制御する一方、Rhoキナーゼによるリン酸化によって活性化される。
ラディキシンについても、前立腺がん細胞PC3や乳がん細胞MDA-MB-231においてRhoファミリー低分子量Gタンパク質の一種であるRac1を介して細胞形態の変化や細胞遊走、細胞接着を制御する[53]。ラディキシンをノックダウンすると細胞面積の増加を引き起こすが、Rac1を発現抑制すると、この細胞面積増加は抑制される。一方、恒常的に活性化したRac1は、細胞の拡散と細胞間接触におけるN-カドヘリンの発現増加を引き起こす[53]。
Rhoグアニンヌクレオチド交換因子との相互作用
エズリンは、FERMドメインを介して、Rhoファミリー低分子量Gタンパク質を活性化する酵素であるRhoグアニンヌクレオチド交換因子 (Rho-GEF) の1つであるPleckstrin Homology Domain-Containing Family G Member 6 (PLEKHG6)と結合する。腎尿細管由来のLLC-PK1細胞とA431細胞において、エズリンはPLEKHG6と結合して頂端膜へと誘導し、PLEKFG6によるRhoGの活性化を介して微絨毛とラッフル膜の形成とマクロピノサイトーシスを引き起こす[54][54]。また、エズリンはRac1のGEFであるDOCK1と、engulfment and cell motility (ELMO) タンパク質、およびRac1からなる複合体と反応する。ゼブラフィッシュの胚では、線毛の形成過程で基底小体の細胞内移動や細胞膜とのドッキングにはたらく[55]。
Rho-GDP解離阻害因子との相互作用
すべてのRhoファミリーメンバーの阻害性調節因子であるRho-GDIは、不活性型であるGDP結合Rhoファミリー低分子量Gタンパク質と結合し、Rho-GDP/GDI複合体を安定化することでRhoファミリー低分子量Gタンパク質の活性化を妨げる。エズリンはFERMドメインでRho-GDIと結合し、Rho-GDP/GDI複合体の形成を妨げることでRhoファミリー低分子量Gタンパク質の活性化を補助する[11] (図3)。
Rho関連コイルドコイル含有キナーゼとの相互作用
Rho関連コイルドコイル含有キナーゼは、Rhoファミリー低分子量Gタンパク質の1つであるRhoAの下流エフェクターである[56][57]。ミオシン軽鎖を直接リン酸化、ミオシンホスファターゼを阻害することで、ストレスファイバーの集合を誘導する[58]。その一方、Rho関連コイルドコイル含有キナーゼはエズリンのC末端ドメインのThr567をリン酸化して活性化する。一方、Rho関連コイルドコイル含有キナーゼ阻害剤であるY27632はエズリンのリン酸化とアクチン細胞骨格への結合を阻害する[59]。
シグナル伝達タンパク質の足場タンパク質
エズリンはリン酸化を受けて、肝細胞増殖因子 (HGF)、上皮成長因子 (EGF)、PI3キナーゼ(PI3K)-Akt経路などのシグナル伝達において、関連タンパク質の足場タンパク質として機能する。いくつかのシグナル伝達経路はクロストークして、細胞増殖やがんの浸潤や転移に関わる。
HGF/c-Metシグナル伝達
エズリンは、肝細胞増殖因子/c-Metシグナル伝達誘導性の細胞の形態変化や、がん細胞の浸潤・転移を引き起こす。HGFは受容体型チロシンキナーゼc-Metと結合してリン酸化を引き起こす。この活性化c-Metは非受容体型チロシンキナーゼc-Srcを誘導し、エズリンのTyr477をリン酸化する (Tyr477はエズリンに見られるがERMタンパク質の中では保存されていない)。リン酸化エズリンは、細胞の形態変化にかかわる非受容体型チロシンキナーゼであるFesと結合する。活性化されたFesはエズリンによってシート状の細胞間の接着部にリクルートされ、細胞の形態変化をともなう拡散・散乱をおこす[60]。
EGF/EGFRシグナル伝達
ヒトの皮膚がん由来のA431細胞を上皮成長因子で処理すると、エズリンのリン酸化と共に、微絨毛様構造やラッフル膜が形成されるなど細胞表面構造の変化が観察される[61]。エズリンは上皮成長因子受容体と複合体を形成する。上皮成長因子処理によってエズリンのFERMドメインのTyr145と、中央αヘリックス構造のTyr353がリン酸化を受け、上皮成長因子受容体との結合が増強される[62]。エズリンを欠損または阻害すると、上皮成長因子受容体のリン酸化やシグナル下流のErkやSTAT3の活性化、細胞増殖が阻害を受ける[63]。Tyr353のリン酸化は細胞増殖や上皮間葉転換、アポトーシス阻害にも関わる[64]。
PI3K-Akt経路
エズリンは上皮成長因子のような外部シグナルを受けてTyr353がリン酸化されると、PI3Kの調節サブユニットであるp85のC末端SH2ドメインと結合することでPI3Kを活性化する。PI3Kによって産生されるホスファチジルイノシトール3,4,5-三リン酸は、プロテインキナーゼであるAktを活性化し、細胞増殖を促すとともに細胞をアポトーシスから保護する[65]。また、上皮間葉転換を促進する。
一方、マーリンは脳特異的GTPaseであるPI3Kエンハンサー(PIKE) Lに結合し、PI3K活性を阻害して細胞増殖を抑制する[66]。
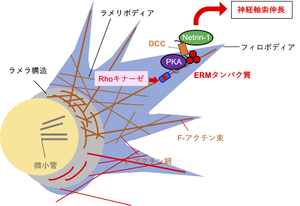
神経軸索の誘因/反発因子として働く分泌性タンパク質Netrin-1は受容体であるDCCに結合し、PKA依存的に神経細胞発達を誘導する。ERMタンパク質はDCCと結合すると共にPKAとも結合し、タンパク質複合体を形成する。この複合体形成が、DCCを介したPKAの活性化に重要である。特にエズリン は、Netrin-1依存的にDCCと結合し、Rhoキナーゼによって自身がリン酸化を受けてアクチン細胞骨格の再構築を引き起こし、神経軸索伸長などを引き起こすと考えられる。
神経での機能
成長円錐の形成
ラディキシンは神経細胞の成長円錐の形成において重要な役割を担う。たとえばニワトリの神経培養細胞の培地から神経成長因子 (NGF)を除くと、成長円錐の急速な崩壊と同時にラディキシンの発現は大幅に低下する。一方、神経成長因子を再添加すると成長円錐が再形成されると同時にラディキシンの成長円錐での再局在化が引き起こされる[67]。
また、海馬神経細胞の初代培養におけるアンチセンスオリゴヌクレオチドを用いたERMファミリーの発現抑制実験では、ラディキシンとモエシンを二重発現抑制すると、成長円錐の劇的な減少や放射状条線の消失、糸状仮足数の減少および長さの増加など、成長円錐の形成異常が認められる。他方、エズリンとラディキシン、エズリンとモエシンを二重発現抑制しても、成長円錐の形態や大きさや糸状仮足の数、細胞骨格に変化は見られない[28]。タイムラプスVideo Enhanced Contrast-微分干渉顕微鏡 (VEC-DIC顕微鏡)で成長円錐の拡大を解析すると、ラディキシンとモエシンを二重発現抑制すると、軸索伸長速度の劇的な遅延が見られ、成長円錐の拡大が傷害される[28]。
また、神経軸索の誘因/反発因子として働く分泌性タンパク質Netrin-1は、受容体であるdeleted in colorectal cancer (DCC) に結合して、cAMP依存性タンパク質リン酸化酵素 (cAMP-dependent protein kinase, protein kinase A, PKA)依存的に神経細胞発達に関与する。PKAの足場となるAキナーゼアンカータンパク質 (AKAP)機能を欠損したラディキシン、エズリンとモエシンの変異体を導入すると、成長円錐において特徴的なラメラ構造やラメリポディアが消失する。これにラディキシンを発現させると成長円錐の形態を回復させる[68](図4)。
神経突起形成
エズリンはネトリン-1依存的にDCCと結合し、自らがRhoキナーゼによってリン酸化を受けて、軸索の伸長を活性化する (図4)。初代培養神経細胞においてエズリンの機能を欠損させると、突起伸長は阻害を受ける[69]。
また、エズリンの発現が野生型マウスの5%以下まで抑制されたノックダウンマウス (Vil2kd/kd マウス) 胚由来の初代培養神経細胞では、野生型マウスと比較して神経突起の形成障害が見られる。Vil2kd/kd マウス神経細胞では、RhoA活性の上昇およびミオシン軽鎖2 (MLC2)のリン酸化が認められ、ミオシンIIやRho関連コイルドコイル含有キナーゼを阻害すると神経細胞の神経突起形成が回復する[70]。
アストロサイトPAP構造とグルタミン酸輸送
アストロサイトにはシナプス周囲アストロサイト突起 (perisynaptic astrocytic process, PAP)と呼ばれるシナプス近傍の微細な突起が見られ、全細胞表面の70-80%を占め、グリアと神経細胞の相互作用に重要な膜タンパク質が局在する[20][71]。PAPにはエズリンおよびラディキシンが高発現しており、特に活性型であるC末端リン酸化型エズリンが集積する[71][72]。エズリンは足場タンパク質であるNHERF1を介して、アストロサイトの細胞骨格タンパク質であるグリア線維性酸性タンパク質 (GFAP)や、グルタミン酸-アスパラギン酸トランスポーターであるGLASTと結合し、PAPを含むアストロサイト突起で共局在する[48]。エズリンは、NHERF1-GLAST複合体とアクチン細胞骨格の間のリンカータンパク質として機能し、GLASTのPAPでの発現を安定化し、グルタミン酸輸送能を向上させることによってグルタミン酸による脳障害に対する保護に働く[73]。
ミクログリア活性化
モエシンはミクログリアに発現する。マウスの初代培養ミクログリアをモエシンのリン酸化を阻害するNSC305787で処理すると、リン酸化レベルの低下に対応してUDP誘導性の食作用やADP誘導性の遊走、リポポリサッカライド (LPS)誘導性のTNF-α分泌が阻害される[74]。また、モエシンノックアウトマウス由来の初代培養ミクログリアではADP誘導性の遊走活性の低下やUDP感受性の貪食能の低下が観察されることから、モエシンはミクログリアの遊走や貪食に重要な役割を担うと考えられる[75]。
シュワン細胞における髄鞘形成
エズリンはシュワン細胞の微絨毛構造に発現する。エズリンを高発現する突起部分ではミエリンが欠如しており、この部位がランヴィエ絞輪の形成に関与するものと見られる[76]。
マーリンもまたシュワン細胞の膜ドメインに高発現する[77]。末梢神経系では損傷後に軸索再生と再髄鞘形成が起きるが、シュワン細胞特異的マーリン欠損マウスではこれらが傷害される。マーリンは、細胞増殖とアポトーシスを通じて器官のサイズを制御するHippo経路の転写因子であるYes-associated protein (YAP) と結合することで髄鞘形成に関与し、機能的な神経修復において重要な働きを担う[78]。
疾患との関連
自閉症スペクトラム
モエシンは自閉症スペクトラム (ASD) に関わる因子の一つであることが知られている。自閉症スペクトラムにかかわるlong noncoding RNA (lncRNA) の一つとして見出されたmoesin pseudogene 1 antisense (MSNP1AS) は、自閉症スペクトラム患者の大脳皮質ではコントロール患者と比較して12倍も発現が増加する。MSNP1ASはモエシンのRNAと二本鎖を形成し、モエシンの発現を阻害する[79]。ヒト培養海馬神経細胞にMSNP1ASを過剰発現させるとRhoAの活性化とPI3K/Aktの活性化阻害が見られ、神経突起の数と長さの減少が観察される。さらに、自閉症のモデルであるBTBRマウスの海馬にレンチウイルスを用いてモエシンのcDNAを注入して行動観察を行ったところ、社会的な相互作用が改善され、反復行動、不安行動の減少が見られた[80]。オープンフィールドテストの結果、モエシンノックアウトマウスは野生型マウスと比較して不安様行動が見られることが報告されている[81]。
癌
エズリンはがん細胞の浸潤や転移に関連し、一方、マーリンは腫瘍増殖抑制に関わる。
エズリンと癌
一般にエズリンの発現が高い程、予後が悪く生存率は低下する。その原因の一つとしてがんの転移能が上昇することがある。エズリンが転移に関わるメカニズムの例として、CD44とアクチン細胞骨格とのクロスリンクや、EGF/EGFRを介した上皮間葉転換が挙げられる。CD44v6 (変異型エクソンv6配列を含むCD44アイソフォーム) はHGF/c-Metの共受容体としてエズリンと結合し、アクチン細胞骨格に繋留されることでがん細胞の浸潤を促進する[82]。上皮間葉転換には、EGF/EGFRシグナル伝達が関与する。舌扁平上皮癌において、EGFがエズリンのTyr353をリン酸化し、AktおよびNF-κBの活性化を介して上皮間葉転換とがん転移を誘導する[64]。
マーリンの抗腫瘍作用
がん抑制遺伝子であるnf2はマーリンをコードする。nf2の不活化は、両側性に発生する前庭神経鞘腫および髄膜腫や脳室上衣腫などの脳腫瘍を特徴とする優性遺伝疾患である神経線維腫症II型を引き起こす[83]。神経線維腫症II型は、特有の疾患として両側性前庭神経鞘腫 (第VIII脳神経に発生する腫瘍) を、一般的には脳神経や後根神経節、末梢神経にも神経鞘種を引き起こす。マーリンは、PI3KやRaf/ERK、Wnt/β-カテニン、受容体型チロシンキナーゼ、mTOR、Hippo経路などさまざまなシグナル伝達経路を阻害することで腫瘍抑制効果を示す[84]。
関連項目
参考文献
- ↑ 1.0 1.1
Bretscher, A. (1983).
Purification of an 80,000-dalton protein that is a component of the isolated microvillus cytoskeleton, and its localization in nonmuscle cells. The Journal of cell biology, 97(2), 425-32. [PubMed:6885906] [PMC] [WorldCat] [DOI] - ↑
Lankes, W., Griesmacher, A., Grünwald, J., Schwartz-Albiez, R., & Keller, R. (1988).
A heparin-binding protein involved in inhibition of smooth-muscle cell proliferation. The Biochemical journal, 251(3), 831-42. [PubMed:3046603] [PMC] [WorldCat] [DOI] - ↑ 3.0 3.1
Tsukita, S., Hieda, Y., & Tsukita, S. (1989).
A new 82-kD barbed end-capping protein (radixin) localized in the cell-to-cell adherens junction: purification and characterization. The Journal of cell biology, 108(6), 2369-82. [PubMed:2500445] [PMC] [WorldCat] [DOI] - ↑
Trofatter, J.A., MacCollin, M.M., Rutter, J.L., Murrell, J.R., Duyao, M.P., Parry, D.M., ..., & Pulaski, K. (1993).
A novel moesin-, ezrin-, radixin-like gene is a candidate for the neurofibromatosis 2 tumor suppressor. Cell, 72(5), 791-800. [PubMed:8453669] [WorldCat] [DOI] - ↑
Tikoo, A., Varga, M., Ramesh, V., Gusella, J., & Maruta, H. (1994).
An anti-Ras function of neurofibromatosis type 2 gene product (NF2/Merlin). The Journal of biological chemistry, 269(38), 23387-90. [PubMed:8089100] [WorldCat] - ↑
Edwards, S.D., & Keep, N.H. (2001).
The 2.7 A crystal structure of the activated FERM domain of moesin: an analysis of structural changes on activation. Biochemistry, 40(24), 7061-8. [PubMed:11401550] [WorldCat] [DOI] - ↑
Smith, W.J., Nassar, N., Bretscher, A., Cerione, R.A., & Karplus, P.A. (2003).
Structure of the active N-terminal domain of Ezrin. Conformational and mobility changes identify keystone interactions. The Journal of biological chemistry, 278(7), 4949-56. [PubMed:12429733] [WorldCat] [DOI] - ↑ 8.0 8.1 8.2
Kawaguchi, K., Yoshida, S., Hatano, R., & Asano, S. (2017).
Pathophysiological Roles of Ezrin/Radixin/Moesin Proteins. Biological & pharmaceutical bulletin, 40(4), 381-390. [PubMed:28381792] [WorldCat] [DOI] - ↑ 9.0 9.1
Reczek, D., Berryman, M., & Bretscher, A. (1997).
Identification of EBP50: A PDZ-containing phosphoprotein that associates with members of the ezrin-radixin-moesin family. The Journal of cell biology, 139(1), 169-79. [PubMed:9314537] [PMC] [WorldCat] [DOI] - ↑ 10.0 10.1
Takeda, T. (2003).
Podocyte cytoskeleton is connected to the integral membrane protein podocalyxin through Na+/H+-exchanger regulatory factor 2 and ezrin. Clinical and experimental nephrology, 7(4), 260-9. [PubMed:14712354] [WorldCat] [DOI] - ↑ 11.0 11.1
Takahashi, K., Sasaki, T., Mammoto, A., Takaishi, K., Kameyama, T., Tsukita, S., & Takai, Y. (1997).
Direct interaction of the Rho GDP dissociation inhibitor with ezrin/radixin/moesin initiates the activation of the Rho small G protein. The Journal of biological chemistry, 272(37), 23371-5. [PubMed:9287351] [WorldCat] [DOI] - ↑
Takahashi, K., Sasaki, T., Mammoto, A., Hotta, I., Takaishi, K., Imamura, H., ..., & Takai, Y. (1998).
Interaction of radixin with Rho small G protein GDP/GTP exchange protein Dbl. Oncogene, 16(25), 3279-84. [PubMed:9681826] [WorldCat] [DOI] - ↑
Niggli, V., Andréoli, C., Roy, C., & Mangeat, P. (1995).
Identification of a phosphatidylinositol-4,5-bisphosphate-binding domain in the N-terminal region of ezrin. FEBS letters, 376(3), 172-6. [PubMed:7498535] [WorldCat] [DOI] - ↑ 14.0 14.1
Barret, C., Roy, C., Montcourrier, P., Mangeat, P., & Niggli, V. (2000).
Mutagenesis of the phosphatidylinositol 4,5-bisphosphate (PIP(2)) binding site in the NH(2)-terminal domain of ezrin correlates with its altered cellular distribution. The Journal of cell biology, 151(5), 1067-80. [PubMed:11086008] [PMC] [WorldCat] [DOI] - ↑
Turunen, O., Wahlström, T., & Vaheri, A. (1994).
Ezrin has a COOH-terminal actin-binding site that is conserved in the ezrin protein family. The Journal of cell biology, 126(6), 1445-53. [PubMed:8089177] [PMC] [WorldCat] [DOI] - ↑
Kawaguchi, K., & Asano, S. (2022).
Pathophysiological Roles of Actin-Binding Scaffold Protein, Ezrin. International journal of molecular sciences, 23(6). [PubMed:35328667] [PMC] [WorldCat] [DOI] - ↑
Hirao, M., Sato, N., Kondo, T., Yonemura, S., Monden, M., Sasaki, T., ..., & Tsukita, S. (1996).
Regulation mechanism of ERM (ezrin/radixin/moesin) protein/plasma membrane association: possible involvement of phosphatidylinositol turnover and Rho-dependent signaling pathway. The Journal of cell biology, 135(1), 37-51. [PubMed:8858161] [PMC] [WorldCat] [DOI] - ↑
Viswanatha, R., Ohouo, P.Y., Smolka, M.B., & Bretscher, A. (2012).
Local phosphocycling mediated by LOK/SLK restricts ezrin function to the apical aspect of epithelial cells. The Journal of cell biology, 199(6), 969-84. [PubMed:23209304] [PMC] [WorldCat] [DOI] - ↑
Zaman, R., Lombardo, A., Sauvanet, C., Viswanatha, R., Awad, V., Bonomo, L.E., ..., & Bretscher, A. (2021).
Effector-mediated ERM activation locally inhibits RhoA activity to shape the apical cell domain. The Journal of cell biology, 220(6). [PubMed:33836044] [PMC] [WorldCat] [DOI] - ↑ 20.0 20.1 20.2 20.3 20.4
Derouiche, A., & Frotscher, M. (2001).
Peripheral astrocyte processes: monitoring by selective immunostaining for the actin-binding ERM proteins. Glia, 36(3), 330-41. [PubMed:11746770] [WorldCat] [DOI] - ↑ 21.0 21.1 21.2 21.3
Persson, Å., Osman, A., Bolouri, H., Mallard, C., & Kuhn, H.G. (2013).
Radixin expression in microglia after cortical stroke lesion. Glia, 61(5), 790-9. [PubMed:23440885] [WorldCat] [DOI] - ↑ 22.0 22.1 22.2
Johnson, M.W., Miyata, H., & Vinters, H.V. (2002).
Ezrin and moesin expression within the developing human cerebrum and tuberous sclerosis-associated cortical tubers. Acta neuropathologica, 104(2), 188-96. [PubMed:12111362] [WorldCat] [DOI] - ↑ 23.0 23.1
Grönholm, M., Vossebein, L., Carlson, C.R., Kuja-Panula, J., Teesalu, T., Alfthan, K., ..., & Carpén, O. (2003).
Merlin links to the cAMP neuronal signaling pathway by anchoring the RIbeta subunit of protein kinase A. The Journal of biological chemistry, 278(42), 41167-72. [PubMed:12896975] [WorldCat] [DOI] - ↑ 24.0 24.1 24.2
Toledo, A., Grieger, E., Karram, K., Morrison, H., & Baader, S.L. (2018).
Neurofibromatosis type 2 tumor suppressor protein is expressed in oligodendrocytes and regulates cell proliferation and process formation. PloS one, 13(5), e0196726. [PubMed:29715273] [PMC] [WorldCat] [DOI] - ↑ 25.0 25.1 25.2
Persson, A., Lindwall, C., Curtis, M.A., & Kuhn, H.G. (2010).
Expression of ezrin radixin moesin proteins in the adult subventricular zone and the rostral migratory stream. Neuroscience, 167(2), 312-22. [PubMed:20109539] [WorldCat] [DOI] - ↑ 26.0 26.1
Persson, A., Lindberg, O.R., & Kuhn, H.G. (2013).
Radixin inhibition decreases adult neural progenitor cell migration and proliferation in vitro and in vivo. Frontiers in cellular neuroscience, 7, 161. [PubMed:24065889] [PMC] [WorldCat] [DOI] - ↑ 27.0 27.1
Cleary, M.A., Uboha, N., Picciotto, M.R., & Beech, R.D. (2006).
Expression of ezrin in glial tubes in the adult subventricular zone and rostral migratory stream. Neuroscience, 143(3), 851-61. [PubMed:16996217] [PMC] [WorldCat] [DOI] - ↑ 28.0 28.1 28.2 28.3
Paglini, G., Kunda, P., Quiroga, S., Kosik, K., & Cáceres, A. (1998).
Suppression of radixin and moesin alters growth cone morphology, motility, and process formation in primary cultured neurons. The Journal of cell biology, 143(2), 443-55. [PubMed:9786954] [PMC] [WorldCat] [DOI] - ↑
Hanzel, D., Reggio, H., Bretscher, A., Forte, J.G., & Mangeat, P. (1991).
The secretion-stimulated 80K phosphoprotein of parietal cells is ezrin, and has properties of a membrane cytoskeletal linker in the induced apical microvilli. The EMBO journal, 10(9), 2363-73. [PubMed:1831124] [PMC] [WorldCat] [DOI] - ↑
Yoshida, S., Fukutomi, T., Kimura, T., Sakurai, H., Hatano, R., Yamamoto, H., ..., & Asano, S. (2016).
Comprehensive proteome analysis of brush border membrane fraction of ileum of ezrin knockdown mice. Biomedical research (Tokyo, Japan), 37(2), 127-39. [PubMed:27108882] [WorldCat] [DOI] - ↑
Hugo, C., Nangaku, M., Shankland, S.J., Pichler, R., Gordon, K., Amieva, M.R., ..., & Johnson, R.J. (1998).
The plasma membrane-actin linking protein, ezrin, is a glomerular epithelial cell marker in glomerulogenesis, in the adult kidney and in glomerular injury. Kidney international, 54(6), 1934-44. [PubMed:9853258] [WorldCat] [DOI] - ↑ 32.0 32.1
Hatano, R., Fujii, E., Segawa, H., Mukaisho, K., Matsubara, M., Miyamoto, K., ..., & Asano, S. (2013).
Ezrin, a membrane cytoskeletal cross-linker, is essential for the regulation of phosphate and calcium homeostasis. Kidney international, 83(1), 41-9. [PubMed:22895514] [WorldCat] [DOI] - ↑
Laoukili, J., Perret, E., Willems, T., Minty, A., Parthoens, E., Houcine, O., ..., & Tournier, F. (2001).
IL-13 alters mucociliary differentiation and ciliary beating of human respiratory epithelial cells. The Journal of clinical investigation, 108(12), 1817-24. [PubMed:11748265] [PMC] [WorldCat] [DOI] - ↑
Hugo, C., Hugo, C., Pichler, R., Gordon, K., Schmidt, R., Amieva, M., ..., & Johnson, R.J. (1996).
The cytoskeletal linking proteins, moesin and radixin, are upregulated by platelet-derived growth factor, but not basic fibroblast growth factor in experimental mesangial proliferative glomerulonephritis. The Journal of clinical investigation, 97(11), 2499-508. [PubMed:8647942] [PMC] [WorldCat] [DOI] - ↑
Berryman, M., Franck, Z., & Bretscher, A. (1993).
Ezrin is concentrated in the apical microvilli of a wide variety of epithelial cells whereas moesin is found primarily in endothelial cells. Journal of cell science, 105 ( Pt 4), 1025-43. [PubMed:8227193] [WorldCat] [DOI] - ↑
Schwartz-Albiez, R., Merling, A., Spring, H., Möller, P., & Koretz, K. (1995).
Differential expression of the microspike-associated protein moesin in human tissues. European journal of cell biology, 67(3), 189-98. [PubMed:7588875] [WorldCat] - ↑
Hirata, T., Nomachi, A., Tohya, K., Miyasaka, M., Tsukita, S., Watanabe, T., & Narumiya, S. (2012).
Moesin-deficient mice reveal a non-redundant role for moesin in lymphocyte homeostasis. International immunology, 24(11), 705-17. [PubMed:22875842] [WorldCat] [DOI] - ↑
Kawaguchi, K., Hatano, R., Matsubara, M., & Asano, S. (2018).
Internalization of NKCC2 is impaired in thick ascending limb of Henle in moesin knockout mice. Pflugers Archiv : European journal of physiology, 470(7), 1055-1068. [PubMed:29541861] [WorldCat] [DOI] - ↑
Tsukita, S., Oishi, K., Sato, N., Sagara, J., Kawai, A., & Tsukita, S. (1994).
ERM family members as molecular linkers between the cell surface glycoprotein CD44 and actin-based cytoskeletons. The Journal of cell biology, 126(2), 391-401. [PubMed:7518464] [PMC] [WorldCat] [DOI] - ↑ 40.0 40.1
Yonemura, S., Hirao, M., Doi, Y., Takahashi, N., Kondo, T., Tsukita, S., & Tsukita, S. (1998).
Ezrin/radixin/moesin (ERM) proteins bind to a positively charged amino acid cluster in the juxta-membrane cytoplasmic domain of CD44, CD43, and ICAM-2. The Journal of cell biology, 140(4), 885-95. [PubMed:9472040] [PMC] [WorldCat] [DOI] - ↑
Heiska, L., Alfthan, K., Grönholm, M., Vilja, P., Vaheri, A., & Carpén, O. (1998).
Association of ezrin with intercellular adhesion molecule-1 and -2 (ICAM-1 and ICAM-2). Regulation by phosphatidylinositol 4, 5-bisphosphate. The Journal of biological chemistry, 273(34), 21893-900. [PubMed:9705328] [WorldCat] [DOI] - ↑
Denker, S.P., Huang, D.C., Orlowski, J., Furthmayr, H., & Barber, D.L. (2000).
Direct binding of the Na--H exchanger NHE1 to ERM proteins regulates the cortical cytoskeleton and cell shape independently of H(+) translocation. Molecular cell, 6(6), 1425-36. [PubMed:11163215] [WorldCat] [DOI] - ↑
Luciani, F., Molinari, A., Lozupone, F., Calcabrini, A., Lugini, L., Stringaro, A., ..., & Fais, S. (2002).
P-glycoprotein-actin association through ERM family proteins: a role in P-glycoprotein function in human cells of lymphoid origin. Blood, 99(2), 641-8. [PubMed:11781249] [WorldCat] [DOI] - ↑
Kikuchi, S., Hata, M., Fukumoto, K., Yamane, Y., Matsui, T., Tamura, A., ..., & Tsukita, S. (2002).
Radixin deficiency causes conjugated hyperbilirubinemia with loss of Mrp2 from bile canalicular membranes. Nature genetics, 31(3), 320-5. [PubMed:12068294] [WorldCat] [DOI] - ↑
Carmosino, M., Rizzo, F., Procino, G., Zolla, L., Timperio, A.M., Basco, D., ..., & Svelto, M. (2012).
Identification of moesin as NKCC2-interacting protein and analysis of its functional role in the NKCC2 apical trafficking. Biology of the cell, 104(11), 658-76. [PubMed:22708623] [WorldCat] [DOI] - ↑
Short, D.B., Trotter, K.W., Reczek, D., Kreda, S.M., Bretscher, A., Boucher, R.C., ..., & Milgram, S.L. (1998).
An apical PDZ protein anchors the cystic fibrosis transmembrane conductance regulator to the cytoskeleton. The Journal of biological chemistry, 273(31), 19797-801. [PubMed:9677412] [WorldCat] [DOI] - ↑
Lamprecht, G., Weinman, E.J., & Yun, C.H. (1998).
The role of NHERF and E3KARP in the cAMP-mediated inhibition of NHE3. The Journal of biological chemistry, 273(45), 29972-8. [PubMed:9792717] [WorldCat] [DOI] - ↑ 48.0 48.1
Lee, A., Rayfield, A., Hryciw, D.H., Ma, T.A., Wang, D., Pow, D., ..., & Poronnik, P. (2007).
Na+-H+ exchanger regulatory factor 1 is a PDZ scaffold for the astroglial glutamate transporter GLAST. Glia, 55(2), 119-29. [PubMed:17048262] [PMC] [WorldCat] [DOI] - ↑
Kawaguchi, K., Nakayama, S., Saito, D., Kogiso, H., Yasuoka, K., Marunaka, Y., ..., & Asano, S. (2022).
Ezrin knockdown reduces procaterol-stimulated ciliary beating without morphological changes in mouse airway cilia. Journal of cell science, 135(6). [PubMed:35132996] [WorldCat] [DOI] - ↑
Ding, X., Deng, H., Wang, D., Zhou, J., Huang, Y., Zhao, X., ..., & Yao, X. (2010).
Phospho-regulated ACAP4-Ezrin interaction is essential for histamine-stimulated parietal cell secretion. The Journal of biological chemistry, 285(24), 18769-80. [PubMed:20360010] [PMC] [WorldCat] [DOI] - ↑
Tamura, A., Kikuchi, S., Hata, M., Katsuno, T., Matsui, T., Hayashi, H., ..., & Tsukita, S. (2005).
Achlorhydria by ezrin knockdown: defects in the formation/expansion of apical canaliculi in gastric parietal cells. The Journal of cell biology, 169(1), 21-8. [PubMed:15809309] [PMC] [WorldCat] [DOI] - ↑
Ivetic, A., & Ridley, A.J. (2004).
Ezrin/radixin/moesin proteins and Rho GTPase signalling in leucocytes. Immunology, 112(2), 165-76. [PubMed:15147559] [PMC] [WorldCat] [DOI] - ↑ 53.0 53.1
Valderrama, F., Thevapala, S., & Ridley, A.J. (2012).
Radixin regulates cell migration and cell-cell adhesion through Rac1. Journal of cell science, 125(Pt 14), 3310-9. [PubMed:22467863] [WorldCat] [DOI] - ↑
D'Angelo, R., Aresta, S., Blangy, A., Del Maestro, L., Louvard, D., & Arpin, M. (2007).
Interaction of ezrin with the novel guanine nucleotide exchange factor PLEKHG6 promotes RhoG-dependent apical cytoskeleton rearrangements in epithelial cells. Molecular biology of the cell, 18(12), 4780-93. [PubMed:17881735] [PMC] [WorldCat] [DOI] - ↑
Epting, D., Slanchev, K., Boehlke, C., Hoff, S., Loges, N.T., Yasunaga, T., ..., & Kramer-Zucker, A. (2015).
The Rac1 regulator ELMO controls basal body migration and docking in multiciliated cells through interaction with Ezrin. Development (Cambridge, England), 142(1), 174-84. [PubMed:25516973] [WorldCat] [DOI] - ↑
Leung, T., Manser, E., Tan, L., & Lim, L. (1995).
A novel serine/threonine kinase binding the Ras-related RhoA GTPase which translocates the kinase to peripheral membranes. The Journal of biological chemistry, 270(49), 29051-4. [PubMed:7493923] [WorldCat] [DOI] - ↑
Nakagawa, O., Fujisawa, K., Ishizaki, T., Saito, Y., Nakao, K., & Narumiya, S. (1996).
ROCK-I and ROCK-II, two isoforms of Rho-associated coiled-coil forming protein serine/threonine kinase in mice. FEBS letters, 392(2), 189-93. [PubMed:8772201] [WorldCat] [DOI] - ↑
Totsukawa, G., Yamakita, Y., Yamashiro, S., Hartshorne, D.J., Sasaki, Y., & Matsumura, F. (2000).
Distinct roles of ROCK (Rho-kinase) and MLCK in spatial regulation of MLC phosphorylation for assembly of stress fibers and focal adhesions in 3T3 fibroblasts. The Journal of cell biology, 150(4), 797-806. [PubMed:10953004] [PMC] [WorldCat] [DOI] - ↑
Tran Quang, C., Gautreau, A., Arpin, M., & Treisman, R. (2000).
Ezrin function is required for ROCK-mediated fibroblast transformation by the Net and Dbl oncogenes. The EMBO journal, 19(17), 4565-76. [PubMed:10970850] [PMC] [WorldCat] [DOI] - ↑
Naba, A., Reverdy, C., Louvard, D., & Arpin, M. (2008).
Spatial recruitment and activation of the Fes kinase by ezrin promotes HGF-induced cell scattering. The EMBO journal, 27(1), 38-50. [PubMed:18046454] [PMC] [WorldCat] [DOI] - ↑
Bretscher, A. (1989).
Rapid phosphorylation and reorganization of ezrin and spectrin accompany morphological changes induced in A-431 cells by epidermal growth factor. The Journal of cell biology, 108(3), 921-30. [PubMed:2646308] [PMC] [WorldCat] [DOI] - ↑
Krieg, J., & Hunter, T. (1992).
Identification of the two major epidermal growth factor-induced tyrosine phosphorylation sites in the microvillar core protein ezrin. The Journal of biological chemistry, 267(27), 19258-65. [PubMed:1382070] [WorldCat] - ↑
Saygideğer-Kont, Y., Minas, T.Z., Jones, H., Hour, S., Çelik, H., Temel, I., ..., & Üren, A. (2016).
Ezrin Enhances EGFR Signaling and Modulates Erlotinib Sensitivity in Non-Small Cell Lung Cancer Cells. Neoplasia (New York, N.Y.), 18(2), 111-20. [PubMed:26936397] [PMC] [WorldCat] [DOI] - ↑ 64.0 64.1
Wang, Y., Lin, Z., Sun, L., Fan, S., Huang, Z., Zhang, D., ..., & Chen, W. (2014).
Akt/Ezrin Tyr353/NF-κB pathway regulates EGF-induced EMT and metastasis in tongue squamous cell carcinoma. British journal of cancer, 110(3), 695-705. [PubMed:24346284] [PMC] [WorldCat] [DOI] - ↑
Gautreau, A., Poullet, P., Louvard, D., & Arpin, M. (1999).
Ezrin, a plasma membrane-microfilament linker, signals cell survival through the phosphatidylinositol 3-kinase/Akt pathway. Proceedings of the National Academy of Sciences of the United States of America, 96(13), 7300-5. [PubMed:10377409] [PMC] [WorldCat] [DOI] - ↑
Rong, R., Tang, X., Gutmann, D.H., & Ye, K. (2004).
Neurofibromatosis 2 (NF2) tumor suppressor merlin inhibits phosphatidylinositol 3-kinase through binding to PIKE-L. Proceedings of the National Academy of Sciences of the United States of America, 101(52), 18200-5. [PubMed:15598747] [PMC] [WorldCat] [DOI] - ↑
Gonzalez-Agosti, C., & Solomon, F. (1996).
Response of radixin to perturbations of growth cone morphology and motility in chick sympathetic neurons in vitro. Cell motility and the cytoskeleton, 34(2), 122-36. [PubMed:8769724] [WorldCat] [DOI] - ↑
Deming, P.B., Campbell, S.L., Stone, J.B., Rivard, R.L., Mercier, A.L., & Howe, A.K. (2015).
Anchoring of protein kinase A by ERM (ezrin-radixin-moesin) proteins is required for proper netrin signaling through DCC (deleted in colorectal cancer). The Journal of biological chemistry, 290(9), 5783-96. [PubMed:25575591] [PMC] [WorldCat] [DOI] - ↑
Antoine-Bertrand, J., Ghogha, A., Luangrath, V., Bedford, F.K., & Lamarche-Vane, N. (2011).
The activation of ezrin-radixin-moesin proteins is regulated by netrin-1 through Src kinase and RhoA/Rho kinase activities and mediates netrin-1-induced axon outgrowth. Molecular biology of the cell, 22(19), 3734-46. [PubMed:21849478] [PMC] [WorldCat] [DOI] - ↑
Matsumoto, Y., Inden, M., Tamura, A., Hatano, R., Tsukita, S., & Asano, S. (2014).
Ezrin mediates neuritogenesis via down-regulation of RhoA activity in cultured cortical neurons. PloS one, 9(8), e105435. [PubMed:25144196] [PMC] [WorldCat] [DOI] - ↑ 71.0 71.1
Derouiche, A., & Geiger, K.D. (2019).
Perspectives for Ezrin and Radixin in Astrocytes: Kinases, Functions and Pathology. International journal of molecular sciences, 20(15). [PubMed:31382374] [PMC] [WorldCat] [DOI] - ↑
Lavialle, M., Aumann, G., Anlauf, E., Pröls, F., Arpin, M., & Derouiche, A. (2011).
Structural plasticity of perisynaptic astrocyte processes involves ezrin and metabotropic glutamate receptors. Proceedings of the National Academy of Sciences of the United States of America, 108(31), 12915-9. [PubMed:21753079] [PMC] [WorldCat] [DOI] - ↑
Sullivan, S.M., Lee, A., Björkman, S.T., Miller, S.M., Sullivan, R.K., Poronnik, P., ..., & Pow, D.V. (2007).
Cytoskeletal anchoring of GLAST determines susceptibility to brain damage: an identified role for GFAP. The Journal of biological chemistry, 282(40), 29414-23. [PubMed:17684014] [WorldCat] [DOI] - ↑ Okazaki, T., Kawaguchi, K., Hirao, T., & Asano, S. (2020). Moesin is involved in migration and phagocytosis activities of primary microglia. BPB Reports. 3(6), 185-9. WorldCatDOI
- ↑
Okazaki, T., Saito, D., Inden, M., Kawaguchi, K., Wakimoto, S., Nakahari, T., & Asano, S. (2020).
Moesin is involved in microglial activation accompanying morphological changes and reorganization of the actin cytoskeleton. The journal of physiological sciences : JPS, 70(1), 52. [PubMed:33129281] [PMC] [WorldCat] [DOI] - ↑
Melendez-Vasquez, C.V., Rios, J.C., Zanazzi, G., Lambert, S., Bretscher, A., & Salzer, J.L. (2001).
Nodes of Ranvier form in association with ezrin-radixin-moesin (ERM)-positive Schwann cell processes. Proceedings of the National Academy of Sciences of the United States of America, 98(3), 1235-40. [PubMed:11158623] [PMC] [WorldCat] [DOI] - ↑
Scherer, S.S., & Gutmann, D.H. (1996).
Expression of the neurofibromatosis 2 tumor suppressor gene product, merlin, in Schwann cells. Journal of neuroscience research, 46(5), 595-605. [PubMed:8951671] [WorldCat] [DOI] - ↑
Mindos, T., Dun, X.P., North, K., Doddrell, R.D., Schulz, A., Edwards, P., ..., & Parkinson, D.B. (2017).
Merlin controls the repair capacity of Schwann cells after injury by regulating Hippo/YAP activity. The Journal of cell biology, 216(2), 495-510. [PubMed:28137778] [PMC] [WorldCat] [DOI] - ↑
Kerin, T., Ramanathan, A., Rivas, K., Grepo, N., Coetzee, G.A., & Campbell, D.B. (2012).
A noncoding RNA antisense to moesin at 5p14.1 in autism. Science translational medicine, 4(128), 128ra40. [PubMed:22491950] [WorldCat] [DOI] - ↑
Luo, T., Ou, J.N., Cao, L.F., Peng, X.Q., Li, Y.M., & Tian, Y.Q. (2020).
The Autism-Related lncRNA MSNP1AS Regulates Moesin Protein to Influence the RhoA, Rac1, and PI3K/Akt Pathways and Regulate the Structure and Survival of Neurons. Autism research : official journal of the International Society for Autism Research, 13(12), 2073-2082. [PubMed:33215882] [WorldCat] [DOI] - ↑
Cai, H., Lee, S.M., Choi, Y., Lee, B., Im, S.J., Kim, D.H., ..., & Jeon, S. (2025).
Memory Decline and Aberration of Synaptic Proteins in X-Linked Moesin Knockout Male Mice. Psychiatry investigation, 22(1), 10-25. [PubMed:39885788] [PMC] [WorldCat] [DOI] - ↑
Orian-Rousseau, V., Chen, L., Sleeman, J.P., Herrlich, P., & Ponta, H. (2002).
CD44 is required for two consecutive steps in HGF/c-Met signaling. Genes & development, 16(23), 3074-86. [PubMed:12464636] [PMC] [WorldCat] [DOI] - ↑
Asthagiri, A.R., Parry, D.M., Butman, J.A., Kim, H.J., Tsilou, E.T., Zhuang, Z., & Lonser, R.R. (2009).
Neurofibromatosis type 2. Lancet (London, England), 373(9679), 1974-86. [PubMed:19476995] [PMC] [WorldCat] [DOI] - ↑
Vlashi, R., Sun, F., Zheng, C., Zhang, X., Liu, J., & Chen, G. (2024).
The molecular biology of NF2/Merlin on tumorigenesis and development. FASEB journal : official publication of the Federation of American Societies for Experimental Biology, 38(13), e23809. [PubMed:38967126] [WorldCat] [DOI]