「膵臓転写因子1A」の版間の差分
細 →小脳原基 |
細編集の要約なし |
||
| (同じ利用者による、間の16版が非表示) | |||
| 1行目: | 1行目: | ||
Pancreas transcription factor 1a | |||
PTF1A | |||
{{box|text= 膵臓転写因子1A (Pancreas transcription factor 1A, PTF1A)は膵臓の腺房外分泌細胞や多くの中枢神経系ニューロンの分化において重要な役割を持つbHLH型転写因子である。胎生期発達過程において膵臓形成、小脳や脊髄、網膜などにおける主要な神経細胞サブタイプの運命決定、神経回路の構築、さらには視床下部のキスペプチンニューロンを介した脳の性分化にも関与するなど、多様な細胞系譜の分化過程で不可欠な役割を果たすことが明らかになってきた。その異常はヒト先天性疾患(小脳・膵臓無形成を伴う新生児糖尿病)の原因となる。}} | {{box|text= 膵臓転写因子1A (Pancreas transcription factor 1A, PTF1A)は膵臓の腺房外分泌細胞や多くの中枢神経系ニューロンの分化において重要な役割を持つbHLH型転写因子である。胎生期発達過程において膵臓形成、小脳や脊髄、網膜などにおける主要な神経細胞サブタイプの運命決定、神経回路の構築、さらには視床下部のキスペプチンニューロンを介した脳の性分化にも関与するなど、多様な細胞系譜の分化過程で不可欠な役割を果たすことが明らかになってきた。その異常はヒト先天性疾患(小脳・膵臓無形成を伴う新生児糖尿病)の原因となる。}} | ||
== | == PTF1Aとは== | ||
PTF1A(Pancreas transcription factor 1a)/ p48は、1996年に膵臓外分泌細胞で特異的に発現するbHLH型転写因子として同定され、初期には膵外分泌酵素遺伝子群のプロモーター領域に結合する3量複合体PTF1を構成する48kDaのDNA結合タンパク質として知られていた<ref name=Krapp1996><pubmed>8861960</pubmed></ref><ref name=Knöfler1996><pubmed>8756445</pubmed></ref><ref name=Rose2001><pubmed>11110790</pubmed></ref>。その後、マウスPtf1a遺伝子が膵臓外分泌細胞の分化に必須であり、腸管未分化組織から全ての膵前駆細胞への運命獲得に重要な役割を果たすことが示された<ref name=Krapp1998><pubmed>9687503</pubmed></ref><ref name=Kawaguchi2002><pubmed>11850621</pubmed></ref>。 | |||
つづいて血縁家系ゲノム連鎖解析により、PTF1A遺伝子の変異がヒト小脳・膵臓無形成を伴う新生児糖尿病と直接関連していることが報告され、PTF1Aの臨床医学的な重要性が注目された<ref name=Sellick2004><pubmed>15133510</pubmed></ref><ref name=Diabetes2003><pubmed>12525589</pubmed></ref><ref name=Hoveyda1999><pubmed>10394932</pubmed></ref><ref name=Masui2008><pubmed>18227106</pubmed></ref><ref name=Pan2013><pubmed>23364327</pubmed></ref><ref name=Burlison2008><pubmed>18162506</pubmed></ref><ref name=AlShammari2011><pubmed>21044184</pubmed></ref>。膵発生における知見は、遺伝子改変マウスを用いた膵臓形成不全モデルや膵臓がんモデルなどの構築に貢献した<ref name=Adell2000><pubmed>10714713</pubmed></ref><ref name=Masui2007><pubmed>17289922</pubmed></ref><ref name=Magnuson2013><pubmed>23395170</pubmed></ref><ref name=Fujitani2017><pubmed>28154299</pubmed></ref><ref name=VeiteSchmahl2017><pubmed>28281537</pubmed></ref><ref name=Hingorani2003><pubmed>14585359</pubmed></ref>。 | |||
神経系発達への関与については、発生中期胚の神経管背側でのmRNA発現があることで示唆されていた<ref name=Obata2001><pubmed>11442633</pubmed></ref>。2005年に小脳皮質を欠失するセレベレス変異体マウス(cerebelless)の原因遺伝子として同定され、プルキンエ細胞やゴルジ細胞などの小脳の全ての種類のGABA作動性ニューロンがPtf1aを発現する第4脳室周囲帯(ventricular zone)の神経上皮から発生することが示唆されたことから小脳抑制性ニューロンの運命決定因子であることが明らかとなった<ref name=Hoshino2005><pubmed>16157274</pubmed></ref>。また小脳では、PTF1AがOLIG2やGSX1と協調してプルキンエ細胞およびPAX2陽性介在ニューロンといった小脳抑制性ニューロンの多様性を時空間的に制御すること、PTF1Aが別のbHLH型転写因子ATOH1と拮抗し、GABA作動性神経細胞とグルタミン酸作動性神経細胞の適切な産生バランスを制御することが報告されている<ref name=Hoshino2006><pubmed>17120184</pubmed></ref><ref name=Wullimann2011><pubmed>21344019</pubmed></ref><ref name=Yamada2014><pubmed>24501365</pubmed></ref><ref name=Seto2014><pubmed>24413533</pubmed></ref><ref name=Pascual2007><pubmed>17428919</pubmed></ref><ref name=Millen2008><pubmed>18524572</pubmed></ref><ref name=Achim2013><pubmed>23740222</pubmed></ref><ref name=Lowenstein2023><pubmed>36763768</pubmed></ref><ref name=BenArie1997><pubmed>9177350</pubmed></ref><ref name=Machold2005><pubmed>16157276</pubmed></ref><ref name=Wang2005><pubmed>16157275</pubmed></ref>。 | |||
さらに、脊髄においては、PTF1Aが脊髄の背側領域(dI4–dI6)におけるGABA作動性介在ニューロンの分化に不可欠であり、感覚入力の統合や運動制御に関わる神経回路ネットワークの発達において重要な役割を果たすことが知られている<ref name=Glasgow2005><pubmed>16176951</pubmed></ref><ref name=Hori2012><pubmed>22685661</pubmed></ref>。 | |||
加えて、網膜発生過程での水平細胞とアマクリン細胞の分化に不可欠であることも示され、抑制性神経細胞の運命決定に関わるPTF1Aの機能が感覚器系にも及ぶことが明らかとなった<ref name=Fujitani2006><pubmed>16835439</pubmed></ref><ref name=Nakhai2007><pubmed>17699677</pubmed></ref><ref name=Dullin2007><pubmed>17338800</pubmed></ref>。 | |||
脳幹においては、聴覚伝達を司る蝸牛神経核のGABA作動性およびグリシン作動性ニューロンの発生に関与すること<ref name=Fujiyama2009><pubmed>19029042</pubmed></ref>、小脳プルキンエ細胞へ投射する下オリーブ核グルタミン酸作動性の登上線維ニューロンの発生に必要であることが知られている<ref name=Yamada2007><pubmed>17428964</pubmed></ref>。これは、PTF1Aの機能は抑制性ニューロンの運命決定因子としてだけでなく、グルタミン酸作動性ニューロンの産生にも関与するという新たな知見であった<ref name=Aldinger2008><pubmed>18524896</pubmed></ref>。 | |||
一方、発生期視床下部においては、性分化に関与するキスペプチンニューロンの発生に細胞非自律的に必要であることが示され、脳の性分化能の獲得に重要であることが示唆されている<ref name=Fujiyama2018><pubmed>29719267</pubmed></ref>。 | |||
このように、Ptf1a遺伝子は膵前駆細胞の運命決定だけでなく、特定の脳領域における神経細胞サブタイプの運命決定において極めて中心的な役割を果たすと考えられている。また、PTF1Aの過剰発現により、無脊椎動物であるホヤの幼生においてドーパミン神経への分化を誘導促進する<ref name=Horie2018><pubmed>29500243</pubmed></ref>。さらに、マウス大脳皮質での異所性発現では、抑制性ニューロンの特性(遺伝子発現、細胞形態、移動様式)を付与することも示されている<ref name=Hoshino2005><pubmed>16157274</pubmed></ref><ref name=Russ2015><pubmed>25926450</pubmed></ref>。 | |||
[[ファイル:Fujiyama Ptf1a Fig1.png|サムネイル|'''図1. ヒトPTF1Aの構造模式図''']] | [[ファイル:Fujiyama Ptf1a Fig1.png|サムネイル|'''図1. ヒトPTF1Aの構造模式図''']] | ||
[[ファイル:Q7RTS3.pdb|サムネイル|'''図2. ヒトPTF1A立体構造'''<br>AlphaFold予測(Q7RTS3)]] | [[ファイル:Q7RTS3.pdb|サムネイル|'''図2. ヒトPTF1A立体構造'''<br>AlphaFold予測(Q7RTS3)]] | ||
[[ファイル:Fujiyama Ptf1a Fig3.png|サムネイル|'''図3. PTF1複合体として核内E-box配列に結合している様子''']] | [[ファイル:Fujiyama Ptf1a Fig3.png|サムネイル|'''図3. PTF1複合体として核内E-box配列に結合している様子''']] | ||
== 構造 == | == 構造 == | ||
=== 一次構造 === | === 一次構造 === | ||
ヒトPTF1Aタンパク質は328アミノ酸から成り、塩基性ヘリックス・ループ・ヘリックス(basic helix-loop-helix)型DNA結合ドメインを有するClass II bHLH因子群に属する('''図1'''および'''2''')。主に核内で転写因子として機能する。PTF1Aのサブファミリーに属する因子はこれまで同定されていない。 | |||
===複合体=== | |||
=== 複合体 === | PTF1AはEタンパク質およびRBPJ(Notchシグナルの媒介因子)とともに三量複合体PTF1を形成する。まずPTF1AとEタンパク質がヘテロ二量体を形成してDNA上のE-box配列(CANNTG)に結合する。さらにこの二量体にRecombination signal Binding Protein for immunoglobulin kappa J region (RBPJ、別名mammalian Suppressor of Hairless)あるいはRecombination signal Binding Protein for immunoglobulin kappa J region-like (RBPJL)がPTF1AのC末端側トリプトファン残基を介して結合することで、三量体PTF1として転写活性を発揮する('''図3''')<ref name=Obata2001><pubmed>11442633</pubmed></ref><ref name=Duque2022><pubmed>35704392</pubmed></ref><ref name=Beres2006><pubmed>16581783</pubmed></ref>[Beres et al., MCB 200645]。 | ||
[[ファイル:Fujiyama Ptf1a Fig4.png|サムネイル|'''図4. マウス後脳神経管におけるPtf1a遺伝子発現''']] | |||
[[ファイル:Fujiyama Ptf1a Fig4.png|サムネイル|'''図4.マウス後脳神経管におけるPtf1a遺伝子発現''']] | |||
== 発現 == | == 発現 == | ||
=== 組織分布・発現時期 === | === 組織分布・発現時期 === | ||
胎生期より主に以下の発生過程の組織で観察される。 | 胎生期より主に以下の発生過程の組織で観察される。 | ||
'''膵前駆細胞 (Pancreas progenitors)'''<br> | |||
胎生期膵形成初期より発現が開始する。膵外分泌細胞系列、ランゲルハンス島ベータ細胞などの内分泌細胞や導管の前駆細胞に発現する。外分泌細胞における遺伝子発現は成体膵で継続する。膵臓における上流因子として転写因子HHEXがPTF1AおよびNKX6.1の発現を亢進することが示されている<ref name=Ito2023><pubmed>36600673</pubmed></ref>[Ito et al., Sci Rep 202366]。 | |||
'''小脳原基 (Cerebellar anlage)'''<br> | |||
前方背側部の脳室周囲帯(VZ)にmRNAおよびタンパク質の発現がみられ(ロンボメア1レベル)、GABA作動性ニューロン(プルキンエ細胞、PAX2陽性介在ニューロン、小脳核抑制性ニューロンなど)の前駆細胞に発現する('''図4''')<ref name=Hoshino2005><pubmed>16157274</pubmed></ref>[Hoshino et al., 200520]。一方、菱脳唇(rhombic lip)から産生される小脳興奮性ニューロン(顆粒細胞、小脳核興奮性ニューロンなど)の前駆細胞では他のbHLH因子であるATOH1が発現する<ref name=BenArie1997><pubmed>9177350</pubmed></ref><ref name=Machold2005><pubmed>16157276</pubmed></ref><ref name=Wang2005><pubmed>16157275</pubmed></ref>[Ben-Arie et al., Nature 199729; Machold and Fishell, Neuron 200530; Wang, Neuron 200531]。 | |||
'''後方菱脳''' <br> | |||
背側の神経上皮で発現。背側蝸牛神経核および腹側蝸牛神経核の抑制性ニューロンの前駆細胞(ロンボメア2-5レベル)<ref name=Fujiyama2009><pubmed>19029042</pubmed></ref>[Fujiyama et al., 200937]、下オリーブ核(ION)登上線維ニューロンの前駆細胞などに発現する(ロンボメア6-8レベル)<ref name=Yamada2007><pubmed>17428964</pubmed></ref>[Yamada et al., 200738]。登上線維ニューロンは分裂終了後にPTF1A発現を消失し、神経管の背側から腹側に移動する。 | |||
'''脊髄後角''' <br> | |||
神経管背側の中間領域(dI4–dI6)における抑制性介在ニューロンの前駆細胞で発現する<ref name=Glasgow2005><pubmed> | 神経管背側の中間領域(dI4–dI6)における抑制性介在ニューロンの前駆細胞で発現する<ref name=Glasgow2005><pubmed>16176951</pubmed></ref>[Glasgow et al., 200532]。この時、遠位の3' エンハンサー領域でPAX6やSOX3が上流因子として機能することや<ref name=Mona2016><pubmed>27207792</pubmed></ref>[Mona et al., DB 201663]、PTF1複合体によるautoregulation作用を含む発現調節機構が知られている<ref name=Meredith2009><pubmed>19403816</pubmed></ref>[Meredith et al., JN 200964]。 | ||
'''網膜原基''' <br> | |||
網膜形成過程の外神経芽細胞層におけるアマクリン細胞および水平細胞の前駆細胞に発現する<ref name=Fujitani2006><pubmed>16835439</pubmed></ref>[Fujitani et al., 200634]。網膜における上流因子としてFOXN4, RORβ1が知られている<ref name=Liu2013><pubmed>23863971</pubmed></ref>[Liu et al., Nat Commun 201365]。 | |||
'''前脳(終脳/間脳)''' <br> | |||
第三脳室周囲の神経上皮および未成熟ニューロンで発現する。マウスでは主にE10.5以降からE14.5までの視索前野および腹側視床下部の2カ所の神経上皮領域に発現がみられる<ref name=Fujiyama2018><pubmed>29719267</pubmed></ref>[Fujiyama et al., 201840]。 | |||
== 機能 == | == 機能 == | ||
=== 分子機能 === | === 分子機能 === | ||
PTF1AはEタンパク質およびRBPJ(Notchシグナルの媒介因子)とともに三量複合体PTF1を形成することで転写因子として機能する<ref name=Obata2001><pubmed>11442633</pubmed></ref><ref name=Duque2022><pubmed>35704392</pubmed></ref>[Obata et al., 200119; Duque et al., FEBS 202244]。 | |||
Eタンパク質 (E-protein, E12/E47, TCF3)はbHLHファミリーに属する転写因子であり、PTF1Aとヘテロ二量体を形成してDNA上のE- | Eタンパク質 (E-protein, E12/E47, TCF3)はbHLHファミリーに属する転写因子であり、PTF1Aとヘテロ二量体を形成してDNA上のE-box配列(CANNTG)に結合する。さらにこの二量体にRBPJがPTF1AのC末端側トリプトファン残基を介して結合することで、三量体PTF1として転写活性を発揮する('''図3''')<ref name=Beres2006><pubmed>16581783</pubmed></ref>[Beres et al., MCB 200645]。 | ||
RBPJおよびRBPJLはいずれもNotchシグナル経路の中心的転写因子として知られ、DNA上のTC-box配列に結合する。活性化には補助因子との複合体形成が必要である。特に、膵外分泌酵素(elastase-1, amylase)の遺伝子や脊髄、網膜のGABA神経系分化関連遺伝子に対する転写制御においてPTF1複合体形成が転写活性に不可欠である<ref name=Masui2007><pubmed>17289922</pubmed></ref><ref name=Masui2010><pubmed>20398664</pubmed></ref><ref name=Hori2008><pubmed>18227107</pubmed></ref><ref name=Lelievre2011><pubmed>21270207</pubmed></ref>[Masui et al., Genes Dev 200714; Masui et al., Gastroenterology 201046; Hori et al., Genes and Dev 200847; Lelièvre et al., DB 201148]。 | |||
主な下流遺伝子を'''表1'''に示す。 | 主な下流遺伝子を'''表1'''に示す。 | ||
| 80行目: | 67行目: | ||
! 参考文献 | ! 参考文献 | ||
|- | |- | ||
| ''' | | '''Prdm13''' | ||
| | | | ||
小脳GABA作動性ニューロン、視床下部キスペプチンニューロンの発生(マウス・ヒト)<br> | 小脳GABA作動性ニューロン、視床下部キスペプチンニューロンの発生(マウス・ヒト)<br> | ||
脊髄体性感覚サーキットにおけるE-Iバランス調整<br> | 脊髄体性感覚サーキットにおけるE-Iバランス調整<br> | ||
網膜アマクリン細胞の発生 | 網膜アマクリン細胞の発生 | ||
| <ref name=Hanotel2014><pubmed> | | <ref name=Hanotel2014><pubmed>25224256</pubmed></ref><ref name=Whittaker2021><pubmed>33792217</pubmed></ref><ref name=Chang2013><pubmed>24012334</pubmed></ref><ref name=Watanabe2015><pubmed>25762683</pubmed></ref> | ||
|- | |- | ||
| ''' | | '''Tfap2a, Tfap2b''' | ||
| | | | ||
網膜におけるアマクリン細胞と水平細胞の分化 | 網膜におけるアマクリン細胞と水平細胞の分化 | ||
| <ref name=Jin2015><pubmed> | | <ref name=Jin2015><pubmed>26047685</pubmed></ref> | ||
|- | |- | ||
| ''' | | '''Nephrin, Neph3''' | ||
| | | | ||
後脳〜脊髄領域での発現促進に必要 | 後脳〜脊髄領域での発現促進に必要 | ||
| <ref name=Nishida2010><pubmed> | | <ref name=Nishida2010><pubmed>20061380</pubmed></ref> | ||
|- | |- | ||
| ''' | | '''Neurog2''' | ||
| | | | ||
脊髄における発現制御 | 脊髄における発現制御 | ||
| <ref name=Henke2009><pubmed> | | <ref name=Henke2009><pubmed>19700622</pubmed></ref> | ||
|- | |- | ||
| ''' | | '''Pdx1''' | ||
| | | | ||
プロモーター領域に結合し発現促進 | プロモーター領域に結合し発現促進 | ||
| <ref name=Wiebe2007><pubmed> | | <ref name=Wiebe2007><pubmed>17515604</pubmed></ref> | ||
|} | |} | ||
標的遺伝子領域のクロマチンのエピジェネティック修飾状態(ヒストン修飾、DNAメチル化など)がPTF1Aの結合効率に影響を与える可能性がある。一例として、PTF1複合体が標的とする膵臓遺伝子や神経管遺伝子のCANNTGモチーフ配列付近におけるオープンクロマチン状態が、標的遺伝子の発現に影響を与えることが示されている<ref name=Meredith2013><pubmed>23671184</pubmed></ref>[Meredith et al., MCB 201360]。 | |||
C末端側リジン残基を介してE3リガーゼのTRIP12によりユビキチン化プロテアソーム分解制御を受けることが知られている<ref name=Hanoun2014><pubmed>24599952</pubmed></ref>[Hanoun et al., JBC 201449]。またPCAF(P300/CBPコアクチベーターファミリー)によるbHLHドメイン内リジン残基のアセチル化が転写活性に必要であることが報告されている<ref name=Rodolosse2009><pubmed>19346520</pubmed></ref>[Rodolosse et al., 200950]。AKTキナーゼによるセリン残基リン酸化を介した活性制御の可能性があるが、詳細は不明<ref name=Jin2019><pubmed>30808811</pubmed></ref>[Jin and Xiang, 201951]。 | |||
=== 組織・個体レベル=== | |||
=== 組織・個体レベル === | PTF1Aは膵臓発達のみならず、中枢神経系における多様なニューロンの運命決定および領域特異的な神経ネットワーク形成に中心的な役割を果たしている。 | ||
以下に主要な神経領域および膵臓でのPTF1Aの機能を示す。 | |||
===== 脊髄後角前駆細胞 ===== | ====神経系 ==== | ||
脊髄の背側領域(dI4–dI6)においてGABA作動性抑制性介在ニューロンの分化を誘導する<ref name=Glasgow2005><pubmed> | ===== 小脳原基===== | ||
第4脳室周囲帯でGABA作動性ニューロン(プルキンエ細胞、PAX2陽性介在ニューロン、小脳核抑制性ニューロン)の細胞分化を促進し、抑制性ニューロンへの運命決定を誘導する<ref name=Hoshino2005><pubmed>16157274</pubmed></ref><ref name=Pascual2007><pubmed>17428919</pubmed></ref>[Hoshino et al., 200520; Pascual et al., PNAS 200725]。Ptf1aの欠損により小脳皮質が消失し、抑制性ニューロンが橋核ニューロンへと運命転換されるなど、小脳皮質の正常な発生が阻害される<ref name=Millen2014><pubmed>25187558</pubmed></ref>[Millen et al., PNAS 201467]。さらに、菱脳より後方の神経管においてPTF1AとATOH1は相互に影響を与えつつ機能する<ref name=Yamada2014><pubmed>24501365</pubmed></ref>[Yamada et al., JN 201423]。 | |||
===== 脊髄後角前駆細胞===== | |||
脊髄の背側領域(dI4–dI6)においてGABA作動性抑制性介在ニューロンの分化を誘導する<ref name=Glasgow2005><pubmed>16176951</pubmed></ref><ref name=Hori2012><pubmed>22685661</pubmed></ref>[Glasgow et al., Development 200532; Hori and Hoshino, Neural Plast 201233]。また、RBPJとの相互作用が脊髄GABAニューロンの発生に重要である<ref name=Hori2008><pubmed>18227107</pubmed></ref>[Hori et al., Genes and Dev 200847]。さらに、体性感覚や痛みなど脊髄の感覚情報処理や運動制御に関与する抑制性神経回路形成を促す<ref name=Huang2008><pubmed>18385355</pubmed></ref><ref name=Chang2013><pubmed>24012334</pubmed></ref><ref name=Bikoff2016><pubmed>27387990</pubmed></ref><ref name=Zhang2017><pubmed>28111075</pubmed></ref><ref name=Escalante2020><pubmed>32877698</pubmed></ref>[Huang et al., 2008 DB68; Chang et al., Dev Cell 201354; Bikoff et al., 2016 Cell69; Zhang et al., Cell Reports 201770; Escalante and Klein, Cell Rep 202071]。 | |||
===== 網膜原基 ===== | ===== 網膜原基 ===== | ||
網膜形成過程の外神経芽細胞層において、視覚処理に関与する抑制性介在ニューロン(アマクリン細胞および水平細胞)の運命を決定する(マウス、ゼブラフィッシュ、ツメガエルなどでの研究)<ref name=Nakhai2007><pubmed>17699677</pubmed></ref><ref name=Dullin2007><pubmed>17338800</pubmed></ref><ref name=Jusuf2009><pubmed>19642992</pubmed></ref><ref name=Jusuf2011><pubmed>21307263</pubmed></ref><ref name=Mazurier2014><pubmed>25271861</pubmed></ref><ref name=Bessodes2017><pubmed>28915834</pubmed></ref>[Nakhai et al., Development 2007; Dullin et al., BMC Dev Biol 2007; Jusuf and Harris, Neural Dev 2009; Jusuf et al., JN 2011; Mazurier et al., PLOS One 2014; Bessodes et al., Neural Dev 201735,36,72–75]。 | |||
Ptf1a欠損では、これらの細胞が網膜神経節細胞へ運命転換を起こす(マウスおよびニワトリでの研究)<ref name=Fujitani2006><pubmed>16835439</pubmed></ref><ref name=Lelievre2011><pubmed>21270207</pubmed></ref>[Fujitani et al., Development 2006; Lelièvre et al., DB 201134,48]。さらに、アマクリン細胞と共通する性質を持つ幼生ホヤのDAドーパミン細胞の発達にも関与する<ref name=RazyKrajka2012><pubmed>23185947</pubmed></ref>[Razy-Krajka et al., BMC Biol 201276]。 | |||
===== 後方菱脳神経上皮===== | |||
後方菱脳神経上皮は蝸牛神経核、下オリーブ核、孤束核、三叉神経核などの前駆細胞である。ロンボメア2-5レベルでは、マウスにおいて聴覚入力処理に関与する蝸牛神経核(cochlear nucleus)を構成する主要なニューロン産生に関与し、GABA作動性およびグリシン作動性の抑制性ニューロン(Cartwheel細胞、ゴルジ細胞など)の細胞運命を決定する<ref name=Fujiyama2009><pubmed>19029042</pubmed></ref>[Fujiyama et al., 2009 Development37]。 | |||
一方、蝸牛神経核の興奮性ニューロン分化はATOH1が関与する<ref name=Maricich2009><pubmed>19741118</pubmed></ref>[Maricich et al., JN 200977]。 | |||
ロンボメア6-8レベルでは、下オリーブ核(inferior olivary nucleus)を構成するグルタミン酸作動性登上線維ニューロンの細胞運命を決定する<ref name=Yamada2007><pubmed>17428964</pubmed></ref><ref name=Bae2009><pubmed>19389374</pubmed></ref>[Yamada et al., 2007 JN; Bae et al., DB 200938,78]。 | |||
登上線維ニューロンは分裂終了後に神経管の背側から腹側に移動するが、Ptf1a欠失により登上線維ニューロンが産生されず結果として下オリーブ核が消失する。 | |||
また、らせん神経節ニューロンの蝸牛神経核内部における正常な投射様式の形成にも必要である<ref name=Elliott2023><pubmed>36775222</pubmed></ref>[Elliott et al., Neuroscience Letters 202379]。 | |||
さらに、内臓感覚および体性感覚の脳幹神経核の発生にも関与することが報告されており、孤束核や三叉神経脊髄路核・主知覚核(Nucleus of solitary tract, spinal and principal trigeminal nuclei)を構成するニューロンや<ref name=Iskusnykh2016><pubmed>27335480</pubmed></ref>[Iskusnykh et al., JN 201680]、ニワトリのdB1 hindbrain interneuronの運命決定に関与する<ref name=Kohl2015><pubmed>26235646</pubmed></ref>[Kohl et al., JN 201581]。 | |||
===== 前脳(終脳/間脳)、視床下部前駆細胞 ===== | ===== 前脳(終脳/間脳)、視床下部前駆細胞 ===== | ||
マウス視床下部におけるPtf1a機能喪失により、脳の性分化に関与するキスペプチンニューロン数が顕著に減少し、性特異的行動および性腺発達に異常を引き起こす<ref name=Fujiyama2018><pubmed>29719267</pubmed></ref>[Fujiyama et al., Cel Rep 201840]。Ptf1a陽性の神経前駆細胞は内側視索前野や腹内側核などを含む複数の視床下部神経核ニューロン系譜を形成するが、集団としての生理的機能は不明である。 | |||
====膵臓形成==== | |||
==== 膵臓形成 ==== | 胎生期膵形成初期において、外分泌細胞系列の分化を促進し、ランゲルハンス島内分泌細胞や導管の前駆細胞の運命決定にも関与する。 | ||
Ptf1a欠損マウスでは膵臓の外分泌細胞が欠落し、膵器官も無形成となる<ref name=Kawaguchi2002><pubmed>11850621</pubmed></ref><ref name=Sellick2004><pubmed>15133510</pubmed></ref>[Kawaguchi 2002, Sellick 20045,6]。またRBPJとの相互作用が膵臓の正常発生に重要である<ref name=Masui2007><pubmed>17289922</pubmed></ref>[Masui et al., Genes Dev 200714]。さらに、Ptf1a遺伝子の発現量の多寡が膵臓の分化、成長、総β細胞数、島形態形成、および内分泌機能に影響を与えることが示されている<ref name=Fukuda2008><pubmed>18252893</pubmed></ref>[Diabetes 2008, Fukuda et al.82]。成体の外分泌腺房細胞におけるPtf1a欠失が、ERストレスを介してアポトーシスを引き起こすことも知られている<ref name=Sakikubo2018><pubmed>29991721</pubmed></ref>[Sci Rep 2018, Sakikubo et al.83]。 | |||
転写因子PTF1AとNKX6.1が互いに抑制し合うcross-repressiveな作用により、先端(tip)領域と基部(trunk)領域の境界で細胞分化の運命決定がなされる<ref name=Schaffer2010><pubmed>21145504</pubmed></ref>[Schaffer et al., Developmental Cell 201061]。Tip領域の膵外分泌(腺房)前駆細胞ではPTF1AがDll1の発現を活性化し、このDll1によって隣接細胞のNotch経路が活性化されHes1が誘導されることで内分泌細胞への分化が抑制される側方抑制機構が働く<ref name=AhnfeltRonne2012><pubmed>22745315</pubmed></ref>[Ahnfelt-Rønne et al., Development 201262]。NKX6.1が発現するtrunk領域の細胞では、Notchシグナルと協調して内分泌・導管分化が促進される<ref name=Schaffer2010><pubmed>21145504</pubmed></ref>[Schaffer et al., Developmental Cell 201061]。 | |||
== 疾患との関わり == | == 疾患との関わり == | ||
PTF1A遺伝子の機能喪失型変異のホモ接合により、常染色体潜性遺伝性の膵形成不全と小脳形成不全が随伴する新生児糖尿病を引き起こすことが知られている<ref name=Hoveyda1999><pubmed>10394932</pubmed></ref><ref name=Sellick2003><pubmed>12525589</pubmed></ref><ref name=Sellick2004><pubmed>15133510</pubmed></ref><ref name=AlShammari2011><pubmed>21044184</pubmed></ref>[Hoveyda et al., 1999 J Med Genet; Sellick et al., Diabetes 2003; Sellick et al 2004; Al-Shammari et al., Clinical Genetics 20116–8,12]。膵発達不全に伴い、膵内分泌細胞形成にも影響が及ぶため、インスリン注入に反応しない重度の高血糖状態が観察される<ref name=Sellick2004><pubmed>15133510</pubmed></ref>[Sellick et al., 2004 Nat Genet6]。 | |||
==関連項目== | ==関連項目== | ||
2025年9月28日 (日) 00:31時点における版
Pancreas transcription factor 1a PTF1A
膵臓転写因子1A (Pancreas transcription factor 1A, PTF1A)は膵臓の腺房外分泌細胞や多くの中枢神経系ニューロンの分化において重要な役割を持つbHLH型転写因子である。胎生期発達過程において膵臓形成、小脳や脊髄、網膜などにおける主要な神経細胞サブタイプの運命決定、神経回路の構築、さらには視床下部のキスペプチンニューロンを介した脳の性分化にも関与するなど、多様な細胞系譜の分化過程で不可欠な役割を果たすことが明らかになってきた。その異常はヒト先天性疾患(小脳・膵臓無形成を伴う新生児糖尿病)の原因となる。
PTF1Aとは
PTF1A(Pancreas transcription factor 1a)/ p48は、1996年に膵臓外分泌細胞で特異的に発現するbHLH型転写因子として同定され、初期には膵外分泌酵素遺伝子群のプロモーター領域に結合する3量複合体PTF1を構成する48kDaのDNA結合タンパク質として知られていた[1][2][3]。その後、マウスPtf1a遺伝子が膵臓外分泌細胞の分化に必須であり、腸管未分化組織から全ての膵前駆細胞への運命獲得に重要な役割を果たすことが示された[4][5]。
つづいて血縁家系ゲノム連鎖解析により、PTF1A遺伝子の変異がヒト小脳・膵臓無形成を伴う新生児糖尿病と直接関連していることが報告され、PTF1Aの臨床医学的な重要性が注目された[6][7][8][9][10][11][12]。膵発生における知見は、遺伝子改変マウスを用いた膵臓形成不全モデルや膵臓がんモデルなどの構築に貢献した[13][14][15][16][17][18]。
神経系発達への関与については、発生中期胚の神経管背側でのmRNA発現があることで示唆されていた[19]。2005年に小脳皮質を欠失するセレベレス変異体マウス(cerebelless)の原因遺伝子として同定され、プルキンエ細胞やゴルジ細胞などの小脳の全ての種類のGABA作動性ニューロンがPtf1aを発現する第4脳室周囲帯(ventricular zone)の神経上皮から発生することが示唆されたことから小脳抑制性ニューロンの運命決定因子であることが明らかとなった[20]。また小脳では、PTF1AがOLIG2やGSX1と協調してプルキンエ細胞およびPAX2陽性介在ニューロンといった小脳抑制性ニューロンの多様性を時空間的に制御すること、PTF1Aが別のbHLH型転写因子ATOH1と拮抗し、GABA作動性神経細胞とグルタミン酸作動性神経細胞の適切な産生バランスを制御することが報告されている[21][22][23][24][25][26][27][28][29][30][31]。
さらに、脊髄においては、PTF1Aが脊髄の背側領域(dI4–dI6)におけるGABA作動性介在ニューロンの分化に不可欠であり、感覚入力の統合や運動制御に関わる神経回路ネットワークの発達において重要な役割を果たすことが知られている[32][33]。
加えて、網膜発生過程での水平細胞とアマクリン細胞の分化に不可欠であることも示され、抑制性神経細胞の運命決定に関わるPTF1Aの機能が感覚器系にも及ぶことが明らかとなった[34][35][36]。
脳幹においては、聴覚伝達を司る蝸牛神経核のGABA作動性およびグリシン作動性ニューロンの発生に関与すること[37]、小脳プルキンエ細胞へ投射する下オリーブ核グルタミン酸作動性の登上線維ニューロンの発生に必要であることが知られている[38]。これは、PTF1Aの機能は抑制性ニューロンの運命決定因子としてだけでなく、グルタミン酸作動性ニューロンの産生にも関与するという新たな知見であった[39]。
一方、発生期視床下部においては、性分化に関与するキスペプチンニューロンの発生に細胞非自律的に必要であることが示され、脳の性分化能の獲得に重要であることが示唆されている[40]。
このように、Ptf1a遺伝子は膵前駆細胞の運命決定だけでなく、特定の脳領域における神経細胞サブタイプの運命決定において極めて中心的な役割を果たすと考えられている。また、PTF1Aの過剰発現により、無脊椎動物であるホヤの幼生においてドーパミン神経への分化を誘導促進する[41]。さらに、マウス大脳皮質での異所性発現では、抑制性ニューロンの特性(遺伝子発現、細胞形態、移動様式)を付与することも示されている[20][42]。
AlphaFold予測(Q7RTS3)
構造
一次構造
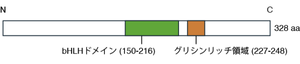
ヒトPTF1Aタンパク質は328アミノ酸から成り、塩基性ヘリックス・ループ・ヘリックス(basic helix-loop-helix)型DNA結合ドメインを有するClass II bHLH因子群に属する(図1および2)。主に核内で転写因子として機能する。PTF1Aのサブファミリーに属する因子はこれまで同定されていない。
複合体
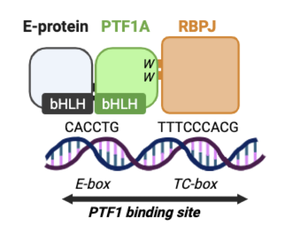
PTF1AはEタンパク質およびRBPJ(Notchシグナルの媒介因子)とともに三量複合体PTF1を形成する。まずPTF1AとEタンパク質がヘテロ二量体を形成してDNA上のE-box配列(CANNTG)に結合する。さらにこの二量体にRecombination signal Binding Protein for immunoglobulin kappa J region (RBPJ、別名mammalian Suppressor of Hairless)あるいはRecombination signal Binding Protein for immunoglobulin kappa J region-like (RBPJL)がPTF1AのC末端側トリプトファン残基を介して結合することで、三量体PTF1として転写活性を発揮する(図3)[19][43][44][Beres et al., MCB 200645]。
発現
組織分布・発現時期
胎生期より主に以下の発生過程の組織で観察される。
膵前駆細胞 (Pancreas progenitors)
胎生期膵形成初期より発現が開始する。膵外分泌細胞系列、ランゲルハンス島ベータ細胞などの内分泌細胞や導管の前駆細胞に発現する。外分泌細胞における遺伝子発現は成体膵で継続する。膵臓における上流因子として転写因子HHEXがPTF1AおよびNKX6.1の発現を亢進することが示されている[45][Ito et al., Sci Rep 202366]。
小脳原基 (Cerebellar anlage)
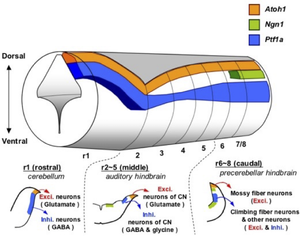
前方背側部の脳室周囲帯(VZ)にmRNAおよびタンパク質の発現がみられ(ロンボメア1レベル)、GABA作動性ニューロン(プルキンエ細胞、PAX2陽性介在ニューロン、小脳核抑制性ニューロンなど)の前駆細胞に発現する(図4)[20][Hoshino et al., 200520]。一方、菱脳唇(rhombic lip)から産生される小脳興奮性ニューロン(顆粒細胞、小脳核興奮性ニューロンなど)の前駆細胞では他のbHLH因子であるATOH1が発現する[29][30][31][Ben-Arie et al., Nature 199729; Machold and Fishell, Neuron 200530; Wang, Neuron 200531]。
後方菱脳
背側の神経上皮で発現。背側蝸牛神経核および腹側蝸牛神経核の抑制性ニューロンの前駆細胞(ロンボメア2-5レベル)[37][Fujiyama et al., 200937]、下オリーブ核(ION)登上線維ニューロンの前駆細胞などに発現する(ロンボメア6-8レベル)[38][Yamada et al., 200738]。登上線維ニューロンは分裂終了後にPTF1A発現を消失し、神経管の背側から腹側に移動する。
脊髄後角
神経管背側の中間領域(dI4–dI6)における抑制性介在ニューロンの前駆細胞で発現する[32][Glasgow et al., 200532]。この時、遠位の3' エンハンサー領域でPAX6やSOX3が上流因子として機能することや[46][Mona et al., DB 201663]、PTF1複合体によるautoregulation作用を含む発現調節機構が知られている[47][Meredith et al., JN 200964]。
網膜原基
網膜形成過程の外神経芽細胞層におけるアマクリン細胞および水平細胞の前駆細胞に発現する[34][Fujitani et al., 200634]。網膜における上流因子としてFOXN4, RORβ1が知られている[48][Liu et al., Nat Commun 201365]。
前脳(終脳/間脳)
第三脳室周囲の神経上皮および未成熟ニューロンで発現する。マウスでは主にE10.5以降からE14.5までの視索前野および腹側視床下部の2カ所の神経上皮領域に発現がみられる[40][Fujiyama et al., 201840]。
機能
分子機能
PTF1AはEタンパク質およびRBPJ(Notchシグナルの媒介因子)とともに三量複合体PTF1を形成することで転写因子として機能する[19][43][Obata et al., 200119; Duque et al., FEBS 202244]。
Eタンパク質 (E-protein, E12/E47, TCF3)はbHLHファミリーに属する転写因子であり、PTF1Aとヘテロ二量体を形成してDNA上のE-box配列(CANNTG)に結合する。さらにこの二量体にRBPJがPTF1AのC末端側トリプトファン残基を介して結合することで、三量体PTF1として転写活性を発揮する(図3)[44][Beres et al., MCB 200645]。
RBPJおよびRBPJLはいずれもNotchシグナル経路の中心的転写因子として知られ、DNA上のTC-box配列に結合する。活性化には補助因子との複合体形成が必要である。特に、膵外分泌酵素(elastase-1, amylase)の遺伝子や脊髄、網膜のGABA神経系分化関連遺伝子に対する転写制御においてPTF1複合体形成が転写活性に不可欠である[14][49][50][51][Masui et al., Genes Dev 200714; Masui et al., Gastroenterology 201046; Hori et al., Genes and Dev 200847; Lelièvre et al., DB 201148]。
主な下流遺伝子を表1に示す。
| 遺伝子 | 機能・役割 | 参考文献 |
|---|---|---|
| Prdm13 |
小脳GABA作動性ニューロン、視床下部キスペプチンニューロンの発生(マウス・ヒト) |
[52][53][54][55] |
| Tfap2a, Tfap2b |
網膜におけるアマクリン細胞と水平細胞の分化 |
[56] |
| Nephrin, Neph3 |
後脳〜脊髄領域での発現促進に必要 |
[57] |
| Neurog2 |
脊髄における発現制御 |
[58] |
| Pdx1 |
プロモーター領域に結合し発現促進 |
[59] |
標的遺伝子領域のクロマチンのエピジェネティック修飾状態(ヒストン修飾、DNAメチル化など)がPTF1Aの結合効率に影響を与える可能性がある。一例として、PTF1複合体が標的とする膵臓遺伝子や神経管遺伝子のCANNTGモチーフ配列付近におけるオープンクロマチン状態が、標的遺伝子の発現に影響を与えることが示されている[60][Meredith et al., MCB 201360]。
C末端側リジン残基を介してE3リガーゼのTRIP12によりユビキチン化プロテアソーム分解制御を受けることが知られている[61][Hanoun et al., JBC 201449]。またPCAF(P300/CBPコアクチベーターファミリー)によるbHLHドメイン内リジン残基のアセチル化が転写活性に必要であることが報告されている[62][Rodolosse et al., 200950]。AKTキナーゼによるセリン残基リン酸化を介した活性制御の可能性があるが、詳細は不明[63][Jin and Xiang, 201951]。
組織・個体レベル
PTF1Aは膵臓発達のみならず、中枢神経系における多様なニューロンの運命決定および領域特異的な神経ネットワーク形成に中心的な役割を果たしている。 以下に主要な神経領域および膵臓でのPTF1Aの機能を示す。
神経系
小脳原基
第4脳室周囲帯でGABA作動性ニューロン(プルキンエ細胞、PAX2陽性介在ニューロン、小脳核抑制性ニューロン)の細胞分化を促進し、抑制性ニューロンへの運命決定を誘導する[20][25][Hoshino et al., 200520; Pascual et al., PNAS 200725]。Ptf1aの欠損により小脳皮質が消失し、抑制性ニューロンが橋核ニューロンへと運命転換されるなど、小脳皮質の正常な発生が阻害される[64][Millen et al., PNAS 201467]。さらに、菱脳より後方の神経管においてPTF1AとATOH1は相互に影響を与えつつ機能する[23][Yamada et al., JN 201423]。
脊髄後角前駆細胞
脊髄の背側領域(dI4–dI6)においてGABA作動性抑制性介在ニューロンの分化を誘導する[32][33][Glasgow et al., Development 200532; Hori and Hoshino, Neural Plast 201233]。また、RBPJとの相互作用が脊髄GABAニューロンの発生に重要である[50][Hori et al., Genes and Dev 200847]。さらに、体性感覚や痛みなど脊髄の感覚情報処理や運動制御に関与する抑制性神経回路形成を促す[65][54][66][67][68][Huang et al., 2008 DB68; Chang et al., Dev Cell 201354; Bikoff et al., 2016 Cell69; Zhang et al., Cell Reports 201770; Escalante and Klein, Cell Rep 202071]。
網膜原基
網膜形成過程の外神経芽細胞層において、視覚処理に関与する抑制性介在ニューロン(アマクリン細胞および水平細胞)の運命を決定する(マウス、ゼブラフィッシュ、ツメガエルなどでの研究)[35][36][69][70][71][72][Nakhai et al., Development 2007; Dullin et al., BMC Dev Biol 2007; Jusuf and Harris, Neural Dev 2009; Jusuf et al., JN 2011; Mazurier et al., PLOS One 2014; Bessodes et al., Neural Dev 201735,36,72–75]。 Ptf1a欠損では、これらの細胞が網膜神経節細胞へ運命転換を起こす(マウスおよびニワトリでの研究)[34][51][Fujitani et al., Development 2006; Lelièvre et al., DB 201134,48]。さらに、アマクリン細胞と共通する性質を持つ幼生ホヤのDAドーパミン細胞の発達にも関与する[73][Razy-Krajka et al., BMC Biol 201276]。
後方菱脳神経上皮
後方菱脳神経上皮は蝸牛神経核、下オリーブ核、孤束核、三叉神経核などの前駆細胞である。ロンボメア2-5レベルでは、マウスにおいて聴覚入力処理に関与する蝸牛神経核(cochlear nucleus)を構成する主要なニューロン産生に関与し、GABA作動性およびグリシン作動性の抑制性ニューロン(Cartwheel細胞、ゴルジ細胞など)の細胞運命を決定する[37][Fujiyama et al., 2009 Development37]。
一方、蝸牛神経核の興奮性ニューロン分化はATOH1が関与する[74][Maricich et al., JN 200977]。 ロンボメア6-8レベルでは、下オリーブ核(inferior olivary nucleus)を構成するグルタミン酸作動性登上線維ニューロンの細胞運命を決定する[38][75][Yamada et al., 2007 JN; Bae et al., DB 200938,78]。
登上線維ニューロンは分裂終了後に神経管の背側から腹側に移動するが、Ptf1a欠失により登上線維ニューロンが産生されず結果として下オリーブ核が消失する。 また、らせん神経節ニューロンの蝸牛神経核内部における正常な投射様式の形成にも必要である[76][Elliott et al., Neuroscience Letters 202379]。 さらに、内臓感覚および体性感覚の脳幹神経核の発生にも関与することが報告されており、孤束核や三叉神経脊髄路核・主知覚核(Nucleus of solitary tract, spinal and principal trigeminal nuclei)を構成するニューロンや[77][Iskusnykh et al., JN 201680]、ニワトリのdB1 hindbrain interneuronの運命決定に関与する[78][Kohl et al., JN 201581]。
前脳(終脳/間脳)、視床下部前駆細胞
マウス視床下部におけるPtf1a機能喪失により、脳の性分化に関与するキスペプチンニューロン数が顕著に減少し、性特異的行動および性腺発達に異常を引き起こす[40][Fujiyama et al., Cel Rep 201840]。Ptf1a陽性の神経前駆細胞は内側視索前野や腹内側核などを含む複数の視床下部神経核ニューロン系譜を形成するが、集団としての生理的機能は不明である。
膵臓形成
胎生期膵形成初期において、外分泌細胞系列の分化を促進し、ランゲルハンス島内分泌細胞や導管の前駆細胞の運命決定にも関与する。 Ptf1a欠損マウスでは膵臓の外分泌細胞が欠落し、膵器官も無形成となる[5][6][Kawaguchi 2002, Sellick 20045,6]。またRBPJとの相互作用が膵臓の正常発生に重要である[14][Masui et al., Genes Dev 200714]。さらに、Ptf1a遺伝子の発現量の多寡が膵臓の分化、成長、総β細胞数、島形態形成、および内分泌機能に影響を与えることが示されている[79][Diabetes 2008, Fukuda et al.82]。成体の外分泌腺房細胞におけるPtf1a欠失が、ERストレスを介してアポトーシスを引き起こすことも知られている[80][Sci Rep 2018, Sakikubo et al.83]。
転写因子PTF1AとNKX6.1が互いに抑制し合うcross-repressiveな作用により、先端(tip)領域と基部(trunk)領域の境界で細胞分化の運命決定がなされる[81][Schaffer et al., Developmental Cell 201061]。Tip領域の膵外分泌(腺房)前駆細胞ではPTF1AがDll1の発現を活性化し、このDll1によって隣接細胞のNotch経路が活性化されHes1が誘導されることで内分泌細胞への分化が抑制される側方抑制機構が働く[82][Ahnfelt-Rønne et al., Development 201262]。NKX6.1が発現するtrunk領域の細胞では、Notchシグナルと協調して内分泌・導管分化が促進される[81][Schaffer et al., Developmental Cell 201061]。
疾患との関わり
PTF1A遺伝子の機能喪失型変異のホモ接合により、常染色体潜性遺伝性の膵形成不全と小脳形成不全が随伴する新生児糖尿病を引き起こすことが知られている[8][83][6][12][Hoveyda et al., 1999 J Med Genet; Sellick et al., Diabetes 2003; Sellick et al 2004; Al-Shammari et al., Clinical Genetics 20116–8,12]。膵発達不全に伴い、膵内分泌細胞形成にも影響が及ぶため、インスリン注入に反応しない重度の高血糖状態が観察される[6][Sellick et al., 2004 Nat Genet6]。
関連項目
参考文献
- ↑
Krapp, A., Knöfler, M., Frutiger, S., Hughes, G.J., Hagenbüchle, O., & Wellauer, P.K. (1996).
The p48 DNA-binding subunit of transcription factor PTF1 is a new exocrine pancreas-specific basic helix-loop-helix protein. The EMBO journal, 15(16), 4317-29. [PubMed:8861960] [PMC] [WorldCat] - ↑
Emerich, D.F., Lindner, M.D., Winn, S.R., Chen, E.Y., Frydel, B.R., & Kordower, J.H. (1996).
Implants of encapsulated human CNTF-producing fibroblasts prevent behavioral deficits and striatal degeneration in a rodent model of Huntington's disease. The Journal of neuroscience : the official journal of the Society for Neuroscience, 16(16), 5168-81. [PubMed:8756445] [PMC] [WorldCat] [DOI] - ↑
Achison, M., Elton, C.M., Hargreaves, P.G., Knight, C.G., Barnes, M.J., & Farndale, R.W. (2001).
Integrin-independent tyrosine phosphorylation of p125(fak) in human platelets stimulated by collagen. The Journal of biological chemistry, 276(5), 3167-74. [PubMed:11110790] [WorldCat] [DOI] - ↑
Lock, P., Abram, C.L., Gibson, T., & Courtneidge, S.A. (1998).
A new method for isolating tyrosine kinase substrates used to identify fish, an SH3 and PX domain-containing protein, and Src substrate. The EMBO journal, 17(15), 4346-57. [PubMed:9687503] [PMC] [WorldCat] [DOI] - ↑ 5.0 5.1
Falck, J., Petrini, J.H., Williams, B.R., Lukas, J., & Bartek, J. (2002).
The DNA damage-dependent intra-S phase checkpoint is regulated by parallel pathways. Nature genetics, 30(3), 290-4. [PubMed:11850621] [WorldCat] [DOI] - ↑ 6.0 6.1 6.2 6.3
Davila, S., Furu, L., Gharavi, A.G., Tian, X., Onoe, T., Qian, Q., ..., & Somlo, S. (2004).
Mutations in SEC63 cause autosomal dominant polycystic liver disease. Nature genetics, 36(6), 575-7. [PubMed:15133510] [WorldCat] [DOI] - ↑
Duszak, R., & Mabry, M.R. (2003).
Clinical services in interventional radiology: results from the national Medicare database and a Society of Interventional Radiology membership survey. Journal of vascular and interventional radiology : JVIR, 14(1), 75-81. [PubMed:12525589] [WorldCat] [DOI] - ↑ 8.0 8.1
Lim, A.S., Fong, Y., & Yu, S.L. (1999).
Estimates of sperm sex chromosome disomy and diploidy rates in a 47,XXY/46,XY mosaic Klinefelter patient. Human genetics, 104(5), 405-9. [PubMed:10394932] [WorldCat] [DOI] - ↑
Emaus, A., Espetvedt, S., Veierød, M.B., Ballard-Barbash, R., Furberg, A.S., Ellison, P.T., ..., & Thune, I. (2008).
17-beta-estradiol in relation to age at menarche and adult obesity in premenopausal women. Human reproduction (Oxford, England), 23(4), 919-27. [PubMed:18227106] [WorldCat] [DOI] - ↑
Zhao, J., Lambert, G., Meijer, A.H., & Rosa, F.M. (2013).
The transcription factor Vox represses endoderm development by interacting with Casanova and Pou2. Development (Cambridge, England), 140(5), 1090-9. [PubMed:23364327] [WorldCat] [DOI] - ↑
Edghill, E.L., Flanagan, S.E., Patch, A.M., Boustred, C., Parrish, A., Shields, B., ..., & Ellard, S. (2008).
Insulin mutation screening in 1,044 patients with diabetes: mutations in the INS gene are a common cause of neonatal diabetes but a rare cause of diabetes diagnosed in childhood or adulthood. Diabetes, 57(4), 1034-42. [PubMed:18162506] [PMC] [WorldCat] [DOI] - ↑ 12.0 12.1
Miyazaki, T., Yamasaki, M., Uchigashima, M., Matsushima, A., & Watanabe, M. (2011).
Cellular expression and subcellular localization of secretogranin II in the mouse hippocampus and cerebellum. The European journal of neuroscience, 33(1), 82-94. [PubMed:21044184] [WorldCat] [DOI] - ↑
Mitka, M. (2000).
Psychiatrists help survivors in the Balkans. JAMA, 283(10), 1277-8. [PubMed:10714713] [WorldCat] [DOI] - ↑ 14.0 14.1 14.2
Kjaerulff, S., Andersen, N.R., Borup, M.T., & Nielsen, O. (2007).
Cdk phosphorylation of the Ste11 transcription factor constrains differentiation-specific transcription to G1. Genes & development, 21(3), 347-59. [PubMed:17289922] [PMC] [WorldCat] [DOI] - ↑
Shi, Y.C., Lau, J., Lin, Z., Zhang, H., Zhai, L., Sperk, G., ..., & Lin, S. (2013).
Arcuate NPY controls sympathetic output and BAT function via a relay of tyrosine hydroxylase neurons in the PVN. Cell metabolism, 17(2), 236-48. [PubMed:23395170] [WorldCat] [DOI] - ↑
Kikusui, T., & Mogi, K. (2017).
[Emotional changes induced by social stress in juvenile period]. Nihon yakurigaku zasshi. Folia pharmacologica Japonica, 149(2), 66-71. [PubMed:28154299] [WorldCat] [DOI] - ↑
Maoz, N., & Buganim, Y. (2017).
Moving towards totipotency without a single miR-acle. Cell research, 27(5), 600-601. [PubMed:28281537] [PMC] [WorldCat] [DOI] - ↑
Jeffers, J.R., Parganas, E., Lee, Y., Yang, C., Wang, J., Brennan, J., ..., & Zambetti, G.P. (2003).
Puma is an essential mediator of p53-dependent and -independent apoptotic pathways. Cancer cell, 4(4), 321-8. [PubMed:14585359] [WorldCat] [DOI] - ↑ 19.0 19.1 19.2
Lorén, C.E., Scully, A., Grabbe, C., Edeen, P.T., Thomas, J., McKeown, M., ..., & Palmer, R.H. (2001).
Identification and characterization of DAlk: a novel Drosophila melanogaster RTK which drives ERK activation in vivo. Genes to cells : devoted to molecular & cellular mechanisms, 6(6), 531-44. [PubMed:11442633] [PMC] [WorldCat] [DOI] - ↑ 20.0 20.1 20.2 20.3
Braz, J.M., Nassar, M.A., Wood, J.N., & Basbaum, A.I. (2005).
Parallel "pain" pathways arise from subpopulations of primary afferent nociceptor. Neuron, 47(6), 787-93. [PubMed:16157274] [WorldCat] [DOI] - ↑
de Gortázar, A.R., Alonso, V., Alvarez-Arroyo, M.V., & Esbrit, P. (2006).
Transient exposure to PTHrP (107-139) exerts anabolic effects through vascular endothelial growth factor receptor 2 in human osteoblastic cells in vitro. Calcified tissue international, 79(5), 360-9. [PubMed:17120184] [WorldCat] [DOI] - ↑
Amerena, J., Chen, S.A., Sriratanasathavorn, C., Cho, J.G., Dejia, H., Omar, R., ..., & King, A. (2011).
An Observational, Prospective Survey Assessing the Control of Atrial Fibrillation in Asia Pacific: Rationale and Design of the RecordAF-AP Registry. Clinical Medicine Insights. Cardiology, 5, 1-6. [PubMed:21344019] [PMC] [WorldCat] [DOI] - ↑ 23.0 23.1
Ljubojevic, V., Luu, P., & De Rosa, E. (2014).
Cholinergic contributions to supramodal attentional processes in rats. The Journal of neuroscience : the official journal of the Society for Neuroscience, 34(6), 2264-75. [PubMed:24501365] [PMC] [WorldCat] [DOI] - ↑
Grodzinski, P., & Farrell, D. (2014).
Future opportunities in cancer nanotechnology--NCI strategic workshop report. Cancer research, 74(5), 1307-10. [PubMed:24413533] [PMC] [WorldCat] [DOI] - ↑ 25.0 25.1
Sun, L.P., Seemann, J., Goldstein, J.L., & Brown, M.S. (2007).
Sterol-regulated transport of SREBPs from endoplasmic reticulum to Golgi: Insig renders sorting signal in Scap inaccessible to COPII proteins. Proceedings of the National Academy of Sciences of the United States of America, 104(16), 6519-26. [PubMed:17428919] [PMC] [WorldCat] [DOI] - ↑
Thomas, J.L., Mack, V.L., Glow, J.A., Moshkelani, D., Terrell, J.R., & Bucholtz, K.M. (2008).
Structure/function of the inhibition of human 3beta-hydroxysteroid dehydrogenase type 1 and type 2 by trilostane. The Journal of steroid biochemistry and molecular biology, 111(1-2), 66-73. [PubMed:18524572] [PMC] [WorldCat] [DOI] - ↑
Rhodes, A.M., & Segre, L.S. (2013).
Perinatal depression: a review of US legislation and law. Archives of women's mental health, 16(4), 259-70. [PubMed:23740222] [PMC] [WorldCat] [DOI] - ↑
Kim, D., & Kang, H.Y. (2023).
Rapid improvement of refractory generalized granuloma annulare with the Janus kinase inhibitor baricitinib in two patients. Clinical and experimental dermatology, 48(4), 375-376. [PubMed:36763768] [WorldCat] [DOI] - ↑ 29.0 29.1
Pan, Y., Lloyd, C., Zhou, H., Dolich, S., Deeds, J., Gonzalo, J.A., ..., & Gearing, D. (1997).
Neurotactin, a membrane-anchored chemokine upregulated in brain inflammation. Nature, 387(6633), 611-7. [PubMed:9177350] [WorldCat] [DOI] - ↑ 30.0 30.1
Tozuka, Y., Fukuda, S., Namba, T., Seki, T., & Hisatsune, T. (2005).
GABAergic excitation promotes neuronal differentiation in adult hippocampal progenitor cells. Neuron, 47(6), 803-15. [PubMed:16157276] [WorldCat] [DOI] - ↑ 31.0 31.1
Lee, J.L., Di Ciano, P., Thomas, K.L., & Everitt, B.J. (2005).
Disrupting reconsolidation of drug memories reduces cocaine-seeking behavior. Neuron, 47(6), 795-801. [PubMed:16157275] [WorldCat] [DOI] - ↑ 32.0 32.1 32.2
Xu, J., Rosoff, W.J., Urbach, J.S., & Goodhill, G.J. (2005).
Adaptation is not required to explain the long-term response of axons to molecular gradients. Development (Cambridge, England), 132(20), 4545-52. [PubMed:16176951] [WorldCat] [DOI] - ↑ 33.0 33.1
Mustafa, R., Ahmed, S., Gupta, A., & Venuto, R.C. (2012).
A comprehensive review of hypertension in pregnancy. Journal of pregnancy, 2012, 105918. [PubMed:22685661] [PMC] [WorldCat] [DOI] - ↑ 34.0 34.1 34.2
Inman, K.E., & Downs, K.M. (2006).
Brachyury is required for elongation and vasculogenesis in the murine allantois. Development (Cambridge, England), 133(15), 2947-59. [PubMed:16835439] [WorldCat] [DOI] - ↑ 35.0 35.1
Kanemaru, K., Okubo, Y., Hirose, K., & Iino, M. (2007).
Regulation of neurite growth by spontaneous Ca2+ oscillations in astrocytes. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(33), 8957-66. [PubMed:17699677] [PMC] [WorldCat] [DOI] - ↑ 36.0 36.1
Berner, D., Fischer, J., & Biedermann, T. (2007).
Emergencies in allergy practice. Journal der Deutschen Dermatologischen Gesellschaft = Journal of the German Society of Dermatology : JDDG, 5(3), 230-45. [PubMed:17338800] [WorldCat] [DOI] - ↑ 37.0 37.1 37.2
Anas, M.K., Lee, M.B., Zhou, C., Hammer, M.A., Slow, S., Karmouch, J., ..., & Baltz, J.M. (2008).
SIT1 is a betaine/proline transporter that is activated in mouse eggs after fertilization and functions until the 2-cell stage. Development (Cambridge, England), 135(24), 4123-30. [PubMed:19029042] [WorldCat] [DOI] - ↑ 38.0 38.1 38.2
Birukova, A.A., Alekseeva, E., Mikaelyan, A., & Birukov, K.G. (2007).
HGF attenuates thrombin-induced endothelial permeability by Tiam1-mediated activation of the Rac pathway and by Tiam1/Rac-dependent inhibition of the Rho pathway. FASEB journal : official publication of the Federation of American Societies for Experimental Biology, 21(11), 2776-86. [PubMed:17428964] [WorldCat] [DOI] - ↑
Ito-Ishida, A., Miura, E., Emi, K., Matsuda, K., Iijima, T., Kondo, T., ..., & Yuzaki, M. (2008).
Cbln1 regulates rapid formation and maintenance of excitatory synapses in mature cerebellar Purkinje cells in vitro and in vivo. The Journal of neuroscience : the official journal of the Society for Neuroscience, 28(23), 5920-30. [PubMed:18524896] [PMC] [WorldCat] [DOI] - ↑ 40.0 40.1 40.2
Wilderman, A., VanOudenhove, J., Kron, J., Noonan, J.P., & Cotney, J. (2018).
High-Resolution Epigenomic Atlas of Human Embryonic Craniofacial Development. Cell reports, 23(5), 1581-1597. [PubMed:29719267] [PMC] [WorldCat] [DOI] - ↑
Hatayama, T., Segawa, R., Mizuno, N., Eguchi, S., Akamatsu, H., Fukuda, M., ..., & Hirasawa, N. (2018).
All-Trans Retinoic Acid Enhances Antibody Production by Inducing the Expression of Thymic Stromal Lymphopoietin Protein. Journal of immunology (Baltimore, Md. : 1950), 200(8), 2670-2676. [PubMed:29500243] [WorldCat] [DOI] - ↑
Sparling, J.S., Bretzner, F., Biernaskie, J., Assinck, P., Jiang, Y., Arisato, H., ..., & Tetzlaff, W. (2015).
Schwann cells generated from neonatal skin-derived precursors or neonatal peripheral nerve improve functional recovery after acute transplantation into the partially injured cervical spinal cord of the rat. The Journal of neuroscience : the official journal of the Society for Neuroscience, 35(17), 6714-30. [PubMed:25926450] [PMC] [WorldCat] [DOI] - ↑ 43.0 43.1
Coulter, M., Entizne, J.C., Guo, W., Bayer, M., Wonneberger, R., Milne, L., ..., & Zhang, R. (2022).
BaRTv2: a highly resolved barley reference transcriptome for accurate transcript-specific RNA-seq quantification. The Plant journal : for cell and molecular biology, 111(4), 1183-1202. [PubMed:35704392] [PMC] [WorldCat] [DOI] - ↑ 44.0 44.1
Hosoda, N., Lejeune, F., & Maquat, L.E. (2006).
Evidence that poly(A) binding protein C1 binds nuclear pre-mRNA poly(A) tails. Molecular and cellular biology, 26(8), 3085-97. [PubMed:16581783] [PMC] [WorldCat] [DOI] - ↑
Petriceks, A.H. (2023).
Knowing one's neighbor: Existential solidarity in W.H. Auden's The Age of Anxiety. Palliative & supportive care, 21(6), 1093-1094. [PubMed:36600673] [WorldCat] [DOI] - ↑
Sun, C., Dotti, G., & Savoldo, B. (2016).
Utilizing cell-based therapeutics to overcome immune evasion in hematologic malignancies. Blood, 127(26), 3350-9. [PubMed:27207792] [PMC] [WorldCat] [DOI] - ↑
Malmierca, M.S., Cristaudo, S., Pérez-González, D., & Covey, E. (2009).
Stimulus-specific adaptation in the inferior colliculus of the anesthetized rat. The Journal of neuroscience : the official journal of the Society for Neuroscience, 29(17), 5483-93. [PubMed:19403816] [PMC] [WorldCat] [DOI] - ↑
Struik, L.L., O'Loughlin, E.K., Dugas, E.N., Bottorff, J.L., & O'Loughlin, J.L. (2014).
Gender differences in reasons to quit smoking among adolescents. The Journal of school nursing : the official publication of the National Association of School Nurses, 30(4), 303-8. [PubMed:23863971] [WorldCat] [DOI] - ↑
Ng, J., Hirota, S.A., Gross, O., Li, Y., Ulke-Lemee, A., Potentier, M.S., ..., & Beck, P.L. (2010).
Clostridium difficile toxin-induced inflammation and intestinal injury are mediated by the inflammasome. Gastroenterology, 139(2), 542-52, 552.e1-3. [PubMed:20398664] [WorldCat] [DOI] - ↑ 50.0 50.1
Selman, T.J., Johnson, N.P., Zamora, J., & Khan, K.S. (2008).
Gynaecologic surgery from uncertainty to science: evolution of randomized control trials. Human reproduction (Oxford, England), 23(4), 827-31. [PubMed:18227107] [WorldCat] [DOI] - ↑ 51.0 51.1
Sacks, D.B. (2011).
A1C versus glucose testing: a comparison. Diabetes care, 34(2), 518-23. [PubMed:21270207] [PMC] [WorldCat] [DOI] - ↑
Chiocchetti, A.G., Kopp, M., Waltes, R., Haslinger, D., Duketis, E., Jarczok, T.A., ..., & Freitag, C.M. (2015).
Variants of the CNTNAP2 5' promoter as risk factors for autism spectrum disorders: a genetic and functional approach. Molecular psychiatry, 20(7), 839-49. [PubMed:25224256] [WorldCat] [DOI] - ↑
Zhu, M.F., Chen, L.X., Gao, F., Sheng, D.Y., Xu, M.J., Zhang, J.R., & Qian, W.X. (2021).
Correlation of STAT6 expression and gene polymorphism with chronic obstructive pulmonary disease. Journal of biological regulators and homeostatic agents, 35(2), 735-738. [PubMed:33792217] [WorldCat] [DOI] - ↑ 54.0 54.1
Ogihara, Y., Yamada, N., Dohi, K., Matsuda, A., Tsuji, A., Ota, S., ..., & Ito, M. (2014).
Utility of right ventricular Tei-index for assessing disease severity and determining response to treatment in patients with pulmonary arterial hypertension. Journal of cardiology, 63(2), 149-53. [PubMed:24012334] [WorldCat] [DOI] - ↑
McCamphill, P.K., Farah, C.A., Anadolu, M.N., Hoque, S., & Sossin, W.S. (2015).
Bidirectional regulation of eEF2 phosphorylation controls synaptic plasticity by decoding neuronal activity patterns. The Journal of neuroscience : the official journal of the Society for Neuroscience, 35(10), 4403-17. [PubMed:25762683] [PMC] [WorldCat] [DOI] - ↑
Paquette, A.M., Harahap, A., Laosombat, V., Patnode, J.M., Satyagraha, A., Sudoyo, H., ..., & Wilder, J.A. (2015).
The evolutionary origins of Southeast Asian Ovalocytosis. Infection, genetics and evolution : journal of molecular epidemiology and evolutionary genetics in infectious diseases, 34, 153-9. [PubMed:26047685] [WorldCat] [DOI] - ↑
Yu, J., Pan, L., Qin, X., Chen, H., Xu, Y., Chen, Y., & Tang, H. (2010).
MTMR4 attenuates transforming growth factor beta (TGFbeta) signaling by dephosphorylating R-Smads in endosomes. The Journal of biological chemistry, 285(11), 8454-62. [PubMed:20061380] [PMC] [WorldCat] [DOI] - ↑
Rhee, D.Y., Zhao, X.Q., Francis, R.J., Huang, G.Y., Mably, J.D., & Lo, C.W. (2009).
Connexin 43 regulates epicardial cell polarity and migration in coronary vascular development. Development (Cambridge, England), 136(18), 3185-93. [PubMed:19700622] [PMC] [WorldCat] [DOI] - ↑
Liu, Y.C., Chen, H.C., Wu, N.Y., & Cheng, S.C. (2007).
A novel splicing factor, Yju2, is associated with NTC and acts after Prp2 in promoting the first catalytic reaction of pre-mRNA splicing. Molecular and cellular biology, 27(15), 5403-13. [PubMed:17515604] [PMC] [WorldCat] [DOI] - ↑
Llau, J.V., & Ferrandis, R. (2013).
Letter by Llau and Ferrandis regarding article, "Bridging evidence-based practice and practice-based evidence in periprocedural anticoagulation". Circulation, 127(19), e616. [PubMed:23671184] [WorldCat] [DOI] - ↑
Büttner, F.M., Zoll, S., Nega, M., Götz, F., & Stehle, T. (2014).
Structure-function analysis of Staphylococcus aureus amidase reveals the determinants of peptidoglycan recognition and cleavage. The Journal of biological chemistry, 289(16), 11083-11094. [PubMed:24599952] [PMC] [WorldCat] [DOI] - ↑
Brugts, J.J., Ninomiya, T., Boersma, E., Remme, W.J., Bertrand, M., Ferrari, R., ..., & Simoons, M.L. (2009).
The consistency of the treatment effect of an ACE-inhibitor based treatment regimen in patients with vascular disease or high risk of vascular disease: a combined analysis of individual data of ADVANCE, EUROPA, and PROGRESS trials. European heart journal, 30(11), 1385-94. [PubMed:19346520] [WorldCat] [DOI] - ↑
Jachimowicz, J.M., Wihler, A., Bailey, E.R., & Galinsky, A.D. (2019).
Reply to Guo et al. and Credé: Grit-S scale measures only perseverance, not passion, and its supposed subfactors are merely artifactors. Proceedings of the National Academy of Sciences of the United States of America, 116(10), 3942-3944. [PubMed:30808811] [PMC] [WorldCat] [DOI] - ↑
Flyvbjerg, H. (2014).
How to get into that "room at the bottom". Proceedings of the National Academy of Sciences of the United States of America, 111(37), 13249-50. [PubMed:25187558] [PMC] [WorldCat] [DOI] - ↑
Levy, A., Merritt, A.J., Aravena-Roman, M., Hodge, M.M., & Inglis, T.J. (2008).
Expanded range of Burkholderia species in Australia. The American journal of tropical medicine and hygiene, 78(4), 599-604. [PubMed:18385355] [WorldCat] - ↑
Skolarus, L.E., Freedman, V.A., Feng, C., Wing, J.J., & Burke, J.F. (2016).
Care Received by Elderly US Stroke Survivors May Be Underestimated. Stroke, 47(8), 2090-5. [PubMed:27387990] [PMC] [WorldCat] [DOI] - ↑
Guo, C.J., Chang, F.Y., Wyche, T.P., Backus, K.M., Acker, T.M., Funabashi, M., ..., & Fischbach, M.A. (2017).
Discovery of Reactive Microbiota-Derived Metabolites that Inhibit Host Proteases. Cell, 168(3), 517-526.e18. [PubMed:28111075] [PMC] [WorldCat] [DOI] - ↑
Jozwiak, M., Chambaz, M., Sentenac, P., Monnet, X., & Teboul, J.L. (2020).
Assessment of tissue oxygenation to personalize mean arterial pressure target in patients with septic shock. Microvascular research, 132, 104068. [PubMed:32877698] [WorldCat] [DOI] - ↑
Woods, R.T., Bruce, E., Edwards, R.T., Hounsome, B., Keady, J., Moniz-Cook, E.D., ..., & Russell, I.T. (2009).
Reminiscence groups for people with dementia and their family carers: pragmatic eight-centre randomised trial of joint reminiscence and maintenance versus usual treatment: a protocol. Trials, 10, 64. [PubMed:19642992] [PMC] [WorldCat] [DOI] - ↑
Davis-López de Carrizosa, M.A., Morado-Díaz, C.J., Miller, J.M., de la Cruz, R.R., & Pastor, A.M. (2011).
Dual encoding of muscle tension and eye position by abducens motoneurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(6), 2271-9. [PubMed:21307263] [PMC] [WorldCat] [DOI] - ↑
Liu, K., Wang, J.L., Zhao, L., & Wang, Q. (2014).
Anticancer and antimicrobial activities and chemical composition of the birch mazegill mushroom Lenzites betulina (higher Basidiomycetes). International journal of medicinal mushrooms, 16(4), 327-37. [PubMed:25271861] [WorldCat] [DOI] - ↑
Herzog, W. (2017).
Skeletal muscle mechanics: questions, problems and possible solutions. Journal of neuroengineering and rehabilitation, 14(1), 98. [PubMed:28915834] [PMC] [WorldCat] [DOI] - ↑
Nel, W.R., Dawjee, S.M., & van Zyl, A.W. (2012).
An insight into the malocclusion of cleidocranial dysplasia. SADJ : journal of the South African Dental Association = tydskrif van die Suid-Afrikaanse Tandheelkundige Vereniging, 67(5), 216-20. [PubMed:23185947] [WorldCat] - ↑
Maricich, S.M., Xia, A., Mathes, E.L., Wang, V.Y., Oghalai, J.S., Fritzsch, B., & Zoghbi, H.Y. (2009).
Atoh1-lineal neurons are required for hearing and for the survival of neurons in the spiral ganglion and brainstem accessory auditory nuclei. The Journal of neuroscience : the official journal of the Society for Neuroscience, 29(36), 11123-33. [PubMed:19741118] [PMC] [WorldCat] [DOI] - ↑
Wuelling, M., Kaiser, F.J., Buelens, L.A., Braunholz, D., Shivdasani, R.A., Depping, R., & Vortkamp, A. (2009).
Trps1, a regulator of chondrocyte proliferation and differentiation, interacts with the activator form of Gli3. Developmental biology, 328(1), 40-53. [PubMed:19389374] [WorldCat] [DOI] - ↑
Ambika, Kumar, V., Chandra, D., Thakur, V., Sharma, U., & Singh, D. (2023).
Depolymerization of lignin using laccase from Bacillus sp. PCH94 for production of valuable chemicals: A sustainable approach for lignin valorization. International journal of biological macromolecules, 234, 123601. [PubMed:36775222] [WorldCat] [DOI] - ↑
(2013).
8. Dose and Volume Parameters for Prescribing, Recording, and Reporting Brachytherapy, Alone and Combined with External-Beam Radiotherapy. Journal of the ICRU, 13(1-2), 105-22. [PubMed:27335480] [WorldCat] [DOI] - ↑
Crook, C.B., Constantin, C., Ahmed, T., Zhu, J.X., Balatsky, A.V., & Haraldsen, J.T. (2015).
Proximity-induced magnetism in transition-metal substituted graphene. Scientific reports, 5, 12322. [PubMed:26235646] [PMC] [WorldCat] [DOI] - ↑
Zhang, X., Yeung, D.C., Karpisek, M., Stejskal, D., Zhou, Z.G., Liu, F., ..., & Xu, A. (2008).
Serum FGF21 levels are increased in obesity and are independently associated with the metabolic syndrome in humans. Diabetes, 57(5), 1246-53. [PubMed:18252893] [WorldCat] [DOI] - ↑
Rauh, O., Hansen, U.P., Scheub, D.D., Thiel, G., & Schroeder, I. (2018).
Site-specific ion occupation in the selectivity filter causes voltage-dependent gating in a viral K+ channel. Scientific reports, 8(1), 10406. [PubMed:29991721] [PMC] [WorldCat] [DOI] - ↑ 81.0 81.1
Rewitz, K.F., Yamanaka, N., & O'Connor, M.B. (2010).
Steroid hormone inactivation is required during the juvenile-adult transition in Drosophila. Developmental cell, 19(6), 895-902. [PubMed:21145504] [PMC] [WorldCat] [DOI] - ↑
Bejarano, F., Bortolamiol-Becet, D., Dai, Q., Sun, K., Saj, A., Chou, Y.T., ..., & Lai, E.C. (2012).
A genome-wide transgenic resource for conditional expression of Drosophila microRNAs. Development (Cambridge, England), 139(15), 2821-31. [PubMed:22745315] [PMC] [WorldCat] [DOI] - ↑
Duszak, R., & Mabry, M.R. (2003).
Clinical services in interventional radiology: results from the national Medicare database and a Society of Interventional Radiology membership survey. Journal of vascular and interventional radiology : JVIR, 14(1), 75-81. [PubMed:12525589] [WorldCat] [DOI]