「脳室下帯」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| 13行目: | 13行目: | ||
(以下のパラグラフはイントロダクションの最後に持ってきても良いと思います) | (以下のパラグラフはイントロダクションの最後に持ってきても良いと思います) | ||
現在、成体脳の脳室壁に沿って存在するニューロン新生部位は、研究者によって異なる用語で呼ばれており、混乱が生じている。もともと脳室下帯(subventricular zone)という用語は、胎生期の脳において、脳室帯に隣接した領域(脳室に接していない増殖細胞を含む領域)を指す言葉として神経発生学者らによって命名されたものである。これと区別するため、成体脳の上衣細胞の内側に存在する層という意味で、[[上衣下層]](subependymal layerまたはsubependymal zone)という用語が用いられる場合もある。しかしながら、近年の研究によって脳室下帯の細胞構築が更に詳細に解析され、神経幹細胞の一部が脳室面に接しており、その細胞体が上衣細胞層から脳室下帯にまたがって存在することが明らかになった<ref name=ref16 />。このような状況を考慮して、[[wikipedia:es:Arturo Álvarez-Buylla|Alvarez-Buylla]]は「[[脳室-脳室下帯]]」(ventricular-subventricular zone, V-SVZ)という新しい呼称を用いることを提唱しており<ref name=ref49><pubmed></pubmed></ref>、これが最も的確にその位置と細胞構築を表現していると考えられる。 | 現在、成体脳の脳室壁に沿って存在するニューロン新生部位は、研究者によって異なる用語で呼ばれており、混乱が生じている。もともと脳室下帯(subventricular zone)という用語は、胎生期の脳において、脳室帯に隣接した領域(脳室に接していない増殖細胞を含む領域)を指す言葉として神経発生学者らによって命名されたものである。これと区別するため、成体脳の上衣細胞の内側に存在する層という意味で、[[上衣下層]](subependymal layerまたはsubependymal zone)という用語が用いられる場合もある。しかしながら、近年の研究によって脳室下帯の細胞構築が更に詳細に解析され、神経幹細胞の一部が脳室面に接しており、その細胞体が上衣細胞層から脳室下帯にまたがって存在することが明らかになった<ref name=ref16><pubmed>18786414</pubmed></ref>。このような状況を考慮して、[[wikipedia:es:Arturo Álvarez-Buylla|Alvarez-Buylla]]は「[[脳室-脳室下帯]]」(ventricular-subventricular zone, V-SVZ)という新しい呼称を用いることを提唱しており<ref name=ref49><pubmed>21609824</pubmed></ref>、これが最も的確にその位置と細胞構築を表現していると考えられる。 | ||
==胎生期== | ==胎生期== | ||
| 29行目: | 29行目: | ||
===脳室下帯を構成する細胞とその機能=== | ===脳室下帯を構成する細胞とその機能=== | ||
成熟した上衣細胞は、表面に多数の長い繊毛を有する上皮細胞で、脳室帯を形成する。その内側の脳室下帯には、アストロサイト、一過性増殖細胞、神経芽細胞の3種類の細胞が存在する(図1A)。これらの細胞は、細胞種特異的マーカーの発現や[[wj:電子顕微鏡|電子顕微鏡]]解析によって観察される細胞内微細構造の特徴などによって分類された<ref name=ref5><pubmed></pubmed></ref>。なお、併記したType E, B, C, A cellという名称のうち、Eは上衣細胞の英語表記から(ependymal cell)、A・B・Cは脳室下帯内に占める細胞数の多い順(おおよそ3:2:1の割合で存在)に付与されたものである。 | 成熟した上衣細胞は、表面に多数の長い繊毛を有する上皮細胞で、脳室帯を形成する。その内側の脳室下帯には、アストロサイト、一過性増殖細胞、神経芽細胞の3種類の細胞が存在する(図1A)。これらの細胞は、細胞種特異的マーカーの発現や[[wj:電子顕微鏡|電子顕微鏡]]解析によって観察される細胞内微細構造の特徴などによって分類された<ref name=ref5><pubmed>9185542</pubmed></ref>。なお、併記したType E, B, C, A cellという名称のうち、Eは上衣細胞の英語表記から(ependymal cell)、A・B・Cは脳室下帯内に占める細胞数の多い順(おおよそ3:2:1の割合で存在)に付与されたものである。 | ||
====上衣細胞==== | ====上衣細胞==== | ||
| 36行目: | 36行目: | ||
脳室壁の最表面を覆う単層の上皮を構成する細胞であり、細胞表面に長い運動性の繊毛を多数持っている。[[カルシウム結合タンパク質]]である[[S100β]]を強く発現している。運動性繊毛を持つ様々な細胞に発現する[[転写因子]][[FoxJ1]]も、脳内では上衣細胞の特異的なマーカーとなる。長い論争があったが、少なくとも生理的条件下では増殖しないと考えられている<ref name=ref2 />。 | 脳室壁の最表面を覆う単層の上皮を構成する細胞であり、細胞表面に長い運動性の繊毛を多数持っている。[[カルシウム結合タンパク質]]である[[S100β]]を強く発現している。運動性繊毛を持つ様々な細胞に発現する[[転写因子]][[FoxJ1]]も、脳内では上衣細胞の特異的なマーカーとなる。長い論争があったが、少なくとも生理的条件下では増殖しないと考えられている<ref name=ref2 />。 | ||
上衣細胞は非連続性の[[密着結合]]と[[接着結合]]・[[ギャップ結合]]により結合した単層上皮を形成し、[[脳脊髄液]]で満たされた脳室と脳室下帯を隔てているが、細胞の間隙や上衣細胞自体の細胞質を通って物質の交換が行われる<ref name=ref6><pubmed></pubmed></ref>。上衣細胞は[[BMP]]([[bone morphogenetic protein]])シグナルを阻害する[[Noggin]]を産生しており、神経幹細胞の維持やニューロン産生の制御に関与している<ref name=ref7><pubmed></pubmed></ref> <ref name=ref8><pubmed></pubmed></ref> <ref name=ref9><pubmed></pubmed></ref>。また、上衣細胞の繊毛の協調運動によって作られる脳脊髄液の流動が、神経芽細胞の移動方向の決定に関与している<ref name=ref10><pubmed></pubmed></ref>。 | 上衣細胞は非連続性の[[密着結合]]と[[接着結合]]・[[ギャップ結合]]により結合した単層上皮を形成し、[[脳脊髄液]]で満たされた脳室と脳室下帯を隔てているが、細胞の間隙や上衣細胞自体の細胞質を通って物質の交換が行われる<ref name=ref6><pubmed>7615341</pubmed></ref>。上衣細胞は[[BMP]]([[bone morphogenetic protein]])シグナルを阻害する[[Noggin]]を産生しており、神経幹細胞の維持やニューロン産生の制御に関与している<ref name=ref7><pubmed>18184786</pubmed></ref> <ref name=ref8><pubmed>11163261</pubmed></ref> <ref name=ref9><pubmed>17151667</pubmed></ref>。また、上衣細胞の繊毛の協調運動によって作られる脳脊髄液の流動が、神経芽細胞の移動方向の決定に関与している<ref name=ref10><pubmed>16410488</pubmed></ref>。 | ||
====アストロサイト==== | ====アストロサイト==== | ||
| 43行目: | 43行目: | ||
電子顕微鏡像において、豊富な[[中間径フィラメント]]・[[グリコーゲン顆粒]]を含む明るい[[wj:細胞質|細胞質]]と細胞間隙に入り込むような複雑な形状の突起を有する細胞として、微細形態学的に同定される。また、アストロサイト特異的な[[グルタミントランスポーター]]タンパク質[[GLAST]]や中間径フィラメントタンパク質[[GFAP]]を発現すると同時に、放射状グリアや神経上皮細胞に発現する[[BLBP]]や[[ネスチン]]なども発現している。 | 電子顕微鏡像において、豊富な[[中間径フィラメント]]・[[グリコーゲン顆粒]]を含む明るい[[wj:細胞質|細胞質]]と細胞間隙に入り込むような複雑な形状の突起を有する細胞として、微細形態学的に同定される。また、アストロサイト特異的な[[グルタミントランスポーター]]タンパク質[[GLAST]]や中間径フィラメントタンパク質[[GFAP]]を発現すると同時に、放射状グリアや神経上皮細胞に発現する[[BLBP]]や[[ネスチン]]なども発現している。 | ||
脳室帯に接する場所に存在するアストロサイトを[[Type B1 cell]]と呼び<ref name=ref5 />、神経幹細胞を含む細胞集団である<ref name=ref11><pubmed></pubmed></ref> <ref name=ref12><pubmed></pubmed></ref> <ref name=ref13><pubmed></pubmed></ref>。一方、脳室下帯と[[線条体]]の境界に存在するアストロサイトは[[Type B2 cell]]と呼ばれ、Type B1 cellとともに神経芽細胞の細胞集団を取り囲んでいる。 | 脳室帯に接する場所に存在するアストロサイトを[[Type B1 cell]]と呼び<ref name=ref5 />、神経幹細胞を含む細胞集団である<ref name=ref11><pubmed>10380923</pubmed></ref> <ref name=ref12><pubmed>15494728</pubmed></ref> <ref name=ref13><pubmed>12684469</pubmed></ref>。一方、脳室下帯と[[線条体]]の境界に存在するアストロサイトは[[Type B2 cell]]と呼ばれ、Type B1 cellとともに神経芽細胞の細胞集団を取り囲んでいる。 | ||
Type B1 cellは、神経幹細胞として自己複製を行いながらゆっくり増殖を続けており、増殖力の高いニューロンの前駆細胞である一過性増殖細胞を産生する。[[線維芽細胞増殖因子]] ([[fibroblast growth factor]], [[FGF]])、[[血小板由来成長因子]] ([[platelet-derived growth factor]], [[PDGF]])、[[インスリン様成長因子]] ([[insulin-like growth factor]] ,[[IGF]])、[[ソニックヘッジホッグ]] ([[sonic hedgehog]]、[[Shh]])、[[WNT|Wnt]]、[[骨形成因子]] ([[bone morphogenetic protein]], [[BMP]])、[[Notch]]など発生を制御するシグナル分子が、神経幹細胞の増殖の制御にも関与している。''In vitro''の条件下ではニューロン・アストロサイト・[[オリゴデンドロサイト]]を産生することができるが<ref name=ref14><pubmed></pubmed></ref> <ref name=ref15><pubmed></pubmed></ref>、少なくとも生理的条件下では、脳室下帯で産生される細胞は、ほとんどがニューロンのみに分化する(オリゴデンドロサイトの産生については後述する)。 | Type B1 cellは、神経幹細胞として自己複製を行いながらゆっくり増殖を続けており、増殖力の高いニューロンの前駆細胞である一過性増殖細胞を産生する。[[線維芽細胞増殖因子]] ([[fibroblast growth factor]], [[FGF]])、[[血小板由来成長因子]] ([[platelet-derived growth factor]], [[PDGF]])、[[インスリン様成長因子]] ([[insulin-like growth factor]] ,[[IGF]])、[[ソニックヘッジホッグ]] ([[sonic hedgehog]]、[[Shh]])、[[WNT|Wnt]]、[[骨形成因子]] ([[bone morphogenetic protein]], [[BMP]])、[[Notch]]など発生を制御するシグナル分子が、神経幹細胞の増殖の制御にも関与している。''In vitro''の条件下ではニューロン・アストロサイト・[[オリゴデンドロサイト]]を産生することができるが<ref name=ref14><pubmed>7946346</pubmed></ref> <ref name=ref15><pubmed>1553558</pubmed></ref>、少なくとも生理的条件下では、脳室下帯で産生される細胞は、ほとんどがニューロンのみに分化する(オリゴデンドロサイトの産生については後述する)。 | ||
神経幹細胞(Type B1 cell)の細胞体の一部は上衣細胞層に入り込んでおり、上衣細胞間に細い突起を伸ばして脳室に直接コンタクトする。脳室面から観察すると、上衣細胞はこれを取り囲み、風車(pinwheel)のように配列している<ref name=ref16 | 神経幹細胞(Type B1 cell)の細胞体の一部は上衣細胞層に入り込んでおり、上衣細胞間に細い突起を伸ばして脳室に直接コンタクトする。脳室面から観察すると、上衣細胞はこれを取り囲み、風車(pinwheel)のように配列している<ref name=ref16 />(図1B)。この風車状の配列はニューロンの産生が行われている部位に特異的であり、[[側脳室]]の尾側内側壁や[[第三脳室]]などニューロンが産生されていない領域では観察されないことから、周囲を囲む上衣細胞と神経幹細胞の何らかの相互作用が幹細胞機能の調節に関与しているのではないかと考えられている。神経幹細胞は、脳室面に非運動性の一次繊毛を形成している。この一次繊毛の機能には不明な点が多いが、脳脊髄液内にはShhやWnt、BMP、[[インスリン様成長因子-2]][[insulin-like growth factor-2]]([[IGF-2]])など、脳室下帯におけるニューロンの産生を制御することが知られている分子が含まれており、これらを受容する化学的なセンサー、更には脳脊髄液の流動を感知する機械的センサーとして働いているのではないかと考えられている<ref name=ref17><pubmed>21791285</pubmed></ref> <ref name=ref18><pubmed>21382550</pubmed></ref>。 | ||
神経幹細胞は、脳実質側に向かって伸長する長い突起を有し、血管上に終足を形成して直接コンタクトしている<ref name=ref16 /> <ref name=ref19><pubmed></pubmed></ref> <ref name=ref20><pubmed></pubmed></ref>。血管との関係については、次項で詳しく述べる。 | 神経幹細胞は、脳実質側に向かって伸長する長い突起を有し、血管上に終足を形成して直接コンタクトしている<ref name=ref16 /> <ref name=ref19><pubmed></pubmed></ref> <ref name=ref20><pubmed></pubmed></ref>。血管との関係については、次項で詳しく述べる。 | ||
2015年6月22日 (月) 10:46時点における版
金子 奈穂子、澤本 和延
名古屋市立大学大学院医学研究科再生医学分野
DOI:10.14931/bsd.6036 原稿受付日:2015年6月19日 原稿完成日:2015年月日
担当編集委員:大隅 典子(東北大学 大学院医学系研究科 附属創生応用医学研究センター 脳神経科学コアセンター 発生発達神経科学分野)
英語名:subventricular zone 独:subventrikuläre Zone 仏:zone sous-ventriculaire
一段落程度の抄録をお願いいたします
脳室下帯とは
(イントロをお願いします)
(以下のパラグラフはイントロダクションの最後に持ってきても良いと思います) 現在、成体脳の脳室壁に沿って存在するニューロン新生部位は、研究者によって異なる用語で呼ばれており、混乱が生じている。もともと脳室下帯(subventricular zone)という用語は、胎生期の脳において、脳室帯に隣接した領域(脳室に接していない増殖細胞を含む領域)を指す言葉として神経発生学者らによって命名されたものである。これと区別するため、成体脳の上衣細胞の内側に存在する層という意味で、上衣下層(subependymal layerまたはsubependymal zone)という用語が用いられる場合もある。しかしながら、近年の研究によって脳室下帯の細胞構築が更に詳細に解析され、神経幹細胞の一部が脳室面に接しており、その細胞体が上衣細胞層から脳室下帯にまたがって存在することが明らかになった[1]。このような状況を考慮して、Alvarez-Buyllaは「脳室-脳室下帯」(ventricular-subventricular zone, V-SVZ)という新しい呼称を用いることを提唱しており[2]、これが最も的確にその位置と細胞構築を表現していると考えられる。
胎生期
胎生期の脳内において、脳室を取り囲む脳室周囲層は、大脳皮質のニューロンを産生する主要な部位として重要な役割を果たす。脳室に面した脳室帯(ventricular zone)に存在する神経上皮細胞は、自己複製とニューロンの産生を行う神経幹細胞として機能する。発生中期以降は、脳表面側に達する長い突起を伸ばし、放射状グリアと呼ばれる。放射状グリアによって産生され、ニューロンの細胞系譜に運命づけられた二次的な前駆細胞によって脳室帯の内側に形成されるのが脳室下帯(subventricular zone)である。これは、鳥類・爬虫類など3層構造の大脳皮質を有する動物種には見られず、哺乳類に特異的な構造である。霊長類などの高次の動物種では、顕著に脳室下帯が拡大しており、進化の過程における大脳皮質の発達に寄与していると考えられている(後述の「ヒトの脳室下帯」を参照)。
新生児期
げっ歯類と霊長類の脳室下帯は、基本構造に違いがある。以下は、詳細に研究されているげっ歯類の脳室下帯について述べ、最後の章においてヒトの脳室下帯を取り上げる。
脳室帯の放射状グリアは、出生後約1週間までに主に脳実質のアストロサイトに分化するが、一部は脳室周囲に留まり、上衣細胞や神経幹細胞としての能力を維持した特殊なアストロサイトに分化する[3] [4]。
上衣細胞は、脳室壁の表面に並んで単層上皮(上衣層)を構成し、出生後10日目ぐらいから多数の運動性の繊毛を発達させる[5] [6]。また、アストロサイト様の神経幹細胞は、産生した中間的な前駆細胞(一過性増殖細胞)・幼若な新生ニューロン(神経芽細胞)とともに脳室下帯を形成する。出生後2週間ほどで、成体の脳室下帯とほぼ同等の形態になる。
成体
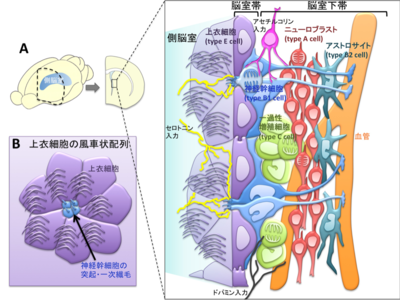
A:脳室下帯の模式図。脳室帯-脳室下帯には、上衣細胞(紫)、神経幹細胞(青)、一過性増殖細胞(黄緑)、神経芽細胞(赤)が存在する。脳室下帯への縫線核からのセロトニン入力(黄線)・黒質からのドーパミン入力(黒線)・脳室下帯内のコリン作動性ニューロン(桃)によるアセチルコリン入力は、ニューロンの再生を制御している。
B:脳室面から観察した上衣細胞の風車状配列。中央には一次繊毛を有する神経幹細胞の突起が存在する。
脳室下帯を構成する細胞とその機能
成熟した上衣細胞は、表面に多数の長い繊毛を有する上皮細胞で、脳室帯を形成する。その内側の脳室下帯には、アストロサイト、一過性増殖細胞、神経芽細胞の3種類の細胞が存在する(図1A)。これらの細胞は、細胞種特異的マーカーの発現や電子顕微鏡解析によって観察される細胞内微細構造の特徴などによって分類された[7]。なお、併記したType E, B, C, A cellという名称のうち、Eは上衣細胞の英語表記から(ependymal cell)、A・B・Cは脳室下帯内に占める細胞数の多い順(おおよそ3:2:1の割合で存在)に付与されたものである。
上衣細胞
脳室壁の最表面を覆う単層の上皮を構成する細胞であり、細胞表面に長い運動性の繊毛を多数持っている。カルシウム結合タンパク質であるS100βを強く発現している。運動性繊毛を持つ様々な細胞に発現する転写因子FoxJ1も、脳内では上衣細胞の特異的なマーカーとなる。長い論争があったが、少なくとも生理的条件下では増殖しないと考えられている[4]。
上衣細胞は非連続性の密着結合と接着結合・ギャップ結合により結合した単層上皮を形成し、脳脊髄液で満たされた脳室と脳室下帯を隔てているが、細胞の間隙や上衣細胞自体の細胞質を通って物質の交換が行われる[8]。上衣細胞はBMP(bone morphogenetic protein)シグナルを阻害するNogginを産生しており、神経幹細胞の維持やニューロン産生の制御に関与している[9] [10] [11]。また、上衣細胞の繊毛の協調運動によって作られる脳脊髄液の流動が、神経芽細胞の移動方向の決定に関与している[12]。
アストロサイト
電子顕微鏡像において、豊富な中間径フィラメント・グリコーゲン顆粒を含む明るい細胞質と細胞間隙に入り込むような複雑な形状の突起を有する細胞として、微細形態学的に同定される。また、アストロサイト特異的なグルタミントランスポータータンパク質GLASTや中間径フィラメントタンパク質GFAPを発現すると同時に、放射状グリアや神経上皮細胞に発現するBLBPやネスチンなども発現している。
脳室帯に接する場所に存在するアストロサイトをType B1 cellと呼び[7]、神経幹細胞を含む細胞集団である[13] [14] [15]。一方、脳室下帯と線条体の境界に存在するアストロサイトはType B2 cellと呼ばれ、Type B1 cellとともに神経芽細胞の細胞集団を取り囲んでいる。
Type B1 cellは、神経幹細胞として自己複製を行いながらゆっくり増殖を続けており、増殖力の高いニューロンの前駆細胞である一過性増殖細胞を産生する。線維芽細胞増殖因子 (fibroblast growth factor, FGF)、血小板由来成長因子 (platelet-derived growth factor, PDGF)、インスリン様成長因子 (insulin-like growth factor ,IGF)、ソニックヘッジホッグ (sonic hedgehog、Shh)、Wnt、骨形成因子 (bone morphogenetic protein, BMP)、Notchなど発生を制御するシグナル分子が、神経幹細胞の増殖の制御にも関与している。In vitroの条件下ではニューロン・アストロサイト・オリゴデンドロサイトを産生することができるが[16] [17]、少なくとも生理的条件下では、脳室下帯で産生される細胞は、ほとんどがニューロンのみに分化する(オリゴデンドロサイトの産生については後述する)。
神経幹細胞(Type B1 cell)の細胞体の一部は上衣細胞層に入り込んでおり、上衣細胞間に細い突起を伸ばして脳室に直接コンタクトする。脳室面から観察すると、上衣細胞はこれを取り囲み、風車(pinwheel)のように配列している[1](図1B)。この風車状の配列はニューロンの産生が行われている部位に特異的であり、側脳室の尾側内側壁や第三脳室などニューロンが産生されていない領域では観察されないことから、周囲を囲む上衣細胞と神経幹細胞の何らかの相互作用が幹細胞機能の調節に関与しているのではないかと考えられている。神経幹細胞は、脳室面に非運動性の一次繊毛を形成している。この一次繊毛の機能には不明な点が多いが、脳脊髄液内にはShhやWnt、BMP、インスリン様成長因子-2insulin-like growth factor-2(IGF-2)など、脳室下帯におけるニューロンの産生を制御することが知られている分子が含まれており、これらを受容する化学的なセンサー、更には脳脊髄液の流動を感知する機械的センサーとして働いているのではないかと考えられている[18] [19]。
神経幹細胞は、脳実質側に向かって伸長する長い突起を有し、血管上に終足を形成して直接コンタクトしている[1] [20] [21]。血管との関係については、次項で詳しく述べる。
一過性増殖細胞
神経幹細胞から産生され、ニューロンを産生する中間的な前駆細胞である。増殖能が高く、短いサイクルで分裂するが、数回の分裂の後には神経芽細胞へと分化する。転写因子であるMash1(Ascl1)や上皮成長因子受容体 (epidermal growth factor receptor) が細胞マーカーとして用いられている。微細形態学的には、細胞質中に中間径フィラメントがないことや、複雑な突起も持たないシンプルな形状を持つなどの特徴により、アストロサイトと区別される[7]。細胞体自体が脳室下帯の血管の近傍に分布しており[22]、血管から様々なシグナルを受けていると考えられている。
神経芽細胞
一過性増殖細胞を介して産生された幼若な新生ニューロンで、微小管構成タンパク質βIII-チューブリンや、微小管に結合するタンパク質doublecortin (Dcx)、細胞表面に発現するPSA-NCAMなどが細胞特異的なマーカーとして用いられている。
神経芽細胞は、進行方向に先導突起と呼ばれる短い突起を伸ばし、成体脳内を吻側(前方)へと長距離にわたって移動するが[23] [24]、その間も増殖を続けている。神経芽細胞間に小さな接着結合を断続的に作って、鎖状の細長い細胞塊を形成し、この中で互いを足場としてスライドするように移動している(鎖状細胞移動、chain migration)。また、この鎖状の神経芽細胞の集団の周囲は、アストロサイトの突起がトンネルを作るように取り囲んでいる(glial tube)。この2つは、成体脳の脳室下帯由来の神経芽細胞に特徴的な移動形態である。
脳室下帯のニューロン新生における血管の役割
脳室下帯には血管が豊富に存在する。血管内皮細胞は、血管内皮細胞増殖因子 (vascular endothelial growth factor, VEGF)、線維芽細胞増殖因子-2 (fibroblast growth factor-2, FGF2), インスリン様成長因子-1(insulin-like growth factor-1, IGF-1)、 脳由来神経栄養因子(brain-derived neurotrophic factor, BDNF)など、細胞の生存・増殖・分化に関与する拡散性の分子を産生し、様々な器官の幹細胞を維持する微小環境の構築に重要な役割を果たしている。また、血液にも増殖因子やサイトカインなど様々な分子が含まれるが、成体の脳内では周皮細胞やアストロサイトによって血液脳関門が形成され、血管成分の脳実質への流出は制限されている。しかし脳室下帯の血管は、脳実質に比べて周皮細胞やアストロサイトの被覆が少なく、物質の透過性が高い特殊な構造になっている[21]。
神経幹細胞は、脳実質側に伸ばした突起で血管上に終足を形成している。血管内皮細胞が産生するケモカインストロマ細胞由来因子(stromal cell-derived factor, SDF)-1による誘引作用や血管基底膜に豊富に存在する細胞外基質であるラミニンとその受容体であるインテグリンがこの構造の形成に関与しており[20] [22] 、血管との接着が神経幹細胞の増殖を活性化する[22]。また、一過性増殖細胞は細胞体自体が血管のごく近傍に位置し[22]、神経芽細胞は移動過程でしばしば血管に沿っている[25] [26]。従って、脳室下帯はニューロン新生過程において、多段階にわたって血管内皮細胞や血液からの制御を受けていると考えられている[27]。
脳室下帯への神経入力
様々な神経伝達物質の受容体刺激や阻害が、脳室下帯におけるニューロンの産生に影響を与える。更に近年の研究により、神経活動に依存したニューロン産生制御機構が回路レベルで明らかになってきた(図1A)。
脳室下帯の一過性増殖細胞は、黒質からのドーパミン作動性入力を受けて増殖が促進される[28]。セロトニン刺激も脳室下帯の細胞増殖を促進してニューロンの産生を増加させるが、近年、上衣細胞層の表面に縫線核からのセロトニン作動性神経繊維が網の目のように走行しており、上衣細胞やType B1 cellに直接入力して神経幹細胞の増殖を促進的に制御していることが報告された[29]。また、脳室下帯の上衣細胞層の直下には少数のコリン作動性ニューロンが存在し、活動依存的にアセチルコリンを分泌して、神経幹細胞の増殖を促進している[30]。
一方、神経芽細胞はGABAを分泌して神経幹細胞の増殖を抑制しており、脳室下帯内の局所的なネガティブフィードバック機構として機能しているのかも知れない[31] [32] [33]。神経回路によるコントロール機構は非常に複雑であり、これらの知見はまだ断片的であるが、ニューロン新生の生理的意義を理解する上でも非常に興味深いものである。
神経芽細胞の長距離移動と成熟
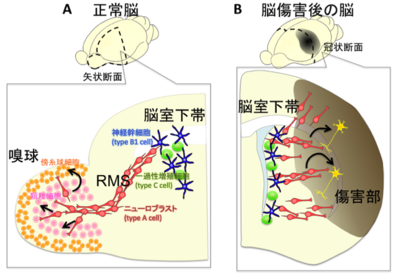
A:正常脳で産生された神経芽細胞の移動。RMSを通って嗅球へ移動し、介在ニューロンへと分化・成熟する。
B:傷害後の神経芽細胞の移動。脳室下帯で産生された神経芽細胞の一部は傷害部へ移動し、分化・成熟する。
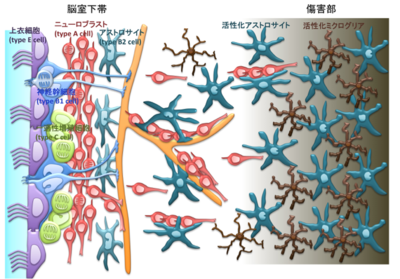
脳梗塞などの傷害後には、脳室下帯における細胞増殖が亢進し、神経芽細胞が増加する。一部の神経芽細胞は、傷害部へ向かって移動する。
脳室下帯で産生された神経芽細胞の鎖状の集団は、脳室下帯の前方につづく吻側移動流(rostral migratory stream, RMS)に入り、嗅球へと移動する[23] [24](図2A)。RMS内でも神経芽細胞は増殖を続けている。移動相と休止相を交互に繰り返す移動形式をとるが、平均した移動速度は早いものでは時速100μmにも達する。
RMSは、成熟ニューロンの細胞体や軸索がほとんど存在しない、神経芽細胞の移動を支える特殊な環境である。神経芽細胞との相互作用によって形成されたアストロサイトのトンネルは[34]、神経芽細胞の移動を制御する分子の分泌・取り込みを行うとともに、軸索の侵入を防ぎ、RMSを物理的に維持する役割も担っていると考えられる[35] [36] [37] [38] [39]。またRMSのアストロサイトの一部は、脳室下帯と同様に神経幹細胞として機能している[40]。
数日から1週間で嗅球に達すると、鎖状の連結が解かれ、個々に嗅球の表層に向かって放射状に移動を始める。神経芽細胞はブレーキング機構によって移動を停止し[41]、2種類の介在ニューロン(顆粒細胞・傍糸球細胞)に分化し、新生から4週間ほどで成熟して神経回路に統合される[42]。嗅球の新生ニューロンは、嗅いの学習や識別に関与している[43] [44] [45] [46]。
脳室下帯の神経幹細胞の不均一性
嗅球の介在ニューロンである顆粒細胞・傍糸球細胞の大部分はGABA作動性の抑制性ニューロンであるが、マーカータンパク質の発現などの特徴により、オーバーラップしない複数のサブタイプに分類されている。例えば傍糸球細胞は、ドーパミン作動性のチロシン水酸化酵素発現細胞、カルシウム結合タンパクであるカルレチニンやカルビンディンを発現する細胞の3種類で主に構成されている。加えて、短い軸索をもつグルタミン酸作動性の介在ニューロンも存在する。顆粒細胞においても、一部の細胞はカルレチニンを発現しており、更に深層の細胞と表層の細胞は投射パターンや入力が異なっている。
これらの嗅球介在ニューロンの起源となる脳室下帯の神経幹細胞は、領域毎に産生するニューロンの種類が異なっていることが分かってきた。例えば背側領域は主に表層の、腹側領域は深層の顆粒細胞を産生している。一方、前方領域ではドーパミン作動性の傍糸球細胞が産生される。神経幹細胞を脳室下帯から取り出し、培養したのち脳室下帯の別の領域に移植しても、この性質が保たれることから、環境に依らない内在性の性質であることが示唆される[47]。実際、Pax6, Dlx2, Neurogenin2, Tbr2などの転写因子が領域によって異なる発現パターンを示し、その一部はすでに特定の種類のニューロンの産生に寄与していることが示されている[6] [48]。従って、脳室下帯の神経幹細胞は同じ性質を持った集団ではなく、多様性のある不均一な集団であると言えるが、この性質がいつ、どのように決定されるのかはまだ分かっていない。
傷害への反応
脳にニューロンが大規模に脱落するような侵襲が加わると、脳室下帯におけるニューロン産生が亢進する。この反応は、ハンチントン病やパーキンソン病などの神経変性疾患モデルや外傷モデルでも生じるが、特に脳梗塞モデル動物で最も詳細に研究されている[49] [50] [51] [52]。
げっ歯類の中大脳動脈を閉塞して作製する脳梗塞モデルでは、線条体の外側と隣接する大脳皮質のニューロンが脱落し、梗塞巣が形成される。傷害から1週間ほど経つと脳室下帯におけるニューロン産生が増加する。神経幹細胞の数や活性化状態の細胞の割合が増加し[53]、一過性増殖細胞・神経芽細胞の産生が促進される(図2B、図3)。
ニューロン産生の増加には、虚血による低酸素誘導因子-1α (hypoxia-inducible factor-1α, HIF-1α)の活性化や炎症によって誘導されるFGF2、上皮成長因子 (epidermal growth factor, EGF)、グリア細胞由来神経栄養因子 (glial cell-derived neurotrophic factor, GDNF)、BDNF、VEGF、毛様体神経栄養因子 (ciliary neurotrophic factor, CNTF)、IGF-1など様々な栄養因子・増殖因子やサイトカインなどが関連している。また、Wnt・Notch1・Shhなど生理的条件下で神経幹細胞・一過性増殖細胞の機能制御に深く関わっている分子も、傷害後に発現が上昇し、脳室下帯におけるニューロン産生に促進的に働く[54] [55]。
虚血刺激やHIF-1αは血管新生を強力に誘導し、直接ダメージを受けない脳室下帯でも血管新生により血管が増加するという報告もある[56]。血管新生促進因子とニューロン産生促進因子は重複しているものが多く、同じ分子を介して増殖が促進されているのかも知れない。また、血管が増加することで血管内皮細胞や血流からの増殖促進シグナルが増加して、二次的に神経幹細胞・前駆細胞の増殖が促進されている可能性もある。
産生された神経芽細胞の一部は、ケモカインなど誘引性に働く因子によって傷害部へ向かって脳室下帯から線条体へ移動していく[57] [58]。脳室下帯におけるニューロンの産生亢進・神経芽細胞の傷害部への移動は、数週間をピークとするが、その後も数ヶ月以上に亘って持続する[51] [56]。線条体に移動した神経芽細胞の大部分は成熟前に死滅するが、ごく一部は傷害部やその周囲に生着し、回路に編入される[59]。傷害部に生着するニューロンが、線条体の投射性ニューロンに分化するのか[49]、本来の運命通りに嗅球の介在ニューロンのサブタイプとなるのかは[60]、議論の最中である。傷害部に新生するニューロンは非常に少数で、脱落したニューロンの機能を補うには不十分であるが、これを様々な介入によって促進し、再生医学的な治療アプローチに発展させるため、研究が世界中で行われている。
脳室下帯におけるオリゴデンドロサイトの産生
脳室下帯では、オリゴデンドロサイト前駆細胞も産生されている[61] [62] [63] [64]。神経幹細胞や一過性増殖細胞の一部は、NG2やOlig2など、オリゴデンドロサイト前駆細胞が発現するタンパク質を発現しており、これらの細胞がオリゴデンドロサイトを産生している。脳室下帯で産生されたオリゴデンドロサイト前駆細胞は、先導突起を伸ばした単極性または双極性の形態をしており、新生ニューロンと似ているが、鎖状の細胞塊を形成することはなく、単独で軸索に沿って脳梁に移動したのち分化し、ミエリンを形成する成熟オリゴデンドロサイトとなる。
オリゴデンドロサイトは、白質・灰白質に存在する前駆細胞によっても産生されており、これらの細胞と脳室下帯由来のオリゴデンドロサイトの機能に差異があるのかは分かっていない。しかし、脱随などの侵襲時に、脳室下帯由来のオリゴデンドロサイト前駆細胞が遠隔の傷害部まで移動するのに対して、実質で産生されたオリゴデンドロサイト前駆細胞の移動能は限定的であることから、オリゴデンドロサイトやミエリンの再生において、脳室下帯が重要な役割を担っている可能性がある[65] [66]。
ヒトの脳室下帯
皮質形成における脳室下帯
霊長類の脳発生には、脳室下帯が重要な役割を果たす。脳室帯が主なニューロン産生領域であるげっ歯類とは異なり、霊長類脳では皮質形成の途中で脳室帯が縮小するとともに脳室下帯が拡大し、主なニューロン産生領域となる[67] [68]。脳室下帯は薄い繊維層によって内層(inner SVZ, iSVZ)と分厚い外層(outer SVZ, oSVZ)に分けられ、oSVZには脳室帯の放射状グリアと同様の放射状の形態を保った前駆細胞(outer radial glia, oRG)が多数存在する。これらの細胞は、自己複製しながら分裂を繰り返すことができる。げっ歯類の脳室下帯にもoRGは少数存在する。例外はあるが、進化過程における大脳皮質の発達の程度はoSVZの細胞増殖活性と相関関係にあり[69]、大脳皮質形成における脳室下帯の役割が注目されている。
出生後〜成体脳の脳室下帯
ヒトでは、生後6ヶ月までは胎生期と同様に脳室面に放射状グリア様の形態の細胞が並んでいる。細胞増殖が盛んで、げっ歯類の脳室下帯でみられるような神経芽細胞が鎖状に連なった集団や嗅球への移動経路であるRMSも存在する。しかしその後はニューロンの産生は急激に減少していき、生後18ヶ月までには移動経路も消失して、ほぼ成体と同じ基本構造になる[70]。ヒト脳では、生後6ヶ月までのごく短期間、RMSから内側に分岐し、腹内側前頭前野に続く移動経路が存在する。この経路を移動するニューロンは腹内側前頭前野において分化・定着することが示唆されているが、他の霊長類では報告がなく、ヒト脳に特異的な構造であるため、機能や動態の詳細な解析は困難である[70]。腹内側前頭前野は空間の概念化や感情の処理に関わる領域であり、脳室下帯からこの領域への新生ニューロンの供給がヒトに特異的な脳機能とどのような関わりがあるのか、解明が待たれる。
ヒトや近縁の霊長類の成体脳では、脳室面の上衣細胞層以外の基本構造は、げっ歯類とは大きく異なる[71] [72] [73] [74]。第1層である上衣細胞層の直下には、細胞体がほとんど存在しない第2層(hypocellular gap)が存在する。この層は、その下の第3層に存在するアストロサイトの突起が主な構成成分である。細胞体が高密度に存在する第三層の大部分はGFAPを発現するアストロサイトであり、その下には線条体との移行部(第四層)が存在する。神経芽細胞は非常に少数で、第2層と第3層に分布し、細胞集団を作らずに個々に存在する。この所見から、ヒトの脳室下帯ではニューロンの産生能力は非常に低いことが示唆される。しかし脳梗塞後の急性期に死亡した患者脳では、細胞増殖や神経芽細胞の数は増加しており、傷害後の反応性のニューロン産生の増加はヒトにも共通の現象のようである[75]。
関連項目
参考文献
- ↑ 1.0 1.1 1.2
Mirzadeh, Z., Merkle, F.T., Soriano-Navarro, M., Garcia-Verdugo, J.M., & Alvarez-Buylla, A. (2008).
Neural stem cells confer unique pinwheel architecture to the ventricular surface in neurogenic regions of the adult brain. Cell stem cell, 3(3), 265-78. [PubMed:18786414] [PMC] [WorldCat] [DOI] - ↑
Ihrie, R.A., & Alvarez-Buylla, A. (2011).
Lake-front property: a unique germinal niche by the lateral ventricles of the adult brain. Neuron, 70(4), 674-86. [PubMed:21609824] [PMC] [WorldCat] [DOI] - ↑
Merkle, F.T., Tramontin, A.D., García-Verdugo, J.M., & Alvarez-Buylla, A. (2004).
Radial glia give rise to adult neural stem cells in the subventricular zone. Proceedings of the National Academy of Sciences of the United States of America, 101(50), 17528-32. [PubMed:15574494] [PMC] [WorldCat] [DOI] - ↑ 4.0 4.1
Spassky, N., Merkle, F.T., Flames, N., Tramontin, A.D., García-Verdugo, J.M., & Alvarez-Buylla, A. (2005).
Adult ependymal cells are postmitotic and are derived from radial glial cells during embryogenesis. The Journal of neuroscience : the official journal of the Society for Neuroscience, 25(1), 10-8. [PubMed:15634762] [PMC] [WorldCat] [DOI] - ↑
Guirao, B., Meunier, A., Mortaud, S., Aguilar, A., Corsi, J.M., Strehl, L., ..., & Spassky, N. (2010).
Coupling between hydrodynamic forces and planar cell polarity orients mammalian motile cilia. Nature cell biology, 12(4), 341-50. [PubMed:20305650] [WorldCat] [DOI] - ↑ 6.0 6.1
Hirota, Y., Meunier, A., Huang, S., Shimozawa, T., Yamada, O., Kida, Y.S., ..., & Sawamoto, K. (2010).
Planar polarity of multiciliated ependymal cells involves the anterior migration of basal bodies regulated by non-muscle myosin II. Development (Cambridge, England), 137(18), 3037-46. [PubMed:20685736] [WorldCat] [DOI] 引用エラー: 無効な<ref>タグ; name "ref4"が異なる内容で複数回定義されています - ↑ 7.0 7.1 7.2
Doetsch, F., García-Verdugo, J.M., & Alvarez-Buylla, A. (1997).
Cellular composition and three-dimensional organization of the subventricular germinal zone in the adult mammalian brain. The Journal of neuroscience : the official journal of the Society for Neuroscience, 17(13), 5046-61. [PubMed:9185542] [WorldCat] - ↑
Del Bigio, M.R. (1995).
The ependyma: a protective barrier between brain and cerebrospinal fluid. Glia, 14(1), 1-13. [PubMed:7615341] [WorldCat] [DOI] - ↑
Colak, D., Mori, T., Brill, M.S., Pfeifer, A., Falk, S., Deng, C., ..., & Götz, M. (2008).
Adult neurogenesis requires Smad4-mediated bone morphogenic protein signaling in stem cells. The Journal of neuroscience : the official journal of the Society for Neuroscience, 28(2), 434-46. [PubMed:18184786] [PMC] [WorldCat] [DOI] - ↑
Lim, D.A., Tramontin, A.D., Trevejo, J.M., Herrera, D.G., García-Verdugo, J.M., & Alvarez-Buylla, A. (2000).
Noggin antagonizes BMP signaling to create a niche for adult neurogenesis. Neuron, 28(3), 713-26. [PubMed:11163261] [WorldCat] [DOI] - ↑
Piccirillo, S.G., Reynolds, B.A., Zanetti, N., Lamorte, G., Binda, E., Broggi, G., ..., & Vescovi, A.L. (2006).
Bone morphogenetic proteins inhibit the tumorigenic potential of human brain tumour-initiating cells. Nature, 444(7120), 761-5. [PubMed:17151667] [WorldCat] [DOI] - ↑
Sawamoto, K., Wichterle, H., Gonzalez-Perez, O., Cholfin, J.A., Yamada, M., Spassky, N., ..., & Alvarez-Buylla, A. (2006).
New neurons follow the flow of cerebrospinal fluid in the adult brain. Science (New York, N.Y.), 311(5761), 629-32. [PubMed:16410488] [WorldCat] [DOI] - ↑
Doetsch, F., Caillé, I., Lim, D.A., García-Verdugo, J.M., & Alvarez-Buylla, A. (1999).
Subventricular zone astrocytes are neural stem cells in the adult mammalian brain. Cell, 97(6), 703-16. [PubMed:10380923] [WorldCat] [DOI] - ↑
Garcia, A.D., Doan, N.B., Imura, T., Bush, T.G., & Sofroniew, M.V. (2004).
GFAP-expressing progenitors are the principal source of constitutive neurogenesis in adult mouse forebrain. Nature neuroscience, 7(11), 1233-41. [PubMed:15494728] [WorldCat] [DOI] - ↑
Imura, T., Kornblum, H.I., & Sofroniew, M.V. (2003).
The predominant neural stem cell isolated from postnatal and adult forebrain but not early embryonic forebrain expresses GFAP. The Journal of neuroscience : the official journal of the Society for Neuroscience, 23(7), 2824-32. [PubMed:12684469] [PMC] [WorldCat] - ↑
Morshead, C.M., Reynolds, B.A., Craig, C.G., McBurney, M.W., Staines, W.A., Morassutti, D., ..., & van der Kooy, D. (1994).
Neural stem cells in the adult mammalian forebrain: a relatively quiescent subpopulation of subependymal cells. Neuron, 13(5), 1071-82. [PubMed:7946346] [WorldCat] [DOI] - ↑
Reynolds, B.A., & Weiss, S. (1992).
Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science (New York, N.Y.), 255(5052), 1707-10. [PubMed:1553558] [WorldCat] [DOI] - ↑
Ihrie, R.A., Shah, J.K., Harwell, C.C., Levine, J.H., Guinto, C.D., Lezameta, M., ..., & Alvarez-Buylla, A. (2011).
Persistent sonic hedgehog signaling in adult brain determines neural stem cell positional identity. Neuron, 71(2), 250-62. [PubMed:21791285] [PMC] [WorldCat] [DOI] - ↑
Lehtinen, M.K., Zappaterra, M.W., Chen, X., Yang, Y.J., Hill, A.D., Lun, M., ..., & Walsh, C.A. (2011).
The cerebrospinal fluid provides a proliferative niche for neural progenitor cells. Neuron, 69(5), 893-905. [PubMed:21382550] [PMC] [WorldCat] [DOI] - ↑ 20.0 20.1 Resource not found in PubMed.
- ↑ 21.0 21.1 Resource not found in PubMed.
- ↑ 22.0 22.1 22.2 22.3 Resource not found in PubMed.
- ↑ 23.0 23.1 Resource not found in PubMed.
- ↑ 24.0 24.1 Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ 49.0 49.1 Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ 51.0 51.1 Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ 56.0 56.1 Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ 70.0 70.1 Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.