膵臓転写因子1A
藤山 知之
筑波大学 国際統合睡眠医科学研究機構
星野 幹雄
国立研究開発法人国立精神・神経医療研究センター
DOI:10.14931/bsd.11389 原稿受付日:2025年8月19日 原稿完成日:2025年9月5日
担当編集委員:山形 方人(ハーバード大学・脳科学センター)
英:Pancreas transcription factor 1A
英略称:PTF1A
膵臓転写因子1A (Pancreas transcription factor 1A, PTF1A)は膵臓の腺房外分泌細胞や多くの中枢神経系ニューロンの分化において重要な役割を持つbHLH型転写因子である。胎生期発達過程において膵臓形成、小脳や脊髄、網膜などにおける主要な神経細胞サブタイプの運命決定、神経回路の構築、さらには視床下部のキスペプチンニューロンを介した脳の性分化にも関与するなど、多様な細胞系譜の分化過程で不可欠な役割を果たすことが明らかになってきた。その異常はヒト先天性疾患(小脳・膵臓無形成を伴う新生児糖尿病)の原因となる。
PTF1Aとは
PTF1A(Pancreas transcription factor 1a)/ p48は、1996年に膵臓外分泌細胞で特異的に発現するbHLH型転写因子として同定され、初期には膵外分泌酵素遺伝子群のプロモーター領域に結合する3量複合体PTF1を構成する48kDaのDNA結合タンパク質として知られていた[1][2][3]。その後、マウスPtf1a遺伝子が膵臓外分泌細胞の分化に必須であり、腸管未分化組織から全ての膵前駆細胞への運命獲得に重要な役割を果たすことが示された[4][5]。
つづいて血縁家系ゲノム連鎖解析により、PTF1A遺伝子の変異がヒト小脳・膵臓無形成を伴う新生児糖尿病と直接関連していることが報告され、PTF1Aの臨床医学的な重要性が注目された[6][7][8][9][10][11][12]。膵発生における知見は、遺伝子改変マウスを用いた膵臓形成不全モデルや膵臓がんモデルなどの構築に貢献した[13][14][15][16][17][18]。
神経系発達への関与については、発生中期胚の神経管背側でのmRNA発現があることで示唆されていた[19]。2005年に小脳皮質を欠失するセレベレス変異体マウス(cerebelless)の原因遺伝子として同定され、プルキンエ細胞やゴルジ細胞などの小脳の全ての種類のGABA作動性ニューロンがPtf1aを発現する第4脳室周囲帯(ventricular zone)の神経上皮から発生することが示唆されたことから小脳抑制性ニューロンの運命決定因子であることが明らかとなった[20]。また小脳では、PTF1AがOLIG2やGSX1と協調してプルキンエ細胞およびPAX2陽性介在ニューロンといった小脳抑制性ニューロンの多様性を時空間的に制御すること、PTF1Aが別のbHLH型転写因子ATOH1と拮抗し、GABA作動性神経細胞とグルタミン酸作動性神経細胞の適切な産生バランスを制御することが報告されている[21][22][23][24][25][26][27][28]。
さらに、脊髄においては、PTF1Aが脊髄の背側領域(dI4–dI6)におけるGABA作動性介在ニューロンの分化に不可欠であり、感覚入力の統合や運動制御に関わる神経回路ネットワークの発達において重要な役割を果たすことが知られている[29][30]。
加えて、網膜発生過程での水平細胞とアマクリン細胞の分化に不可欠であることも示され、抑制性神経細胞の運命決定に関わるPTF1Aの機能が感覚器系にも及ぶことが明らかとなった[31][32][33]。
脳幹においては、聴覚伝達を司る蝸牛神経核のGABA作動性およびグリシン作動性ニューロンの発生に関与すること[34]、小脳プルキンエ細胞へ投射する下オリーブ核グルタミン酸作動性の登上線維ニューロンの発生に必要であることが知られている[35]。これは、PTF1Aの機能は抑制性ニューロンの運命決定因子としてだけでなく、グルタミン酸作動性ニューロンの産生にも関与するという新たな知見であった[36]。
一方、発生期視床下部においては、性分化に関与するキスペプチンニューロンの発生に細胞非自律的に必要であることが示され、脳の性分化能の獲得に重要であることが示唆されている[37]。
このように、Ptf1a遺伝子は膵前駆細胞の運命決定だけでなく、特定の脳領域における神経細胞サブタイプの運命決定において極めて中心的な役割を果たすと考えられている。また、PTF1Aの過剰発現により、無脊椎動物であるホヤの幼生においてドーパミン神経への分化を誘導促進する[38]。さらに、マウス大脳皮質での異所性発現では、抑制性ニューロンの特性(遺伝子発現、細胞形態、移動様式)を付与することも示されている[20][39]。
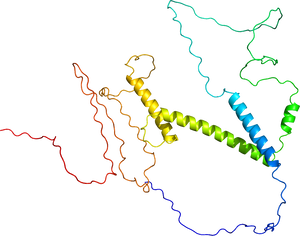
AlphaFold予測(Q7RTS3)
構造
一次構造
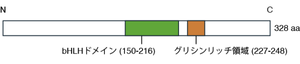
ヒトPTF1Aタンパク質は328アミノ酸から成り、塩基性ヘリックス・ループ・ヘリックス(basic helix-loop-helix)型DNA結合ドメインを有するClass II bHLH因子群に属する(図1および2)。主に核内で転写因子として機能する。PTF1Aのサブファミリーに属する因子はこれまで同定されていない。
複合体
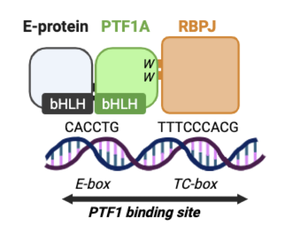
PTF1AはEタンパク質およびRBPJ(Notchシグナルの媒介因子)とともに三量複合体PTF1を形成する。まずPTF1AとEタンパク質がヘテロ二量体を形成してDNA上のE-box配列(CANNTG)に結合する。さらにこの二量体にRecombination signal Binding Protein for immunoglobulin kappa J region (RBPJ、別名mammalian Suppressor of Hairless)あるいはRecombination signal Binding Protein for immunoglobulin kappa J region-like (RBPJL)がPTF1AのC末端側トリプトファン残基を介して結合することで、三量体PTF1として転写活性を発揮する(図3)[19][40][41][Beres et al., MCB 200645]。
発現
組織分布・発現時期
胎生期より主に以下の発生過程の組織で観察される。
膵前駆細胞 (Pancreas progenitors)
胎生期膵形成初期より発現が開始する。膵外分泌細胞系列、ランゲルハンス島ベータ細胞などの内分泌細胞や導管の前駆細胞に発現する。外分泌細胞における遺伝子発現は成体膵で継続する。膵臓における上流因子として転写因子HHEXがPTF1AおよびNKX6.1の発現を亢進することが示されている[42][Ito et al., Sci Rep 202366]。
小脳原基 (Cerebellar anlage)
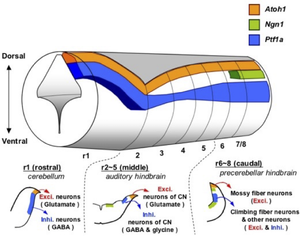
前方背側部の脳室周囲帯(VZ)にmRNAおよびタンパク質の発現がみられ(ロンボメア1レベル)、GABA作動性ニューロン(プルキンエ細胞、PAX2陽性介在ニューロン、小脳核抑制性ニューロンなど)の前駆細胞に発現する(図4)[20][Hoshino et al., 200520]。一方、菱脳唇(rhombic lip)から産生される小脳興奮性ニューロン(顆粒細胞、小脳核興奮性ニューロンなど)の前駆細胞では他のbHLH因子であるATOH1が発現する[43][44][45][Ben-Arie et al., Nature 199729; Machold and Fishell, Neuron 200530; Wang, Neuron 200531]。
後方菱脳
背側の神経上皮で発現。背側蝸牛神経核および腹側蝸牛神経核の抑制性ニューロンの前駆細胞(ロンボメア2-5レベル)[34][Fujiyama et al., 200937]、下オリーブ核(ION)登上線維ニューロンの前駆細胞などに発現する(ロンボメア6-8レベル)[35][Yamada et al., 200738]。登上線維ニューロンは分裂終了後にPTF1A発現を消失し、神経管の背側から腹側に移動する。
脊髄後角
神経管背側の中間領域(dI4–dI6)における抑制性介在ニューロンの前駆細胞で発現する[29][Glasgow et al., 200532]。この時、遠位の3' エンハンサー領域でPAX6やSOX3が上流因子として機能することや[46][Mona et al., DB 201663]、PTF1複合体によるautoregulation作用を含む発現調節機構が知られている[47][Meredith et al., JN 200964]。
網膜原基
網膜形成過程の外神経芽細胞層におけるアマクリン細胞および水平細胞の前駆細胞に発現する[31][Fujitani et al., 200634]。網膜における上流因子としてFOXN4, RORβ1が知られている[48][Liu et al., Nat Commun 201365]。
前脳(終脳/間脳)
第三脳室周囲の神経上皮および未成熟ニューロンで発現する。マウスでは主にE10.5以降からE14.5までの視索前野および腹側視床下部の2カ所の神経上皮領域に発現がみられる[37][Fujiyama et al., 201840]。
機能
分子機能
PTF1AはEタンパク質およびRBPJ(Notchシグナルの媒介因子)とともに三量複合体PTF1を形成することで転写因子として機能する[19][40][Obata et al., 200119; Duque et al., FEBS 202244]。
Eタンパク質 (E-protein, E12/E47, TCF3)はbHLHファミリーに属する転写因子であり、PTF1Aとヘテロ二量体を形成してDNA上のE-box配列(CANNTG)に結合する。さらにこの二量体にRBPJがPTF1AのC末端側トリプトファン残基を介して結合することで、三量体PTF1として転写活性を発揮する(図3)[41][Beres et al., MCB 200645]。
RBPJおよびRBPJLはいずれもNotchシグナル経路の中心的転写因子として知られ、DNA上のTC-box配列に結合する。活性化には補助因子との複合体形成が必要である。特に、膵外分泌酵素(elastase-1, amylase)の遺伝子や脊髄、網膜のGABA神経系分化関連遺伝子に対する転写制御においてPTF1複合体形成が転写活性に不可欠である[14][49][50][51][Masui et al., Genes Dev 200714; Masui et al., Gastroenterology 201046; Hori et al., Genes and Dev 200847; Lelièvre et al., DB 201148]。
主な下流遺伝子を表1に示す。
| 遺伝子 | 機能・役割 | 参考文献 |
|---|---|---|
| Prdm13 |
小脳GABA作動性ニューロン、視床下部キスペプチンニューロンの発生(マウス・ヒト) |
[52][53][54][55] |
| Tfap2a, Tfap2b |
網膜におけるアマクリン細胞と水平細胞の分化 |
[56] |
| Nephrin, Neph3 |
後脳〜脊髄領域での発現促進に必要 |
[57] |
| Neurog2 |
脊髄における発現制御 |
[58] |
| Pdx1 |
プロモーター領域に結合し発現促進 |
[59] |
標的遺伝子領域のクロマチンのエピジェネティック修飾状態(ヒストン修飾、DNAメチル化など)がPTF1Aの結合効率に影響を与える可能性がある。一例として、PTF1複合体が標的とする膵臓遺伝子や神経管遺伝子のCANNTGモチーフ配列付近におけるオープンクロマチン状態が、標的遺伝子の発現に影響を与えることが示されている[60][Meredith et al., MCB 201360]。
C末端側リジン残基を介してE3リガーゼのTRIP12によりユビキチン化プロテアソーム分解制御を受けることが知られている[61][Hanoun et al., JBC 201449]。またPCAF(P300/CBPコアクチベーターファミリー)によるbHLHドメイン内リジン残基のアセチル化が転写活性に必要であることが報告されている[62][Rodolosse et al., 200950]。AKTキナーゼによるセリン残基リン酸化を介した活性制御の可能性があるが、詳細は不明[63][Jin and Xiang, 201951]。
組織・個体レベル
PTF1Aは膵臓発達のみならず、中枢神経系における多様なニューロンの運命決定および領域特異的な神経ネットワーク形成に中心的な役割を果たしている。 以下に主要な神経領域および膵臓でのPTF1Aの機能を示す。
神経系
小脳原基
第4脳室周囲帯でGABA作動性ニューロン(プルキンエ細胞、PAX2陽性介在ニューロン、小脳核抑制性ニューロン)の細胞分化を促進し、抑制性ニューロンへの運命決定を誘導する[20][25][Hoshino et al., 200520; Pascual et al., PNAS 200725]。Ptf1aの欠損により小脳皮質が消失し、抑制性ニューロンが橋核ニューロンへと運命転換されるなど、小脳皮質の正常な発生が阻害される[64][Millen et al., PNAS 201467]。さらに、菱脳より後方の神経管においてPTF1AとATOH1は相互に影響を与えつつ機能する[23][Yamada et al., JN 201423]。
脊髄後角前駆細胞
脊髄の背側領域(dI4–dI6)においてGABA作動性抑制性介在ニューロンの分化を誘導する[29][30][Glasgow et al., Development 200532; Hori and Hoshino, Neural Plast 201233]。また、RBPJとの相互作用が脊髄GABAニューロンの発生に重要である[50][Hori et al., Genes and Dev 200847]。さらに、体性感覚や痛みなど脊髄の感覚情報処理や運動制御に関与する抑制性神経回路形成を促す[65][54][66][67][68][Huang et al., 2008 DB68; Chang et al., Dev Cell 201354; Bikoff et al., 2016 Cell69; Zhang et al., Cell Reports 201770; Escalante and Klein, Cell Rep 202071]。
網膜原基
網膜形成過程の外神経芽細胞層において、視覚処理に関与する抑制性介在ニューロン(アマクリン細胞および水平細胞)の運命を決定する(マウス、ゼブラフィッシュ、ツメガエルなどでの研究)[32][33][69][70][71][72][Nakhai et al., Development 2007; Dullin et al., BMC Dev Biol 2007; Jusuf and Harris, Neural Dev 2009; Jusuf et al., JN 2011; Mazurier et al., PLOS One 2014; Bessodes et al., Neural Dev 201735,36,72–75]。 Ptf1a欠損では、これらの細胞が網膜神経節細胞へ運命転換を起こす(マウスおよびニワトリでの研究)[31][51][Fujitani et al., Development 2006; Lelièvre et al., DB 201134,48]。さらに、アマクリン細胞と共通する性質を持つ幼生ホヤのDAドーパミン細胞の発達にも関与する[73][Razy-Krajka et al., BMC Biol 201276]。
後方菱脳神経上皮
後方菱脳神経上皮は蝸牛神経核、下オリーブ核、孤束核、三叉神経核などの前駆細胞である。ロンボメア2-5レベルでは、マウスにおいて聴覚入力処理に関与する蝸牛神経核(cochlear nucleus)を構成する主要なニューロン産生に関与し、GABA作動性およびグリシン作動性の抑制性ニューロン(Cartwheel細胞、ゴルジ細胞など)の細胞運命を決定する[34][Fujiyama et al., 2009 Development37]。
一方、蝸牛神経核の興奮性ニューロン分化はATOH1が関与する[74][Maricich et al., JN 200977]。 ロンボメア6-8レベルでは、下オリーブ核(inferior olivary nucleus)を構成するグルタミン酸作動性登上線維ニューロンの細胞運命を決定する[35][75][Yamada et al., 2007 JN; Bae et al., DB 200938,78]。
登上線維ニューロンは分裂終了後に神経管の背側から腹側に移動するが、Ptf1a欠失により登上線維ニューロンが産生されず結果として下オリーブ核が消失する。 また、らせん神経節ニューロンの蝸牛神経核内部における正常な投射様式の形成にも必要である[76][Elliott et al., Neuroscience Letters 202379]。 さらに、内臓感覚および体性感覚の脳幹神経核の発生にも関与することが報告されており、孤束核や三叉神経脊髄路核・主知覚核(Nucleus of solitary tract, spinal and principal trigeminal nuclei)を構成するニューロンや[77][Iskusnykh et al., JN 201680]、ニワトリのdB1 hindbrain interneuronの運命決定に関与する[78][Kohl et al., JN 201581]。
前脳(終脳/間脳)、視床下部前駆細胞
マウス視床下部におけるPtf1a機能喪失により、脳の性分化に関与するキスペプチンニューロン数が顕著に減少し、性特異的行動および性腺発達に異常を引き起こす[37][Fujiyama et al., Cel Rep 201840]。Ptf1a陽性の神経前駆細胞は内側視索前野や腹内側核などを含む複数の視床下部神経核ニューロン系譜を形成するが、集団としての生理的機能は不明である。
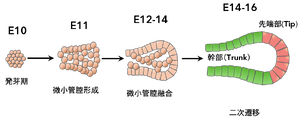
未分化膵原基からの膵組織の分化プロセス。文献[79]より改変。
膵臓形成
胎生期膵形成初期において、外分泌細胞系列の分化を促進し、ランゲルハンス島内分泌細胞や導管の前駆細胞の運命決定にも関与する。 Ptf1a欠損マウスでは膵臓の外分泌細胞が欠落し、膵器官も無形成となる[5][6][Kawaguchi 2002, Sellick 20045,6]。またRBPJとの相互作用が膵臓の正常発生に重要である[14][Masui et al., Genes Dev 200714]。さらに、Ptf1a遺伝子の発現量の多寡が膵臓の分化、成長、総β細胞数、島形態形成、および内分泌機能に影響を与えることが示されている[80][Diabetes 2008, Fukuda et al.82]。成体の外分泌腺房細胞におけるPtf1a欠失が、ERストレスを介してアポトーシスを引き起こすことも知られている[81][Sci Rep 2018, Sakikubo et al.83]。
PTF1Aによって膵運命を決定され原腸から発芽した未分化膵原基は、樹状構造を形成し先端部分(tip領域)と幹部分(trunk領域)に分かれる(図5)[79][82][追加引用1、2]。転写因子PTF1AとNKX6.1が互いに抑制し合うcross-repressiveな作用により、これらの領域で細胞分化の運命決定がなされる[83][Schaffer et al., Developmental Cell 2010]。外分泌組織を形成するtip領域の膵外分泌(腺房)前駆細胞ではPTF1AがDll1の発現を活性化し、このDll1によって隣接細胞のNotch経路が活性化されHes1が誘導されることで内分泌細胞への分化が抑制される側方抑制機構が働く[84][Ahnfelt-Rønne et al., Development 2012]。一方NKX6.1が発現するtrunk領域の細胞では隣接細胞の外分泌細胞分化が抑制され、Notchシグナルと協調して内分泌・導管分化が促進される[83][Schaffer et al., Developmental Cell 2010]。
疾患との関わり
PTF1A遺伝子の機能喪失型変異のホモ接合により、常染色体潜性遺伝性の膵形成不全と小脳形成不全が随伴する新生児糖尿病を引き起こすことが知られている[8][7][6][12][Hoveyda et al., 1999 J Med Genet; Sellick et al., Diabetes 2003; Sellick et al., 2004 Nat Genet; Al-Shammari et al., Clinical Genetics 2011, 6–8,12]。膵発達不全に伴い、膵内分泌細胞形成にも影響が及ぶため、インスリン注入に反応しない重度の高血糖状態が観察される[6][Sellick et al., 2004 Nat Genet6]。
関連項目
参考文献
- ↑
Krapp, A., Knöfler, M., Frutiger, S., Hughes, G.J., Hagenbüchle, O., & Wellauer, P.K. (1996).
The p48 DNA-binding subunit of transcription factor PTF1 is a new exocrine pancreas-specific basic helix-loop-helix protein. The EMBO journal, 15(16), 4317-29. [PubMed:8861960] [PMC] [WorldCat] - ↑
Knöfler, M., Krapp, A., Hagenbüchle, O., & Wellauer, P.K. (1996).
Constitutive expression of the gene for the cell-specific p48 DNA-binding subunit of pancreas transcription factor 1 in cultured cells is under control of binding sites for transcription factors Sp1 and alphaCbf. The Journal of biological chemistry, 271(36), 21993-2002. [PubMed:8703005] [WorldCat] [DOI] - ↑
Rose, S.D., Swift, G.H., Peyton, M.J., Hammer, R.E., & MacDonald, R.J. (2001).
The role of PTF1-P48 in pancreatic acinar gene expression. The Journal of biological chemistry, 276(47), 44018-26. [PubMed:11562365] [WorldCat] [DOI] - ↑
Krapp, A., Knöfler, M., Ledermann, B., Bürki, K., Berney, C., Zoerkler, N., ..., & Wellauer, P.K. (1998).
The bHLH protein PTF1-p48 is essential for the formation of the exocrine and the correct spatial organization of the endocrine pancreas. Genes & development, 12(23), 3752-63. [PubMed:9851981] [PMC] [WorldCat] [DOI] - ↑ 5.0 5.1
Kawaguchi, Y., Cooper, B., Gannon, M., Ray, M., MacDonald, R.J., & Wright, C.V. (2002).
The role of the transcriptional regulator Ptf1a in converting intestinal to pancreatic progenitors. Nature genetics, 32(1), 128-34. [PubMed:12185368] [WorldCat] [DOI] 引用エラー: 無効な<ref>タグ; name "Kawaguchi2002"が異なる内容で複数回定義されています - ↑ 6.0 6.1 6.2 6.3
Sellick, G.S., Barker, K.T., Stolte-Dijkstra, I., Fleischmann, C., Coleman, R.J., Garrett, C., ..., & Houlston, R.S. (2004).
Mutations in PTF1A cause pancreatic and cerebellar agenesis. Nature genetics, 36(12), 1301-5. [PubMed:15543146] [WorldCat] [DOI] 引用エラー: 無効な<ref>タグ; name "Sellick2004"が異なる内容で複数回定義されています - ↑ 7.0 7.1
Sellick, G.S., Garrett, C., & Houlston, R.S. (2003).
A novel gene for neonatal diabetes maps to chromosome 10p12.1-p13. Diabetes, 52(10), 2636-8. [PubMed:14514650] [WorldCat] [DOI] - ↑ 8.0 8.1
Hoveyda, N., Shield, J.P., Garrett, C., Chong, W.K., Beardsall, K., Bentsi-Enchill, E., ..., & Thompson, M.H. (1999).
Neonatal diabetes mellitus and cerebellar hypoplasia/agenesis: report of a new recessive syndrome. Journal of medical genetics, 36(9), 700-4. [PubMed:10507728] [PMC] [WorldCat] - ↑
Masui, T., Swift, G.H., Hale, M.A., Meredith, D.M., Johnson, J.E., & Macdonald, R.J. (2008).
Transcriptional autoregulation controls pancreatic Ptf1a expression during development and adulthood. Molecular and cellular biology, 28(17), 5458-68. [PubMed:18606784] [PMC] [WorldCat] [DOI] - ↑
Pan, F.C., Bankaitis, E.D., Boyer, D., Xu, X., Van de Casteele, M., Magnuson, M.A., ..., & Wright, C.V. (2013).
Spatiotemporal patterns of multipotentiality in Ptf1a-expressing cells during pancreas organogenesis and injury-induced facultative restoration. Development (Cambridge, England), 140(4), 751-64. [PubMed:23325761] [PMC] [WorldCat] [DOI] - ↑
Burlison, J.S., Long, Q., Fujitani, Y., Wright, C.V., & Magnuson, M.A. (2008).
Pdx-1 and Ptf1a concurrently determine fate specification of pancreatic multipotent progenitor cells. Developmental biology, 316(1), 74-86. [PubMed:18294628] [PMC] [WorldCat] [DOI] - ↑ 12.0 12.1
Al-Shammari, M., Al-Husain, M., Al-Kharfy, T., & Alkuraya, F.S. (2011).
A novel PTF1A mutation in a patient with severe pancreatic and cerebellar involvement. Clinical genetics, 80(2), 196-8. [PubMed:21749365] [WorldCat] [DOI] - ↑
Adell, T., Gómez-Cuadrado, A., Skoudy, A., Pettengill, O.S., Longnecker, D.S., & Real, F.X. (2000).
Role of the basic helix-loop-helix transcription factor p48 in the differentiation phenotype of exocrine pancreas cancer cells. Cell growth & differentiation : the molecular biology journal of the American Association for Cancer Research, 11(3), 137-47. [PubMed:10768861] [WorldCat] - ↑ 14.0 14.1 14.2
Masui, T., Long, Q., Beres, T.M., Magnuson, M.A., & MacDonald, R.J. (2007).
Early pancreatic development requires the vertebrate Suppressor of Hairless (RBPJ) in the PTF1 bHLH complex. Genes & development, 21(20), 2629-43. [PubMed:17938243] [PMC] [WorldCat] [DOI] 引用エラー: 無効な<ref>タグ; name "Masui2007"が異なる内容で複数回定義されています - ↑
Magnuson, M.A., & Osipovich, A.B. (2013).
Pancreas-specific Cre driver lines and considerations for their prudent use. Cell metabolism, 18(1), 9-20. [PubMed:23823474] [PMC] [WorldCat] [DOI] - ↑
Fujitani, Y. (2017).
Transcriptional regulation of pancreas development and β-cell function [Review]. Endocrine journal, 64(5), 477-486. [PubMed:28420858] [WorldCat] [DOI] - ↑
Veite-Schmahl, M.J., Joesten, W.C., & Kennedy, M.A. (2017).
HMGA1 expression levels are elevated in pancreatic intraepithelial neoplasia cells in the Ptf1a-Cre; LSL-KrasG12D transgenic mouse model of pancreatic cancer. British journal of cancer, 117(5), 639-647. [PubMed:28697176] [PMC] [WorldCat] [DOI] - ↑
Hingorani, S.R., Petricoin, E.F., Maitra, A., Rajapakse, V., King, C., Jacobetz, M.A., ..., & Tuveson, D.A. (2003).
Preinvasive and invasive ductal pancreatic cancer and its early detection in the mouse. Cancer cell, 4(6), 437-50. [PubMed:14706336] [WorldCat] [DOI] - ↑ 19.0 19.1 19.2
Obata, J., Yano, M., Mimura, H., Goto, T., Nakayama, R., Mibu, Y., ..., & Kawaichi, M. (2001).
p48 subunit of mouse PTF1 binds to RBP-Jkappa/CBF-1, the intracellular mediator of Notch signalling, and is expressed in the neural tube of early stage embryos. Genes to cells : devoted to molecular & cellular mechanisms, 6(4), 345-60. [PubMed:11318877] [WorldCat] [DOI] 引用エラー: 無効な<ref>タグ; name "Obata2001"が異なる内容で複数回定義されています - ↑ 20.0 20.1 20.2 20.3
Hoshino, M., Nakamura, S., Mori, K., Kawauchi, T., Terao, M., Nishimura, Y.V., ..., & Nabeshima, Y. (2005).
Ptf1a, a bHLH transcriptional gene, defines GABAergic neuronal fates in cerebellum. Neuron, 47(2), 201-13. [PubMed:16039563] [WorldCat] [DOI] 引用エラー: 無効な<ref>タグ; name "Hoshino2005"が異なる内容で複数回定義されています - ↑
Hoshino, M. (2006).
Molecular machinery governing GABAergic neuron specification in the cerebellum. Cerebellum (London, England), 5(3), 193-8. [PubMed:16997750] [WorldCat] [DOI] - ↑
Wullimann, M.F., Mueller, T., Distel, M., Babaryka, A., Grothe, B., & Köster, R.W. (2011).
The long adventurous journey of rhombic lip cells in jawed vertebrates: a comparative developmental analysis. Frontiers in neuroanatomy, 5, 27. [PubMed:21559349] [PMC] [WorldCat] [DOI] - ↑ 23.0 23.1
Yamada, M., Seto, Y., Taya, S., Owa, T., Inoue, Y.U., Inoue, T., ..., & Hoshino, M. (2014).
Specification of spatial identities of cerebellar neuron progenitors by ptf1a and atoh1 for proper production of GABAergic and glutamatergic neurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 34(14), 4786-800. [PubMed:24695699] [PMC] [WorldCat] [DOI] 引用エラー: 無効な<ref>タグ; name "Yamada2014"が異なる内容で複数回定義されています - ↑
Seto, Y., Nakatani, T., Masuyama, N., Taya, S., Kumai, M., Minaki, Y., ..., & Hoshino, M. (2014).
Temporal identity transition from Purkinje cell progenitors to GABAergic interneuron progenitors in the cerebellum. Nature communications, 5, 3337. [PubMed:24535035] [PMC] [WorldCat] [DOI] - ↑ 25.0 25.1
Pascual, M., Abasolo, I., Mingorance-Le Meur, A., Martínez, A., Del Rio, J.A., Wright, C.V., ..., & Soriano, E. (2007).
Cerebellar GABAergic progenitors adopt an external granule cell-like phenotype in the absence of Ptf1a transcription factor expression. Proceedings of the National Academy of Sciences of the United States of America, 104(12), 5193-8. [PubMed:17360405] [PMC] [WorldCat] [DOI] 引用エラー: 無効な<ref>タグ; name "Pascual2007"が異なる内容で複数回定義されています - ↑
Millen, K.J., & Gleeson, J.G. (2008).
Cerebellar development and disease. Current opinion in neurobiology, 18(1), 12-9. [PubMed:18513948] [PMC] [WorldCat] [DOI] - ↑
Achim, K., Salminen, M., & Partanen, J. (2014).
Mechanisms regulating GABAergic neuron development. Cellular and molecular life sciences : CMLS, 71(8), 1395-415. [PubMed:24196748] [PMC] [WorldCat] [DOI] - ↑
Lowenstein, E.D., Cui, K., & Hernandez-Miranda, L.R. (2023).
Regulation of early cerebellar development. The FEBS journal, 290(11), 2786-2804. [PubMed:35262281] [WorldCat] [DOI] - ↑ 29.0 29.1 29.2
Glasgow, S.M., Henke, R.M., Macdonald, R.J., Wright, C.V., & Johnson, J.E. (2005).
Ptf1a determines GABAergic over glutamatergic neuronal cell fate in the spinal cord dorsal horn. Development (Cambridge, England), 132(24), 5461-9. [PubMed:16291784] [WorldCat] [DOI] 引用エラー: 無効な<ref>タグ; name "Glasgow2005"が異なる内容で複数回定義されています - ↑ 30.0 30.1
Hori, K., & Hoshino, M. (2012).
GABAergic neuron specification in the spinal cord, the cerebellum, and the cochlear nucleus. Neural plasticity, 2012, 921732. [PubMed:22830054] [PMC] [WorldCat] [DOI] 引用エラー: 無効な<ref>タグ; name "Hori2012"が異なる内容で複数回定義されています - ↑ 31.0 31.1 31.2
Fujitani, Y., Fujitani, S., Luo, H., Qiu, F., Burlison, J., Long, Q., ..., & Wright, C.V. (2006).
Ptf1a determines horizontal and amacrine cell fates during mouse retinal development. Development (Cambridge, England), 133(22), 4439-50. [PubMed:17075007] [WorldCat] [DOI] 引用エラー: 無効な<ref>タグ; name "Fujitani2006"が異なる内容で複数回定義されています - ↑ 32.0 32.1
Nakhai, H., Sel, S., Favor, J., Mendoza-Torres, L., Paulsen, F., Duncker, G.I., & Schmid, R.M. (2007).
Ptf1a is essential for the differentiation of GABAergic and glycinergic amacrine cells and horizontal cells in the mouse retina. Development (Cambridge, England), 134(6), 1151-60. [PubMed:17301087] [WorldCat] [DOI] 引用エラー: 無効な<ref>タグ; name "Nakhai2007"が異なる内容で複数回定義されています - ↑ 33.0 33.1
Dullin, J.P., Locker, M., Robach, M., Henningfeld, K.A., Parain, K., Afelik, S., ..., & Perron, M. (2007).
Ptf1a triggers GABAergic neuronal cell fates in the retina. BMC developmental biology, 7, 110. [PubMed:17910758] [PMC] [WorldCat] [DOI] 引用エラー: 無効な<ref>タグ; name "Dullin2007"が異なる内容で複数回定義されています - ↑ 34.0 34.1 34.2
Fujiyama, T., Yamada, M., Terao, M., Terashima, T., Hioki, H., Inoue, Y.U., ..., & Hoshino, M. (2009).
Inhibitory and excitatory subtypes of cochlear nucleus neurons are defined by distinct bHLH transcription factors, Ptf1a and Atoh1. Development (Cambridge, England), 136(12), 2049-58. [PubMed:19439493] [WorldCat] [DOI] 引用エラー: 無効な<ref>タグ; name "Fujiyama2009"が異なる内容で複数回定義されています - ↑ 35.0 35.1 35.2
Yamada, M., Terao, M., Terashima, T., Fujiyama, T., Kawaguchi, Y., Nabeshima, Y., & Hoshino, M. (2007).
Origin of climbing fiber neurons and their developmental dependence on Ptf1a. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(41), 10924-34. [PubMed:17928434] [PMC] [WorldCat] [DOI] 引用エラー: 無効な<ref>タグ; name "Yamada2007"が異なる内容で複数回定義されています - ↑
Aldinger, K.A., & Elsen, G.E. (2008).
Ptf1a is a molecular determinant for both glutamatergic and GABAergic neurons in the hindbrain. The Journal of neuroscience : the official journal of the Society for Neuroscience, 28(2), 338-9. [PubMed:18184775] [PMC] [WorldCat] [DOI] - ↑ 37.0 37.1 37.2
Wilderman, A., VanOudenhove, J., Kron, J., Noonan, J.P., & Cotney, J. (2018).
High-Resolution Epigenomic Atlas of Human Embryonic Craniofacial Development. Cell reports, 23(5), 1581-1597. [PubMed:29719267] [PMC] [WorldCat] [DOI] - ↑
Horie, T., Horie, R., Chen, K., Cao, C., Nakagawa, M., Kusakabe, T.G., ..., & Levine, M. (2018).
Regulatory cocktail for dopaminergic neurons in a protovertebrate identified by whole-embryo single-cell transcriptomics. Genes & development, 32(19-20), 1297-1302. [PubMed:30228204] [PMC] [WorldCat] [DOI] - ↑
Russ, J.B., Borromeo, M.D., Kollipara, R.K., Bommareddy, P.K., Johnson, J.E., & Kaltschmidt, J.A. (2015).
Misexpression of ptf1a in cortical pyramidal cells in vivo promotes an inhibitory peptidergic identity. The Journal of neuroscience : the official journal of the Society for Neuroscience, 35(15), 6028-37. [PubMed:25878276] [PMC] [WorldCat] [DOI] - ↑ 40.0 40.1
Duque, M., Amorim, J.P., & Bessa, J. (2022).
Ptf1a function and transcriptional cis-regulation, a cornerstone in vertebrate pancreas development. The FEBS journal, 289(17), 5121-5136. [PubMed:34125483] [PMC] [WorldCat] [DOI] - ↑ 41.0 41.1
Beres, T.M., Masui, T., Swift, G.H., Shi, L., Henke, R.M., & MacDonald, R.J. (2006).
PTF1 is an organ-specific and Notch-independent basic helix-loop-helix complex containing the mammalian Suppressor of Hairless (RBP-J) or its paralogue, RBP-L. Molecular and cellular biology, 26(1), 117-30. [PubMed:16354684] [PMC] [WorldCat] [DOI] - ↑
Ito, R., Kimura, A., Hirose, Y., Hatano, Y., Mima, A., Mae, S.I., ..., & Osafune, K. (2023).
Elucidation of HHEX in pancreatic endoderm differentiation using a human iPSC differentiation model. Scientific reports, 13(1), 8659. [PubMed:37248264] [PMC] [WorldCat] [DOI] - ↑
Pan, Y., Lloyd, C., Zhou, H., Dolich, S., Deeds, J., Gonzalo, J.A., ..., & Gearing, D. (1997).
Neurotactin, a membrane-anchored chemokine upregulated in brain inflammation. Nature, 387(6633), 611-7. [PubMed:9177350] [WorldCat] [DOI] - ↑
Tozuka, Y., Fukuda, S., Namba, T., Seki, T., & Hisatsune, T. (2005).
GABAergic excitation promotes neuronal differentiation in adult hippocampal progenitor cells. Neuron, 47(6), 803-15. [PubMed:16157276] [WorldCat] [DOI] - ↑
Lee, J.L., Di Ciano, P., Thomas, K.L., & Everitt, B.J. (2005).
Disrupting reconsolidation of drug memories reduces cocaine-seeking behavior. Neuron, 47(6), 795-801. [PubMed:16157275] [WorldCat] [DOI] - ↑
Mona, B., Avila, J.M., Meredith, D.M., Kollipara, R.K., & Johnson, J.E. (2016).
Regulating the dorsal neural tube expression of Ptf1a through a distal 3' enhancer. Developmental biology, 418(1), 216-225. [PubMed:27350561] [PMC] [WorldCat] [DOI] - ↑
Meredith, D.M., Masui, T., Swift, G.H., MacDonald, R.J., & Johnson, J.E. (2009).
Multiple transcriptional mechanisms control Ptf1a levels during neural development including autoregulation by the PTF1-J complex. The Journal of neuroscience : the official journal of the Society for Neuroscience, 29(36), 11139-48. [PubMed:19741120] [PMC] [WorldCat] [DOI] - ↑
Liu, H., Kim, S.Y., Fu, Y., Wu, X., Ng, L., Swaroop, A., & Forrest, D. (2013).
An isoform of retinoid-related orphan receptor β directs differentiation of retinal amacrine and horizontal interneurons. Nature communications, 4, 1813. [PubMed:23652001] [PMC] [WorldCat] [DOI] - ↑
Masui, T., Swift, G.H., Deering, T., Shen, C., Coats, W.S., Long, Q., ..., & MacDonald, R.J. (2010).
Replacement of Rbpj with Rbpjl in the PTF1 complex controls the final maturation of pancreatic acinar cells. Gastroenterology, 139(1), 270-80. [PubMed:20398665] [PMC] [WorldCat] [DOI] - ↑ 50.0 50.1
Hori, K., Cholewa-Waclaw, J., Nakada, Y., Glasgow, S.M., Masui, T., Henke, R.M., ..., & Johnson, J.E. (2008).
A nonclassical bHLH Rbpj transcription factor complex is required for specification of GABAergic neurons independent of Notch signaling. Genes & development, 22(2), 166-78. [PubMed:18198335] [PMC] [WorldCat] [DOI] - ↑ 51.0 51.1
Lelièvre, E.C., Lek, M., Boije, H., Houille-Vernes, L., Brajeul, V., Slembrouck, A., ..., & Guillonneau, X. (2011).
Ptf1a/Rbpj complex inhibits ganglion cell fate and drives the specification of all horizontal cell subtypes in the chick retina. Developmental biology, 358(2), 296-308. [PubMed:21839069] [WorldCat] [DOI] - ↑
Hanotel, J., Bessodes, N., Thélie, A., Hedderich, M., Parain, K., Van Driessche, B., ..., & Bellefroid, E.J. (2014).
The Prdm13 histone methyltransferase encoding gene is a Ptf1a-Rbpj downstream target that suppresses glutamatergic and promotes GABAergic neuronal fate in the dorsal neural tube. Developmental biology, 386(2), 340-57. [PubMed:24370451] [WorldCat] [DOI] - ↑
Whittaker, D.E., Oleari, R., Gregory, L.C., Le Quesne-Stabej, P., Williams, H.J., GOSgene, ..., & Dattani, M.T. (2021).
A recessive PRDM13 mutation results in congenital hypogonadotropic hypogonadism and cerebellar hypoplasia. The Journal of clinical investigation, 131(24). [PubMed:34730112] [PMC] [WorldCat] [DOI] - ↑ 54.0 54.1
Chang, J.C., Meredith, D.M., Mayer, P.R., Borromeo, M.D., Lai, H.C., Ou, Y.H., & Johnson, J.E. (2013).
Prdm13 mediates the balance of inhibitory and excitatory neurons in somatosensory circuits. Developmental cell, 25(2), 182-95. [PubMed:23639443] [PMC] [WorldCat] [DOI] - ↑
Watanabe, S., Sanuki, R., Sugita, Y., Imai, W., Yamazaki, R., Kozuka, T., ..., & Furukawa, T. (2015).
Prdm13 regulates subtype specification of retinal amacrine interneurons and modulates visual sensitivity. The Journal of neuroscience : the official journal of the Society for Neuroscience, 35(20), 8004-20. [PubMed:25995483] [PMC] [WorldCat] [DOI] - ↑
Jin, K., Jiang, H., Xiao, D., Zou, M., Zhu, J., & Xiang, M. (2015).
Tfap2a and 2b act downstream of Ptf1a to promote amacrine cell differentiation during retinogenesis. Molecular brain, 8, 28. [PubMed:25966682] [PMC] [WorldCat] [DOI] - ↑
Nishida, K., Hoshino, M., Kawaguchi, Y., & Murakami, F. (2010).
Ptf1a directly controls expression of immunoglobulin superfamily molecules Nephrin and Neph3 in the developing central nervous system. The Journal of biological chemistry, 285(1), 373-80. [PubMed:19887377] [PMC] [WorldCat] [DOI] - ↑
Henke, R.M., Savage, T.K., Meredith, D.M., Glasgow, S.M., Hori, K., Dumas, J., ..., & Johnson, J.E. (2009).
Neurog2 is a direct downstream target of the Ptf1a-Rbpj transcription complex in dorsal spinal cord. Development (Cambridge, England), 136(17), 2945-54. [PubMed:19641016] [PMC] [WorldCat] [DOI] - ↑
Wiebe, P.O., Kormish, J.D., Roper, V.T., Fujitani, Y., Alston, N.I., Zaret, K.S., ..., & Gannon, M. (2007).
Ptf1a binds to and activates area III, a highly conserved region of the Pdx1 promoter that mediates early pancreas-wide Pdx1 expression. Molecular and cellular biology, 27(11), 4093-104. [PubMed:17403901] [PMC] [WorldCat] [DOI] - ↑
Meredith, D.M., Borromeo, M.D., Deering, T.G., Casey, B.H., Savage, T.K., Mayer, P.R., ..., & Johnson, J.E. (2013).
Program specificity for Ptf1a in pancreas versus neural tube development correlates with distinct collaborating cofactors and chromatin accessibility. Molecular and cellular biology, 33(16), 3166-79. [PubMed:23754747] [PMC] [WorldCat] [DOI] - ↑
Hanoun, N., Fritsch, S., Gayet, O., Gigoux, V., Cordelier, P., Dusetti, N., ..., & Dufresne, M. (2014).
The E3 ubiquitin ligase thyroid hormone receptor-interacting protein 12 targets pancreas transcription factor 1a for proteasomal degradation. The Journal of biological chemistry, 289(51), 35593-604. [PubMed:25355311] [PMC] [WorldCat] [DOI] - ↑
Rodolosse, A., Campos, M.L., Rooman, I., Lichtenstein, M., & Real, F.X. (2009).
p/CAF modulates the activity of the transcription factor p48/Ptf1a involved in pancreatic acinar differentiation. The Biochemical journal, 418(2), 463-73. [PubMed:18834332] [WorldCat] [DOI] - ↑
Jin, K., & Xiang, M. (2019).
Transcription factor Ptf1a in development, diseases and reprogramming. Cellular and molecular life sciences : CMLS, 76(5), 921-940. [PubMed:30470852] [PMC] [WorldCat] [DOI] - ↑
Millen, K.J., Steshina, E.Y., Iskusnykh, I.Y., & Chizhikov, V.V. (2014).
Transformation of the cerebellum into more ventral brainstem fates causes cerebellar agenesis in the absence of Ptf1a function. Proceedings of the National Academy of Sciences of the United States of America, 111(17), E1777-86. [PubMed:24733890] [PMC] [WorldCat] [DOI] - ↑
Huang, M., Huang, T., Xiang, Y., Xie, Z., Chen, Y., Yan, R., ..., & Cheng, L. (2008).
Ptf1a, Lbx1 and Pax2 coordinate glycinergic and peptidergic transmitter phenotypes in dorsal spinal inhibitory neurons. Developmental biology, 322(2), 394-405. [PubMed:18634777] [WorldCat] [DOI] - ↑
Bikoff, J.B., Gabitto, M.I., Rivard, A.F., Drobac, E., Machado, T.A., Miri, A., ..., & Jessell, T.M. (2016).
Spinal Inhibitory Interneuron Diversity Delineates Variant Motor Microcircuits. Cell, 165(1), 207-219. [PubMed:26949184] [PMC] [WorldCat] [DOI] - ↑
Zhang, J., Weinrich, J.A.P., Russ, J.B., Comer, J.D., Bommareddy, P.K., DiCasoli, R.J., ..., & Kaltschmidt, J.A. (2017).
A Role for Dystonia-Associated Genes in Spinal GABAergic Interneuron Circuitry. Cell reports, 21(3), 666-678. [PubMed:29045835] [PMC] [WorldCat] [DOI] - ↑
Escalante, A., & Klein, R. (2020).
Spinal Inhibitory Ptf1a-Derived Neurons Prevent Self-Generated Itch. Cell reports, 33(8), 108422. [PubMed:33238109] [WorldCat] [DOI] - ↑
Jusuf, P.R., & Harris, W.A. (2009).
Ptf1a is expressed transiently in all types of amacrine cells in the embryonic zebrafish retina. Neural development, 4, 34. [PubMed:19732413] [PMC] [WorldCat] [DOI] - ↑
Jusuf, P.R., Almeida, A.D., Randlett, O., Joubin, K., Poggi, L., & Harris, W.A. (2011).
Origin and determination of inhibitory cell lineages in the vertebrate retina. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(7), 2549-62. [PubMed:21325522] [PMC] [WorldCat] [DOI] - ↑
Mazurier, N., Parain, K., Parlier, D., Pretto, S., Hamdache, J., Vernier, P., ..., & Perron, M. (2014).
Ascl1 as a novel player in the Ptf1a transcriptional network for GABAergic cell specification in the retina. PloS one, 9(3), e92113. [PubMed:24643195] [PMC] [WorldCat] [DOI] - ↑
Bessodes, N., Parain, K., Bronchain, O., Bellefroid, E.J., & Perron, M. (2017).
Prdm13 forms a feedback loop with Ptf1a and is required for glycinergic amacrine cell genesis in the Xenopus Retina. Neural development, 12(1), 16. [PubMed:28863786] [PMC] [WorldCat] [DOI] - ↑
Razy-Krajka, F., Brown, E.R., Horie, T., Callebert, J., Sasakura, Y., Joly, J.S., ..., & Vernier, P. (2012).
Monoaminergic modulation of photoreception in ascidian: evidence for a proto-hypothalamo-retinal territory. BMC biology, 10, 45. [PubMed:22642675] [PMC] [WorldCat] [DOI] - ↑
Maricich, S.M., Xia, A., Mathes, E.L., Wang, V.Y., Oghalai, J.S., Fritzsch, B., & Zoghbi, H.Y. (2009).
Atoh1-lineal neurons are required for hearing and for the survival of neurons in the spiral ganglion and brainstem accessory auditory nuclei. The Journal of neuroscience : the official journal of the Society for Neuroscience, 29(36), 11123-33. [PubMed:19741118] [PMC] [WorldCat] [DOI] - ↑
Bae, Y.K., Kani, S., Shimizu, T., Tanabe, K., Nojima, H., Kimura, Y., ..., & Hibi, M. (2009).
Anatomy of zebrafish cerebellum and screen for mutations affecting its development. Developmental biology, 330(2), 406-26. [PubMed:19371731] [WorldCat] [DOI] - ↑
Elliott, K.L., Iskusnykh, I.Y., Chizhikov, V.V., & Fritzsch, B. (2023).
Ptf1a expression is necessary for correct targeting of spiral ganglion neurons within the cochlear nuclei. Neuroscience letters, 806, 137244. [PubMed:37055006] [PMC] [WorldCat] [DOI] - ↑
Iskusnykh, I.Y., Steshina, E.Y., & Chizhikov, V.V. (2016).
Loss of Ptf1a Leads to a Widespread Cell-Fate Misspecification in the Brainstem, Affecting the Development of Somatosensory and Viscerosensory Nuclei. The Journal of neuroscience : the official journal of the Society for Neuroscience, 36(9), 2691-710. [PubMed:26937009] [PMC] [WorldCat] [DOI] - ↑
Kohl, A., Hadas, Y., Klar, A., & Sela-Donenfeld, D. (2012).
Axonal patterns and targets of dA1 interneurons in the chick hindbrain. The Journal of neuroscience : the official journal of the Society for Neuroscience, 32(17), 5757-71. [PubMed:22539838] [PMC] [WorldCat] [DOI] - ↑ 79.0 79.1
Stanger, B.Z., & Hebrok, M. (2013).
Control of cell identity in pancreas development and regeneration. Gastroenterology, 144(6), 1170-9. [PubMed:23622126] [PMC] [WorldCat] [DOI] - ↑
Zhang, X., Yeung, D.C., Karpisek, M., Stejskal, D., Zhou, Z.G., Liu, F., ..., & Xu, A. (2008).
Serum FGF21 levels are increased in obesity and are independently associated with the metabolic syndrome in humans. Diabetes, 57(5), 1246-53. [PubMed:18252893] [WorldCat] [DOI] - ↑
Sakikubo, M., Furuyama, K., Horiguchi, M., Hosokawa, S., Aoyama, Y., Tsuboi, K., ..., & Kawaguchi, Y. (2018).
Ptf1a inactivation in adult pancreatic acinar cells causes apoptosis through activation of the endoplasmic reticulum stress pathway. Scientific reports, 8(1), 15812. [PubMed:30361559] [PMC] [WorldCat] [DOI] - ↑
Pan, F.C., & Wright, C. (2011).
Pancreas organogenesis: from bud to plexus to gland. Developmental dynamics : an official publication of the American Association of Anatomists, 240(3), 530-65. [PubMed:21337462] [WorldCat] [DOI] - ↑ 83.0 83.1
Schaffer, A.E., Freude, K.K., Nelson, S.B., & Sander, M. (2010).
Nkx6 transcription factors and Ptf1a function as antagonistic lineage determinants in multipotent pancreatic progenitors. Developmental cell, 18(6), 1022-9. [PubMed:20627083] [PMC] [WorldCat] [DOI] - ↑
Ahnfelt-Rønne, J., Jørgensen, M.C., Klinck, R., Jensen, J.N., Füchtbauer, E.M., Deering, T., ..., & Serup, P. (2012).
Ptf1a-mediated control of Dll1 reveals an alternative to the lateral inhibition mechanism. Development (Cambridge, England), 139(1), 33-45. [PubMed:22096075] [PMC] [WorldCat] [DOI]