佐藤 亘、西道 隆臣
国立研究開発法人理化学研究所 脳科学総合研究センター
DOI:10.14931/bsd.6462 原稿受付日:2015年9月8日 原稿完成日:2015年X月X日
担当編集委員:和田 圭司(国立研究開発法人国立精神・神経医療研究センター)
英語名:calpain 独:Calpain 仏:calpaïne
同義語:calcium-activated neutral protease, CANP
カルパインは非リソソームシステインプロテアーゼファミリーに属し、Ca2+依存的に基質の限定的な分解を行うことでその下流シグナルを制御する「モジュレータ・プロテアーゼ」として知られている。神経系においては、アルツハイマー病やハンチントン病、パーキンソン病などの神経変性疾患にみられる神経細胞死に関与する可能性が報告されているほか、LTP誘導などの生理的機能においても重要な役割を担っていることが示唆されている。また、組織特異的に発現を示すカルパインの中には肢帯型筋ジストロフィーや胃潰瘍などに関与するものが報告されている。以下、哺乳類のカルパインについて記述する。
| Calpain | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifiers | |||||||||
| Symbol | Calpain | ||||||||
| Pfam | PF00648 | ||||||||
| Pfam clan | CL0125 | ||||||||
| InterPro | IPR001300 | ||||||||
| SMART | CysPc | ||||||||
| PROSITE | PDOC50203 | ||||||||
| MEROPS | C2 | ||||||||
| SCOP | 1mdw | ||||||||
| SUPERFAMILY | 1mdw | ||||||||
| |||||||||
カルパインとは
カルパインは、カルシウムにより活性化される細胞内プロテアーゼとして1960~70年代に東京大学の今堀・鈴木らによってCANP(calcium-activated neutral protease)として精製・同定され[1] [2] [3] [4]、1980年に京都大学の村地によりカルパイン(calcium-dependent papain-like enzyme)と命名された[5]。
この当時に同定されたカルパインは、生体内の多くの組織に広く発現を示す組織普遍的カルパイン、カルパイン1およびカルパイン2として知られている。その後、1989年に骨格筋からカルパイン3(発見当初はp94と呼ばれた)が発見された[6]のを皮切りに多くの特定の組織に発現を示す組織特異的カルパインが同定され、ヒトにおいては15の遺伝子が同定されている。
カルパインはユビキチン・プロテアソーム系やオートファジー系など細胞内タンパク質をアミノ酸レベルに分解する機構とは異なり、カルシウムなどの刺激によって基質の一部を分解することで、その機能を不可逆的に変化する「モジュレータ・プロテアーゼ」である[1]。カルパインの中でもこれまでに最も研究が進んでいるのはカルパイン1およびカルパイン2であり、脳神経系では主にこれらのカルパインが機能していると考えられる。神経特異的に発現あるいは機能を示すカルパインの有無については不明である。
なお、これまでカルパイン1およびカルパイン2はそのin vitroにおける活性化に必要なカルシウム濃度(それぞれμMオーダー(10-6-10-4M)およびmMオーダー(10-3M))の違いから、それぞれμ-カルパインおよびm-カルパインと呼ばれてきた。しかし、実際の細胞内カルシウム濃度は数十nMから数十μM(10-8M-10-5M)程度でありmMオーダーのような高濃度になることは考えづらく、名称からの誤解を招きかねないことからアミノ酸配列をベースにした命名が提唱され、現在の呼び方が推奨されている[7]。
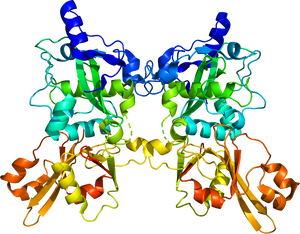
構造
カルパイン1はCAPN1及びCAPNS1のヘテロ二量体、カルパイン2はCAPN2及びCAPNS1のヘテロ二量体である。
PC1およびPC2: プロテアーゼ・コアドメイン、CBSW: カルパイン型βサンドウィッチドメイン、PEF: ペンタEFハンドドメイン、GR: グリシンリッチドメイン
以下、カルパイン1および2の構造について記す(図)。
カルパイン1および2は活性サブユニットと調節サブユニットから構成される活性酵素複合体である。カルパイン1および2はそれぞれ分子量80kDaの CAPN1、CAPN2を活性サブユニットとして、分子量30kDaの調節サブユニット(CAPNS1、または30K)とともに1 : 1のヘテロ二量体(CAPN1/S1またはCAPN2/S1)を形成する。
活性サブユニットはアミノ末端から順にアンカーへリックス領域、2つのプロテアーゼ・コアドメイン(PC1およびPC2)、カルパイン型βサンドウィッチドメイン(CBSW、以前までC2様ドメインと呼ばれた[8])およびペンタEFハンドドメイン(PEFドメイン)から構成される。一方、調節サブユニットはアミノ酸末端にグリシンリッチドメイン、カルボキシル末端にPEFドメインを有する。
活性化に際して、二つのPCドメインのそれぞれにCa2+が結合することでアミノ酸の再配列が起きて基質への結合が可能となり、PC1ドメイン中のシステイン(カルパイン1ではC115、カルパイン2ではC105)を活性中心として基質の限定分解を引き起こす。カルパイン1および2の唯一の内在性阻害タンパク質であるカルパスタチンは、カルシウム依存的にこれらPCドメインに結合することで基質の分解を阻害すると考えられている。
分類
ヒトのカルパイン遺伝子としてはこれまでに15の遺伝子が同定されており、その発現様式から組織普遍的カルパイン(CAPN1, 2, 5, 7, 10, 13, 14, 15, 16)と組織特異的カルパイン(CAPN3, 6, 8, 9, 11, 12)に分類される。これらカルパイン活性サブユニットとCAPNS1(以前までCAPN4と呼ばれたが、現在は欠番となっている)を含めてカルパインファミリーを形成している。
また、構造的な分類としてカルパイン1および2と同様のドメイン構造をもつものを古典的カルパイン(CAPN 3, 8, 9, 11, 12, 13, 14)、CBSWドメインやPEFドメインをもたないものを非古典的カルパイン(CAPN 5, 6, 7, 15, 16)と呼ぶ[9]。
| 名称 | 遺伝子 | 別名 | EF-Handの有無 | 主な発現組織 |
|---|---|---|---|---|
| カルパイン1 | capn1 | µ-カルパイン | + | 普遍的 |
| カルパイン2 | capn2 | m-カルパイン | + | 普遍的 |
| カルパイン3 | capn3 | nCL-1, p94 | + | 骨格筋, 水晶体, 網膜 |
| カルパイン5 | capn5 | htra3, nCL-3 | - | 普遍的 |
| カルパイン6 | capn6 | CAPNX, カルパモジュリン | - | 胎盤, 子宮 |
| カルパイン7 | capn7 | palBX | - | 普遍的 |
| カルパイン8 | capn8 | nCL-2 | + | 胃 |
| カルパイン9 | capn9 | nCL-4 | + | 消化管 |
| カルパイン10 | capn10 | CAPN8 | - | 普遍的 |
| カルパイン11 | capn11 | + | 精巣 | |
| カルパイン12 | capn12 | + | 毛包 | |
| カルパイン13 | capn13 | + | 精巣、肺 | |
| カルパイン14 | capn14 | - | 普遍的 | |
| カルパイン15 | capn15 | SolH | - | 普遍的 |
| アンドログロビン | ADGB | C6orf103, CAPN16, FLJ23121, dJ408K24.1 | - | 精巣 |
カルパイン4はカルパインスモールサブユニット1とされたので欠番である。
| 名称 | 遺伝子名 | 別名 | EF-Handの有無 | 主な発現組織 |
|---|---|---|---|---|
| カルパインスモールサブユニット1 (calpain small-subunit1, css1) | cpns1 | カルパイン4 (CAPN4) | + | 普遍的 |
| カルパインスモールサブユニット2 (calpain small-subunit2, css2) | cpns2 | + |
発現様式
カルパイン1および2を含め組織普遍的なカルパインは様々な組織に広く発現している。一方、組織特異的なカルパインとしてはカルパイン3(骨格筋)、カルパイン6(胎児筋肉および胎盤)、カルパイン8 / 9(消化管・胃腸管)、カルパイン11(精巣)、カルパイン12(毛包)が存在する[9]。
細胞内においてカルパイン1および2は不活性型として細胞質に存在し、活性化に伴って細胞膜や細胞骨格付近へ移動して基質の分解を引き起こすと考えられている。
活性化機構と基質特異性
ここではカルパイン1および2の活性化機構について記す。
カルパイン1および2の活性化は細胞内カルシウム濃度の上昇によって引き起こされる。実験的には、培養細胞に対してカルシウムイオノフォア処理やグルタミン酸、NMDAなどの刺激を行うことでカルパイン1および2の活性化を引き起こすことが可能である。
一方、細胞内でこれらカルパインの活性化に必要なカルシウム濃度へ達することは病理的状態(例えばカルシウム恒常性の破たんなど)以外で考えづらいことから、生理的状態におけるカルパイン1および2の活性化にはカルシウム以外の何らかの制御機構が存在する可能性が指摘されている。例えば、カルパイン2についてはEGF刺激を介した酸性リン脂質による活性化[10]やBDNF刺激を介したERKによるリン酸化修飾により制御されることが報告されている[11]。
また、カルパイン3についてはCa2+のほかNa+によって活性化されることが最近明らかとなり、それぞれのイオンにより異なる基質特異性を示すことがわかっている[12]。
カルパインはプロテアソームに対するユビキチンやオートファジーに対するオートファゴソームのように基質に特定のタグを必要とせず、直接的に基質の認識を行う。その基質特異性は、特定のアミノ酸配列による一次構造ではなく高次の立体構造によって決定されていると考えられている。カルパイン1および2の代表的な基質としては細胞骨格タンパク質であるαIIスペクトリン(α-フォドリン)が知られ、全長αIIスペクトリン(分子量280kDa)からの切断産物(分子量150kDaおよび136kDa)はしばしばカルパイン活性化の簡便な指標として用いられる。その他の基質としてはMAP1B、MAP2、ニューロフィラメント、アクチンなどの細胞骨格系タンパク質のほか、NMDA型グルタミン酸受容体、AMPA型グルタミン酸受容体などの受容体タンパク質、CaMKIIやPKC、PP2Bなどの各種酵素[13]、Cdk5活性化因子p35などが同定されている[14] [15]。
機能
カルパインは生体調節因子として極めて重要である一方、その異常活性化は種々の病態に関与することが示されている[16]。
生体調節因子としての役割
カルパインは主に細胞骨格系のタンパク質を限定分解することにより細胞の形態的変化を伴う現象(例えば細胞の移動など)に関与していると考えられている。
遺伝子改変マウスの解析例として、カルパイン1欠損マウスでは目立った表現型はみられないが[17]、カルパイン2欠損マウスおよびCAPNS1欠損マウスでは胚性期に致死を示すことから、カルパイン2は初期発生に必須である[18] [19]。また、カルパイン3の遺伝子変異は肢帯型筋ジストロフィーの原因として同定されている[20]ほか、カルパイン10のSNPと2型糖尿病との関連が報告されている[21]。
一方、神経特異的なCAPNS1コンディショナル欠損マウスにおいてはカルパイン1および2の発現量低下とともに樹状突起の形態異常やLTPの減弱がみられることから[22]カルパイン1および2とシナプス可塑性との関連が強く示唆されるが、その詳しいメカニズムについては不明である。
病態関連因子としての役割
アルツハイマー病患者脳において活性化カルパイン量の上昇が報告されて以来[23]、カルパインとアルツハイマー病との関連が多数報告されている。最新のアルツハイマー病モデルマウスを用いた研究からは、カルパインがアミロイド斑の形成促進と神経炎症の増悪化に関与する可能性が示されている[24]。
また、スナネズミを用いた虚血モデルの研究では脳虚血時の神経細胞死に先立ってカルパイン活性の上昇がみられることから[25]、カルパインは血管型認知症における遅発性神経細胞死にも関与する可能性がある。
一方、発達障害疾患である滑脳症とカルパインとの関連も報告されている。微小管モータータンパク質・ダイニンの局在や機能を制御するLis1のヘテロ欠損マウスでは滑脳症を呈するが、カルパインはLis1タンパク質量の制御を介してこれらの病態に関与することが示されている[26]。これら病態解析を目的として、カルパスタチンの過剰発現マウスおよび欠損マウスが作製されており[27] [28]、それらを用いた新たな知見が得られている[29] [30]。
以上のように、カルパインの異常活性化は種々の病態に関与すると考えられ、それらの治療標的としてカルパイン阻害剤の開発が進んでいるが、その特異的な阻害剤の開発には至っていない。
関連項目
外部リンク
参考文献
- ↑ 1.0 1.1 Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ 9.0 9.1 Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.