記憶想起
鈴木 章円
横瀬 淳
井ノ口 馨
富山大学医学薬学研究部(医学)生化学講座
DOI:10.14931/bsd.7426 原稿受付日:2017年4月5日 原稿完成日:2017年月日
担当編集委員:定藤 規弘(自然科学研究機構生理学研究所 大脳皮質機能研究系)
英語名:memory retrieval, memory reactivation
(編集部コメント:抄録とイントロは別々にお願い致します)
「記憶想起」とは一度覚えた記憶を「思い出す」プロセスのことを指す。「特定のものを認識しているにもかかわらず、その名前がなかなか思い出せない」などという気分に陥ることがあるが、これは記憶しているが想起ができないことを示している。さまざまな経験から得られた情報は、まず不安定化状態の短期記憶として形成され、その後、固定化のプロセスを経て、安定した状態の長期記憶として脳内に保存される。想起された記憶は再度不安定化状態となる場合があり、元の記憶を安定化状態の記憶として脳内に再保存するために再固定化のプロセスを誘導する。一方、記憶想起は元の記憶と相反する記憶を学習する消去学習(extinction)のプロセスを誘導することもある。
記憶想起とは
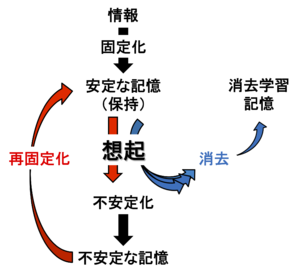
情報は固定化され安定な記憶として保持される。その記憶が想起されると、記憶は一度不安定な状態(不安定化)となる場合があるが、再固定化のプロセスにより再び安定した記憶として保持される。一方で、長期間の想起、もしくは短期間内の繰返し想起により、恐怖記憶は消去学習のプロセスに入り、元の記憶と相反する記憶を新たに獲得する場合もある。このように記憶の想起プロセスは想起時のさまざまな条件によって異なる記憶プロセスをとる。
「記憶想起」とは一度覚えた記憶を「思い出す」プロセスのことを指す。「特定のものを認識しているにもかかわらず、その名前がなかなか思い出せない」などという気分に陥ることがあるが、これは記憶しているが想起ができないことを示している。
さまざまな経験から得られた情報は、まず不安定化状態の短期記憶として形成され、その後、固定化のプロセスを経て、安定した状態の長期記憶として脳内に保存される。
想起された記憶は再度不安定化状態となる場合があり、元の記憶を安定化状態の記憶として脳内に再保存するために再固定化のプロセスを誘導する。
一方、記憶想起は元の記憶と相反する記憶を学習する消去学習(extinction)のプロセスを誘導することもある(図1)。
メカニズム
脳内には学習時の刺激に応答して活動するニューロン群が存在するが、それら活動したニューロン群は強いシナプス結合で結ばれ、セルアセンブリ(細胞集成体)を形成し、記憶はその中に符号化して蓄えられると想定されている。つまり記憶は、学習時に活動した特定のニューロンの集団という形で脳のなかに保存される。
このような学習時に活動した特定のニューロン集団という形で脳内に残った物理的な痕跡のことを記憶痕跡(memory engram)と呼び、2012年、利根川進らのグループにより記憶痕跡の物理的存在が示された[1]。何らかのきっかけでこのニューロン集団に属する一部のニューロンが活動すると、強いシナプス結合で結ばれたニューロン集団全体が活動し、その結果として記憶が想起されると考えられている(図2)。また、記憶は学習した当時とまったく同じ状況ではなくとも類似した状況など一部の手がかりでその記憶全体を想起することが可能である。
このように不完全な情報から完全な情報の神経活動パターンを再現し、記憶を想起する働きはパターン完成 (pattern completion)と呼ばれ,海馬CA3領域内のフィードバック機能をもつリカレント回路(反回性回路)にその機能があると想定されている[2]。
記憶想起を制御する脳領域
現在のところ、想起を直接調べる実験系が少ないため、記憶の他のプロセスに比べ研究が進んでいないのが現状ではあるものの、徐々に記憶想起のメカニズムが明らかになってきている。記憶の固定化には海馬や扁桃体などが関与することが示されているが、これまでの研究により想起にも多くの脳領域が関与することが示唆されている。
扁桃体
2015年にKarim Naderらのグループは聴覚性恐怖条件づけ学習課題を用いて、恐怖記憶を憶えさせたラットの扁桃体にタンパク質合成阻害剤を注入した後に聴覚刺激を与えても、ラットは記憶を想起することが出来なかった。このことから、後に記す再固定化や消去のプロセスと同様に想起にはタンパク質合成が必要であることが示されている[3]。
海馬
また2002年、利根川らのグループは海馬のCA3領域がパターン完成に極めて重要な役割を果たすと考えられえていることから、CA3特異的にNMDA型グルタミン酸受容体をノックアウトしたマウスを作製した。それらのマウスをモリス水迷路に供し、空間記憶を評価した。
この実験において、初めマウスはプールに入れられるとそこから逃れるためにプール内を泳ぎ回り、偶然、水面下に設置されたプラットフォームに辿り着くが、この試行を繰り返すうちにマウスは周囲の目印からプラットフォームの空間的な位置を学習し、プラットフォームまで素早く辿り着くようになった。
マウスがプラットフォームの位置を十分に認識した後、プラットフォームおよび周囲の目印をいくつか取り除き、再度試験を行った。正常なマウス、NMDA型グルタミン酸受容体をノックアウトしたマウス共に、周囲の目印が4つすべて揃っている場合では、プラットフォームが存在していた場所を泳ぐ割合に差はなかった。しかし、周囲の目印を1つだけに減らした場合では、NMDA型グルタミン酸受容体ノックアウトマウスは正常なマウスに比べ、プラットフォームが存在していた場所を泳ぐ割合が有意に少なく、NMDA型グルタミン酸受容体ノックアウトマウスは想起に異常を示した。
このことから、CA3領域におけるNMDA型グルタミン酸受容体は記憶の想起に重要であることが示唆された[4]。
大脳皮質
また、大脳皮質と想起の関連性も研究されてきている。海馬依存的に形成された記憶は時間経過に伴って大脳皮質依存性に移行し保存される(遠隔記憶)と考えられている。このような移行メカニズムにより固定化された記憶は記憶形成後に長時間が経過しても想起することが可能となっている。しかし、想起を担う神経回路が時間とともにどう変化するかは、ほとんど分かっていなかった。
2015年、Gregory Quirkらのグループは聴覚性恐怖条件づけ学習課題を用いて、恐怖記憶を形成させ、一定期間経過後にラットの背側視床正中核(dorsal midline thalamus)にGABAA受容体のアゴニストであるムシモールを注入することで背側視床正中核の活動を抑制し、想起と背側視床正中核の関連性を検討した。その結果、学習後短い時間(30分、6時間)ではラットは恐怖記憶を想起でき、背側視床正中核を必要としないが、学習から長い時間(24時間、7、28日)が経過した後ではラットは恐怖記憶を想起できず、長時間経過後の想起には、背側視床正中核が必要であることが明らかになった。
同様に、背側視床正中核の一部である視床室傍核(paraventricular nucleus of the thalamus)では、長時間経過後(24時間経過後)から想起時にc-Fosの発現が増加することや、視床室傍核ニューロンの聴覚性刺激(音)に対する条件反応が増大したことを発見し、記憶後の経過時間と共に視床室傍核が恐怖記憶の想起に関わっていくことを示した。視床室傍核には大脳皮質の一部である前辺縁皮質(prelimbic cortex)から高密度にニューロンが投射しており、学習から長時間経過後に記憶を想起すると、視床室傍核に投射する前辺縁皮質ニューロンが活性化した。光遺伝学的手法を用いて、これらの投射ニューロンを抑制すると長時間経過後の記憶想起が阻害されるが、短時間経過後の想起は阻害されない。これとは対照的に、前辺縁皮質から扁桃体基底外側部への入力を光遺伝学的に抑制すると短時間経過後の記憶想起が阻害されるが、長時間経過後の想起は阻害されないことから、記憶想起を司る神経回路が時間に応じて変化することが明らかになった[5]。
大脳皮質は主に6層から構成されており、各層は等質な層構造ではなく、それぞれ異なる細胞種構成や層内・層間の異なるサブネットワークを形成している。各層へ連続的に情報が伝達されることで、より複雑な情報が処理されるというモデルが提唱されてきた。つまり各層ごとに役割が異なることが示唆されているが、手法的な限界により想起に対する役割は解析されていなかった。
このような状況の中、2016年に宮下保司らのグループは微小電極記録法、核磁気共鳴画像法(MRI)と組織切片法を組み合わせた手法を開発し、手がかりとなる図形からペアを組む図形を記憶から想起して選択するように訓練されたマカクザルを用いて大脳皮質の各層から神経細胞の活動を記録し、想起に対する各層構造の関連を解析した。その結果、側頭葉の36野と呼ばれる領域内の、第2層~4層の神経細胞は手がかりとなる図形の情報を保持しており、一方、第5層・6層の神経細胞は想起させる図形の情報を処理していた。このことから、記憶の想起は第5・6層において主に行われていることが明らかとなり、記憶を想起する際に、側頭葉における各層が異なる情報処理機能を担っていることが明らかとなった[6]。
記憶想起によって誘起されるプロセス
記憶再固定化
Memory Reconsolidation
脳内に保存された記憶(固定化された記憶)が想起された後に、その記憶を再び固定し、脳内に再保存するプロセスのことを指す。
2000年にKarim Naderらは、聴覚性恐怖条件づけ学習課題を用いて、ラットに恐怖記憶を憶えさせた。その後、聴覚刺激の再暴露により恐怖記憶を想起させ、その直後にタンパク質合成を阻害する薬剤を扁桃体に注入すると、恐怖記憶が消失することを示した[7]。この結果から、固定化(安定化)された記憶においても、その記憶は想起されると、一度不安定な状態となり(不安定化:destabilization)、脳内に安定した状態で再保存されるには、「再固定化 (reconsolidation)」が必要であると提唱した(図1)。
また、これまでに固定化と再固定には共にタンパク質合成を伴う事や、転写調節因子CREBが関わること[8]が示され、一方で固定化のプロセスには脳由来神経栄養因子 (brain-derived neurotrophic factor, BDNF)が、再固定化のプロセスにはzif268がそれぞれ関わる[9]などが明らかとなり、再固定化は固定化と類似したプロセスではあるが、分子メカニズムは一部異なることが示唆されている。
再固定化の主な役割として、元の記憶をそのまま維持し脳内に保存すること(maintenance)や元の記憶をより強化すること(enhancement)が挙げられる。また、一度固定化された記憶を別の新たな記憶と統合させたり、修正し記憶をアップデートしたりするためであるとも考えられている。なお、想起に伴い常に再固定化が誘導されるわけではなく、記憶の古さや強さなどにより再固定化プロセスに入るか否かは影響を受ける[10][11]。
記憶不安定化
Karim Naderらによる再固定化の発見当時、不安定化とは、想起後に誘導される再固定化が抑制されると、元の恐怖記憶が消失することから、想起された記憶は一度、不安定な状態になるはずであるという考えから産まれた概念に過ぎなかった。しかしながら、現在では不安定化の誘導にはタンパク質分解が関与すること[12]や、L型電位依存性カルシウムチャネル(LVGCCs)とカナビノイド受容体(CB1) の活性化が記憶不安定化に必要であること[13]が明らとなり、不安定化は概念上のものではなく、固定化や再固定化と同様に分子機構を有するプロセスであると考えられている。
消去学習
Extinction learning
消去学習とは、恐怖条件づけにより恐怖反応を誘発するようになった動物に対し、条件刺激(CS;チャンバー、音、匂いなど)を繰返し与える、もしくは長時間再曝露することにより条件づけされた恐怖反応の表出(すくみ反応など)が減弱する現象を指す。
重要なのは、恐怖記憶自体が消去されるのではなく、恐怖体験と恐怖条件づけに用いた条件刺激とのあいだに関連性がないことを改めて新規に学習するプロセスということである。つまり消去学習とは、想起した記憶とは相反する記憶を形成するプロセスであり、再固定化阻害によって引き起こされる恐怖記憶の消失とは異なり、消去学習後も、元の恐怖記憶自体は脳内に保存されているが、消去学習によって抑制されている状態となっている。したがって、消去学習により抑制された恐怖反応は、他の感覚刺激などが引き金となり再び回復し得ることが知られている。これまでに観察されている恐怖反応が回復する現象として、次のことが報告されている[14][15](図3)。
- 復元 (reinstatement): 消去学習成立後に、通常では恐怖条件づけが成立しないような弱い嫌悪刺激(無条件刺激(US)の再提示など)を与えることで、条件づけ刺激(CS‐US pairing)誘発性恐怖反応が再び現れる。
- 更新 (renewal): 消去学習成立後に再度CSを提示すると、その後のCS提示に対して恐怖反応が再生される。
- 自発的回復 (spontaneous recovery): 消去学習成立後に1 ヵ月程度の期間をおいて再びCSのみを与えると、元の高いレベルの恐怖反応が現れる。
消去学習には前頭前野(prefrontal cortex)と扁桃体(Amygdala)が深く関与する[16]。
恐怖条件づけ学習、消去学習、消去学習後の想起時において扁桃体基底外側核(BLA)領域から単一細胞記録により、条件づけ刺激(CS)に対して示す神経発火パターンの解析から、すくみ反応が高い時に発火頻度が上昇する細胞(恐怖細胞;Fear neuron)と消去学習を経験してすくみ反応が低下した際に発火頻度が増加する細胞(消去細胞;Extinction neuron)が検出されており、恐怖反応と消去反応はそれぞれ異なる細胞が担っていることが示唆されている[17]。恐怖細胞は腹側海馬からの弱い入力を受け、前頭前野の一領域である前辺縁皮質(PL)に投射している。
一方、消去細胞は外辺縁皮質(IL)との間に双方向性の投射を持っている。また、消去学習後のテスト時に、前辺縁皮質に投射する扁桃体基底外側核ニューロンを光抑制すると消去学習が促進する一方で、外辺縁皮質に投射する扁桃体基底外側核ニューロンを光抑制すると恐怖反応は促進する[18]。
このように、BLAを基点とした前頭前野との接続により恐怖反応は正負に制御されている[15][17]。
記憶の連合
Memory association
別々に形成された関連のない記憶同士でも、連続して想起することで関連づけ(記憶の連合)されることがある[19]。また、それぞれの記憶に対応する記憶痕跡細胞(記憶エングラム細胞)を光遺伝学的手法を用いて人為的に同時活動させ同時強制想起させると、両者の間に関連づけが生じて虚記憶が形成される[20]。
これらは同時想起によりそれぞれの記憶に対応する記憶エングラム細胞が同時活動し、その結果として記憶エングラム細胞の間のシナプス強化が起こり記憶痕跡を部分的に共有するためであると想定されている[19][20]。個々の記憶同士が相互作用し合うことにより記憶間で新たな連合が生まれ、既存の記憶を更新していくことで、私たちは知識や概念を形成していくことから、想起に伴う記憶の連合メカニズムの理解はヒトの高次脳機能の解明につながると期待されている。
以上述べてきたように、想起によって誘導される再固定化、消去学習、記憶連合のプロセスは維持、強化、消去、記憶の書き換えなど、元の記憶を修飾する機能を有している。つまり記憶のアップデートと関連しており、想起は状況に応じて柔軟に対応する脳の活動に欠かせないプロセスである。想起についてはまだまだ不明な点が多く研究の途上である。今後、想起のメカニズムがより詳細に解明されることが期待される。
関連項目
参考文献
- ↑
Liu, X., Ramirez, S., Pang, P.T., Puryear, C.B., Govindarajan, A., Deisseroth, K., & Tonegawa, S. (2012).
Optogenetic stimulation of a hippocampal engram activates fear memory recall. Nature, 484(7394), 381-5. [PubMed:22441246] [PMC] [WorldCat] [DOI] - ↑
Rolls, E.T. (2013).
The mechanisms for pattern completion and pattern separation in the hippocampus. Frontiers in systems neuroscience, 7, 74. [PubMed:24198767] [PMC] [WorldCat] [DOI] - ↑
Lopez, J., Gamache, K., Schneider, R., & Nader, K. (2015).
Memory retrieval requires ongoing protein synthesis and NMDA receptor activity-mediated AMPA receptor trafficking. The Journal of neuroscience : the official journal of the Society for Neuroscience, 35(6), 2465-75. [PubMed:25673841] [PMC] [WorldCat] [DOI] - ↑
Nakazawa, K., Quirk, M.C., Chitwood, R.A., Watanabe, M., Yeckel, M.F., Sun, L.D., ..., & Tonegawa, S. (2002).
Requirement for hippocampal CA3 NMDA receptors in associative memory recall. Science (New York, N.Y.), 297(5579), 211-8. [PubMed:12040087] [PMC] [WorldCat] [DOI] - ↑
Do-Monte, F.H., Quiñones-Laracuente, K., & Quirk, G.J. (2015).
A temporal shift in the circuits mediating retrieval of fear memory. Nature, 519(7544), 460-3. [PubMed:25600268] [PMC] [WorldCat] [DOI] - ↑
Koyano, K.W., Takeda, M., Matsui, T., Hirabayashi, T., Ohashi, Y., & Miyashita, Y. (2016).
Laminar Module Cascade from Layer 5 to 6 Implementing Cue-to-Target Conversion for Object Memory Retrieval in the Primate Temporal Cortex. Neuron, 92(2), 518-529. [PubMed:27720482] [WorldCat] [DOI] - ↑
Nader, K., Schafe, G.E., & Le Doux, J.E. (2000).
Fear memories require protein synthesis in the amygdala for reconsolidation after retrieval. Nature, 406(6797), 722-6. [PubMed:10963596] [WorldCat] [DOI] - ↑
Kida, S., Josselyn, S.A., Peña de Ortiz, S., Kogan, J.H., Chevere, I., Masushige, S., & Silva, A.J. (2002).
CREB required for the stability of new and reactivated fear memories. Nature neuroscience, 5(4), 348-55. [PubMed:11889468] [WorldCat] [DOI] - ↑
Lee, J.L., Everitt, B.J., & Thomas, K.L. (2004).
Independent cellular processes for hippocampal memory consolidation and reconsolidation. Science (New York, N.Y.), 304(5672), 839-43. [PubMed:15073322] [WorldCat] [DOI] - ↑
Lee, S.H., Choi, J.H., Lee, N., Lee, H.R., Kim, J.I., Yu, N.K., ..., & Kaang, B.K. (2008).
Synaptic protein degradation underlies destabilization of retrieved fear memory. Science (New York, N.Y.), 319(5867), 1253-6. [PubMed:18258863] [WorldCat] [DOI] - ↑
Suzuki, A., Josselyn, S.A., Frankland, P.W., Masushige, S., Silva, A.J., & Kida, S. (2004).
Memory reconsolidation and extinction have distinct temporal and biochemical signatures. The Journal of neuroscience : the official journal of the Society for Neuroscience, 24(20), 4787-95. [PubMed:15152039] [PMC] [WorldCat] [DOI] - ↑
Feig, S.A., Krailo, M.D., Harris, R.E., Baum, E., Holcenberg, J.S., Kaizer, H., ..., & Warkentin, P.L. (1992).
Determination of the maximum tolerated dose of idarubicin when used in a combination chemotherapy program of reinduction of childhood ALL at first marrow relapse and a preliminary assessment of toxicity compared to that of daunorubicin: a report from the Childrens Cancer Study Group. Medical and pediatric oncology, 20(2), 124-9. [PubMed:1734217] [WorldCat] [DOI] - ↑
Suzuki, A., Mukawa, T., Tsukagoshi, A., Frankland, P.W., & Kida, S. (2008).
Activation of LVGCCs and CB1 receptors required for destabilization of reactivated contextual fear memories. Learning & memory (Cold Spring Harbor, N.Y.), 15(6), 426-33. [PubMed:18511694] [PMC] [WorldCat] [DOI] - ↑
Myers, K.M., & Davis, M. (2007).
Mechanisms of fear extinction. Molecular psychiatry, 12(2), 120-50. [PubMed:17160066] [WorldCat] [DOI] - ↑ 15.0 15.1
Tovote, P., Fadok, J.P., & Lüthi, A. (2015).
Neuronal circuits for fear and anxiety. Nature reviews. Neuroscience, 16(6), 317-31. [PubMed:25991441] [WorldCat] [DOI] - ↑
Likhtik, E., & Paz, R. (2015).
Amygdala-prefrontal interactions in (mal)adaptive learning. Trends in neurosciences, 38(3), 158-66. [PubMed:25583269] [PMC] [WorldCat] [DOI] - ↑ 17.0 17.1
Herry, C., Ciocchi, S., Senn, V., Demmou, L., Müller, C., & Lüthi, A. (2008).
Switching on and off fear by distinct neuronal circuits. Nature, 454(7204), 600-6. [PubMed:18615015] [WorldCat] [DOI] - ↑
Senn, V., Wolff, S.B., Herry, C., Grenier, F., Ehrlich, I., Gründemann, J., ..., & Lüthi, A. (2014).
Long-range connectivity defines behavioral specificity of amygdala neurons. Neuron, 81(2), 428-37. [PubMed:24462103] [WorldCat] [DOI] - ↑ 19.0 19.1
Yokose, J., Okubo-Suzuki, R., Nomoto, M., Ohkawa, N., Nishizono, H., Suzuki, A., ..., & Inokuchi, K. (2017).
Overlapping memory trace indispensable for linking, but not recalling, individual memories. Science (New York, N.Y.), 355(6323), 398-403. [PubMed:28126819] [WorldCat] [DOI] - ↑ 20.0 20.1
Ohkawa, N., Saitoh, Y., Suzuki, A., Tsujimura, S., Murayama, E., Kosugi, S., ..., & Inokuchi, K. (2015).
Artificial association of pre-stored information to generate a qualitatively new memory. Cell reports, 11(2), 261-9. [PubMed:25843716] [WorldCat] [DOI]