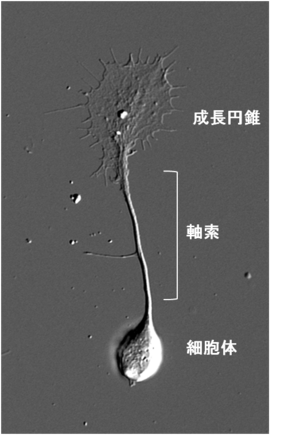
成長円錐
英語名 Growth cone
成長円錐は伸長中の神経突起の先端部に見られるアメーバ状の構造物である(図1)。19世紀にスペインの神経科学者Ramón y Cajalにより、固定染色した神経組織において神経軸索先端部に円錐状の構造が発見され、growth cone=成長円錐と名付けられた。2次元基質上で培養した場合は薄く扁平な形態をとり、多くが伸長中の神経軸索の先端に存在するが樹状突起の先端にも存在する。また、PC12細胞やN1E-115細胞のような株化細胞から伸びる神経突起様構造物の先端にも見られる。軸索の成長円錐の場合、標的神経細胞の樹状突起や組織へと到達した後は形態変化を起こし前シナプス部となる。成長円錐は極めて高い運動性を示し、細胞骨格や接着分子、膜輸送経路の制御を通じて前方へと移動し、神経突起を牽引することで伸長させる。また、成長円錐の形質膜には軸索ガイダンス因子に対する受容体が多数発現しており、軸索の成長円錐は細胞外環境に存在する軸索ガイダンス因子に応じてその運動性と進行方向を変化させ、神経軸索を正しい標的細胞へと投射させる。
構造
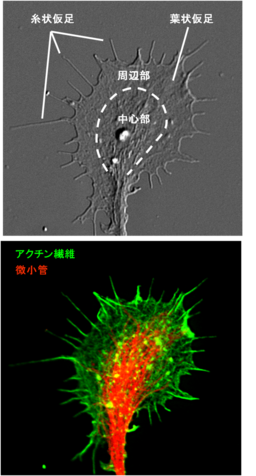
成長円錐は2次元基質上では扇状に広がった手のような構造で、その形態から周辺部(Peripheral domain)と中心部(Central domain)の2つの部分に大別される(図2、上)。また、周辺部と中心部の境界部分を移行帯(Transition zone)として分類することもある。
周辺部
周辺部は扁平の構造で、成長円錐中央から放射状に伸びた細い指のような糸状仮足(filopodia)の間を、水掻きのような薄いシート状の葉状仮足(lamellipodia)が埋めている(図2)。成長円錐の周辺部はアクチン(actin)繊維に保持されているが、糸状仮足と葉状仮足ではアクチン繊維の形状が異なる。糸状仮足内のアクチン繊維は比較的長い束状の直線的な形状であるのに対し、葉状仮足内では短いアクチン繊維が枝分かれした網目状の構造をしている。また、周辺部には比較的動的な微小管(microtuble)末端も見られる[1] 。周辺部のアクチン繊維は糸状仮足、葉状仮足ともプラス端を外側に向けて配向しており、先端部における単量体アクチンの重合によるアクチン繊維の伸長が糸状仮足や葉状仮足の周辺部への拡大につながり、成長円錐の形質膜を前方に推し進める原動力となっている。
中心部
中心部は軸索からつながった成長円錐中央部の比較的厚みのある部分で、軸索から伸びている安定な微小管が主な構成成分である(図2)。軸索内の微小管はMicrotubule-associated proteins(MAPs)により束ねられているが、中心部では先端部がほどけ、一部の微小管は周辺部に向かって放射状に広がっている。中心部には比較的安定なアクチン繊維も存在し、細胞骨格の他にもミトコンドリアや小胞体などの細胞小器官、膜小胞などを多く含んでいる。
前進運動の分子メカニズム
成長円錐は①周辺部先端での糸状仮足の形成・伸長、②糸状仮足間への葉状仮足の流れ込みによる周辺部の拡大、③後方からの中心部の侵入、という3つの過程を繰り返すことで前方へと移動していく。この成長円錐の前方移動の分子メカニズムとして、前方移動の仕組みを自動車の走行に例えたクラッチ仮説が有力なものとして提唱されている。クラッチ仮説ではアクチン繊維のターンオーバーと成長円錐形質膜上に発現する接着分子、接着分子とアクチン繊維をつなぐクラッチ分子、接着分子のリサイクリングが協調して働き、成長円錐が前方移動を行っていると説明される。
アクチン繊維の動態
周辺部に存在するアクチン繊維は、プラス端を成長円錐先端に、マイナス端を中心部側に向けて規則正しく配置されており、単量体アクチンのアクチン繊維への付加は主に先端部で、アクチン繊維の解離は主に中心部側で起こる。同時にアクチン繊維全体はモータータンパク質であるミオシン(myosin)ⅠbやミオシンⅡの作用により一定の速度(約5 μm/min)で先端部から中心部へと移動している。そのため、見かけ上、周辺部が運動を停止しているような場合でも、その内部に存在するアクチン繊維は先端部から中心部へと運ばれており、その移動分を補うように先端部では重合、中心部では脱重合が続いている(トレッドミル)。
接着分子
成長円錐の形質膜には免疫グロブリン(immunogloblin)ファミリー、カドヘリン(cadherin)ファミリー、インテグリン(integrin)ファミリーなどの接着分子が発現しており、細胞外基質、または隣接する細胞との接着を媒介している。多くの場合、細胞外領域での接着分子のリガンド結合および細胞表面での接着分子クラスタリングは細胞内領域における接着分子とアクチン繊維間の結合を誘導する。例えば、インテグリン細胞外領域におけるフィブロネクチン(fibronectin)との結合は、インテグリン細胞内領域と細胞骨格の結合を引き起こす。このような接着分子-アクチン繊維間の結合は、接着分子の接着性を増強するとともに、アクチン繊維の後方移動により発生した牽引力を細胞外周囲環境に伝達し、その結果として成長円錐が前方に推進されると考えられている。
クラッチ分子
成長円錐の前方移動の仕組みを自動車の走行に例えると、エンジンの役割を果たすのがアクチン繊維の動態(重合・脱重合・後方移動)であり、タイヤの役割を果たすのが周辺環境と接着している接着分子である。このエンジンとタイヤをつなぐ役割を果たすものがクラッチ分子と呼ばれ、アクチン繊維の動態を、接着分子を介した成長円錐の推進力へと変換する役割を持っている。成長円錐内においてクラッチ分子の実態および制御機構は不明な点が多いが、アクチン繊維とL1間のクラッチ分子としてシューティン(shootin)が同定され、アンキリンやカテニン(catenin)といったリンカー分子もクラッチ分子として機能すると考えられている。
接着分子のリサイクリング
アクチン繊維と結合した接着分子は、アクチンの後方移動に伴って成長円錐中心部へと運ばれてしまう。成長円錐ではその前方移動を恒常的に維持するため、後方へ移動した接着分子を周辺環境から脱着し、再び成長円錐先端部へと輸送し再利用する機構が存在すると考えられている。例えば、アクチン繊維の後方移動により中心部に到達したL1は、クラスリン依存的エンドサイトーシスによって膜小胞に取り込まれた後、微小管のガイドによって細胞質内を成長円錐先端部まで輸送され、形質膜に再挿入される。一方、インテグリンは成長円錐形質膜上を中心部から先端部に向かって順行性に移動しうることから、エンドサイトーシス非依存的な接着分子のリサイクル機構も存在すると考えられている。
成長円錐と軸索ガイダンス
神経回路の形成過程において、成長円錐は細胞周辺に存在する軸索ガイダンス因子を検出するアンテナとして機能する。すなわち、成長円錐は軸索ガイダンス因子の空間情報を軸索の伸長方向の制御へと変換する上で極めて重要な構造である。成長円錐の運動性は糸状仮足と葉状仮足の伸展と退縮と相関しているが、特に糸状仮足は成長円錐の中でも初めに軸索ガイダンス因子に遭遇する場所であり、軸索ガイダンスにおける成長円錐の旋回運動の制御に重要であると考えられている。糸状仮足は誘引性ガイダンス因子に遭遇すると安定化され、一方反発性ガイダンス因子に遭遇すると退縮する。もし、この応答が成長円錐の前後軸に対し片側で起きると成長円錐はガイダンス因子に対し誘引あるいは反発する方向へと旋回する。このような成長円錐の旋回運動は経路選択や特定のチェックポイントにおいて重要である。
軸索ガイダンス因子
軸索ガイダンス因子は発生過程の組織内に領域特異的に存在することで成長円錐に空間情報を提供し、成長円錐を正しい標的細胞へと誘導する分子として定義できる。生体内における軸索ガイダンス因子は多種多様であるが、大きく4つの作用様式に分類される。細胞外基質や細胞膜に発現し接触を介して近距離に作用する接触因子と、分泌性で濃度勾配によって長距離に作用する拡散性因子、そしてそのそれぞれに対して誘引因子と反発因子が存在する。生体内ではこれら4種類のガイダンス因子が協調的に働くことで軸索を正しい標的へ導くと考えられる。成長円錐には個々の軸索ガイダンス因子に対する特異的な受容体ファミリーが存在しており、受容体の形質膜への発現は軸索ガイダンス因子に対する成長円錐の感受性を規定する。また、成長円錐には同一の軸索ガイダンス因子に対する反応性を場所や時期に応じて切り替える機構が備わっている。 以下に代表的な軸索ガイダンスについて概説する。
ネトリン
ネトリン(netrin)は分泌性タンパク質で、Tessier-Lavigneのグループによって脊髄交連神経軸索を誘引する分子として同定された[2]。発生期の脊髄においてネトリン‐1は低板から分泌されており、交連神経軸索を誘引して運動神経軸索を反発する典型的な両方向性軸索ガイダンス因子として働く[3][4]。ネトリン受容体としてはDCCとUNC-5が同定されている。ネトリン-1に対する成長円錐の反応性はこれら2種類の受容体の発現パターンに依存しており、DCCのみでは誘引、DCCとUNC-5が共発現し形質膜上で受容体ヘテロダイマーを形成すると反発を呈する[5]。
セマフォリン
セマフォリン(semaphorin)ファミリーは代表的な反発性軸索ガイダンス因子で、分泌型の他に膜貫通型、GPIアンカー膜結合型など8つのグループに分類される[6]。分泌型であるSema3Aは生体内で脊髄神経の走行領域を取り囲むように発現しており、Sema3Aノックアウトマウスでは脊髄神経軸索が脱束化しその走行と投射パターンが大幅に乱れる[7]。クラス3セマフォリンに対する受容体としては、ニューロピリン(neuropilin)とプレキシン(plexin)が同定されている。ニューロピリンの細胞内領域は短く、ニューロピリン単独ではセマフォリンによる細胞内シグナル経路を活性化できないが、プレキシンと複合体を形成しプレキシンの細胞内領域において別の分子と相互作用することにより、セマフォリンのシグナルを細胞内シグナルへと伝達する[8]。
Slit
Slitは脊椎動物の脊髄において底板に発現する分泌型の反発性軸索ガイダンス因子である。Slitの受容体であるRoboの遺伝子に変異を持つショウジョウバエ(Roundabout)では、軸索の正中交差が過剰に起きる表現型を示す[9]。Roundaboutとは別に、正中交差が全く起きなくなるCommissureless(comm)変異体も同定されているが、CommはRoboの形質膜発現を抑制することで、交連軸索が一度だけ正中を交差する経路選択に中心的な役割を果たしていると考えられている [10]。
エフリン
受容体チロシンキナーゼEphのリガンドであるエフリン(Ephrin)は、GPIアンカーによる膜結合型のエフリンA(エフリンA1-A5)と、細胞膜貫通型であるエフリンB(エフリンB1-B3)に分類される[11]。いずれも膜に結合した形で存在するため、エフリンは接触型のガイダンス因子として機能する。受容体であるEphファミリーはEphAとEphBに大別され、大まかにはエフリンAグループはEphAグループと、エフリンBグループはEphBグループと結合する。エフリンとEphは発生過程の様々な領域、特に網膜-視蓋投射系において、神経回路形成に重要な役割を担っている。
モルフォゲン
初期発生における未分化な細胞に対しその発生運命を決定する因子をモルフォゲン(morphogen)といい、代表的なものとしてヘジホッッグ(hedgehog)、Wnt、TGFβ、BMPなどの分泌性タンパク質が知られている。近年、モルフォゲンが細胞運命決定後の神経細胞に対し軸索ガイダンス因子として機能することが報告されている。例えば、脊髄蓋板から分泌され交連神経等の脊髄背側介在神経細胞への運命決定を司るBMPは、分化した交連神経の軸索に対しては反発性ガイダンス因子として機能する[12]。また、底板から分泌されるソニックヘッジホッグ(sonic hedgehog)は、ネトリン-1とともに交連軸索に対する誘因性ガイダンス因子としてはたらく[13]。
神経栄養因子
NGF、BDNFなどの神経栄養因子は、発生過程において神経細胞の分化、軸索伸長、生存維持等の生理活性を持つく[14]。多くの場合、神経栄養因子は標的細胞から分泌され、それを受容した神経細胞が分化したり、軸索を伸長させたりする。発生期の生体内において、神経栄養因子が明瞭な濃度勾配を形成しているという決定的な証拠はないが、NGFは培養条件下で成長円錐を誘引する作用を持つ因子として最初に報告されたとしてはたらく[15]。また、発生期の組織内に神経栄養因子に浸したビーズを置くと周辺の軸索がビーズに向かって伸長することも報告されている[16]。
成長円錐の旋回運動を制御する細胞内シグナル経路
成長円錐の運動性は細胞骨格や接着分子により規定されることは上述したが、成長円錐の前進速度に空間的な非対称性が生じれば、成長円錐は全体として旋回運動を呈することになる。実際に、軸索ガイダンス因子が制御する成長円錐の旋回運動にもRhoファミリー低分子量Gタンパク質、ADF/cofilin、Ena/Vasp、APCなどによる細胞骨格制御、CalpainやFAK、Srcチロシンキナーゼなどによる細胞接着制御が関与することが明らかにされている。
=== 誘引-反発応答を制御する分子メカニズム
軸索ガイダンスの分子メカニズムの研究の多くは、Pooのグループによって開発されたターニングアッセイと呼ばれる実験系を用いて行われている。この手法は、培養条件下でガラスピペットから分泌性ガイダンス因子をパルス状に放出し、成長円錐近傍にガイダンス因子の濃度勾配を人工的に作り出し、それに対する成長円錐の挙動を観察するものである。このターニングアッセイを用いた解析では、しばしば特定のシグナルカスケードを遮断すると誘引-反発の応答が逆転する現象が見られる。例えば、ネトリン-1及びBDNFの濃度勾配に対する成長円錐の誘引は、cAMPのアンタゴニストであるRp-cAMPsの投与により反発へと逆転する。このように、成長円錐の旋回運動の方向は様々な細胞内シグナル伝達経路が協調的に働き、複雑なクロストークの結果決定されると予想される。これは、生体内で成長円錐が様々な軸索ガイダンス因子のシグナルを受容しながらそのシグナルを統合し進行する経路を選択することを反映していると考えられる。ここでは、誘引-反発応答を制御するメカニズムについて概説する。
セカンドメッセンジャーによる制御
環状ヌクレオチド
成長円錐内のcAMPおよびcGMPシグナルは、同一軸索ガイダンス因子に対する成長円錐の誘引-反発応答性を規定するものとして報告例が多い。 上述のようにネトリン-1及びBDNFの濃度勾配に対する成長円錐の誘引は、cAMPシグナルの抑制により反発へと逆転する。また、軸索再生阻害因子として知られ軸索反発を誘導するMAGの濃度勾配に対する反発は、cAMPアゴニストであるsp-cAMPsの投与により誘引へと逆転する。逆に、cGMPのアゴニストである8-Br-cGMPの投与によりネトリン-1による誘引が反発へと逆転する報告もあり、多くの軸索ガイダンス因子に共通するメカニズムとしてcAMP/cGMPシグナルにより成長円錐の旋回方向が決定されると考えられている。 cAMP/cGMPの下流では主にプロテインキナーゼA(PKA)/プロテインキナーゼG(PKG)が機能することも示されており、これら2種類のリン酸化酵素の標的分子などの違いにより成長円錐の誘引または反発という正反対の応答が誘導されると考えられている。
細胞内カルシウムシグナル
ケージドカルシウム光解離法を用いて、成長円錐内に局所的なカルシウムシグナルを励起すると、成長円錐の旋回運動が誘導される。また、様々な軸索ガイダンス因子の濃度勾配に遭遇した成長円錐内で非対称なカルシウムイオン濃度上昇が観察されること、成長円錐内のカルシウムシグナルを遮断すると成長円錐の誘引-反発応答が消失することから、局所的なカルシウムシグナルは誘引性、反発性を問わず軸索ガイダンスシグナルの中心的役割を担っていると考えられている。
成長円錐の誘引、反発という全く逆の応答の両方にカルシウムシグナルが関与することは非常に興味深く、カルシウムシグナルによる誘引-反発の決定機構として、現在2つのモデルが提唱されている。
1つは成長円錐内で上昇するカルシウムイオン濃度の絶対量による差が誘引-反発を決定するというモデルで、高カルシウムイオン流入は誘引性応答を、低カルシウムイオン流入は反発性応答を誘導するとされている。
2つ目は誘引-反発は流入するカルシウムチャネルの種類に依存するというモデルで、小胞体ストアからのカルシウム放出を伴うと誘引性、それ以外のカルシウムシグナルは反発性応答を誘導するというものである。このモデルでは、各種カルシウムチャネルの近傍に存在するカルシウム感受性分子の種類の違いが誘引-反発の応答を決定すると考えられている。
誘引-反発のカルシウムシグナルの下流因子として、誘引性カルシウムシグナルにはカルモジュリン依存性リン酸化酵素であるCaMキナーゼⅡ(CaMKⅡ)が、反発性カルシウムシグナルには脱リン酸化酵素であるカルシニューリン(calcineurin)がそれぞれ中心的な役割を担っていると考えられている。
膜トラフィッキング
局所タンパク質合成と分解
成長円錐には小胞体やmRNA、リボソーム、翻訳制御因子等タンパク質の翻訳合成に必要な分子機構が備わっており、近年、このタンパク質の局所翻訳が軸索ガイダンス因子が誘導する成長円錐の旋回運動に関与することが報告されている。
Holtのグループは、細胞体から切り離した軸索の成長円錐のネトリン-1への誘引応答がタンパク質合成阻害剤により消失することを報告した。このことは成長円錐の旋回運動には成長円錐における局所タンパク質合成が必要であることを示している。その後、BDNF、Sema3A、Slit2など、他の軸索ガイダンス因子ついても成長円錐の旋回運動の誘導に局所タンパク質合成が必要であることが報告されている。
軸索ガイダンス因子による局所翻訳の制御機構は不明な点も多いが、少しずつ知見が得られている。例えば、ネトリン-1による軸索誘引では、ネトリン-1非存在下では受容体であるDCCとリボソームが結合しタンパク質合成を阻害しているが、ネトリン-1のDCCへの結合によりリボソームがDCCから解離することでタンパク質合成が起きることが報告されている。また、BDNFの誘引シグナルでは受容体TrkBの下流でチロシンキナーゼであるSrcがRNA結合タンパク質であるZBP1をリン酸化し、β-アクチンmRNAの構造変化を誘導して翻訳を促進すると考えられている。 また、旋回運動を誘導するカルシウムシグナルに応じて空間的に非対称なβ-アクチンmRNAの翻訳が誘発されることも報告されており、カルシウムシグナルの下流でタンパク質の翻訳合成を制御する機構の存在する。
また、最近になり、マイクロRNA(miRNA)によるタンパク質翻訳が成長円錐の旋回運動に関与することも報告されている[17]。
一方、成長円錐においてユビキチン-プロテアソーム系によるタンパク質分解システムも機能しており、これも旋回運動に関与すると考えられ、今後軸索ガイダンスシグナルにより分解が促進されるタンパク質群の同定や、分解系の活性化機構の解明が待たれる。
引用文献
- ↑
Schaefer, A.W., Kabir, N., & Forscher, P. (2002).
Filopodia and actin arcs guide the assembly and transport of two populations of microtubules with unique dynamic parameters in neuronal growth cones. The Journal of cell biology, 158(1), 139-52. [PubMed:12105186] [PMC] [WorldCat] [DOI] - ↑
Serafini, T., Kennedy, T.E., Galko, M.J., Mirzayan, C., Jessell, T.M., & Tessier-Lavigne, M. (1994).
The netrins define a family of axon outgrowth-promoting proteins homologous to C. elegans UNC-6. Cell, 78(3), 409-24. [PubMed:8062384] [WorldCat] [DOI] - ↑
Serafini, T., Colamarino, S.A., Leonardo, E.D., Wang, H., Beddington, R., Skarnes, W.C., & Tessier-Lavigne, M. (1996).
Netrin-1 is required for commissural axon guidance in the developing vertebrate nervous system. Cell, 87(6), 1001-14. [PubMed:8978605] [WorldCat] [DOI] - ↑
Barallobre, M.J., Pascual, M., Del Río, J.A., & Soriano, E. (2005).
The Netrin family of guidance factors: emphasis on Netrin-1 signalling. Brain research. Brain research reviews, 49(1), 22-47. [PubMed:15960985] [DOI] - ↑
Hong, K., Hinck, L., Nishiyama, M., Poo, M.M., Tessier-Lavigne, M., & Stein, E. (1999).
A ligand-gated association between cytoplasmic domains of UNC5 and DCC family receptors converts netrin-induced growth cone attraction to repulsion. Cell, 97(7), 927-41. [PubMed:10399920] [WorldCat] [DOI] - ↑
Tamagnone, L., & Comoglio, P.M. (2000).
Signalling by semaphorin receptors: cell guidance and beyond. Trends in cell biology, 10(9), 377-83. [PubMed:10932095] [WorldCat] - ↑
Taniguchi, M., Yuasa, S., Fujisawa, H., Naruse, I., Saga, S., Mishina, M., & Yagi, T. (1997).
Disruption of semaphorin III/D gene causes severe abnormality in peripheral nerve projection. Neuron, 19(3), 519-30. [PubMed:9331345] [WorldCat] [DOI] - ↑
Takahashi, T., Fournier, A., Nakamura, F., Wang, L.H., Murakami, Y., Kalb, R.G., ..., & Strittmatter, S.M. (1999).
Plexin-neuropilin-1 complexes form functional semaphorin-3A receptors. Cell, 99(1), 59-69. [PubMed:10520994] [WorldCat] [DOI] - ↑
Dubkin, B.P., Govorunov, G.V., & Kreĭndlin, I.u.Z. (1977).
[Reconstructive operation of the vessels in ischemia of the lower extremities]. Rekonstruktivnye operatsii na sosudakh pri ishemii nizhnikh konechnosteĭ Khirurgiia, (1), 36-40. [PubMed:846113] [WorldCat] - ↑
Tear, G., Harris, R., Sutaria, S., Kilomanski, K., Goodman, C.S., & Seeger, M.A. (1996).
commissureless controls growth cone guidance across the CNS midline in Drosophila and encodes a novel membrane protein. Neuron, 16(3), 501-14. [PubMed:8785048] [WorldCat] [DOI] - ↑
Flanagan, J.G., & Vanderhaeghen, P. (1998).
The ephrins and Eph receptors in neural development. Annual review of neuroscience, 21, 309-45. [PubMed:9530499] [WorldCat] [DOI] - ↑
Augsburger, A., Schuchardt, A., Hoskins, S., Dodd, J., & Butler, S. (1999).
BMPs as mediators of roof plate repulsion of commissural neurons. Neuron, 24(1), 127-41. [PubMed:10677032] [WorldCat] [DOI] - ↑
Charron, F., Stein, E., Jeong, J., McMahon, A.P., & Tessier-Lavigne, M. (2003).
The morphogen sonic hedgehog is an axonal chemoattractant that collaborates with netrin-1 in midline axon guidance. Cell, 113(1), 11-23. [PubMed:12679031] [WorldCat] [DOI] - ↑
Huang, E.J., & Reichardt, L.F. (2001).
Neurotrophins: roles in neuronal development and function. Annual review of neuroscience, 24, 677-736. [PubMed:11520916] [PMC] [WorldCat] [DOI] - ↑
Gundersen, R.W., & Barrett, J.N. (1979).
Neuronal chemotaxis: chick dorsal-root axons turn toward high concentrations of nerve growth factor. Science (New York, N.Y.), 206(4422), 1079-80. [PubMed:493992] [WorldCat] [DOI] - ↑
Tucker, K.L., Meyer, M., & Barde, Y.A. (2001).
Neurotrophins are required for nerve growth during development. Nature neuroscience, 4(1), 29-37. [PubMed:11135642] [WorldCat] [DOI] - ↑
Han, L., Wen, Z., Lynn, R.C., Baudet, M.L., Holt, C.E., Sasaki, Y., ..., & Zheng, J.Q. (2011).
Regulation of chemotropic guidance of nerve growth cones by microRNA. Molecular brain, 4, 40. [PubMed:22051374] [PMC] [WorldCat] [DOI]