放射状グリア細胞
吉川 貴子、大隅 典子
東北大学 大学院医学系研究科 発生発達神経科学分野
DOI:10.14931/bsd.3707 原稿受付日:2021年8月2日 原稿完成日:2021年8月4日
担当編集委員:河崎 洋志(金沢大学 医学系 脳神経医学教室)
英:radial glial cell 独:radiale Gliazelle
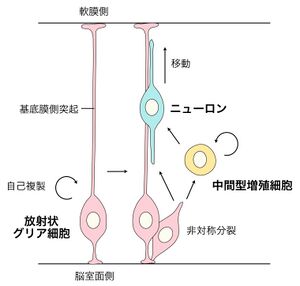
放射状グリア細胞は、胎生期脳の発生過程における、自己複製能と多分化能を持つ神経幹細胞(神経前駆細胞)である。放射状グリア細胞は、脳表面(軟膜側)まで非常に長い放射状の突起を伸ばしており、この突起は放射状グリア細胞から生み出された新生ニューロンが軟膜側に移動する際の足場となる。この基底膜方向に向かう放射状の突起は基底膜側突起と呼ばれ、突起の先端部は基底膜に接して固定されている。一方、脳室面側では、放射状グリア細胞は細胞接着装置によって互いに繋ぎとめられている。ヒトなどの霊長類で特に発達した大脳皮質原基において、脳室帯の外側にある外側脳室下帯には、脳室面側の突起が無く基底膜側突起のみを持つ外側放射状グリア細胞(outer radial glial cells, oRG cells)が豊富に存在する。oRG 細胞もまた神経幹細胞として働き、進化の過程において大脳皮質の拡大に貢献したことが近年明らかになっている。
放射状グリア細胞とは
放射状グリア細胞は、その名が示す様に、長い放射状の突起を持つ特徴的な形態をしている。胎生期の中枢神経系(脳・脊髄)に存在する。
放射状グリア細胞は神経幹細胞(神経前駆細胞)として様々な神経系の細胞を産生する。発生初期では神経幹細胞は神経上皮細胞という丈の短い形態をしており、自己複製を繰り返す(「細胞増殖」参照)。発生中期になると神経上皮細胞は、放射状方向に伸びて長くなり、軟膜側へと突起を伸ばした放射状グリア細胞となる。放射状グリア細胞は、非対称分裂を行って積極的にニューロンを生み出す(図1)。また、中間型増殖細胞というニューロンのみを生み出す一過性の前駆細胞にも分化し、この細胞は脳室帯よりも軟膜側に位置する脳室下帯に位置している(「神経前駆細胞」参照)。発生後期になるとグリア細胞(アストロサイトやオリゴデンドロサイト)を産生するようになる(「脳室帯」参照)。
放射状グリア細胞は、高い極性を持ち、脳室面側が頂端側、軟膜側が基底膜側となる(図1)。基底膜側に向かって非常に長い放射状の突起を伸ばしており、この突起は基底膜側突起(basal process)と呼ばれる。基底膜側突起の先端部は基底膜に接して固定されている。この突起は、放射状グリア細胞から生み出された新生ニューロンが軟膜側に移動する際の「足場」となり、ニューロンが適切な場所へと配置されるのに重要である。一方、頂端側は、細胞接着装置によって隣接した放射状グリア細胞に繋ぎとめられている。放射状グリア細胞の核は脳室面側の脳室帯にとどまり、細胞周期依存的に核が移動し(「エレベーター運動」参照)、脳室面で細胞分裂が起こる。 なお、ニューロン新生が生後も続く海馬でも、神経幹細胞は放射状グリアの形態を取ることが知られている(ニューロン新生参照)。
分子局在
放射状グリア細胞は非常に極性が高く、細胞内での分子の局在は著しく偏っている(図2)。
核には、転写制御因子のpaired box 6(Pax6)やSRY-box 2(Sox2)が発現する[1][2]。Pax6の機能阻害により神経幹細胞の増殖や分化に異常が生じる[3][4][5](「Pax遺伝子群」参照)。
基底膜側突起には、脂肪酸結合タンパク質のBLBP(Fabp7)、アストロサイト特異的なグルタミン酸トランスポーターのGLAST(Slc1a3)、放射状グリアマーカーのRC2などが発現する[6][7][8]。Fabp7はPax6の転写制御を受けており[9]、神経幹細胞の増殖を維持する[10]。
頂端側には、細胞接着分子、とくにアドヘレンスジャンクション関連分子のN-カドヘリン(Cdh2)やβ-カテニン(Ctnnb1)が局在し、放射状グリア細胞同士をお互いに接着させている[11][12]。ニューロンが分化する際には、細胞接着分子の発現が低下し、脳室面からのすみやかな離脱と外側への移動が開始する[13][14]。中心体タンパクのナイニン(Ninein, Nin)も頂端側に局在しており、エレベーター運動を制御している[15]。
基底膜側突起の先端部は基底膜に接しており、細胞外基質からインテグリン受容体を介して増殖のためのシグナルを受け取っている[16]。近年、大脳皮質では、脆弱X症候群の原因遺伝子FMR1にコードされるRNA結合タンパク質のFMRPが、基底膜側突起の先端部に存在し、特定のmRNAを輸送していることが明らかになった[17][18][19]。また、細胞周期促進因子のCyclin D2(Ccnd2)のmRNAやタンパク質が基底膜側突起の先端部に集積しており、放射状グリア細胞の運命決定を行なう可能性が示唆された[20]。
脳の進化との関わり
霊長類などで特に発達した大脳皮質においては、脳室帯(ventricular zone, VZ)および脳室下帯(subventricular zone, SVZ)のさらに外側に、発達した増殖層が存在する。この層は、外側脳室下帯(outer subventricular zone, OSVZ)と呼ばれ、脳室面側突起が無く基底膜側突起のみを持つ放射状グリア細胞(outer radial glial cells, oRG細胞)が豊富に存在する[21]。oRG 細胞は神経幹細胞として働き、転写制御因子のPax6, Sox2, HopX(HOP homeobox)などの分子マーカーを発現する[22][23][24]。マウスではoRG 細胞がごく少数であるのに対し、ヒトを含む霊長類では多くのoRG細胞が存在し、莫大な数のニューロンを生み出すことに繋がったと考えられている(図3)。このような放射状グリア細胞集団が進化の過程において大脳皮質の拡大に貢献した可能性が高い。
参考文献
- ↑
Götz, M., Stoykova, A., & Gruss, P. (1998).
Pax6 controls radial glia differentiation in the cerebral cortex. Neuron, 21(5), 1031-44. [PubMed:9856459] [WorldCat] [DOI] - ↑
Uwanogho, D., Rex, M., Cartwright, E.J., Pearl, G., Healy, C., Scotting, P.J., & Sharpe, P.T. (1995).
Embryonic expression of the chicken Sox2, Sox3 and Sox11 genes suggests an interactive role in neuronal development. Mechanisms of development, 49(1-2), 23-36. [PubMed:7748786] [WorldCat] [DOI] - ↑
Götz, M., Stoykova, A., & Gruss, P. (1998).
Pax6 controls radial glia differentiation in the cerebral cortex. Neuron, 21(5), 1031-44. [PubMed:9856459] [WorldCat] [DOI] - ↑
Heins, N., Malatesta, P., Cecconi, F., Nakafuku, M., Tucker, K.L., Hack, M.A., ..., & Götz, M. (2002).
Glial cells generate neurons: the role of the transcription factor Pax6. Nature neuroscience, 5(4), 308-15. [PubMed:11896398] [WorldCat] [DOI] - ↑
Osumi, N., Shinohara, H., Numayama-Tsuruta, K., & Maekawa, M. (2008).
Concise review: Pax6 transcription factor contributes to both embryonic and adult neurogenesis as a multifunctional regulator. Stem cells (Dayton, Ohio), 26(7), 1663-72. [PubMed:18467663] [WorldCat] [DOI] - ↑
Feng, L., Hatten, M.E., & Heintz, N. (1994).
Brain lipid-binding protein (BLBP): a novel signaling system in the developing mammalian CNS. Neuron, 12(4), 895-908. [PubMed:8161459] [WorldCat] [DOI] - ↑
Shibata, T., Yamada, K., Watanabe, M., Ikenaka, K., Wada, K., Tanaka, K., & Inoue, Y. (1997).
Glutamate transporter GLAST is expressed in the radial glia-astrocyte lineage of developing mouse spinal cord. The Journal of neuroscience : the official journal of the Society for Neuroscience, 17(23), 9212-9. [PubMed:9364068] [WorldCat] - ↑
Hartfuss, E., Galli, R., Heins, N., & Götz, M. (2001).
Characterization of CNS precursor subtypes and radial glia. Developmental biology, 229(1), 15-30. [PubMed:11133151] [WorldCat] [DOI] - ↑
Inada, H., Numayama-Tsuruta, K., Mochizuki, K., Sasaki-Hoshino, M., & Osumi, N. (2018).
Pax6-dependent regulation of the rat Fabp7 promoter activity. Genes to cells : devoted to molecular & cellular mechanisms. [PubMed:29984875] [WorldCat] [DOI] - ↑
Arai, Y., Funatsu, N., Numayama-Tsuruta, K., Nomura, T., Nakamura, S., & Osumi, N. (2005).
Role of Fabp7, a downstream gene of Pax6, in the maintenance of neuroepithelial cells during early embryonic development of the rat cortex. The Journal of neuroscience : the official journal of the Society for Neuroscience, 25(42), 9752-61. [PubMed:16237179] [PMC] [WorldCat] [DOI] - ↑
Hatta, K., Takagi, S., Fujisawa, H., & Takeichi, M. (1987).
Spatial and temporal expression pattern of N-cadherin cell adhesion molecules correlated with morphogenetic processes of chicken embryos. Developmental biology, 120(1), 215-27. [PubMed:3817290] [WorldCat] [DOI] - ↑
Kadowaki, M., Nakamura, S., Machon, O., Krauss, S., Radice, G.L., & Takeichi, M. (2007).
N-cadherin mediates cortical organization in the mouse brain. Developmental biology, 304(1), 22-33. [PubMed:17222817] [WorldCat] [DOI] - ↑
Hatakeyama, J., Wakamatsu, Y., Nagafuchi, A., Kageyama, R., Shigemoto, R., & Shimamura, K. (2014).
Cadherin-based adhesions in the apical endfoot are required for active Notch signaling to control neurogenesis in vertebrates. Development (Cambridge, England), 141(8), 1671-82. [PubMed:24715457] [WorldCat] [DOI] - ↑
Kawaue, T., Shitamukai, A., Nagasaka, A., Tsunekawa, Y., Shinoda, T., Saito, K., ..., & Kawaguchi, A. (2019).
Lzts1 controls both neuronal delamination and outer radial glial-like cell generation during mammalian cerebral development. Nature communications, 10(1), 2780. [PubMed:31239441] [PMC] [WorldCat] [DOI] - ↑
Shinohara, H., Sakayori, N., Takahashi, M., & Osumi, N. (2013).
Ninein is essential for the maintenance of the cortical progenitor character by anchoring the centrosome to microtubules. Biology open, 2(7), 739-49. [PubMed:23862022] [PMC] [WorldCat] [DOI] - ↑
Stenzel, D., Wilsch-Bräuninger, M., Wong, F.K., Heuer, H., & Huttner, W.B. (2014).
Integrin αvβ3 and thyroid hormones promote expansion of progenitors in embryonic neocortex. Development (Cambridge, England), 141(4), 795-806. [PubMed:24496617] [WorldCat] [DOI] - ↑
Saffary, R., & Xie, Z. (2011).
FMRP regulates the transition from radial glial cells to intermediate progenitor cells during neocortical development. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(4), 1427-39. [PubMed:21273427] [PMC] [WorldCat] [DOI] - ↑
Pilaz, L.J., Lennox, A.L., Rouanet, J.P., & Silver, D.L. (2016).
Dynamic mRNA Transport and Local Translation in Radial Glial Progenitors of the Developing Brain. Current biology : CB, 26(24), 3383-3392. [PubMed:27916527] [PMC] [WorldCat] [DOI] - ↑
Casingal, C.R., Kikkawa, T., Inada, H., Sasaki, Y., & Osumi, N. (2020).
Identification of FMRP target mRNAs in the developmental brain: FMRP might coordinate Ras/MAPK, Wnt/β-catenin, and mTOR signaling during corticogenesis. Molecular brain, 13(1), 167. [PubMed:33323119] [PMC] [WorldCat] [DOI] - ↑
Pincus, D.H., Salkin, I.F., Hurd, N.J., Levy, I.L., & Kemna, M.A. (1988).
Modification of potassium nitrate assimilation test for identification of clinically important yeasts. Journal of clinical microbiology, 26(2), 366-8. [PubMed:3343330] [PMC] [WorldCat] [DOI] - ↑
Hansen, D.V., Lui, J.H., Parker, P.R., & Kriegstein, A.R. (2010).
Neurogenic radial glia in the outer subventricular zone of human neocortex. Nature, 464(7288), 554-561. [PubMed:20154730] [WorldCat] [DOI] - ↑
Fietz, S.A., Kelava, I., Vogt, J., Wilsch-Bräuninger, M., Stenzel, D., Fish, J.L., ..., & Huttner, W.B. (2010).
OSVZ progenitors of human and ferret neocortex are epithelial-like and expand by integrin signaling. Nature neuroscience, 13(6), 690-9. [PubMed:20436478] [WorldCat] [DOI] - ↑
Hansen, D.V., Lui, J.H., Parker, P.R., & Kriegstein, A.R. (2010).
Neurogenic radial glia in the outer subventricular zone of human neocortex. Nature, 464(7288), 554-561. [PubMed:20154730] [WorldCat] [DOI] - ↑
Pollen, A.A., Nowakowski, T.J., Chen, J., Retallack, H., Sandoval-Espinosa, C., Nicholas, C.R., ..., & Kriegstein, A.R. (2015).
Molecular identity of human outer radial glia during cortical development. Cell, 163(1), 55-67. [PubMed:26406371] [PMC] [WorldCat] [DOI]