「脆弱X症候群」の版間の差分
(ページの作成:「英:fragile X syndrome • 要約 脆弱X症候群はX連鎖性遺伝形式をとる、知的障害、自閉傾向、特有の顔貌などを示す疾患である。X…」) |
細編集の要約なし |
||
| (同じ利用者による、間の14版が非表示) | |||
| 1行目: | 1行目: | ||
<div align="right"> | |||
<font size="+1">[https://researchmap.jp/t-okazaki 岡崎 哲也]</font><br> | |||
''鳥取大学医学部附属病院遺伝子診療科''<br> | |||
<font size="+1">[https://researchmap.jp/yujin_4751 中山 祐二]、[https://researchmap.jp/adachika 足立 香織]</font><br> | |||
''鳥取大学 研究推進機構 研究基盤センター''<br> | |||
<font size="+1">[https://researchmap.jp/read0015465 難波 栄二]</font><br> | |||
''鳥取大学 研究推進機構 研究戦略室''<br> | |||
DOI:<selfdoi /> 原稿受付日:2020年11月16日 原稿完成日:2020年12月2日<br> | |||
担当編集委員:[https://researchmap.jp/hayashi-takagi/?lang=japanese 林(高木)朗子](国立研究開発法人理化学研究所 脳神経科学研究センター)<br> | |||
</div> | |||
英:fragile X syndrome 独:Fragiles-X-Syndrom 仏:syndrome de l'X fragile | |||
{{box|text= 脆弱X症候群はX連鎖性遺伝形式をとる、知的障害、自閉傾向、特有の顔貌などを示す疾患である。X染色体上のFMR1遺伝子の5’非翻訳領域のCGGリピートの伸長(201リピート以上)により引き起こされる。遺伝性の知的障害では、最も研究の進んでいる疾患の一つで、病態、診断、治療などの研究が盛んに行われている。本疾患はCGGリピートが下の世代へ受け継がれる際、減数分裂・体細胞分裂において複製される過程で伸長することにより発症する。家系内には同じ伸長リピート、あるいは201リピートよりも短い伸長リピートを有する母などがいる。短い伸長リピートをもつ人では、50代以降で発症する神経変性疾患(fragile-X associated tremor and ataxia syndrome、FXTAS)や早期卵巣不全などの症状を呈する場合がある。これらの遺伝の特徴を踏まえた、遺伝カウンセリングや診療体制が必要となる。}} | |||
== 脆弱X症候群とは== | |||
脆弱X症候群は、1943年に[[w:James Purdon Martin|Martin]]と[[w:Julia Bell|Bell]]によって[[X連鎖性]]を示す家族性の[[知的障害]]をきたす疾患として初めて報告された。1969年に[[w:Herbert Lubs|Lubs]]によってX染色体上の脆弱部位が明らかにされ、初期には葉酸欠乏培地を用いた染色体検査で、この部位の脆弱性を示すことにより診断が行われた。1991年にVerkerkらによって[[染色体]]Xq27.3に原因遺伝子[[FMR1]]([[FMRP translational regulator 1]])遺伝子が同定され、この遺伝子の5’端[[非翻訳領域]]に位置する3[[塩基]](CGG)の繰り返し配列伸長が原因であることが分かった<ref name=難波2015>'''難波 栄二 (2015).'''<br>脆弱X症候群の診断と治療: updateとレビュー. 脳と発達 47:112—116.</ref><ref name=deVries1998><pubmed>9678703</pubmed></ref> 。 | |||
欧米では脆弱X症候群は知的障害の代表的疾患として知られており、知的障害患者では広く遺伝学的検査が実施されている。また、知的障害の病態解明も進んでおり、治療法の開発が行われている。本疾患は代を経るごとにCGG繰り返し配列が伸長することにより発症し、家系内には、別の症状を呈する家系員([[脆弱X症候群関連疾患]])がいることもある。そのために、遺伝カウンセリングの面も十分に考慮した診断体制、診療体制が必要となる。 | |||
==症状== | ==症状== | ||
知的障害や[[自閉症状]]の他に、長い顔、大耳介、大きな精巣などの症状が知られている<ref name=Guruju2009><pubmed>19560928</pubmed></ref> 。しかし、これらの特徴は他疾患でもみられ、脆弱X症候群症例であっても目立たない場合もあることから、臨床症状のみから脆弱X症候群を必ずしも鑑別に挙げることはできない。また、女性が全変異を有する場合、多くの場合知的障害はないか、あるいは知的障害を有していても軽度のことが多いが、知的障害の程度が強い症例も少数ながら報告されている<ref> '''Neri, G. (2017).'''<br>The clinical phenotype of the Fragile X syndrome and related disorders. In: Willemsen R, Kooy RF (eds). Fragile X syndrome, 1st edn. ''Academic Press'': Ann Arbor MI.USA, 2017, pp 10</ref>。このように女性でも知的障害の原因となることがあるため、性別を問わず、原因不明の知的障害を有する症例では、脆弱X症候群を鑑別疾患として挙げる必要がある。 | |||
== 疫学 == | |||
FMR1遺伝子のCGG繰り返し配列数伸長について、一般人口での調査が各国で行われているが、その頻度は報告によりばらつきがある。2014年に報告された各国の情報をもとにした[[メタ解析]]の報告によれば、脆弱X症候群(全変異)の出現頻度は男性では7,143人、女性では11,111人に1人とされている<ref name=Hunter2014><pubmed>24700618</pubmed></ref> 。これまでの調査からFMR1遺伝子のCGGリピート数伸長の頻度には人種差があり、アジアよりも欧米でやや多いと考えられている。日本国内で実施した調査(平成21~23年度難治性疾患克服研究事業)では、男性10,000人に1人の頻度と推定される<ref name=難波2015></ref>。これは、知的障害が人口の2.5%とすると、知的障害をもつ男性では250人に1人の頻度で、これは日本での検討結果<ref name=Nanba1995><pubmed>8579216</pubmed></ref>ともほぼ一致する。 | |||
[[ファイル:Okazaki Fragile X syndrom Fig.png|サムネイル|'''図. FMR1遺伝子のCGGリピートの伸長と発症様式''']] | |||
== 遺伝 == | |||
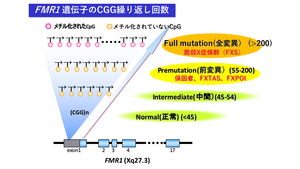
原因遺伝子であるFMR1遺伝子の5’非翻訳領域(エクソン1内)にあるCGG繰り返し配列の繰り返し回数は、正常では6から44回、intermediate(中間型)では45から54回、premutation(前変異)では55回から200回、full mutation(全変異)では201回以上を呈し、脆弱X症候群症例は全変異である('''図''')。現時点では、正常範囲の回数の親から、こどものCGG繰り返し回数が全変異にまで伸長することはないとされ、中間型の回数を有する親からこどもが前変異の回数に、前変異の回数を有する親からこどもが全変異の回数への伸長が生じうると考えられている([[表現促進現象]])。そのためFMR1遺伝子の解析で全変異が見つかった場合には、母が前変異あるいは全変異を有している。一方、父が前変異を有する場合にも伸長することがあるが、こどもが全変異となる程は伸長しないとされている<ref>[https://www.ncbi.nlm.nih.gov/books/NBK1384/ FMR1-Related Disorders - GeneReviews® - NCBI Bookshelf.] 15th May, 2017.</ref>。 | |||
なお、FMR1遺伝子のCGG繰り返し配列中には所々AGG配列があり、このAGG配列の出現頻度が少ない場合に、CGGリピートが伸長しやすいことが知られている<ref name=Eichler1994><pubmed>7987398</pubmed></ref><ref name=Nolin2011><pubmed>21717484</pubmed></ref> 。ただし、AGG配列出現頻度によるこどもの繰り返し回数の伸長予測方法としての臨床応用はまだされていない。 | |||
中間型の繰り返し回数を有する者に、明らかな臨床症状が出現したとの報告はない。米国での報告では、中間型の繰り返し回数が、次世代で前変異の繰り返し回数になる確率は約14%で<ref name=Yrigollen2014><pubmed>25110527</pubmed></ref> 、次世代へ引き継ぐ際に繰り返し回数が伸長しない場合もあるが、伸長するときには、早ければ次々世代(本人にとって孫の世代)で全変異となり、脆弱X症候群の症状を呈する可能性がある。なお、欧米では中間型の繰り返し回数を有する女性の頻度は53人に1人との報告がある<ref name=Cronister2008><pubmed>18310361</pubmed></ref> 。 | |||
== 病態生理 == | |||
FMR1遺伝子のCGG繰り返し配列が201回以上の全変異の場合に、伸長したCGG繰り返し回数と近傍のFMR1遺伝子[[プロモーター]]領域のCpGアイランドが、過剰な[[メチル化]]修飾を受ける。そのためFMR1遺伝子の発現が抑制され、コードするタンパク質であるFMRPを産生できないことが脆弱X症候群の病態生理の中核である。Liuら<ref name=Liu2018><pubmed>29456084</pubmed></ref> はこのメチル化を除去することにより、伸長したリピート数を保っていてもFMR1の発現が回復することを、脆弱X症候群の[[iPS細胞]]由来神経細胞と[[CRISPR/Cas9]]を用いた実験で示している。 | |||
FMRPはユビキタスに発現しているが、脳と精巣で比較的強く発現する[[RNA結合タンパク質]]である<ref name=難波2011>'''難波 栄二 (2011)''' 脆弱X症候群の分子機構と治療. 医学のあゆみ 239: 633—638.</ref> 。FMRPは[[核]]内[[mRNA]]に結合するが、神経細胞では核内のみならず、[[樹状突起]]や[[樹状突起棘]]の局所的mRNAと複合体を形成している。この局所的mRNAの[[翻訳調節]]は、[[代謝型グルタミン酸受容体5]]([[mGluR5]])からのシグナルが引き金になっており、[[リン酸化]]されたFMRPのみがタンパク翻訳に抑制的に働く。mGluR5が刺激されるとFMRPが急速に脱リン酸化され、シナプスの局所的なmRNAの急激な増加を引き起こし、翻訳を活性化させる<ref name=Ceman2003><pubmed>14570712</pubmed></ref> 。この調節機構には[[mTOR]]カスケードが必要であり、最終的には[[S6キナーゼ]]がFMRPをリン酸化している。 | |||
FMRPは標的mRNAの翻訳を抑制することにより、[[シナプス]]機能を維持しているため、脆弱X症候群でFMRPが欠損することでこの機能が失われると、[[シナプス可塑性]]に変化をもたらし、知的障害などの症状を呈すると考えられている。シナプスの活動状況によって[[シナプス伝達]]の効率が変化するシナプス可塑性は[[記憶]]や[[学習]]に重要な役割を担っており、シナプス伝達効率が増加する[[長期増強現象]]([[LTP]])や、伝達効率が低下する[[長期抑制現象]]([[LTD]])などの生理的な現象と密接な関係がある。実際にヒト脆弱X症候群患者やFmr1[[ノックアウトマウス]]モデルにおいても、シナプス樹状突起棘(スパイン)に異常(数が多い、異常に長く曲がった形)があり、未熟であることが明らかにされており、脆弱X症候群では[[海馬]]と[[小脳]]のLTDが増強され、[[大脳]]や海馬ではLTPに変化を起こすことなど、可塑性の異常が報告されている<ref name=難波2015 /><ref name=Huber2002><pubmed>12032354</pubmed></ref> 。 | |||
==検査== | |||
脆弱X症候群の診断には遺伝学的検査が必須であり、[[染色体]]検査、[[サザンブロット]]法、[[PCR]]法などの方法がある。染色体検査ではX染色体長腕末端の脆弱部位を検出するが、CGG繰り返し配列が伸長していても陽性にならない場合がある。また、サザンブロット法はCGGリピートの繰り返し回数だけでなく、伸長したリピートに特有のメチル化の状態も同時に検出できるため、脆弱X症候群の診断としては確実性が高い。しかし、前変異の場合には、は同定が困難となる場合がある。 | |||
= | 繰り返し回数の最も簡便な評価方法がPCR法であるが、ターゲットがCGG繰り返し配列というGC含量が極めて高い塩基配列の増幅であるため、脆弱X症候群の遺伝学的検査の標準法として安定した結果を得るためには様々な試行錯誤が必要であった。しかし、近年のPCR法の改良を経て、現在では正常範囲から全変異まで、すべての長さの繰り返し回数を正確に検出する方法が開発されている<ref name=Kwok2016><pubmed>26947966</pubmed></ref> 。国内では2017年から登録衛生検査所において、この方法を用いた検査が保険診療として実施可能となっている。 | ||
診断における留意点として、未診断の知的障害症例においては、[[次世代シークエンサー]]を用いた網羅的な遺伝子解析が診断率に大きく貢献しているが、現在主流を占めているショートリードを用いた次世代シークエンサー技術では、脆弱X症候群の原因となるCGG繰り返し配列伸長の同定はできない。同様に染色体検査やマイクロアレイ検査でもリピートの長さは評価できないため、現時点では脆弱X症候群の遺伝学的検査は、PCR法あるいはサザンブロット法で実施する必要がある。 | |||
== 脆弱X症候群関連疾患 == | |||
FMR1遺伝子の前変異を有する場合、脆弱X症候群関連疾患である[[脆弱X随伴振戦/失調症候群]]([[FXTAS]]:[[Fragile X-associated tremor/ataxia syndrome]])や[[脆弱X関連早期卵巣不全]]([[FXPOI]]: [[Fragile X-associated primary ovarian insufficiency]])の症状を呈することがある。国内での頻度は不明だが、海外では前変異をもつ人のうち男性で46%、女性では17%で脆弱X随伴振戦/失調症候群の症状を呈し、女性の15〜20%に脆弱X関連早期卵巣不全がみられたことが報告されている<ref name=Rodriguez-Revenga2009><pubmed>19367323</pubmed></ref> 。脆弱X随伴振戦/失調症候群は典型的には50歳以降に出現する進行性の[[振戦]]、[[小脳失調]]、[[末梢神経障害]]、[[非典型的パーキンソニズム]]、[[認知症]]を特徴とする。検査所見として、頭部[[MRI]]での[[中小脳脚]](middle cerebellar peduncles)の高信号([[MCP兆候]])が有用とされているが<ref name=Hagerman2001><pubmed>11445641</pubmed></ref> 、FMR1遺伝子のCGG繰り返し回数が前変異の範囲であることを確認する必要がある。一方、脆弱X関連早期卵巣不全は不規則な月経、[[FSH]]上昇、妊孕性の低下、早発閉経を来す。 | |||
== 治療 == | |||
脆弱X症候群は知的障害、自閉症状をきたす単一遺伝子疾患であり、これらの症状に対する治療研究対象疾患として、現時点で確立した治療はないものの、現在も海外では盛んに治療研究が行われている。様々な薬剤の臨床研究の進行については、各ウェブサイトで調べることができる<ref name=clinicaltraials>[http://www.clinicaltrials.gov. ClinicalTrials.gov.]</ref>。ここでは、現在も治験が行われている主な候補薬剤を解説する。 | |||
=== 代謝型グルタミン酸受容体拮抗薬 === | |||
神経細胞における局所的mRNAの翻訳調節は、代謝型グルタミン酸受容体5型(mGluR5)からのシグナルが引き金になっており、リン酸化されたFMRPのみがタンパク質翻訳に抑制的に働く。脆弱X症候群ではFMR1の発現が抑制され、FMRPが産生されないため、治療薬の候補としてmGluR5[[拮抗薬]]が以前から挙げられている<ref name=Protic2019><pubmed>31241016</pubmed></ref> 。 | |||
=== GABA受容体調整薬 === | |||
[[GABA]]経路は抑制系の中枢神経経路で、[[イオンチャネル型]]の[[GABAA受容体|GABA<sub>A</sub>受容体]]と代謝型の[[GABAB受容体|GABA<sub>B</sub>受容体]]の2つの主な受容体のサブタイプがある。 | |||
Fmr1ノックアウトマウスではGABA<sub>A</sub>受容体が減少していることが知られている<ref name=clinicaltraials />。一方、GABA<sub>B</sub>受容体はシナプス前にあり、GABA放出を調節している。脆弱X症候群のGABA<sub>B</sub>の標的はGABAシステムの抑制機能の増強及び、mGluRの過剰な活動からの入力を減らすことで、GABA<sub>B</sub>受容体[[作動薬]]である[[アーバクロフェン]]([[バクロフェン]]のR異性体)が候補薬として挙げられている。その他に、GABA<sub>A</sub>、GABA<sub>B</sub>両方に作用する[[アカンプロセート]]の臨床研究が行われている<ref name=Ligsay2016><pubmed>27672538</pubmed></ref> 。 | |||
=== ミノサイクリン === | |||
脆弱X症候群では、FMRPの欠如により[[マトリックスメタロプロテアーゼ-9]]([[MMP-9]])活性が亢進する。この機序は、脆弱X症候群において[[PI3K|PI<sub>3</sub>K]]-[[mTOR]]経路が活性化されることで[[eIF4E]]のリン酸化が上昇する結果、MMP-9の翻訳レベルが上昇するためである。FMRPはMMP-9の活性亢進を抑制しているが、FMRPが欠損している場合には、MMP-9がmTORシグナル伝達系の経路の活性化を促し、このことが脆弱X症候群でのシナプス形態の変化、行動異常の病態の一つと考えられている<ref name=Dziembowska2012><pubmed>22326910</pubmed></ref> 。[[抗生物質]]として知られる[[ミノサイクリン]]はMMP-9活性を低下させる働きを有し、候補薬として挙げられている<ref name=Utari2010><pubmed>20687826</pubmed></ref><ref name=Paribello2010><pubmed>20937127</pubmed></ref> 。 | |||
=== 選択的セロトニン再取り込み阻害薬 === | |||
以前から、[[セロトニン]]の機能障害と脆弱X症候群および[[自閉スペクトラム症]]との関連が知られている。月齢12から50か月の小児脆弱X症候群を対象に行われた少量の[[選択的セロトニン再取り込み阻害薬]]([[SSRI]])である[[セルトラリン]]を用いた臨床研究では、非投与群に比べて特に[[言語発達]]において有意に効果が認められた<ref name=Winarni2012><pubmed>23074686</pubmed></ref> 。この結果を受けて、2歳から6歳を対象とした52人に対し、[[ランダム化2相性試験]]が行われた。この結果では、プラシーボ群に対し、[[粗大運動]]、[[視覚認知]]、[[認知機能]]で有意に効果がみられた<ref name=Ligsay2016><pubmed>27672538</pubmed></ref> 。 | |||
=== ロバスタチン === | |||
脆弱X症候群では[[RAS]]-[[MAPK]]-[[ERK1]]/[[ERK2|2]]経路の障害が関与していると考えられている。高脂血症の治療薬である[[ロバスタチン]]は、RAS-MAPK-ERK1/2活性を阻害することが分かっている。Fmr1ノックアウトマウスでの検討では、mGluR関連LTDの正常化、海馬ニューロンによる[[てんかん]]原生の阻害などロバスタチンの効果が確認された<ref name=Osterweil2010><pubmed>21084617</pubmed></ref><ref name=Osterweil2013><pubmed>23352161</pubmed></ref> 。平均年齢18歳(18±5歳)、15例の脆弱X症候群に対するロバスタチンの臨床研究が行われ、[[多動]]、[[無気力]]、社会性などに効果を認めた<ref name=Caku2014><pubmed>25258112</pubmed></ref> 。 | |||
=== メトフォルミン === | |||
[[メトフォルミン]]は[[2型糖尿病]]の治療薬として知られているが、2017年に脆弱X症候群モデルマウスでの効果が認められたとの報告がなされた<ref name=Gantois2017><pubmed>28504725</pubmed></ref> 。作用機序として、亢進したRAS-MAPK-ERK1/2経路およびMMP-9産生の阻害が考えられている。臨床試験の報告が翌年にはなされ、現在も臨床研究が行われている<ref name=Dy2018><pubmed>28436599</pubmed></ref> 。 | |||
=== カナビジオール === | |||
[[大麻]]の有効成分の一つである、[[カナビジオール]](CBD)は神経疾患のみならず、炎症性疾患、自己免疫疾患などに対する効果が報告されている<ref name=Protic2019><pubmed>31241016</pubmed></ref> 。現在では[[抗てんかん作用]]が最も知られており、[[Dravet症候群]]と[[Lennox-Gastaut症候群]]による難治性てんかんに対する治療薬としてFDAの承認を得ている。カナビジオールジェルを用いた治療が、脆弱X症候群症例の[[不安障害]]やその他の行動異常に対する治療薬候補としても挙げられており、2018年の米国神経精神薬理学会(ACNP)でHeusslerらにより発表された第二相の結果を受けて、第三相(NCT03614663)の臨床試験が行われたが、明らかな効果は示されなかった。 | |||
上記の他にも[[ビタミンC]]および[[ビタミンE|E]]を用いた治療に関するもの、ミノサイクリンとロバスタチンを併用するものなど、様々な臨床研究が候補として挙げられている。 | |||
==おわりに== | |||
現在脆弱X症候群の治療研究が非常に活発に行われており、将来的には、これらの成果が日本人脆弱X症候群症例に有益な治療となる可能性が充分にあり、未診断となっている症例の診断を推進し、これらの治療を受けることができる体制を構築することが必要である。このような背景から本邦では2015年に脆弱X症候群(206)ならびに脆弱X症候群関連疾患(205)が[[指定難病]]となり、2016年には遺伝学的検査が保険収載された。2017年にレジストリシステムが構築され、登録者数が少しずつ増えている状況である。 | |||
== 参考文献 == | |||
2020年12月2日 (水) 19:54時点における最新版
岡崎 哲也
鳥取大学医学部附属病院遺伝子診療科
中山 祐二、足立 香織
鳥取大学 研究推進機構 研究基盤センター
難波 栄二
鳥取大学 研究推進機構 研究戦略室
DOI:10.14931/bsd.9540 原稿受付日:2020年11月16日 原稿完成日:2020年12月2日
担当編集委員:林(高木)朗子(国立研究開発法人理化学研究所 脳神経科学研究センター)
英:fragile X syndrome 独:Fragiles-X-Syndrom 仏:syndrome de l'X fragile
脆弱X症候群はX連鎖性遺伝形式をとる、知的障害、自閉傾向、特有の顔貌などを示す疾患である。X染色体上のFMR1遺伝子の5’非翻訳領域のCGGリピートの伸長(201リピート以上)により引き起こされる。遺伝性の知的障害では、最も研究の進んでいる疾患の一つで、病態、診断、治療などの研究が盛んに行われている。本疾患はCGGリピートが下の世代へ受け継がれる際、減数分裂・体細胞分裂において複製される過程で伸長することにより発症する。家系内には同じ伸長リピート、あるいは201リピートよりも短い伸長リピートを有する母などがいる。短い伸長リピートをもつ人では、50代以降で発症する神経変性疾患(fragile-X associated tremor and ataxia syndrome、FXTAS)や早期卵巣不全などの症状を呈する場合がある。これらの遺伝の特徴を踏まえた、遺伝カウンセリングや診療体制が必要となる。
脆弱X症候群とは
脆弱X症候群は、1943年にMartinとBellによってX連鎖性を示す家族性の知的障害をきたす疾患として初めて報告された。1969年にLubsによってX染色体上の脆弱部位が明らかにされ、初期には葉酸欠乏培地を用いた染色体検査で、この部位の脆弱性を示すことにより診断が行われた。1991年にVerkerkらによって染色体Xq27.3に原因遺伝子FMR1(FMRP translational regulator 1)遺伝子が同定され、この遺伝子の5’端非翻訳領域に位置する3塩基(CGG)の繰り返し配列伸長が原因であることが分かった[1][2] 。
欧米では脆弱X症候群は知的障害の代表的疾患として知られており、知的障害患者では広く遺伝学的検査が実施されている。また、知的障害の病態解明も進んでおり、治療法の開発が行われている。本疾患は代を経るごとにCGG繰り返し配列が伸長することにより発症し、家系内には、別の症状を呈する家系員(脆弱X症候群関連疾患)がいることもある。そのために、遺伝カウンセリングの面も十分に考慮した診断体制、診療体制が必要となる。
症状
知的障害や自閉症状の他に、長い顔、大耳介、大きな精巣などの症状が知られている[3] 。しかし、これらの特徴は他疾患でもみられ、脆弱X症候群症例であっても目立たない場合もあることから、臨床症状のみから脆弱X症候群を必ずしも鑑別に挙げることはできない。また、女性が全変異を有する場合、多くの場合知的障害はないか、あるいは知的障害を有していても軽度のことが多いが、知的障害の程度が強い症例も少数ながら報告されている[4]。このように女性でも知的障害の原因となることがあるため、性別を問わず、原因不明の知的障害を有する症例では、脆弱X症候群を鑑別疾患として挙げる必要がある。
疫学
FMR1遺伝子のCGG繰り返し配列数伸長について、一般人口での調査が各国で行われているが、その頻度は報告によりばらつきがある。2014年に報告された各国の情報をもとにしたメタ解析の報告によれば、脆弱X症候群(全変異)の出現頻度は男性では7,143人、女性では11,111人に1人とされている[5] 。これまでの調査からFMR1遺伝子のCGGリピート数伸長の頻度には人種差があり、アジアよりも欧米でやや多いと考えられている。日本国内で実施した調査(平成21~23年度難治性疾患克服研究事業)では、男性10,000人に1人の頻度と推定される[1]。これは、知的障害が人口の2.5%とすると、知的障害をもつ男性では250人に1人の頻度で、これは日本での検討結果[6]ともほぼ一致する。
遺伝
原因遺伝子であるFMR1遺伝子の5’非翻訳領域(エクソン1内)にあるCGG繰り返し配列の繰り返し回数は、正常では6から44回、intermediate(中間型)では45から54回、premutation(前変異)では55回から200回、full mutation(全変異)では201回以上を呈し、脆弱X症候群症例は全変異である(図)。現時点では、正常範囲の回数の親から、こどものCGG繰り返し回数が全変異にまで伸長することはないとされ、中間型の回数を有する親からこどもが前変異の回数に、前変異の回数を有する親からこどもが全変異の回数への伸長が生じうると考えられている(表現促進現象)。そのためFMR1遺伝子の解析で全変異が見つかった場合には、母が前変異あるいは全変異を有している。一方、父が前変異を有する場合にも伸長することがあるが、こどもが全変異となる程は伸長しないとされている[7]。
なお、FMR1遺伝子のCGG繰り返し配列中には所々AGG配列があり、このAGG配列の出現頻度が少ない場合に、CGGリピートが伸長しやすいことが知られている[8][9] 。ただし、AGG配列出現頻度によるこどもの繰り返し回数の伸長予測方法としての臨床応用はまだされていない。
中間型の繰り返し回数を有する者に、明らかな臨床症状が出現したとの報告はない。米国での報告では、中間型の繰り返し回数が、次世代で前変異の繰り返し回数になる確率は約14%で[10] 、次世代へ引き継ぐ際に繰り返し回数が伸長しない場合もあるが、伸長するときには、早ければ次々世代(本人にとって孫の世代)で全変異となり、脆弱X症候群の症状を呈する可能性がある。なお、欧米では中間型の繰り返し回数を有する女性の頻度は53人に1人との報告がある[11] 。
病態生理
FMR1遺伝子のCGG繰り返し配列が201回以上の全変異の場合に、伸長したCGG繰り返し回数と近傍のFMR1遺伝子プロモーター領域のCpGアイランドが、過剰なメチル化修飾を受ける。そのためFMR1遺伝子の発現が抑制され、コードするタンパク質であるFMRPを産生できないことが脆弱X症候群の病態生理の中核である。Liuら[12] はこのメチル化を除去することにより、伸長したリピート数を保っていてもFMR1の発現が回復することを、脆弱X症候群のiPS細胞由来神経細胞とCRISPR/Cas9を用いた実験で示している。
FMRPはユビキタスに発現しているが、脳と精巣で比較的強く発現するRNA結合タンパク質である[13] 。FMRPは核内mRNAに結合するが、神経細胞では核内のみならず、樹状突起や樹状突起棘の局所的mRNAと複合体を形成している。この局所的mRNAの翻訳調節は、代謝型グルタミン酸受容体5(mGluR5)からのシグナルが引き金になっており、リン酸化されたFMRPのみがタンパク翻訳に抑制的に働く。mGluR5が刺激されるとFMRPが急速に脱リン酸化され、シナプスの局所的なmRNAの急激な増加を引き起こし、翻訳を活性化させる[14] 。この調節機構にはmTORカスケードが必要であり、最終的にはS6キナーゼがFMRPをリン酸化している。
FMRPは標的mRNAの翻訳を抑制することにより、シナプス機能を維持しているため、脆弱X症候群でFMRPが欠損することでこの機能が失われると、シナプス可塑性に変化をもたらし、知的障害などの症状を呈すると考えられている。シナプスの活動状況によってシナプス伝達の効率が変化するシナプス可塑性は記憶や学習に重要な役割を担っており、シナプス伝達効率が増加する長期増強現象(LTP)や、伝達効率が低下する長期抑制現象(LTD)などの生理的な現象と密接な関係がある。実際にヒト脆弱X症候群患者やFmr1ノックアウトマウスモデルにおいても、シナプス樹状突起棘(スパイン)に異常(数が多い、異常に長く曲がった形)があり、未熟であることが明らかにされており、脆弱X症候群では海馬と小脳のLTDが増強され、大脳や海馬ではLTPに変化を起こすことなど、可塑性の異常が報告されている[1][15] 。
検査
脆弱X症候群の診断には遺伝学的検査が必須であり、染色体検査、サザンブロット法、PCR法などの方法がある。染色体検査ではX染色体長腕末端の脆弱部位を検出するが、CGG繰り返し配列が伸長していても陽性にならない場合がある。また、サザンブロット法はCGGリピートの繰り返し回数だけでなく、伸長したリピートに特有のメチル化の状態も同時に検出できるため、脆弱X症候群の診断としては確実性が高い。しかし、前変異の場合には、は同定が困難となる場合がある。
繰り返し回数の最も簡便な評価方法がPCR法であるが、ターゲットがCGG繰り返し配列というGC含量が極めて高い塩基配列の増幅であるため、脆弱X症候群の遺伝学的検査の標準法として安定した結果を得るためには様々な試行錯誤が必要であった。しかし、近年のPCR法の改良を経て、現在では正常範囲から全変異まで、すべての長さの繰り返し回数を正確に検出する方法が開発されている[16] 。国内では2017年から登録衛生検査所において、この方法を用いた検査が保険診療として実施可能となっている。
診断における留意点として、未診断の知的障害症例においては、次世代シークエンサーを用いた網羅的な遺伝子解析が診断率に大きく貢献しているが、現在主流を占めているショートリードを用いた次世代シークエンサー技術では、脆弱X症候群の原因となるCGG繰り返し配列伸長の同定はできない。同様に染色体検査やマイクロアレイ検査でもリピートの長さは評価できないため、現時点では脆弱X症候群の遺伝学的検査は、PCR法あるいはサザンブロット法で実施する必要がある。
脆弱X症候群関連疾患
FMR1遺伝子の前変異を有する場合、脆弱X症候群関連疾患である脆弱X随伴振戦/失調症候群(FXTAS:Fragile X-associated tremor/ataxia syndrome)や脆弱X関連早期卵巣不全(FXPOI: Fragile X-associated primary ovarian insufficiency)の症状を呈することがある。国内での頻度は不明だが、海外では前変異をもつ人のうち男性で46%、女性では17%で脆弱X随伴振戦/失調症候群の症状を呈し、女性の15〜20%に脆弱X関連早期卵巣不全がみられたことが報告されている[17] 。脆弱X随伴振戦/失調症候群は典型的には50歳以降に出現する進行性の振戦、小脳失調、末梢神経障害、非典型的パーキンソニズム、認知症を特徴とする。検査所見として、頭部MRIでの中小脳脚(middle cerebellar peduncles)の高信号(MCP兆候)が有用とされているが[18] 、FMR1遺伝子のCGG繰り返し回数が前変異の範囲であることを確認する必要がある。一方、脆弱X関連早期卵巣不全は不規則な月経、FSH上昇、妊孕性の低下、早発閉経を来す。
治療
脆弱X症候群は知的障害、自閉症状をきたす単一遺伝子疾患であり、これらの症状に対する治療研究対象疾患として、現時点で確立した治療はないものの、現在も海外では盛んに治療研究が行われている。様々な薬剤の臨床研究の進行については、各ウェブサイトで調べることができる[19]。ここでは、現在も治験が行われている主な候補薬剤を解説する。
代謝型グルタミン酸受容体拮抗薬
神経細胞における局所的mRNAの翻訳調節は、代謝型グルタミン酸受容体5型(mGluR5)からのシグナルが引き金になっており、リン酸化されたFMRPのみがタンパク質翻訳に抑制的に働く。脆弱X症候群ではFMR1の発現が抑制され、FMRPが産生されないため、治療薬の候補としてmGluR5拮抗薬が以前から挙げられている[20] 。
GABA受容体調整薬
GABA経路は抑制系の中枢神経経路で、イオンチャネル型のGABAA受容体と代謝型のGABAB受容体の2つの主な受容体のサブタイプがある。
Fmr1ノックアウトマウスではGABAA受容体が減少していることが知られている[19]。一方、GABAB受容体はシナプス前にあり、GABA放出を調節している。脆弱X症候群のGABABの標的はGABAシステムの抑制機能の増強及び、mGluRの過剰な活動からの入力を減らすことで、GABAB受容体作動薬であるアーバクロフェン(バクロフェンのR異性体)が候補薬として挙げられている。その他に、GABAA、GABAB両方に作用するアカンプロセートの臨床研究が行われている[21] 。
ミノサイクリン
脆弱X症候群では、FMRPの欠如によりマトリックスメタロプロテアーゼ-9(MMP-9)活性が亢進する。この機序は、脆弱X症候群においてPI3K-mTOR経路が活性化されることでeIF4Eのリン酸化が上昇する結果、MMP-9の翻訳レベルが上昇するためである。FMRPはMMP-9の活性亢進を抑制しているが、FMRPが欠損している場合には、MMP-9がmTORシグナル伝達系の経路の活性化を促し、このことが脆弱X症候群でのシナプス形態の変化、行動異常の病態の一つと考えられている[22] 。抗生物質として知られるミノサイクリンはMMP-9活性を低下させる働きを有し、候補薬として挙げられている[23][24] 。
選択的セロトニン再取り込み阻害薬
以前から、セロトニンの機能障害と脆弱X症候群および自閉スペクトラム症との関連が知られている。月齢12から50か月の小児脆弱X症候群を対象に行われた少量の選択的セロトニン再取り込み阻害薬(SSRI)であるセルトラリンを用いた臨床研究では、非投与群に比べて特に言語発達において有意に効果が認められた[25] 。この結果を受けて、2歳から6歳を対象とした52人に対し、ランダム化2相性試験が行われた。この結果では、プラシーボ群に対し、粗大運動、視覚認知、認知機能で有意に効果がみられた[21] 。
ロバスタチン
脆弱X症候群ではRAS-MAPK-ERK1/2経路の障害が関与していると考えられている。高脂血症の治療薬であるロバスタチンは、RAS-MAPK-ERK1/2活性を阻害することが分かっている。Fmr1ノックアウトマウスでの検討では、mGluR関連LTDの正常化、海馬ニューロンによるてんかん原生の阻害などロバスタチンの効果が確認された[26][27] 。平均年齢18歳(18±5歳)、15例の脆弱X症候群に対するロバスタチンの臨床研究が行われ、多動、無気力、社会性などに効果を認めた[28] 。
メトフォルミン
メトフォルミンは2型糖尿病の治療薬として知られているが、2017年に脆弱X症候群モデルマウスでの効果が認められたとの報告がなされた[29] 。作用機序として、亢進したRAS-MAPK-ERK1/2経路およびMMP-9産生の阻害が考えられている。臨床試験の報告が翌年にはなされ、現在も臨床研究が行われている[30] 。
カナビジオール
大麻の有効成分の一つである、カナビジオール(CBD)は神経疾患のみならず、炎症性疾患、自己免疫疾患などに対する効果が報告されている[20] 。現在では抗てんかん作用が最も知られており、Dravet症候群とLennox-Gastaut症候群による難治性てんかんに対する治療薬としてFDAの承認を得ている。カナビジオールジェルを用いた治療が、脆弱X症候群症例の不安障害やその他の行動異常に対する治療薬候補としても挙げられており、2018年の米国神経精神薬理学会(ACNP)でHeusslerらにより発表された第二相の結果を受けて、第三相(NCT03614663)の臨床試験が行われたが、明らかな効果は示されなかった。
上記の他にもビタミンCおよびEを用いた治療に関するもの、ミノサイクリンとロバスタチンを併用するものなど、様々な臨床研究が候補として挙げられている。
おわりに
現在脆弱X症候群の治療研究が非常に活発に行われており、将来的には、これらの成果が日本人脆弱X症候群症例に有益な治療となる可能性が充分にあり、未診断となっている症例の診断を推進し、これらの治療を受けることができる体制を構築することが必要である。このような背景から本邦では2015年に脆弱X症候群(206)ならびに脆弱X症候群関連疾患(205)が指定難病となり、2016年には遺伝学的検査が保険収載された。2017年にレジストリシステムが構築され、登録者数が少しずつ増えている状況である。
参考文献
- ↑ 1.0 1.1 1.2 難波 栄二 (2015).
脆弱X症候群の診断と治療: updateとレビュー. 脳と発達 47:112—116. - ↑
de Vries, B.B., Halley, D.J., Oostra, B.A., & Niermeijer, M.F. (1998).
The fragile X syndrome. Journal of medical genetics, 35(7), 579-89. [PubMed:9678703] [PMC] [WorldCat] [DOI] - ↑
Guruju, M.R., Lavanya, K., Thelma, B.K., Sujatha, M., OmSai, V.R., Nagarathna, V., ..., & Anandaraj, M.P. (2009).
Assessment of a clinical checklist in the diagnosis of fragile X syndrome in India. Journal of clinical neuroscience : official journal of the Neurosurgical Society of Australasia, 16(10), 1305-10. [PubMed:19560928] [WorldCat] [DOI] - ↑ Neri, G. (2017).
The clinical phenotype of the Fragile X syndrome and related disorders. In: Willemsen R, Kooy RF (eds). Fragile X syndrome, 1st edn. Academic Press: Ann Arbor MI.USA, 2017, pp 10 - ↑
Hunter, J., Rivero-Arias, O., Angelov, A., Kim, E., Fotheringham, I., & Leal, J. (2014).
Epidemiology of fragile X syndrome: a systematic review and meta-analysis. American journal of medical genetics. Part A, 164A(7), 1648-58. [PubMed:24700618] [WorldCat] [DOI] - ↑
Nanba, E., Kohno, Y., Matsuda, A., Yano, M., Sato, C., Hashimoto, K., ..., & Maeoka, Y. (1995).
Non-radioactive DNA diagnosis for the fragile X syndrome in mentally retarded Japanese males. Brain & development, 17(5), 317-21; discussion 323-4. [PubMed:8579216] [WorldCat] [DOI] - ↑ FMR1-Related Disorders - GeneReviews® - NCBI Bookshelf. 15th May, 2017.
- ↑
Eichler, E.E., Holden, J.J., Popovich, B.W., Reiss, A.L., Snow, K., Thibodeau, S.N., ..., & Nelson, D.L. (1994).
Length of uninterrupted CGG repeats determines instability in the FMR1 gene. Nature genetics, 8(1), 88-94. [PubMed:7987398] [WorldCat] [DOI] - ↑
Nolin, S.L., Glicksman, A., Ding, X., Ersalesi, N., Brown, W.T., Sherman, S.L., & Dobkin, C. (2011).
Fragile X analysis of 1112 prenatal samples from 1991 to 2010. Prenatal diagnosis, 31(10), 925-31. [PubMed:21717484] [WorldCat] [DOI] - ↑
Yrigollen, C.M., Martorell, L., Durbin-Johnson, B., Naudo, M., Genoves, J., Murgia, A., ..., & Tassone, F. (2014).
AGG interruptions and maternal age affect FMR1 CGG repeat allele stability during transmission. Journal of neurodevelopmental disorders, 6(1), 24. [PubMed:25110527] [PMC] [WorldCat] [DOI] - ↑
Cronister, A., Teicher, J., Rohlfs, E.M., Donnenfeld, A., & Hallam, S. (2008).
Prevalence and instability of fragile X alleles: implications for offering fragile X prenatal diagnosis. Obstetrics and gynecology, 111(3), 596-601. [PubMed:18310361] [WorldCat] [DOI] - ↑
Liu, X.S., Wu, H., Krzisch, M., Wu, X., Graef, J., Muffat, J., ..., & Jaenisch, R. (2018).
Rescue of Fragile X Syndrome Neurons by DNA Methylation Editing of the FMR1 Gene. Cell, 172(5), 979-992.e6. [PubMed:29456084] [PMC] [WorldCat] [DOI] - ↑ 難波 栄二 (2011) 脆弱X症候群の分子機構と治療. 医学のあゆみ 239: 633—638.
- ↑
Ceman, S., O'Donnell, W.T., Reed, M., Patton, S., Pohl, J., & Warren, S.T. (2003).
Phosphorylation influences the translation state of FMRP-associated polyribosomes. Human molecular genetics, 12(24), 3295-305. [PubMed:14570712] [WorldCat] [DOI] - ↑
Huber, K.M., Gallagher, S.M., Warren, S.T., & Bear, M.F. (2002).
Altered synaptic plasticity in a mouse model of fragile X mental retardation. Proceedings of the National Academy of Sciences of the United States of America, 99(11), 7746-50. [PubMed:12032354] [PMC] [WorldCat] [DOI] - ↑
Kwok, Y.K., Wong, K.M., Lo, F.M., Kong, G.W.S., Moore, J.K., Wu, S., ..., & Choy, K.W. (2016).
Validation of a robust PCR-based assay for quantifying fragile X CGG repeats. Clinica chimica acta; international journal of clinical chemistry, 456, 137-143. [PubMed:26947966] [WorldCat] [DOI] - ↑
Rodriguez-Revenga, L., Madrigal, I., Pagonabarraga, J., Xunclà, M., Badenas, C., Kulisevsky, J., ..., & Milà, M. (2009).
Penetrance of FMR1 premutation associated pathologies in fragile X syndrome families. European journal of human genetics : EJHG, 17(10), 1359-62. [PubMed:19367323] [PMC] [WorldCat] [DOI] - ↑
Hagerman, R.J., Leehey, M., Heinrichs, W., Tassone, F., Wilson, R., Hills, J., ..., & Hagerman, P.J. (2001).
Intention tremor, parkinsonism, and generalized brain atrophy in male carriers of fragile X. Neurology, 57(1), 127-30. [PubMed:11445641] [WorldCat] [DOI] - ↑ 19.0 19.1 ClinicalTrials.gov.
- ↑ 20.0 20.1
Protic, D., Salcedo-Arellano, M.J., Dy, J.B., Potter, L.A., & Hagerman, R.J. (2019).
New Targeted Treatments for Fragile X Syndrome. Current pediatric reviews, 15(4), 251-258. [PubMed:31241016] [PMC] [WorldCat] [DOI] - ↑ 21.0 21.1
Ligsay, A., & Hagerman, R.J. (2016).
Review of targeted treatments in fragile X syndrome. Intractable & rare diseases research, 5(3), 158-67. [PubMed:27672538] [PMC] [WorldCat] [DOI] - ↑
Dziembowska, M., & Wlodarczyk, J. (2012).
MMP9: a novel function in synaptic plasticity. The international journal of biochemistry & cell biology, 44(5), 709-13. [PubMed:22326910] [WorldCat] [DOI] - ↑
Utari, A., Chonchaiya, W., Rivera, S.M., Schneider, A., Hagerman, R.J., Faradz, S.M., ..., & Nguyen, D.V. (2010).
Side effects of minocycline treatment in patients with fragile X syndrome and exploration of outcome measures. American journal on intellectual and developmental disabilities, 115(5), 433-43. [PubMed:20687826] [PMC] [WorldCat] [DOI] - ↑
Paribello, C., Tao, L., Folino, A., Berry-Kravis, E., Tranfaglia, M., Ethell, I.M., & Ethell, D.W. (2010).
Open-label add-on treatment trial of minocycline in fragile X syndrome. BMC neurology, 10, 91. [PubMed:20937127] [PMC] [WorldCat] [DOI] - ↑
Winarni, T.I., Schneider, A., Borodyanskara, M., & Hagerman, R.J. (2012).
Early intervention combined with targeted treatment promotes cognitive and behavioral improvements in young children with fragile x syndrome. Case reports in genetics, 2012, 280813. [PubMed:23074686] [PMC] [WorldCat] [DOI] - ↑
Osterweil, E.K., Krueger, D.D., Reinhold, K., & Bear, M.F. (2010).
Hypersensitivity to mGluR5 and ERK1/2 leads to excessive protein synthesis in the hippocampus of a mouse model of fragile X syndrome. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(46), 15616-27. [PubMed:21084617] [PMC] [WorldCat] [DOI] - ↑
Osterweil, E.K., Chuang, S.C., Chubykin, A.A., Sidorov, M., Bianchi, R., Wong, R.K., & Bear, M.F. (2013).
Lovastatin corrects excess protein synthesis and prevents epileptogenesis in a mouse model of fragile X syndrome. Neuron, 77(2), 243-50. [PubMed:23352161] [PMC] [WorldCat] [DOI] - ↑
Çaku, A., Pellerin, D., Bouvier, P., Riou, E., & Corbin, F. (2014).
Effect of lovastatin on behavior in children and adults with fragile X syndrome: an open-label study. American journal of medical genetics. Part A, 164A(11), 2834-42. [PubMed:25258112] [WorldCat] [DOI] - ↑
Gantois, I., Khoutorsky, A., Popic, J., Aguilar-Valles, A., Freemantle, E., Cao, R., ..., & Sonenberg, N. (2017).
Metformin ameliorates core deficits in a mouse model of fragile X syndrome. Nature medicine, 23(6), 674-677. [PubMed:28504725] [WorldCat] [DOI] - ↑
Dy, A.B.C., Tassone, F., Eldeeb, M., Salcedo-Arellano, M.J., Tartaglia, N., & Hagerman, R. (2018).
Metformin as targeted treatment in fragile X syndrome. Clinical genetics, 93(2), 216-222. [PubMed:28436599] [PMC] [WorldCat] [DOI]