恐怖条件づけ
喜田 聡、福島 穂高、稲葉 洋芳
東京農業大学・応用生物科学部・バイオサイエンス学科
DOI:10.14931/bsd.4865 原稿受付日:2014年3月27日 原稿完成日:2014年5月3日 原稿修正日:2014年11月21日
担当編集委員:加藤 忠史(独立行政法人理化学研究所 脳科学総合研究センター)
英語名:fear conditioning 独:Angstkonditionierung 仏:peur conditionnée
動物に音、光、場所(文脈)など、それ自体では恐怖反応を誘導しない条件刺激と、電気ショックなどの恐怖反応を誘導する非条件刺激を提示し続けると、動物は両者の関連を学習し、非条件刺激のみで恐怖反応を示すようになる。これを恐怖条件づけとよび、生物が危険を予測することを学ぶ行動現象であり、動物にとっての一種の防御反応であると考えられている。一方、恐怖条件づけが成立した後に、非条件刺激が提示されない条件下で、条件刺激のみを、繰り返し提示し続けると、条件刺激に対する反応が見られなくなる。これを消去と呼ぶ。恐怖条件づけの獲得、その後の恐怖記憶の形成、貯蔵、そして、想起には扁桃体が中心的な役割を果たすことが明らかにされている。心的外傷後ストレス障害は恐怖記憶制御の異常が関係すると考えられており、恐怖記憶制御の観点からのメカニズムの解明が期待されている。
恐怖条件づけ
ヒトを含めた動物では、恐怖体験の記憶として恐怖記憶が形成(固定化)される。この恐怖記憶の実体は、恐怖を感じさせたこと(例えば、交通事故)を非条件刺激、一方、恐怖体験時の文脈(視覚、聴覚、嗅覚など五感で感じたこと全て)を条件刺激とする恐怖条件づけ記憶である。従って、恐怖体験時の文脈の一部(何れかの条件刺激)に遭遇すると、この条件刺激に反応して、恐怖記憶が想起(思い出)され、恐怖反応が表出される。恐怖条件づけ後に恐怖記憶を保持するためのプロセスが「固定化」である。恐怖記憶は生物が危険を予測することを学ぶ行動現象であり、動物にとっての一種の防御反応であると考えられている[1] [2]。
心理学的実験において、音、光、場所(文脈)など、それ自体では恐怖反応を誘導しない条件刺激(conditioned stimulus; CS)と、電気ショックなどの恐怖反応を誘導する非条件刺激(unconditioned stimulus; US)を提示すると、動物は両者の関連を学習し、恐怖反応を示すようになる。これを恐怖条件づけという。現在までに、恐怖条件づけは、昆虫からヒトに至る多くの動物種において観察されている[3] [4]。これは一種のパブロフ型条件づけである。
通常、条件刺激と非条件刺激が時間的に接近して提示されるが、非条件刺激が提示されない状況で、条件刺激のみが持続的に、または、繰り返し提示され続けると、条件刺激に対する反応が見られなくなる条件づけ反応の「消去」が起こる。恐怖条件づけの消去は、固定化された恐怖記憶が想起された時に誘導されるプロセスである。逆に、条件刺激の提示時間が短い場合には、恐怖記憶想起に伴って恐怖記憶が維持あるいは増強する、再固定化という現象が起きる。このように、恐怖記憶想起後には、恐怖記憶を維持(再固定化)するか、あるいは、消去するかを決定するメカニズムが存在するものと考えられている[5] [6] [7]。
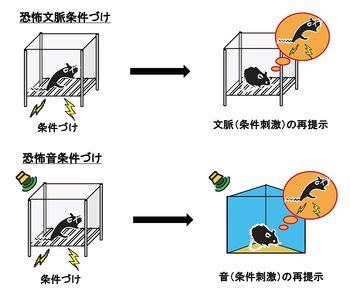
恐怖文脈条件づけでは(上段)、チャンバー(文脈)が条件刺激、電気ショックが非条件刺激となる。一方、恐怖音条件づけでは(下段)、ブザー音が条件刺激となる。
げっ歯類における恐怖条件づけ
恐怖文脈条件づけ
床に電線を敷いた小箱(チャンバー;文脈)の中で、軽い電流を数秒間流す電気ショックをマウス(あるいはラット)に与える。この場合には、場所を含めた状況(文脈)を条件刺激、一方、電気ショックによる恐怖を非条件刺激とする恐怖文脈条件づけが行われる(図1上)。条件づけが成立したか否かは、恐怖文脈条件づけの場合、電気ショックを与えたチャンバーにマウスを再び戻して、マウスの恐怖反応である、身動き一つ取らない「すくみ(恐怖)反応」を測定して評価する。恐怖文脈条件づけが成立していれば、チャンバーに3−5分程度戻した際に、すくみ反応を示す時間が長くなる。また、恐怖増強驚愕や心拍数も恐怖反応の指標として用いられる[8] [9]。
恐怖音条件づけ
チャンバーの中で電気ショックを与える際に、大きな音量のブザー音を30秒程度鳴らして、ブサー音の終了間際に1~2秒間の電気ショックを与えれば、ブザー音を条件刺激とする恐怖音条件づけとなる(図1下)。この場合、電気ショックを与えた時とは異なるチャンバーにマウスを入れ、条件刺激であるブザー音を提示した時のすくみ反応を測定する。恐怖音条件づけの場合、一度だけ電気ショックとブザー音の組み合わせ(ペアリング)を与えるのが一般的である。
痕跡恐怖音条件づけ
恐怖音条件づけの重要な点として、たった一度だけのペアリングで、音と電気ショックの関連づけルールを選択的に学習できるわけではなく、あくまでも、場所や音を含めて恐怖を与えられた状況(文脈)を記憶しており、条件刺激の一つである「音」が提示されると、音を手がかり(cue)にして恐怖反応を表出しているに過ぎない。音と電気ショックの関連づけを選択的に学習させるには、このペアリングを何度も繰り返し提示する必要がある。これを痕跡恐怖音条件づけという。
ヒトにおける恐怖条件づけ
ヒトにおける最初の恐怖条件づけの実験は、心理学者ジョン・ワトソンが1920年に行ったリトルアルバートの実験である[10]。この実験では、生後11ヶ月の乳児(アルバート)に対して、白ネズミを条件刺激、一方、乳児を恐がらせるに十分な、ハンマーで鋼鉄の棒を叩くことによる大音量の音を非条件刺激とする恐怖条件づけに成功した[10]。まず、アルバートが白ネズミを怖がっていない(アルバートにとって白ネズミが恐怖を感じさせる非条件刺激ではない)ことを確認した。この条件下で、アルバートがネズミを触ろうとする時に、背後においてハンマーで鋼鉄の棒を叩いて大きな音をたてた。このような、白ネズミ(条件刺激)と大きな音(非条件刺激)との提示を何度か行った結果、アルバートは白ネズミと音の提示に反応して泣き出すようになった(恐怖反応を示した)。さらに、ついには、アルバートは白ネズミ(条件刺激)を見せられるだけで、泣き出すようになった。興味深いことに、白ネズミによる恐怖条件づけ成立後には、アルバートはウサギ、犬、毛皮のコートなど、白ネズミを連想させるものを見せられても、泣き出した。このような実験結果は、恐怖条件づけのみならず、強い恐怖条件づけ後に観察される条件刺激の普遍化(generalization)を示唆していると言えよう。
ヒトにおける実験的な恐怖条件づけの場合、例えば、コンピューターの画面上にある模様が出てきた時に腕に軽い電気ショックを与え、条件刺激(模様)と非条件刺激(電気ショックによる恐怖)との関連性を条件づけする[11]。恐怖反応の評価としては、皮膚電気伝導度を中心に、口頭報告や脳画像解析、筋電図検査を介した筋肉応答の変化も用いられる[4] [11] [12] [13]。
消去
消去は1927年にパブロフによって指摘された現象であり、後に、フロイトによって「馴化(habituation)」とも呼ばれていた。現在では、「消去(extinction)」と呼ぶのが一般的であり、心理学的のみならず、神経生物学的な研究の対象となっている。
恐怖条件づけが成立した後に、非条件刺激が提示されない条件下で、条件刺激のみを持続的に、または、繰り返し提示し続けると、条件刺激に対する反応が見られなくなる。例えば、恐怖音条件づけ及び恐怖文脈条件づけの場合、条件刺激である音を提示し続ける、あるいは、電気ショックを与えたチャンバーに長時間戻す場合に、条件刺激から表出される恐怖反応が観察されなくなる。このような現象が消去であり、条件刺激に対して反応する必要がないことを新たに学習することである。
消去を説明する上で、重要な点は、消去学習が進行しても、条件づけそのもの(条件づけ記憶)が失われるわけではないことである。消去学習から長期間経過後に、条件刺激を提示すると再び条件反射が現れる(spontaneous recovery)[5] [14]。また、消去学習後に恐怖条件づけが成立しないような弱い非条件刺激を与えても、条件刺激に対する条件反射が復活する(reinstatement)[5] [15]。さらに、恐怖音条件づけを例にすると、ある文脈(電気ショックを受けたものとは異なるチャンバー)において、音を提示し続けて消去を誘導しても、さらに異なる文脈(別のチャンバーや電気ショックを受けたチャンバー)において音を提示すると、恐怖反応が再び表出する(renewal)[5] [16]。以上のような観察から、消去学習後にも、条件づけは保持されていることが示されている。
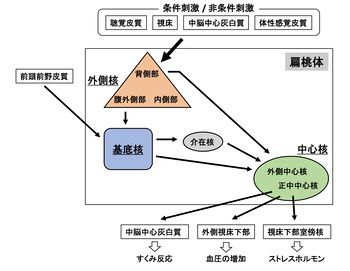
げっ歯類を用いた解析に基づいた扁桃体内神経回路図。恐怖条件づけを制御する投射経路を黒矢印で示した[17]。
恐怖条件づけを制御する脳領野
薬理学的解析や損傷実験により、恐怖条件づけの獲得、その後の恐怖記憶の形成、貯蔵、そして、想起には扁桃体が中心的な役割を果たすことが明らかにされている[18] [19] [20]。一方、恐怖文脈条件づけには、海馬機能も必須であることが明らかにされている[21]。このような研究を通して、恐怖音条件づけは扁桃体、一方、恐怖文脈条件づけは扁桃体と海馬の両方を責任領野とすることが示されている[22]。ヒトにおいても、げっ歯類と同様に、恐怖条件づけには扁桃体が重要であることも観察されている[23]。
消去には前頭前野皮質と扁桃体が中心的な役割を担っており、海馬も、その制御に重要な役割を果たすことが明らかとなっている[5] [24]。
扁桃体外側核(Lateral Amygdala; LA)は聴覚皮質(Auditory cortex)、聴覚視床 (Auditory thalamus)などから入力を受け、皮質や視床と扁桃体との間のインターフェイス的な役割を果たしていると考えられている。特に重要な点として、外側核の興奮性ニューロンが恐怖音条件づけの記憶回路(記憶痕跡)に参入していること、条件づけ後に神経可塑的変化が誘導されることも明らかにされており、恐怖条件づけの獲得やその記憶の保持に重要な役割を果たすことが実証されている[25] [26] [27]。なかでも扁桃体内中心核は恐怖条件づけにおける恐怖反応の表出を制御することが明らかにされている。中心核は、外側核からの直接経路と、外側核から基底核(Basal nucleus; BA)を経由する間接経路により制御を受ける。最近の解析から、中心核も、視床からの直接的な入力を受けていることが示唆されており、恐怖条件づけの獲得と固定化に必要であることも明らかになりつつある[28] [17] [29]。中心核もいくつかの領域に分類され、中でも、正中中心核(Centromedian nucleus; CeM)はこれまで中心核の役割と考えられてきた恐怖反応を表出する役割を果たす。一方、外側中心核(Central lateral nucleus; CeL)は、GABA産生介在ニューロンを中心に構成され、正中中心核を持続的に抑制しているものの、この抑制の解除により、恐怖条件づけの条件刺激に対する恐怖反応が誘起される[17] [30]。中心核からの直接的な投射先として、外側視床下部と中脳中心灰白質が同定されており、これらの投射を介して血圧の増加やすくみ反応などの恐怖反応の表出がそれぞれ引き起こされる[31] [32] [33]。
扁桃体基底核(BA)は外側核からの投射を受け、この入力によって、直接的に、また、扁桃体の介在核ニューロンを介して間接的に中心核を制御する[17] [30]。さらに、基底核は前頭前野皮質からも投射を受けており、この入力によって、恐怖条件づけの消去を制御する[34]。重要な点として、基底核には恐怖条件づけによる恐怖反応発現時に興奮する「恐怖ニューロン(fear neuron)」と消去発現時に興奮する「消去ニューロン(extinction neuron)」が存在することが明らかにされ、これらのニューロン群が前頭前野皮質と連携して、恐怖条件づけの獲得や表出を正負に制御していると考えられる[35]。
恐怖条件づけと心的外傷後ストレス障害
心的外傷後ストレス障害 (post-traumatic stress disorder, PTSD)は、恐怖記憶を原因とする精神疾患である。PTSD発症には恐怖記憶制御の異常が関係すると考えられており、恐怖記憶制御の観点から、PTSD発症のメカニズムの解明が期待されている[17] [36]。また、現在、PTSDの有効な治療法として認知行動療法「持続エクスポージャー療法」が知られている。この持続エクスポージャー療法は、恐怖体験の記憶を繰り返し語ることを主体とする治療法であり、この治療方法の生物学的基盤は恐怖記憶消去であると認識されている。そこで、恐怖条件づけ記憶の獲得、固定化、消去や再固定化のメカニズムに基づいて、持続エクスポージャー療法を迅速化する試みも行われている[37] [38] [39] [40]。
関連項目
参考文献
- ↑
Maren, S. (2001).
Neurobiology of Pavlovian fear conditioning. Annual review of neuroscience, 24, 897-931. [PubMed:11520922] [WorldCat] [DOI] - ↑ 喜田 聡
化学と生物
2013, 51, 81-89. - ↑
Tully, T., & Quinn, W.G. (1985).
Classical conditioning and retention in normal and mutant Drosophila melanogaster. Journal of comparative physiology. A, Sensory, neural, and behavioral physiology, 157(2), 263-77. [PubMed:3939242] [DOI] - ↑ 4.0 4.1
Knight, D.C., Smith, C.N., Cheng, D.T., Stein, E.A., & Helmstetter, F.J. (2004).
Amygdala and hippocampal activity during acquisition and extinction of human fear conditioning. Cognitive, affective & behavioral neuroscience, 4(3), 317-25. [PubMed:15535167] [WorldCat] - ↑ 5.0 5.1 5.2 5.3 5.4
Myers, K.M., & Davis, M. (2007).
Mechanisms of fear extinction. Molecular psychiatry, 12(2), 120-50. [PubMed:17160066] [WorldCat] [DOI] - ↑
Nader, K., Schafe, G.E., & Le Doux, J.E. (2000).
Fear memories require protein synthesis in the amygdala for reconsolidation after retrieval. Nature, 406(6797), 722-6. [PubMed:10963596] [WorldCat] [DOI] - ↑
Suzuki, A., Josselyn, S.A., Frankland, P.W., Masushige, S., Silva, A.J., & Kida, S. (2004).
Memory reconsolidation and extinction have distinct temporal and biochemical signatures. The Journal of neuroscience : the official journal of the Society for Neuroscience, 24(20), 4787-95. [PubMed:15152039] [PMC] [WorldCat] [DOI] - ↑
Miserendino, M.J., Sananes, C.B., Melia, K.R., & Davis, M. (1990).
Blocking of acquisition but not expression of conditioned fear-potentiated startle by NMDA antagonists in the amygdala. Nature, 345(6277), 716-8. [PubMed:1972778] [WorldCat] [DOI] - ↑
Stiedl, O., & Spiess, J. (1997).
Effect of tone-dependent fear conditioning on heart rate and behavior of C57BL/6N mice. Behavioral neuroscience, 111(4), 703-11. [PubMed:9267648] [WorldCat] [DOI] - ↑ 10.0 10.1 Watson, J.B. and Rayner, R.
Conditioned emotional reactions.
Journal of Experimental Psychology: 1920, 3, 1–14. - ↑ 11.0 11.1
Schiller, D., Monfils, M.H., Raio, C.M., Johnson, D.C., Ledoux, J.E., & Phelps, E.A. (2010).
Preventing the return of fear in humans using reconsolidation update mechanisms. Nature, 463(7277), 49-53. [PubMed:20010606] [PMC] [WorldCat] [DOI] - ↑
Lissek, S., Levenson, J., Biggs, A.L., Johnson, L.L., Ameli, R., Pine, D.S., & Grillon, C. (2008).
Elevated fear conditioning to socially relevant unconditioned stimuli in social anxiety disorder. The American journal of psychiatry, 165(1), 124-32. [PubMed:18006874] [PMC] [WorldCat] [DOI] - ↑
Vansteenwegen, D., Crombez, G., Baeyens, F., & Eelen, P. (1998).
Extinction in fear conditioning: effects on startle modulation and evaluative self-reports. Psychophysiology, 35(6), 729-36. [PubMed:9844434] [WorldCat] - ↑
Quirk, G.J. (2002).
Memory for extinction of conditioned fear is long-lasting and persists following spontaneous recovery. Learning & memory (Cold Spring Harbor, N.Y.), 9(6), 402-7. [PubMed:12464700] [PMC] [WorldCat] [DOI] - ↑
Westbrook, R.F., Iordanova, M., McNally, G., Richardson, R., & Harris, J.A. (2002).
Reinstatement of fear to an extinguished conditioned stimulus: two roles for context. Journal of experimental psychology. Animal behavior processes, 28(1), 97-110. [PubMed:11868238] [WorldCat] - ↑
Bouton, M.E., García-Gutiérrez, A., Zilski, J., & Moody, E.W. (2006).
Extinction in multiple contexts does not necessarily make extinction less vulnerable to relapse. Behaviour research and therapy, 44(7), 983-94. [PubMed:16198302] [WorldCat] [DOI] - ↑ 17.0 17.1 17.2 17.3 17.4
Johansen, J.P., Cain, C.K., Ostroff, L.E., & LeDoux, J.E. (2011).
Molecular mechanisms of fear learning and memory. Cell, 147(3), 509-24. [PubMed:22036561] [PMC] [WorldCat] [DOI] - ↑
Hitchcock, J., & Davis, M. (1986).
Lesions of the amygdala, but not of the cerebellum or red nucleus, block conditioned fear as measured with the potentiated startle paradigm. Behavioral neuroscience, 100(1), 11-22. [PubMed:3954873] [WorldCat] [DOI] - ↑
Muller, J., Corodimas, K.P., Fridel, Z., & LeDoux, J.E. (1997).
Functional inactivation of the lateral and basal nuclei of the amygdala by muscimol infusion prevents fear conditioning to an explicit conditioned stimulus and to contextual stimuli. Behavioral neuroscience, 111(4), 683-91. [PubMed:9267646] [WorldCat] [DOI] - ↑
Davis, M. (1992).
The role of the amygdala in fear and anxiety. Annual review of neuroscience, 15, 353-75. [PubMed:1575447] [WorldCat] [DOI] - ↑
Anagnostaras, S.G., Gale, G.D., & Fanselow, M.S. (2001).
Hippocampus and contextual fear conditioning: recent controversies and advances. Hippocampus, 11(1), 8-17. [PubMed:11261775] [WorldCat] [DOI] - ↑
Phillips, R.G., & LeDoux, J.E. (1992).
Differential contribution of amygdala and hippocampus to cued and contextual fear conditioning. Behavioral neuroscience, 106(2), 274-85. [PubMed:1590953] [WorldCat] [DOI] - ↑
LaBar, K.S., Gatenby, J.C., Gore, J.C., LeDoux, J.E., & Phelps, E.A. (1998).
Human amygdala activation during conditioned fear acquisition and extinction: a mixed-trial fMRI study. Neuron, 20(5), 937-45. [PubMed:9620698] [WorldCat] [DOI] - ↑
Milad, M.R., & Quirk, G.J. (2002).
Neurons in medial prefrontal cortex signal memory for fear extinction. Nature, 420(6911), 70-4. [PubMed:12422216] [WorldCat] [DOI] - ↑
Reijmers, L.G., Perkins, B.L., Matsuo, N., & Mayford, M. (2007).
Localization of a stable neural correlate of associative memory. Science (New York, N.Y.), 317(5842), 1230-3. [PubMed:17761885] [WorldCat] [DOI] - ↑
Han, J.H., Kushner, S.A., Yiu, A.P., Cole, C.J., Matynia, A., Brown, R.A., ..., & Josselyn, S.A. (2007).
Neuronal competition and selection during memory formation. Science (New York, N.Y.), 316(5823), 457-60. [PubMed:17446403] [WorldCat] [DOI] - ↑
Blair, H.T., Schafe, G.E., Bauer, E.P., Rodrigues, S.M., & LeDoux, J.E. (2001).
Synaptic plasticity in the lateral amygdala: a cellular hypothesis of fear conditioning. Learning & memory (Cold Spring Harbor, N.Y.), 8(5), 229-42. [PubMed:11584069] [WorldCat] [DOI] - ↑
Wilensky, A.E., Schafe, G.E., Kristensen, M.P., & LeDoux, J.E. (2006).
Rethinking the fear circuit: the central nucleus of the amygdala is required for the acquisition, consolidation, and expression of Pavlovian fear conditioning. The Journal of neuroscience : the official journal of the Society for Neuroscience, 26(48), 12387-96. [PubMed:17135400] [PMC] [WorldCat] [DOI] - ↑
Ciocchi, S., Herry, C., Grenier, F., Wolff, S.B., Letzkus, J.J., Vlachos, I., ..., & Lüthi, A. (2010).
Encoding of conditioned fear in central amygdala inhibitory circuits. Nature, 468(7321), 277-82. [PubMed:21068837] [WorldCat] [DOI] - ↑ 30.0 30.1
Ehrlich, I., Humeau, Y., Grenier, F., Ciocchi, S., Herry, C., & Lüthi, A. (2009).
Amygdala inhibitory circuits and the control of fear memory. Neuron, 62(6), 757-71. [PubMed:19555645] [WorldCat] [DOI] - ↑
LeDoux, J.E., Iwata, J., Cicchetti, P., & Reis, D.J. (1988).
Different projections of the central amygdaloid nucleus mediate autonomic and behavioral correlates of conditioned fear. The Journal of neuroscience : the official journal of the Society for Neuroscience, 8(7), 2517-29. [PubMed:2854842] [WorldCat] - ↑
Kim, J.J., Rison, R.A., & Fanselow, M.S. (1993).
Effects of amygdala, hippocampus, and periaqueductal gray lesions on short- and long-term contextual fear. Behavioral neuroscience, 107(6), 1093-8. [PubMed:8136063] [WorldCat] [DOI] - ↑
Beitz, A.J. (1982).
The organization of afferent projections to the midbrain periaqueductal gray of the rat. Neuroscience, 7(1), 133-59. [PubMed:7078723] [WorldCat] [DOI] - ↑
Amano, T., Unal, C.T., & Paré, D. (2010).
Synaptic correlates of fear extinction in the amygdala. Nature neuroscience, 13(4), 489-94. [PubMed:20208529] [PMC] [WorldCat] [DOI] - ↑
Herry, C., Ciocchi, S., Senn, V., Demmou, L., Müller, C., & Lüthi, A. (2008).
Switching on and off fear by distinct neuronal circuits. Nature, 454(7204), 600-6. [PubMed:18615015] [WorldCat] [DOI] - ↑
Johnson, L.R., McGuire, J., Lazarus, R., & Palmer, A.A. (2012).
Pavlovian fear memory circuits and phenotype models of PTSD. Neuropharmacology, 62(2), 638-46. [PubMed:21782833] [WorldCat] [DOI] - ↑
Rauch, S.L., Shin, L.M., & Phelps, E.A. (2006).
Neurocircuitry models of posttraumatic stress disorder and extinction: human neuroimaging research--past, present, and future. Biological psychiatry, 60(4), 376-82. [PubMed:16919525] [WorldCat] [DOI] - ↑
Debiec, J., & LeDoux, J.E. (2006).
Noradrenergic signaling in the amygdala contributes to the reconsolidation of fear memory: treatment implications for PTSD. Annals of the New York Academy of Sciences, 1071, 521-4. [PubMed:16891611] [WorldCat] [DOI] - ↑
Richardson, R., Ledgerwood, L., & Cranney, J. (2004).
Facilitation of fear extinction by D-cycloserine: theoretical and clinical implications. Learning & memory (Cold Spring Harbor, N.Y.), 11(5), 510-6. [PubMed:15466301] [WorldCat] [DOI] - ↑
Brunet, A., Orr, S.P., Tremblay, J., Robertson, K., Nader, K., & Pitman, R.K. (2008).
Effect of post-retrieval propranolol on psychophysiologic responding during subsequent script-driven traumatic imagery in post-traumatic stress disorder. Journal of psychiatric research, 42(6), 503-6. [PubMed:17588604] [WorldCat] [DOI]