「標的認識」の版間の差分
Takeshisakurai (トーク | 投稿記録) 細編集の要約なし |
細編集の要約なし |
||
| (3人の利用者による、間の77版が非表示) | |||
| 1行目: | 1行目: | ||
<div align="right"> | |||
<font size="+1">[http://researchmap.jp/sakurai-2-takeshi/ 櫻井 武]</font><br> | |||
''京都大学大学院医学研究科メディカルイノベーションセンター''<br> | |||
DOI:<selfdoi /> 原稿受付日:2012年4月10日 原稿完成日:2012年8月4日<br> | |||
担当編集委員:[http://researchmap.jp/noriko1128 大隅 典子](東北大学 大学院医学系研究科 附属創生応用医学研究センター 脳神経科学コアセンター 発生発達神経科学分野)<br> | |||
</div> | |||
英語名: target recognition | |||
[[Image:辞典01.jpg|thumb|250px|<b>図1.登上線維の小脳への投射</b><br />延髄の下オリーブ核は軸索を小脳に投射する。軸索は橋の背部で小脳に入り、そこから小脳皮質に投射する。小脳皮質ではいくつかの細胞の中でプルキンエ細胞に特異的なシナプスを形成する。その特徴的な形態により、この軸索は登上線維とよばれるが、この形態はラモニイカハールによってもその著書の中で描写されている。]] | |||
[[Image:辞典02.jpg|thumb|250px|<b>図2.化学親和説</b><br />ニワトリの系において網膜の神経節細胞は視蓋にその軸索を投射する。その時に、網膜の鼻側にある細胞は視蓋の後側に、耳側にある細胞は視蓋の前側に軸索を送る。このトポグラフィックな投射は、視蓋に[[前後軸]]に沿ってグレディエントを形成してエフリンAが発現し、その受容体であるEphAが網膜の神経節細胞において内外軸に沿ってグレディエントを形成して発現していて、その両者の相互作用によってできる。]] | |||
{{box|text= | |||
正常に脳が機能するにはそれを支える[[神経細胞]]群が[[シナプス]]結合によって回路を形成し、回路に入力してきた情報を的確に処理し、出力に変える必要がある。こういった神経回路は脳内のワイヤリングの過程により形成されるが、そのワイヤリングにおいて神経回路が「正しく」形成されるには特異的にシナプスが形成される必要がある。この過程を標的認識という。標識認識ためには神経細胞の[[軸索]]が正しい脳内の領域に到着する必要があり、その領域内にある神経細胞の中から正しい神経細胞を認識し、その細胞上の正しい細胞内のコンパートメント([[樹状突起]]の一部)にシナプスを形成する必要がある。また、この場合、ある線維とある細胞がランダムではなく特異的な結合を果たし、特異的な情報(トポグラフィックカルな情報)を伝達しなければならない。このためには、これらのそれぞれの過程で特異的な標的認識を行う認識分子(recognition molecule)が関与していると考えられる。 | |||
}} | |||
== 標的認識とは == | |||
正常に脳が機能するにはそれを支える[[神経細胞]]群が[[シナプス]]結合によって回路を形成し、回路に入力してきた情報を的確に処理し、出力に変える必要がある。こういった神経回路は脳内のワイヤリングの過程により形成されるが、そのワイヤリングにおいて神経回路が「正しく」形成されるにはシナプス形成の過程で特異的な標的認識が行われる必要がある。そのためには神経細胞の軸索(例えば[[延髄]]の[[下オリーブ核]]の神経細胞の軸索である[[登上線維]])が(途中、延髄で正中線を越えて対側にはいり、その後、背外側の縁を上行し、[[小脳脚]]を経て)正しい脳内の領域(小脳)に到着する必要があり、その領域内([[小脳皮質]])にある神経細胞の中から正しい神経細胞([[プルキンエ細胞]])を認識し、その細胞上の正しい細胞内のコンパートメント(樹状突起の一部)にシナプスを形成する必要がある。また、この場合、ある線維とある細胞がランダムではなく特異的な結合を果たし、特異的な情報(トポグラフィックカルな情報)を伝達しなければならない(そのうえ1つのプルキンエ細胞は一本の登上線維と結合し、幾つもの登上線維とは結合しない)(図1)。このためには、これらのそれぞれの過程で特異的な標的認識を行う認識分子(recognition molecule)が関与していると考えられる。 | |||
標的認識は主に[[神経発生]]における2つの過程で起こる可能性があるが、ここでは主に[[シナプス形成]]における標的認識を例にその概念を説明し、[[軸索ガイダンス]]における中間標的の認識については軸索ガイダンスの項及び、[[ガイドポスト細胞]]の項を参照のこと。 | |||
== 歴史的な考察 == | |||
[[wj:サンティアゴ・ラモン・イ・カハール|Santiago Ramon y Cajal]]が前世紀の初頭にその詳細な組織学的解析から、神経の突起が周りにあるシグナルを選択的に感知しながら目的地へ進んでいるのではないかと推測し、[[wj:走化性|走化性]]に似た現象が神経系の形成に重要なのではないかと提唱していた。それに対して主に[[末梢神経]]の再生の実験結果から1920年代から30年代には[[wj:ポール・ワイス|Paul A Weiss]]らによる、神経系の線維の結合は主に物理的な制約で決定され、その結合は決して特異的なものではなくランダムであり、その後にその回路を使用する事によって、その使われた特定の回路が最終的に残るという説が主流を占めていた。 | |||
その説に対してWeissの学生であった[[w:Roger Sperry|Roger Sperry]]は40年代から50年代にわたって行った彼の一連の[[wj:カエル|カエル]]や[[wj:イモリ|イモリ]]といった動物の眼を使った神経再生の実験により、神経の回路形成にはやはり選択性が存在し、その機構について[[化学親和説]]を提唱した<ref><pubmed>14077501</pubmed></ref>。 | |||
この化学親和説には2つの概念が含まれており、1つは神経細胞はそれぞれの細胞、線維におそらく化学物質からなる個々を認識するタグがついており、これによってお互いを区別して、その化学親和性で神経細胞はおそらく一個の細胞のレベルで特異的な神経結合を作る事ができるというもので、もう1つは特に[[視覚]]系で明らかであるが、その線維投射のパターンが規則正しく、[[トポグラフィック]]であることから、少数の[[モルフォゲン]]の様な濃度勾配を形成するような分子群がこの化学親和性を担う物質として機能するというものである(図2)。化学親和説については激しい論争があったが、やがて分子レベルでの解析、また数理モデル等に支えられ、神経発生の分野で一般に受け入れられる概念となり、現在の標的認識の概念は基本的にこの化学親和説の流れを汲んでいる。 | |||
[[Image:辞典03.jpg|thumb|250px|<b>図3 標的認識の特異性</b><br />神経系において皮質構造をなすところXやYがあり、また、核構造をなすZがあるとする。その中のYに投射しX、Zには投射しない軸索は神経系の様々なところから来るとする(A、B、C)。そして、この線維はYの中のある特定の細胞(薄緑色の細胞群)にシナプスを形成し、その場合、Aは樹状突起の遠位側に、Bは樹状突起の近位側に、Cは細胞体にそれぞれシナプスを形成するとする。こういった場合、それぞれの過程で特異的な標的認識が必要となる。<br>SanesとYamagata<ref><pubmed> 19575668 </pubmed></ref>による図を改変。]] | |||
== シナプス形成の特異性とその分子機構 == | |||
シナプス形成をはじめとする標的認識においては2つのレベルでの特異性が必要となる。神経細胞が機能を果たすには、ある神経細胞は特異的な神経細胞と結合し、神経回路を形成する必要があり(例えば、下オリーブ核の線維はプルキンエ細胞に、[[橋核]]の線維は[[顆粒細胞]]に、顆粒細胞の線維はプルキンエ細胞に)、このレベルでの標的認識の特異性(細胞種のレベル)がまず必要となる。 | |||
また、同じ細胞群の中である特異的な細胞と結合する必要がある。例えば位置情報が重要な場合はトポグラフィカルな結合を果たす必要がある。また、情報処理において、同じ情報は同じ脳内での部位にいく必要がある。例えば[[嗅覚]]において[[嗅上皮]]内の同じ[[嗅覚受容体]]からの線維は[[嗅球]]内の同じ[[糸球体]]につながる必要がある。また、視覚において、同側と対側の眼で捉えられた[[視覚野]]の同じ情報は最終的に視覚野の同じ位置につながる必要がある。したがって、同じ細胞集団の中でも特異的に個々の細胞を認識する必要があり、このレベルでの標的認識の特異性(個々の細胞レベル)も必要となる。 | |||
上記の様にシナプス形成には様々な過程が必要であり、その中で特異性をサポートする必要がある<ref><pubmed>11733797</pubmed></ref>。その分子機構がどうなっているかについては完全には明らかにされていない。個々の細胞レベルでの特異性は鍵と鍵穴のような認識分子があり、それが無数に存在することで達成されるのではないかという様に提唱はされているが、それを支えることができるほどの多様性のある分子としては[[Dscam]]、[[ニューレキシン]]と[[プロトカドヘリン]]しか存在しないし、こういった分子が本当にその多様性でこういった特異的な標的認識を担っているかどうかについてはまだ証明はされていない(以下のChemoaffinity revisitedを参照の事)。一つの分子ではなく、幾つかの分子の組み合わせでそういった多様性が生み出されるという説もある。 | |||
但し、最近の報告では、標的の領域にたどり着くのにはある分子機構が必要であるが、そのあとの正しい細胞を見つけるのはどこの位置に正しい細胞があるかによって形成されるという例もあり、その場合、位置を変えるとつなぎ替えがおこってしまうことも報告されている<ref><pubmed>22078502</pubmed></ref>。したがって、一個の細胞レベルで区別する様な機構は存在しないのかもしれない。 | |||
== Chemoaffinity revisited == | |||
上記のようなタイトルのレビューが2010年のCellにでた<ref><pubmed>21029858</pubmed></ref>。内容は、Dscamやプロトカドヘリンの様な分子は多様性をもつので、化学親和説で特異性を担う分子タグとして機能しているかもしれないという様に考えられていたが、実はこれらの分子は特異的な相互作用を担う分子タグではなく、自己と他者を見分けるためのタグとして使われているのではないかという内容のレビューである。従って、Sperryの仮想した多様な特異性を担う分子は存在しないということを意味する訳ではなく、Dscamやプロトカドヘリンといった分子はその役割を果たしていないのではないかということである。ただし、彼らは鍵と鍵穴のような多様な分子は実際は必要ないのではないかとも述べている。 | |||
== 標的認識に関与する分子機構 == | |||
[[Image:辞典04.jpg|thumb|250px|<b>図4.ショウジョウバエの眼における軸索の投射</b><br />ショウジョウバエの眼では8つの細胞からなる神経細胞のユニットが整然と配置されていて、これによって視覚が担われている。その8つの細胞にはR1-8とそれぞれ名前がつけられているが、R1-6はラミナで中継ニューロンにシナプスを形成するのに対し、R7、R8はメダラに軸索を投射し、そこでシナプスを形成する。R1-6の中継ニューロンは(L: lamina neuron)やはりメダラに投射するが、そのシナプスを形成する層がR7,R8のシナプスが形成される層とは異なる。TM, TMY: tangential medulla neurons, DM: distal medulla intrinsic neurons, これらは中継ニューロンでそれぞれ異なる視覚情報を中枢へ伝える。<br>SanesとZipursky<ref name=Sanes_Zipursky />による図を改変]] | |||
いずれにしても分子機構としては、まず、目的の領域に達する機構(様々な軸索ガイダンスの機構)、そして領域内のどこに到着するかを決定する機構(おそらく神経伸長促進因子か抑制性因子とその受容体の発現レベルによって形成される)、そして特異的な細胞集団を見つける機構(おそらく[[細胞接着因子]]及び抑制因子)、そして細胞内の特異的なコンパートメントを見つける機構(おそらく細胞接着因子及び抑制因子)が必要である(図3)。 この過程で特異性は、それぞれの神経細胞において、標示されているシグナルに対する受容体の発現の変化、発現されている受容体の組み合わせの変化、また、受容体の下流のシグナル系路の変化によって、それぞれのシグナルへの応答性が変わることによって形成されると考えられる。詳細な分子機構については軸索ガイダンスの項を参照のこと。 | |||
== 各論 == | |||
ここではごく限られた例につき、簡単に述べることにする。詳しくはそれぞれの文献を参照のこと。 | |||
=== ショウジョウバエ === | |||
[[Image:辞典05.jpg|thumb|250px|<b>図5.ショウジョウバエの体節筋への神経細胞の投射</b><br />ショウジョウバエの体節筋はステレオティピックな形態を示す<!--IWLINK 40-->のセットからなる。それぞれの筋に投射する神経細胞(RP1, 2, 3, 4, 5a, 6/7b, 8a, aCC)は神経管内に存在しそこから軸索を伸長するが、軸索は途中特異的な神経束を形成し(赤丸)、また途中の様々な特定の部位で(赤丸)束から分かれてそれぞれの特異的な標的である筋肉に投射する。それぞれの特定の部位で様々な分子機構が関与している事が明らかにされつつある。<br>Keshishianら<ref name=Keshishian />による図を改変]] | |||
[[ショウジョウバエ]]の眼は8つの神経細胞(R1-R8)からなる単位の集合体として存在し、これらは高次視覚野である[[ラミナ]](lamina)、[[メダラ]](medulla)に線維を送るが、R1-R6、R7、R8の軸索はそれぞれシナプスを形成する標的が異なる(Rubinら、Zipurskyら)(図4)。この分子機構としては、 カドヘリン、プロトカドヘリンや[[受容体型チロシンフォスファターゼ]]、[[チロシンキナーゼ]]等が関与している事が示されている。また、標的野における[[グリア細胞]]の存在や標的に達するまでの軸索—軸索相互作用がこういった標的認識に重要である事も示されている<ref name=Sanes_Zipursky><pubmed>20399726</pubmed></ref>。 | |||
ショウジョウバエの体節の筋群はステレオティピックな配置をしており、それへの神経支配は[[神経管]]に存在する[[運動神経]]細胞からの線維が行う。この筋群への運動神経の標的認識の系は特異的な標的認識の機構を探る系として研究されてきた(図5)<ref name=Keshishian><pubmed>8833454</pubmed></ref>。この過程には様々な軸索ガイダンスに関わる分子や神経細胞接着因子等が関与している。また、最後のところの[[神経筋接合部]]の形成についても分子レベルで研究が行われており、上記の分子の他、[[骨形成因子]] (BMP)なども関与している<ref><pubmed>20832291</pubmed></ref>。 | |||
またショウジョウバエの嗅覚系等の情報を受けるキノコ体(Mushroom body)ヘの標的認識についても研究が進められている。これにはマウスで明らかにされている様なトポグラフィックなマッピングの機構も関与しているようである<ref><pubmed>20554703</pubmed></ref>。 | |||
=== 脊椎動物の視覚系、嗅覚系 === | |||
Sperryの流れを汲み、視覚系において標的認識がどうなっているかは精力的に研究が進められてきた。網膜内でのトポグラフィックな情報が[[視蓋]]/[[上丘]]、[[外側膝状体]]、そして視覚野において保存される必要があり、それを支える分子群が同定されている。代表的なものは[[Eph受容体]]-[[エフリン]]システムである<ref><pubmed>20880989</pubmed></ref>。また、坂野らによってマウスの嗅覚系におけるトポグラフィックな情報を担った[[セマフォリン]]-[[ニューロピリン]]システムによる標的認識の機構が明らかにされている<ref><pubmed>21469960</pubmed></ref>。これらについては[[トポグラフィックマッピング#.E5.97.85.E8.A6.9A.E7.B3.BB|トポグラフィックマッピング]]の項を参照。 | |||
=== 大脳皮質領域 === | |||
[[Image:辞典06.jpg|thumb|250px|<b>図6 大脳皮質での領域特異的な標的認識</b><br />マウスのE14の脳において、<!--LINK 0:59-->の情報は<!--LINK 0:60-->へ(SM)また、辺縁系からの情報は辺縁系皮質領域へ(PR)、それぞれ投射する。PRの領域には<!--LINK 0:61-->という細胞接着因子が発現している。この時期にLAMP陽性の皮質領域を感覚野へ移植すると辺縁系からの線維は移植された感覚野へ投射する様になる。<br>Barbe ら<ref name=Barbe />による図を改変。]] | |||
かつて、[[w:Pasko Rakic|Pasko Rakic]]とDennis O'Learyの間で[[大脳皮質]]の発生に関して論争があった<ref name= Schlaggar><pubmed>22099452</pubmed></ref>。Protomap vs Protocortexと呼ばれたもので、端的に言えば[[大脳]]は領域ごとに発生の早い段階から遺伝的に決定されているという説と、そうではなくて大脳は他の神経細胞(領域)とつながったあとに領域ごとに差が出てくるという説である<ref name= Schlaggar />。Rakicの弟子であるPat Levittは、もし大脳皮質の領域が早い段階で決定されているならば、例えばある皮質領域に特異的にでている分子があるはずであると考え、それを探したところ[[辺縁系]]皮質領域に特異的にでている分子を得た。これは[[LAMP]]と呼ばれる細胞接着因子であるが、この分子の発現をマーカーとしてこれに皮質の移植の実験を組み合わせる事によって、辺縁系皮質領域は辺縁系からの線維を引き寄せる機構がある事が示されている(図6)<ref name=Barbe><pubmed>1570290</pubmed></ref>。この標的認識に関わる分子はLAMPそのものである可能性もある。 | |||
=== 神経細胞内での特定のコンパートメントへの標的認識 === | |||
[[Image:辞典07.jpg|thumb|250px|<b>図7 小脳のプルキンエ細胞の細胞内コンパートメント特異的な投射</b><br />プルキンエ細胞は様々な介在ニューロンから投射を受けるが、そのシナプスの形成される場所は特異的な細胞内コンパートメントに形成される。バスケット細胞は軸索のイニシャルセグメント(AIS)にシナプスを形成するが、その形成には神経細胞接着因子である<!--LINK 0:67-->のプルキンエ細胞内での濃度勾配様の局在が(ニューロファシンが軸索起始部のところに集中する)重要であることが明らかになっている。<br>Angoら<ref name=Ango />による図を改変。]] | |||
マウスの[[海馬]]では、脳の様々な領域からの入力が錐体細胞の樹状突起の特異的な領域に標的認識をすることが知られている。CA3領域の一番外側の層には[[内側嗅皮質]]からのtemporoammonic fiber、中間部にはCA3[[錐体細胞]]自身の連合線維、そして一番の近位の層には[[歯状回]]の[[顆粒細胞]]からの苔状線維がシナプスを形成する。この層特異的な標的認識には様々なガイダンス分子、例えば、[[ネトリン]]、Eph受容体、セマフォリン、[[スリット]]、[[リーリン]]そして細胞接着因子などが関与している<ref><pubmed>20484647</pubmed></ref>。 | |||
大脳皮質や小脳皮質には様々な[[介在ニューロン]]が存在し、これら多様なもののそれぞれが錐体細胞やプルキンエ細胞の細胞内の特異的なコンパートメントにシナプスを形成することが知られている。例えば[[シャンデリア細胞]]は[[軸索起始部]]に、[[バスケット細胞]]は軸索の起始部や樹状突起側の細胞体のところに、[[マルチノッチ細胞]]は樹状突起の遠位部に、それぞれシナプスを形成する<ref><pubmed>22251963</pubmed></ref>。プルキンエ細胞の場合にはこれは細胞接着因子に依存しておこることが示されている(図7)<ref name=Ango><pubmed>15479642</pubmed></ref>。 | |||
=== 小脳 === | |||
[[Image:辞典08.jpg|thumb|250px|<b>図8 小脳への下オリーブ核からの投射</b><br />延髄の下オリーブ核(右側)にはSC1/DM-GRASP/BEN/ALCAM陽性のところ(黒色)と陰性のところがある。これらSC1/DM-GRASP/BEN/ALCAM陽性の領域の神経細胞はSC1/DM-GRASP/BEN/ALCAM陽性のプルキンエ細胞の存在する小脳皮質領域(左側、黒色)に投射する。SC1/DM-GRASP/BEN/ALCAM陽性の領域は小脳皮質においては矢状断面に沿ったストライプ状に配列している。<br>Chedotalら<ref name=Chedotal />による図を改変。]] | |||
[[小脳]]の神経回路については昔から精力的に研究が行われてきた。小脳に入ってくる2つの主な入力は延髄の下オリーブ核からの登上線維と橋の橋核からの苔状線維であるが、この2つは前者がプルキンエ細胞、後者が[[顆粒細胞]]とそれぞれ標的が異なる<ref>'''J. Altman, S.A. Bayer'''<br>Development of the cerebellum system: In relation to its evolution, structure, and functions<br>''CRC-Press (Boca Raton)'' :1996</ref>。これらの線維が小脳皮質の発達に伴ってどうやって小脳皮質まできて、どういう発達過程を示すかについては詳細な記載がされているが(例えばConstantino SoteloやCarol Masonら)<ref><pubmed>9509518</pubmed></ref><ref><pubmed>9509519</pubmed></ref>、これらの標的認識が分子レベルでどうなっているかについてはまだ明らかになっていない(一つの登上線維が一つのプルキンエ細胞とシナプスを作るようになるリファイメントの過程については日本の狩野らの仕事により分子機構が明らかにされてきている<ref><pubmed>22103426</pubmed></ref>)。 | |||
Constantine Soteloは登上線維のプルキンエ細胞ヘの標的認識に関わる分子に非常に興味を持っていて、彼は小脳のプルキンエ細胞は矢状断面でグループを作り、それに下オリーブ核からの登上線維がトポグラフィックに標的認識することに注目、小脳で矢状断面に沿ったストライプ状に発現する細胞接着因子を探した。そのうちの一つが細胞接着因子の[[Activated leukocyte cell adhesion molecule]] (ALCAMあるいはSC1/DM-GRASP/BEN)である。しかしながら、この分子が登上線維とプルキンエ細胞のマッチングに関与しているかどうかの検証はなされていない(図8)<ref name=Chedotal><pubmed>8627367</pubmed></ref>。 | |||
=== 脊髄運動神経 === | |||
[[Image:辞典09.jpg|thumb|250px|<b>図9 脊髄の運動神経細胞の四肢筋への投射</b><br />脊髄内の運動神経カラムはその支配する四肢筋の位置により、外側群(緑色)と内側群(黄色)に分かれる。運動神経細胞の軸索は神経束を形成し脊髄から出るが四肢へ入るところで四肢の内側にある筋群(medial LMC)と外側にある筋群(lateral LMC)に投射するものでその投射方向が分かれる。この過程には図に示されているような様々な分子機構が関与していることが明らかにされてきている。eAs: ephrinAs, Npn2: neuropilin2。<br>Kaoら<ref><pubmed>22040916</pubmed></ref>による図を改変。]] | |||
[[w:Thomas Jessell|Tom Jessell]]は長年にわたり[[脊髄]]の系を使って神経発生の研究を続けてきている。脊髄の中で[[運動神経]]細胞はある特定の筋に支配神経を送るがその神経細胞はその支配筋からの感覚のフィードバックを受ける。その細胞特異的なループ系路の形成に関わる分子機構が明らかにされつつある。また、脊髄の中での介在ニューロンを介した運動神経細胞への局所サーキットの形成にも特異的な標的認識が必要であるがこれについても分子機構が明らかにされつつある<ref><pubmed>19804761</pubmed></ref><ref><pubmed>22036571</pubmed></ref>。また、運動神経細胞は四肢の筋肉を支配するが、脊髄の運動神経細胞カラム内の神経細胞の位置によって、支配する四肢の筋肉の位置が決定されるというトポグラフィックマップが存在する。この四肢の筋肉の標的認識には様々なガイダンス分子が関与することが知られ、セマフォリンやEph受容体-エフリンなどが関与することが明らかにされている(図9)<ref><pubmed>19109910</pubmed></ref>。 | |||
== Waiting period == | |||
標的認識に関連して、[[Waiting period]]という概念がある。これは軸索が脳内の正しい領域に到達したあとに、正しい神経細胞にシナプスを形成する前に、軸索が待機する時期のことをさす(例えば<ref><pubmed>8325233</pubmed></ref>)。この間に標的細胞が成熟し、その後、軸索がシナプスを形成する。大脳皮質にはいって来る視床からの線維や、小脳皮質にはいってくる線維がこういう行動を示すことが知られている。 | |||
== 関連項目 == | |||
*[[軸索ガイダンス]] | |||
*[[シナプス形成]] | |||
*[[トポグラフィックマッピング]] | |||
*[[神経回路形成]] | |||
== 参考文献 == | |||
<references /> | |||
2017年8月4日 (金) 13:41時点における最新版
櫻井 武
京都大学大学院医学研究科メディカルイノベーションセンター
DOI:10.14931/bsd.575 原稿受付日:2012年4月10日 原稿完成日:2012年8月4日
担当編集委員:大隅 典子(東北大学 大学院医学系研究科 附属創生応用医学研究センター 脳神経科学コアセンター 発生発達神経科学分野)
英語名: target recognition
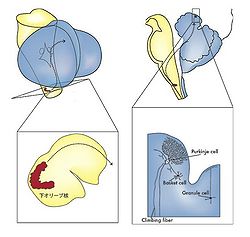
延髄の下オリーブ核は軸索を小脳に投射する。軸索は橋の背部で小脳に入り、そこから小脳皮質に投射する。小脳皮質ではいくつかの細胞の中でプルキンエ細胞に特異的なシナプスを形成する。その特徴的な形態により、この軸索は登上線維とよばれるが、この形態はラモニイカハールによってもその著書の中で描写されている。
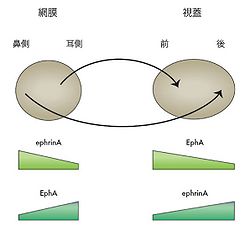
ニワトリの系において網膜の神経節細胞は視蓋にその軸索を投射する。その時に、網膜の鼻側にある細胞は視蓋の後側に、耳側にある細胞は視蓋の前側に軸索を送る。このトポグラフィックな投射は、視蓋に前後軸に沿ってグレディエントを形成してエフリンAが発現し、その受容体であるEphAが網膜の神経節細胞において内外軸に沿ってグレディエントを形成して発現していて、その両者の相互作用によってできる。
正常に脳が機能するにはそれを支える神経細胞群がシナプス結合によって回路を形成し、回路に入力してきた情報を的確に処理し、出力に変える必要がある。こういった神経回路は脳内のワイヤリングの過程により形成されるが、そのワイヤリングにおいて神経回路が「正しく」形成されるには特異的にシナプスが形成される必要がある。この過程を標的認識という。標識認識ためには神経細胞の軸索が正しい脳内の領域に到着する必要があり、その領域内にある神経細胞の中から正しい神経細胞を認識し、その細胞上の正しい細胞内のコンパートメント(樹状突起の一部)にシナプスを形成する必要がある。また、この場合、ある線維とある細胞がランダムではなく特異的な結合を果たし、特異的な情報(トポグラフィックカルな情報)を伝達しなければならない。このためには、これらのそれぞれの過程で特異的な標的認識を行う認識分子(recognition molecule)が関与していると考えられる。
標的認識とは
正常に脳が機能するにはそれを支える神経細胞群がシナプス結合によって回路を形成し、回路に入力してきた情報を的確に処理し、出力に変える必要がある。こういった神経回路は脳内のワイヤリングの過程により形成されるが、そのワイヤリングにおいて神経回路が「正しく」形成されるにはシナプス形成の過程で特異的な標的認識が行われる必要がある。そのためには神経細胞の軸索(例えば延髄の下オリーブ核の神経細胞の軸索である登上線維)が(途中、延髄で正中線を越えて対側にはいり、その後、背外側の縁を上行し、小脳脚を経て)正しい脳内の領域(小脳)に到着する必要があり、その領域内(小脳皮質)にある神経細胞の中から正しい神経細胞(プルキンエ細胞)を認識し、その細胞上の正しい細胞内のコンパートメント(樹状突起の一部)にシナプスを形成する必要がある。また、この場合、ある線維とある細胞がランダムではなく特異的な結合を果たし、特異的な情報(トポグラフィックカルな情報)を伝達しなければならない(そのうえ1つのプルキンエ細胞は一本の登上線維と結合し、幾つもの登上線維とは結合しない)(図1)。このためには、これらのそれぞれの過程で特異的な標的認識を行う認識分子(recognition molecule)が関与していると考えられる。
標的認識は主に神経発生における2つの過程で起こる可能性があるが、ここでは主にシナプス形成における標的認識を例にその概念を説明し、軸索ガイダンスにおける中間標的の認識については軸索ガイダンスの項及び、ガイドポスト細胞の項を参照のこと。
歴史的な考察
Santiago Ramon y Cajalが前世紀の初頭にその詳細な組織学的解析から、神経の突起が周りにあるシグナルを選択的に感知しながら目的地へ進んでいるのではないかと推測し、走化性に似た現象が神経系の形成に重要なのではないかと提唱していた。それに対して主に末梢神経の再生の実験結果から1920年代から30年代にはPaul A Weissらによる、神経系の線維の結合は主に物理的な制約で決定され、その結合は決して特異的なものではなくランダムであり、その後にその回路を使用する事によって、その使われた特定の回路が最終的に残るという説が主流を占めていた。
その説に対してWeissの学生であったRoger Sperryは40年代から50年代にわたって行った彼の一連のカエルやイモリといった動物の眼を使った神経再生の実験により、神経の回路形成にはやはり選択性が存在し、その機構について化学親和説を提唱した[1]。
この化学親和説には2つの概念が含まれており、1つは神経細胞はそれぞれの細胞、線維におそらく化学物質からなる個々を認識するタグがついており、これによってお互いを区別して、その化学親和性で神経細胞はおそらく一個の細胞のレベルで特異的な神経結合を作る事ができるというもので、もう1つは特に視覚系で明らかであるが、その線維投射のパターンが規則正しく、トポグラフィックであることから、少数のモルフォゲンの様な濃度勾配を形成するような分子群がこの化学親和性を担う物質として機能するというものである(図2)。化学親和説については激しい論争があったが、やがて分子レベルでの解析、また数理モデル等に支えられ、神経発生の分野で一般に受け入れられる概念となり、現在の標的認識の概念は基本的にこの化学親和説の流れを汲んでいる。

神経系において皮質構造をなすところXやYがあり、また、核構造をなすZがあるとする。その中のYに投射しX、Zには投射しない軸索は神経系の様々なところから来るとする(A、B、C)。そして、この線維はYの中のある特定の細胞(薄緑色の細胞群)にシナプスを形成し、その場合、Aは樹状突起の遠位側に、Bは樹状突起の近位側に、Cは細胞体にそれぞれシナプスを形成するとする。こういった場合、それぞれの過程で特異的な標的認識が必要となる。
SanesとYamagata[2]による図を改変。
シナプス形成の特異性とその分子機構
シナプス形成をはじめとする標的認識においては2つのレベルでの特異性が必要となる。神経細胞が機能を果たすには、ある神経細胞は特異的な神経細胞と結合し、神経回路を形成する必要があり(例えば、下オリーブ核の線維はプルキンエ細胞に、橋核の線維は顆粒細胞に、顆粒細胞の線維はプルキンエ細胞に)、このレベルでの標的認識の特異性(細胞種のレベル)がまず必要となる。
また、同じ細胞群の中である特異的な細胞と結合する必要がある。例えば位置情報が重要な場合はトポグラフィカルな結合を果たす必要がある。また、情報処理において、同じ情報は同じ脳内での部位にいく必要がある。例えば嗅覚において嗅上皮内の同じ嗅覚受容体からの線維は嗅球内の同じ糸球体につながる必要がある。また、視覚において、同側と対側の眼で捉えられた視覚野の同じ情報は最終的に視覚野の同じ位置につながる必要がある。したがって、同じ細胞集団の中でも特異的に個々の細胞を認識する必要があり、このレベルでの標的認識の特異性(個々の細胞レベル)も必要となる。
上記の様にシナプス形成には様々な過程が必要であり、その中で特異性をサポートする必要がある[3]。その分子機構がどうなっているかについては完全には明らかにされていない。個々の細胞レベルでの特異性は鍵と鍵穴のような認識分子があり、それが無数に存在することで達成されるのではないかという様に提唱はされているが、それを支えることができるほどの多様性のある分子としてはDscam、ニューレキシンとプロトカドヘリンしか存在しないし、こういった分子が本当にその多様性でこういった特異的な標的認識を担っているかどうかについてはまだ証明はされていない(以下のChemoaffinity revisitedを参照の事)。一つの分子ではなく、幾つかの分子の組み合わせでそういった多様性が生み出されるという説もある。
但し、最近の報告では、標的の領域にたどり着くのにはある分子機構が必要であるが、そのあとの正しい細胞を見つけるのはどこの位置に正しい細胞があるかによって形成されるという例もあり、その場合、位置を変えるとつなぎ替えがおこってしまうことも報告されている[4]。したがって、一個の細胞レベルで区別する様な機構は存在しないのかもしれない。
Chemoaffinity revisited
上記のようなタイトルのレビューが2010年のCellにでた[5]。内容は、Dscamやプロトカドヘリンの様な分子は多様性をもつので、化学親和説で特異性を担う分子タグとして機能しているかもしれないという様に考えられていたが、実はこれらの分子は特異的な相互作用を担う分子タグではなく、自己と他者を見分けるためのタグとして使われているのではないかという内容のレビューである。従って、Sperryの仮想した多様な特異性を担う分子は存在しないということを意味する訳ではなく、Dscamやプロトカドヘリンといった分子はその役割を果たしていないのではないかということである。ただし、彼らは鍵と鍵穴のような多様な分子は実際は必要ないのではないかとも述べている。
標的認識に関与する分子機構

ショウジョウバエの眼では8つの細胞からなる神経細胞のユニットが整然と配置されていて、これによって視覚が担われている。その8つの細胞にはR1-8とそれぞれ名前がつけられているが、R1-6はラミナで中継ニューロンにシナプスを形成するのに対し、R7、R8はメダラに軸索を投射し、そこでシナプスを形成する。R1-6の中継ニューロンは(L: lamina neuron)やはりメダラに投射するが、そのシナプスを形成する層がR7,R8のシナプスが形成される層とは異なる。TM, TMY: tangential medulla neurons, DM: distal medulla intrinsic neurons, これらは中継ニューロンでそれぞれ異なる視覚情報を中枢へ伝える。
SanesとZipursky[6]による図を改変
いずれにしても分子機構としては、まず、目的の領域に達する機構(様々な軸索ガイダンスの機構)、そして領域内のどこに到着するかを決定する機構(おそらく神経伸長促進因子か抑制性因子とその受容体の発現レベルによって形成される)、そして特異的な細胞集団を見つける機構(おそらく細胞接着因子及び抑制因子)、そして細胞内の特異的なコンパートメントを見つける機構(おそらく細胞接着因子及び抑制因子)が必要である(図3)。 この過程で特異性は、それぞれの神経細胞において、標示されているシグナルに対する受容体の発現の変化、発現されている受容体の組み合わせの変化、また、受容体の下流のシグナル系路の変化によって、それぞれのシグナルへの応答性が変わることによって形成されると考えられる。詳細な分子機構については軸索ガイダンスの項を参照のこと。
各論
ここではごく限られた例につき、簡単に述べることにする。詳しくはそれぞれの文献を参照のこと。
ショウジョウバエ
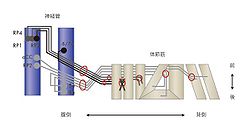
ショウジョウバエの体節筋はステレオティピックな形態を示すのセットからなる。それぞれの筋に投射する神経細胞(RP1, 2, 3, 4, 5a, 6/7b, 8a, aCC)は神経管内に存在しそこから軸索を伸長するが、軸索は途中特異的な神経束を形成し(赤丸)、また途中の様々な特定の部位で(赤丸)束から分かれてそれぞれの特異的な標的である筋肉に投射する。それぞれの特定の部位で様々な分子機構が関与している事が明らかにされつつある。
Keshishianら[7]による図を改変
ショウジョウバエの眼は8つの神経細胞(R1-R8)からなる単位の集合体として存在し、これらは高次視覚野であるラミナ(lamina)、メダラ(medulla)に線維を送るが、R1-R6、R7、R8の軸索はそれぞれシナプスを形成する標的が異なる(Rubinら、Zipurskyら)(図4)。この分子機構としては、 カドヘリン、プロトカドヘリンや受容体型チロシンフォスファターゼ、チロシンキナーゼ等が関与している事が示されている。また、標的野におけるグリア細胞の存在や標的に達するまでの軸索—軸索相互作用がこういった標的認識に重要である事も示されている[6]。
ショウジョウバエの体節の筋群はステレオティピックな配置をしており、それへの神経支配は神経管に存在する運動神経細胞からの線維が行う。この筋群への運動神経の標的認識の系は特異的な標的認識の機構を探る系として研究されてきた(図5)[7]。この過程には様々な軸索ガイダンスに関わる分子や神経細胞接着因子等が関与している。また、最後のところの神経筋接合部の形成についても分子レベルで研究が行われており、上記の分子の他、骨形成因子 (BMP)なども関与している[8]。
またショウジョウバエの嗅覚系等の情報を受けるキノコ体(Mushroom body)ヘの標的認識についても研究が進められている。これにはマウスで明らかにされている様なトポグラフィックなマッピングの機構も関与しているようである[9]。
脊椎動物の視覚系、嗅覚系
Sperryの流れを汲み、視覚系において標的認識がどうなっているかは精力的に研究が進められてきた。網膜内でのトポグラフィックな情報が視蓋/上丘、外側膝状体、そして視覚野において保存される必要があり、それを支える分子群が同定されている。代表的なものはEph受容体-エフリンシステムである[10]。また、坂野らによってマウスの嗅覚系におけるトポグラフィックな情報を担ったセマフォリン-ニューロピリンシステムによる標的認識の機構が明らかにされている[11]。これらについてはトポグラフィックマッピングの項を参照。
大脳皮質領域

マウスのE14の脳において、の情報はへ(SM)また、辺縁系からの情報は辺縁系皮質領域へ(PR)、それぞれ投射する。PRの領域にはという細胞接着因子が発現している。この時期にLAMP陽性の皮質領域を感覚野へ移植すると辺縁系からの線維は移植された感覚野へ投射する様になる。
Barbe ら[12]による図を改変。
かつて、Pasko RakicとDennis O'Learyの間で大脳皮質の発生に関して論争があった[13]。Protomap vs Protocortexと呼ばれたもので、端的に言えば大脳は領域ごとに発生の早い段階から遺伝的に決定されているという説と、そうではなくて大脳は他の神経細胞(領域)とつながったあとに領域ごとに差が出てくるという説である[13]。Rakicの弟子であるPat Levittは、もし大脳皮質の領域が早い段階で決定されているならば、例えばある皮質領域に特異的にでている分子があるはずであると考え、それを探したところ辺縁系皮質領域に特異的にでている分子を得た。これはLAMPと呼ばれる細胞接着因子であるが、この分子の発現をマーカーとしてこれに皮質の移植の実験を組み合わせる事によって、辺縁系皮質領域は辺縁系からの線維を引き寄せる機構がある事が示されている(図6)[12]。この標的認識に関わる分子はLAMPそのものである可能性もある。
神経細胞内での特定のコンパートメントへの標的認識

プルキンエ細胞は様々な介在ニューロンから投射を受けるが、そのシナプスの形成される場所は特異的な細胞内コンパートメントに形成される。バスケット細胞は軸索のイニシャルセグメント(AIS)にシナプスを形成するが、その形成には神経細胞接着因子であるのプルキンエ細胞内での濃度勾配様の局在が(ニューロファシンが軸索起始部のところに集中する)重要であることが明らかになっている。
Angoら[14]による図を改変。
マウスの海馬では、脳の様々な領域からの入力が錐体細胞の樹状突起の特異的な領域に標的認識をすることが知られている。CA3領域の一番外側の層には内側嗅皮質からのtemporoammonic fiber、中間部にはCA3錐体細胞自身の連合線維、そして一番の近位の層には歯状回の顆粒細胞からの苔状線維がシナプスを形成する。この層特異的な標的認識には様々なガイダンス分子、例えば、ネトリン、Eph受容体、セマフォリン、スリット、リーリンそして細胞接着因子などが関与している[15]。
大脳皮質や小脳皮質には様々な介在ニューロンが存在し、これら多様なもののそれぞれが錐体細胞やプルキンエ細胞の細胞内の特異的なコンパートメントにシナプスを形成することが知られている。例えばシャンデリア細胞は軸索起始部に、バスケット細胞は軸索の起始部や樹状突起側の細胞体のところに、マルチノッチ細胞は樹状突起の遠位部に、それぞれシナプスを形成する[16]。プルキンエ細胞の場合にはこれは細胞接着因子に依存しておこることが示されている(図7)[14]。
小脳

延髄の下オリーブ核(右側)にはSC1/DM-GRASP/BEN/ALCAM陽性のところ(黒色)と陰性のところがある。これらSC1/DM-GRASP/BEN/ALCAM陽性の領域の神経細胞はSC1/DM-GRASP/BEN/ALCAM陽性のプルキンエ細胞の存在する小脳皮質領域(左側、黒色)に投射する。SC1/DM-GRASP/BEN/ALCAM陽性の領域は小脳皮質においては矢状断面に沿ったストライプ状に配列している。
Chedotalら[17]による図を改変。
小脳の神経回路については昔から精力的に研究が行われてきた。小脳に入ってくる2つの主な入力は延髄の下オリーブ核からの登上線維と橋の橋核からの苔状線維であるが、この2つは前者がプルキンエ細胞、後者が顆粒細胞とそれぞれ標的が異なる[18]。これらの線維が小脳皮質の発達に伴ってどうやって小脳皮質まできて、どういう発達過程を示すかについては詳細な記載がされているが(例えばConstantino SoteloやCarol Masonら)[19][20]、これらの標的認識が分子レベルでどうなっているかについてはまだ明らかになっていない(一つの登上線維が一つのプルキンエ細胞とシナプスを作るようになるリファイメントの過程については日本の狩野らの仕事により分子機構が明らかにされてきている[21])。
Constantine Soteloは登上線維のプルキンエ細胞ヘの標的認識に関わる分子に非常に興味を持っていて、彼は小脳のプルキンエ細胞は矢状断面でグループを作り、それに下オリーブ核からの登上線維がトポグラフィックに標的認識することに注目、小脳で矢状断面に沿ったストライプ状に発現する細胞接着因子を探した。そのうちの一つが細胞接着因子のActivated leukocyte cell adhesion molecule (ALCAMあるいはSC1/DM-GRASP/BEN)である。しかしながら、この分子が登上線維とプルキンエ細胞のマッチングに関与しているかどうかの検証はなされていない(図8)[17]。
脊髄運動神経

脊髄内の運動神経カラムはその支配する四肢筋の位置により、外側群(緑色)と内側群(黄色)に分かれる。運動神経細胞の軸索は神経束を形成し脊髄から出るが四肢へ入るところで四肢の内側にある筋群(medial LMC)と外側にある筋群(lateral LMC)に投射するものでその投射方向が分かれる。この過程には図に示されているような様々な分子機構が関与していることが明らかにされてきている。eAs: ephrinAs, Npn2: neuropilin2。
Kaoら[22]による図を改変。
Tom Jessellは長年にわたり脊髄の系を使って神経発生の研究を続けてきている。脊髄の中で運動神経細胞はある特定の筋に支配神経を送るがその神経細胞はその支配筋からの感覚のフィードバックを受ける。その細胞特異的なループ系路の形成に関わる分子機構が明らかにされつつある。また、脊髄の中での介在ニューロンを介した運動神経細胞への局所サーキットの形成にも特異的な標的認識が必要であるがこれについても分子機構が明らかにされつつある[23][24]。また、運動神経細胞は四肢の筋肉を支配するが、脊髄の運動神経細胞カラム内の神経細胞の位置によって、支配する四肢の筋肉の位置が決定されるというトポグラフィックマップが存在する。この四肢の筋肉の標的認識には様々なガイダンス分子が関与することが知られ、セマフォリンやEph受容体-エフリンなどが関与することが明らかにされている(図9)[25]。
Waiting period
標的認識に関連して、Waiting periodという概念がある。これは軸索が脳内の正しい領域に到達したあとに、正しい神経細胞にシナプスを形成する前に、軸索が待機する時期のことをさす(例えば[26])。この間に標的細胞が成熟し、その後、軸索がシナプスを形成する。大脳皮質にはいって来る視床からの線維や、小脳皮質にはいってくる線維がこういう行動を示すことが知られている。
関連項目
参考文献
- ↑
SPERRY, R.W. (1963).
CHEMOAFFINITY IN THE ORDERLY GROWTH OF NERVE FIBER PATTERNS AND CONNECTIONS. Proceedings of the National Academy of Sciences of the United States of America, 50, 703-10. [PubMed:14077501] [PMC] [WorldCat] [DOI] - ↑
Sanes, J.R., & Yamagata, M. (2009).
Many paths to synaptic specificity. Annual review of cell and developmental biology, 25, 161-95. [PubMed:19575668] [WorldCat] [DOI] - ↑
Benson, D.L., Colman, D.R., & Huntley, G.W. (2001).
Molecules, maps and synapse specificity. Nature reviews. Neuroscience, 2(12), 899-909. [PubMed:11733797] [WorldCat] [DOI] - ↑
Jessell, T.M., Sürmeli, G., & Kelly, J.S. (2011).
Motor neurons and the sense of place. Neuron, 72(3), 419-24. [PubMed:22078502] [WorldCat] [DOI] - ↑
Zipursky, S.L., & Sanes, J.R. (2010).
Chemoaffinity revisited: dscams, protocadherins, and neural circuit assembly. Cell, 143(3), 343-53. [PubMed:21029858] [WorldCat] [DOI] - ↑ 6.0 6.1
Sanes, J.R., & Zipursky, S.L. (2010).
Design principles of insect and vertebrate visual systems. Neuron, 66(1), 15-36. [PubMed:20399726] [PMC] [WorldCat] [DOI] - ↑ 7.0 7.1
Keshishian, H., Broadie, K., Chiba, A., & Bate, M. (1996).
The drosophila neuromuscular junction: a model system for studying synaptic development and function. Annual review of neuroscience, 19, 545-75. [PubMed:8833454] [WorldCat] [DOI] - ↑
Bayat, V., Jaiswal, M., & Bellen, H.J. (2011).
The BMP signaling pathway at the Drosophila neuromuscular junction and its links to neurodegenerative diseases. Current opinion in neurobiology, 21(1), 182-8. [PubMed:20832291] [PMC] [WorldCat] [DOI] - ↑
Imai, T., Sakano, H., & Vosshall, L.B. (2010).
Topographic mapping--the olfactory system. Cold Spring Harbor perspectives in biology, 2(8), a001776. [PubMed:20554703] [PMC] [WorldCat] [DOI] - ↑
Feldheim, D.A., & O'Leary, D.D. (2010).
Visual map development: bidirectional signaling, bifunctional guidance molecules, and competition. Cold Spring Harbor perspectives in biology, 2(11), a001768. [PubMed:20880989] [PMC] [WorldCat] [DOI] - ↑
Mori, K., & Sakano, H. (2011).
How is the olfactory map formed and interpreted in the mammalian brain? Annual review of neuroscience, 34, 467-99. [PubMed:21469960] [WorldCat] [DOI] - ↑ 12.0 12.1
Barbe, M.F., & Levitt, P. (1992).
Attraction of specific thalamic input by cerebral grafts depends on the molecular identity of the implant. Proceedings of the National Academy of Sciences of the United States of America, 89(9), 3706-10. [PubMed:1570290] [PMC] [WorldCat] [DOI] - ↑ 13.0 13.1
Schlaggar, B.L. (2011).
Mapping genetic influences on cortical regionalization. Neuron, 72(4), 499-501. [PubMed:22099452] [PMC] [WorldCat] [DOI] - ↑ 14.0 14.1
Ango, F., di Cristo, G., Higashiyama, H., Bennett, V., Wu, P., & Huang, Z.J. (2004).
Ankyrin-based subcellular gradient of neurofascin, an immunoglobulin family protein, directs GABAergic innervation at purkinje axon initial segment. Cell, 119(2), 257-72. [PubMed:15479642] [WorldCat] [DOI] - ↑
Tawarayama, H., Yoshida, Y., Suto, F., Mitchell, K.J., & Fujisawa, H. (2010).
Roles of semaphorin-6B and plexin-A2 in lamina-restricted projection of hippocampal mossy fibers. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(20), 7049-60. [PubMed:20484647] [PMC] [WorldCat] [DOI] - ↑
Marín, O. (2012).
Interneuron dysfunction in psychiatric disorders. Nature reviews. Neuroscience, 13(2), 107-20. [PubMed:22251963] [WorldCat] [DOI] - ↑ 17.0 17.1
Chédotal, A., Pourquié, O., Ezan, F., San Clemente, H., & Sotelo, C. (1996).
BEN as a presumptive target recognition molecule during the development of the olivocerebellar system. The Journal of neuroscience : the official journal of the Society for Neuroscience, 16(10), 3296-310. [PubMed:8627367] [WorldCat] - ↑ J. Altman, S.A. Bayer
Development of the cerebellum system: In relation to its evolution, structure, and functions
CRC-Press (Boca Raton) :1996 - ↑
Sotelo, C., & Chédotal, A. (1997).
Development of the olivocerebellar projection. Perspectives on developmental neurobiology, 5(1), 57-67. [PubMed:9509518] [WorldCat] - ↑
Mason, C.A., Morrison, M.E., Ward, M.S., Zhang, Q., & Baird, D.H. (1997).
Axon-target interactions in the developing cerebellum. Perspectives on developmental neurobiology, 5(1), 69-82. [PubMed:9509519] [WorldCat] - ↑
Watanabe, M., & Kano, M. (2011).
Climbing fiber synapse elimination in cerebellar Purkinje cells. The European journal of neuroscience, 34(10), 1697-710. [PubMed:22103426] [WorldCat] [DOI] - ↑
Kao, T.J., Law, C., & Kania, A. (2012).
Eph and ephrin signaling: lessons learned from spinal motor neurons. Seminars in cell & developmental biology, 23(1), 83-91. [PubMed:22040916] [WorldCat] [DOI] - ↑
Betley, J.N., Wright, C.V., Kawaguchi, Y., Erdélyi, F., Szabó, G., Jessell, T.M., & Kaltschmidt, J.A. (2009).
Stringent specificity in the construction of a GABAergic presynaptic inhibitory circuit. Cell, 139(1), 161-74. [PubMed:19804761] [PMC] [WorldCat] [DOI] - ↑
Sürmeli, G., Akay, T., Ippolito, G.C., Tucker, P.W., & Jessell, T.M. (2011).
Patterns of spinal sensory-motor connectivity prescribed by a dorsoventral positional template. Cell, 147(3), 653-65. [PubMed:22036571] [PMC] [WorldCat] [DOI] - ↑
Luria, V., Krawchuk, D., Jessell, T.M., Laufer, E., & Kania, A. (2008).
Specification of motor axon trajectory by ephrin-B:EphB signaling: symmetrical control of axonal patterning in the developing limb. Neuron, 60(6), 1039-53. [PubMed:19109910] [WorldCat] [DOI] - ↑
Ghosh, A., & Shatz, C.J. (1993).
A role for subplate neurons in the patterning of connections from thalamus to neocortex. Development (Cambridge, England), 117(3), 1031-47. [PubMed:8325233] [WorldCat]