「ゲフィリン」の版間の差分
| (2人の利用者による、間の17版が非表示) | |||
| 6行目: | 6行目: | ||
<font size="+1">鍋倉 淳一</font><br> | <font size="+1">鍋倉 淳一</font><br> | ||
''大学共同利用機関法人 自然科学研究機構 生理学研究所''<br> | ''大学共同利用機関法人 自然科学研究機構 生理学研究所''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2015年2月26日 原稿完成日:2015年月日<br> | ||
担当編集委員:[http://researchmap.jp/michisukeyuzaki 柚崎 通介](慶應義塾大学 医学部生理学)<br> | 担当編集委員:[http://researchmap.jp/michisukeyuzaki 柚崎 通介](慶應義塾大学 医学部生理学)<br> | ||
</div> | </div> | ||
| 12行目: | 12行目: | ||
英語名:gephyrin 英略称:GPHN | 英語名:gephyrin 英略称:GPHN | ||
{{box|text= ゲフィリンは、抑制性シナプス後膜における足場タンパク質であり、グリシン受容体および一部のGABA<sub>A</sub> | {{box|text= | ||
ゲフィリンは、抑制性シナプス後膜における足場タンパク質であり、グリシン受容体および一部のGABA<sub>A</sub>受容体のシナプス局在に関わっている(図1)。ゲフィリンの機能や局在は翻訳後修飾、関連タンパク質との結合、神経活動、受容体の活性など様々な要因によって制御される。この他、尿酸生成や造血作用に関わるMoCo(モリブデン補因子)の生合成における触媒作用も知られている<ref name=ref1><pubmed>10811719</pubmed></ref>。 | |||
}} | |||
{{GNF_Protein_box | {{GNF_Protein_box | ||
| Name = Gephyrin | | Name = Gephyrin | ||
| image = | | image = Protein_GPHN_PDB_1ihc.png | ||
| image_source = [[Protein_Data_Bank|PDB]] rendering based on | | image_source = [[Protein_Data_Bank|PDB]] rendering based on 1ihc. | ||
| PDB = {{PDB2|1JLJ}} | | PDB = {{PDB2|1JLJ}} | ||
| HGNCid = 15465 | | HGNCid = 15465 | ||
| 59行目: | 61行目: | ||
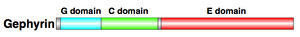
[[ファイル:Scaffolding proteins2.jpg|thumb|right|300px|<b>図1. ゲフィリンのドメイン構造</b>]] | [[ファイル:Scaffolding proteins2.jpg|thumb|right|300px|<b>図1. ゲフィリンのドメイン構造</b>]] | ||
[[image:ゲフィリン1.png|thumb|350px|'''図2.抑制性[[シナプス]]後膜におけるゲフィリン'''<br>Gドメインの三量体形成とEドメインの二量体形成による六方格子(hexagonal lattice)モデルが仮定されている<ref name=ref6><pubmed>15201864</pubmed></ref> <ref name=ref7><pubmed>11554796</pubmed></ref>。<br> | [[image:ゲフィリン1.png|thumb|350px|'''図2.抑制性[[シナプス]]後膜におけるゲフィリン'''<br>Gドメインの三量体形成とEドメインの二量体形成による六方格子(hexagonal lattice)モデルが仮定されている<ref name=ref6><pubmed>15201864</pubmed></ref> <ref name=ref7><pubmed>11554796</pubmed></ref>。<br> | ||
注: [[グリシン]]受容体のサブユニット構成比(3つのαサブユニットと2つのβサブユニット、もしくは2つのαサブユニットと3つのβサブユニット)については、まだ明確になっていない<ref name= | 注: [[グリシン]]受容体のサブユニット構成比(3つのαサブユニットと2つのβサブユニット、もしくは2つのαサブユニットと3つのβサブユニット)については、まだ明確になっていない<ref name=ref19><pubmed></pubmed></ref>。]] | ||
===ドメイン構造並びにタンパク質相互作用=== | ===ドメイン構造並びにタンパク質相互作用=== | ||
93 kDaの表在性[[膜タンパク質]]として同定されたゲフィリンは<ref name=ref2><pubmed>3032237</pubmed></ref> <ref name=ref3><pubmed>1657993</pubmed></ref>、自己オリゴマー化によって凝集体を形成する<ref name=ref1 />。G、C、Eの3ドメインから成り(図1)、GドメインN末端(20 kDa)とEドメインC末端(43 kDa)がCドメイン(リンカー領域: 18-21 kDa)に結合している<ref name=ref4><pubmed>18403029</pubmed></ref>。Gドメインは安定した三量体を形成する一方、Eドメインは二量体を形成し、[[グリシン受容体]]βサブユニットの細胞内ループ(M3-M4)に高親和性を示す。グリシン受容体βサブユニットにおける[[セリン]]残基403が[[プロテインキナーゼC]] ([[PKC]])によって[[リン酸化]]されると、ゲフィリンとの結合が減少する<ref name=ref5><pubmed>21829170</pubmed></ref>。また、[[結晶構造解析]]の結果から、ゲフィリンの二量体形成面における[[フェニルアラニン]]残基330、[[チロシン]]残基673、[[プロリン]] | 93 kDaの表在性[[膜タンパク質]]として同定されたゲフィリンは<ref name=ref2><pubmed>3032237</pubmed></ref> <ref name=ref3><pubmed>1657993</pubmed></ref>、自己オリゴマー化によって凝集体を形成する<ref name=ref1 />。G、C、Eの3ドメインから成り(図1)、GドメインN末端(20 kDa)とEドメインC末端(43 kDa)がCドメイン(リンカー領域: 18-21 kDa)に結合している<ref name=ref4><pubmed>18403029</pubmed></ref>。Gドメインは安定した三量体を形成する一方、Eドメインは二量体を形成し、[[グリシン受容体]]βサブユニットの細胞内ループ(M3-M4)に高親和性を示す。グリシン受容体βサブユニットにおける[[セリン]]残基403が[[プロテインキナーゼC]] ([[PKC]])によって[[リン酸化]]されると、ゲフィリンとの結合が減少する<ref name=ref5><pubmed>21829170</pubmed></ref>。また、[[結晶構造解析]]の結果から、ゲフィリンの二量体形成面における[[フェニルアラニン]]残基330、[[チロシン]]残基673、[[プロリン]]残基713残基がゲフィリンとの高い親和性(編集コメント:ゲフィリン同士の親和性でしょうか?)に重要であると考えられる<ref name=ref4 />。「リンカー領域」とも呼ばれるCドメインにはゲフィリン結合タンパクの作用部位があり、[[peptidyl-prolyl isomerase NIMA interacting protein 1]] ([[Pin1]])は188-201配列に、[[ダイニン軽鎖]]1 ([[dynein light chain]] 1, [[Dlc1]])およびダイニン軽鎖2 ([[dynein]] light chain 2, [[Dlc2]])は203-212配列に、[[アクチン]]重合に関与する[[Cdc42]]に選択的な[[コリビスチン]]([[collybistin]])は319-329配列に作用する。また、タンパク分解をされやすいのもCドメインである。 | ||
組み換えゲフィリンの過剰発現実験の結果から、様々な[[細胞株]]において凝集体を形成することが確認されており、現在はGドメインの三量体化とEドメインの二量体化による六方格子(hexagonal lattice)モデルが仮定されている<ref name=ref6><pubmed>15201864</pubmed></ref> <ref name=ref7 />(図2)。 | 組み換えゲフィリンの過剰発現実験の結果から、様々な[[細胞株]]において凝集体を形成することが確認されており、現在はGドメインの三量体化とEドメインの二量体化による六方格子(hexagonal lattice)モデルが仮定されている<ref name=ref6><pubmed>15201864</pubmed></ref> <ref name=ref7 />(図2)。 | ||
| 67行目: | 69行目: | ||
===アイソフォーム=== | ===アイソフォーム=== | ||
[[転写産物]]は複数の[[エクソン]]から[[選択的スプライシング]]されるため、多様なアイソフォームが存在すると考えられる。但し、ゲフィリンの各スプライシング変異体とそれらの名称は文献によって混在しており、異なるスプライシング変異体が同一の名称で呼ばれている場合があるので注意が必要である。こうしたことから、変異体の名称を統一することも提唱されている<ref name=ref4 /> | [[転写産物]]は複数の[[エクソン]]から[[選択的スプライシング]]されるため、多様なアイソフォームが存在すると考えられる。但し、ゲフィリンの各スプライシング変異体とそれらの名称は文献によって混在しており、異なるスプライシング変異体が同一の名称で呼ばれている場合があるので注意が必要である。こうしたことから、変異体の名称を統一することも提唱されている<ref name=ref4 />。また、変異体の組織特異性と生物種特異性が報告されているが、後者については検討(検証)が不十分との指摘もある<ref name=ref4 />。 | ||
なお、[[哺乳類]]と[[鳥類]]では1つのゲフィリン遺伝子が存在するが、[[ゼブラフィッシュ]]では2つの遺伝子(gphnaとgphnb)が存在する<ref name= | なお、[[哺乳類]]と[[鳥類]]では1つのゲフィリン遺伝子が存在するが、[[ゼブラフィッシュ]]では2つの遺伝子(gphnaとgphnb)が存在する<ref name=ref31><pubmed>11418245</pubmed></ref> <ref name=ref32><pubmed>21712054</pubmed></ref>。 | ||
===翻訳後修飾=== | ===翻訳後修飾=== | ||
[[image:ゲフィリン3.png|thumb|350px|'''図3.ゲフィリン関連分子'''<br>(GABAAR:GABA<sub>A</sub>受容体、GlyR:グリシン受容体、HSC70:HSP70熱ショックタンパク質、KIF5:キネシンスーパーファミリータンパク質5、Dlc1/2:ダイニン軽鎖1/2、GABARAP:GABA<sub>A</sub> receptor-associated protein)]] | [[image:ゲフィリン3.png|thumb|350px|'''図3.ゲフィリン関連分子'''<br>(GABAAR:GABA<sub>A</sub>受容体、GlyR:グリシン受容体、HSC70:HSP70熱ショックタンパク質、KIF5:キネシンスーパーファミリータンパク質5、Dlc1/2:ダイニン軽鎖1/2、GABARAP:GABA<sub>A</sub> receptor-associated protein)]] | ||
ゲフィリンはリン酸化、[[パルミトイル化]]、[[アセチル化]] | ゲフィリンはリン酸化、[[パルミトイル化]]、[[アセチル化]]によってその機能と局在が変化する。例えば、ゲフィリンのシナプス局在は細胞[[接着分子]]である[[β1インテグリン]]の活性化により増加する一方、[[β3インテグリン]]の活性化によって減少する<ref name=ref33><pubmed>20935643</pubmed></ref>。また、ゲフィリンのセリン残基268が[[分裂促進因子活性化タンパク質キナーゼ]]である[[ERK1]]/[[ERK2|2]]によって<ref name=ref34><pubmed>23408424</pubmed></ref>、セリン残基270が[[グリコーゲン合成酵素キナーゼ]]である[[GSK3β]]によって<ref name=ref35><pubmed>21173228</pubmed></ref>リン酸化されると、ゲフィリンのシナプス局在が減少する。これはCa<sup>2+</sup>/ERK依存性[[セリンプロテアーゼ]]である[[カルパイン1]]によるゲフィリンの分解によると考えられる<ref name=ref19 />。この他、[[Cdk5]]によるセリン残基270のリン酸化<ref><pubmed>22778260</pubmed></ref>や[[熱ショックタンパク]]質であるHsc70<ref name=ref36><pubmed>21209184</pubmed></ref>、アクチン結合タンパク質の[[プロフィリン1]]/[[プロフィリン2|2]]、[[mammalian Ena/VASP]] (enabled/vasodilator stimulated phosphoprotein)、[[Raft 1]]、[[チューブリン]]などの因子が報告されている<ref name=ref4 /> <ref name=ref19 />(図3)。 | ||
==発現== | ==発現== | ||
===組織分布=== | ===組織分布=== | ||
ゲフィリンは[[脊髄]]や[[脳幹]]のグリシン作動性シナプスのみならず、[[中枢神経]]で広く発現が認められ、[[網膜]]、[[嗅球]]、[[海馬]]、[[大脳皮質]]の[[GABA作動性]]シナプスにおいても確認されている<ref name=ref1 />。また、中枢神経系以外に[[肝臓]]、[[心臓]]、[[筋肉]]といった末梢組織でも多様なアイソフォームが確認されている<ref name= | ゲフィリンは[[脊髄]]や[[脳幹]]のグリシン作動性シナプスのみならず、[[中枢神経]]で広く発現が認められ、[[網膜]]、[[嗅球]]、[[海馬]]、[[大脳皮質]]の[[GABA作動性]]シナプスにおいても確認されている<ref name=ref1 />。また、中枢神経系以外に[[肝臓]]、[[心臓]]、[[筋肉]]といった末梢組織でも多様なアイソフォームが確認されている<ref name=ref30><pubmed>16402094</pubmed></ref>。 | ||
===細胞局在=== | ===細胞局在=== | ||
これまで、ゲフィリンはグリシン受容体に先行して[[抑制性]]シナプス後膜の細胞質側に凝集すると考えられてきた<ref name= | これまで、ゲフィリンはグリシン受容体に先行して[[抑制性]]シナプス後膜の細胞質側に凝集すると考えられてきた<ref name=ref12 /> <ref name=ref22><pubmed>10941193</pubmed></ref>。そのため、抑制性シナプスの指標として用いられることも多い。[[超解像顕微鏡]]を用いた報告によれば、抑制性シナプス後膜領域にはゲフィリン分子が約5,000-10,000/μm<sup>2</sup>の密度で凝集している<ref name=ref29><pubmed>23889935</pubmed></ref>。しかし、ライブセルイメージングによってマイクロメートルのスケールでみると、ゲフィリンはダイナミックに動いており、樹状突起の微小管に沿った移動も報告されている<ref name=ref23><pubmed>14762130</pubmed></ref> <ref name=ref24><pubmed>16449194</pubmed></ref> <ref name=ref25><pubmed>19439658</pubmed></ref>。このことから、実際には動的平衡状態を維持していると考えられる。また、ゲフィリンの運動性は神経活動に応じて変化することが報告されており<ref name=ref26><pubmed>16641238</pubmed></ref> <ref name=ref27><pubmed>22146684</pubmed></ref>、これは細胞骨格であるFアクチンや微小管とゲフィリンとの結合がCA<sup>2+</sup>依存的に変化するためであると考えられる<ref name=ref26 />。 | ||
==機能== | ==機能== | ||
===グリシン受容体/GABA<sub>A</sub>受容体の固定化=== | ===グリシン受容体/GABA<sub>A</sub>受容体の固定化=== | ||
[[image:ゲフィリン2.png|thumb|350px|''' | [[image:ゲフィリン2.png|thumb|350px|'''図4.シナプス後膜におけるゲフィリンの局在(小矢印)'''<br>DAB染色による電子顕微鏡画像 (スケールバー 0.3 μm)<ref><pubmed>9603375</pubmed></ref>'''使用許諾 未取得''']] | ||
グリシン受容体が集積するマイクロドメインは、グリシン作動性[[シナプス前終末]]と対応した[[シナプス後膜]]に認められる<ref name= | グリシン受容体が集積するマイクロドメインは、グリシン作動性[[シナプス前終末]]と対応した[[シナプス後膜]]に認められる<ref name=ref8><pubmed>14715953</pubmed></ref>(図4)。その際、グリシン受容体βサブユニットの細胞質ループに存在する18のアミノ酸モチーフにゲフィリンが結合することで、シナプス後膜におけるグリシン受容体の係留に関与している<ref name=ref9><pubmed>7546736</pubmed></ref>。そのため、[[免疫組織化学法]]においては、しばしば(グリシン受容体βサブユニットとヘテロマーを形成する)グリシン受容体α1サブユニット特異的抗体を用い、ゲフィリン抗体と二重染色することで[[シナプス]]後膜に局在するグリシン受容体が標識される。 | ||
但し、ゲフィリンはグリシン受容体α2サブユニットにも低親和性結合を示すことから、α2ホモメリックグリシン受容体がシナプスに係留される可能性も示唆されている<ref name= | 但し、ゲフィリンはグリシン受容体α2サブユニットにも低親和性結合を示すことから、α2ホモメリックグリシン受容体がシナプスに係留される可能性も示唆されている<ref name=ref10><pubmed>1318846</pubmed></ref> <ref name=ref11><pubmed>18946536</pubmed></ref>。 | ||
実際に[[アンチセンスオリゴヌクレオチド]]によってゲフィリンの発現を阻害すると、シナプスにおけるグリシン受容体の局在が減少する<ref name= | 実際に[[アンチセンスオリゴヌクレオチド]]によってゲフィリンの発現を阻害すると、シナプスにおけるグリシン受容体の局在が減少する<ref name=ref12><pubmed>8264797</pubmed></ref>。更に、相同組み換えによって全てのゲフィリンアイソフォームをノックアウトした[[マウス]]では、シナプスにおけるグリシン受容体の局在が減少する<ref name=ref13><pubmed>9812897</pubmed></ref>。こうしたことから、グリシン受容体はゲフィリンと結合することで凝集体を形成し、解離することで拡散することが知られている<ref name=ref14><pubmed>10893193</pubmed></ref> <ref name=ref15><pubmed>14960612</pubmed></ref>。 | ||
[[GABA受容体|GABA<sub>A</sub>受容体]]については、ゲフィリンとGABA<sub>A</sub>受容体α2サブユニット、γ2サブユニットの結合が示唆されている<ref name= | [[GABA受容体|GABA<sub>A</sub>受容体]]については、ゲフィリンとGABA<sub>A</sub>受容体α2サブユニット、γ2サブユニットの結合が示唆されている<ref name=ref16><pubmed>18256255</pubmed></ref> <ref name=ref17><pubmed>7644489</pubmed></ref>。また、GABARAPはゲフィリンCドメインと結合するものの、GABA<sub>A</sub>受容体とゲフィリンの輸送に必須ではない<ref name=ref18><pubmed>16307606</pubmed></ref>。グリシン受容体に比べGABA<sub>A</sub>受容体のサブユニットは多様であり、GABA<sub>A</sub>受容体に対するゲフィリンの役割は未だ十分明らかになっていない。 | ||
また、ゲフィリンはシナプス後膜における[[細胞接着分子]]である[[ニューロリギン]]との結合が知られている<ref name= | また、ゲフィリンはシナプス後膜における[[細胞接着分子]]である[[ニューロリギン]]との結合が知られている<ref name=ref19><pubmed>24552784</pubmed></ref>。ニューロリギン2欠損マウスでは、ゲフィリンのシナプス局在が減少し、[[GABA]]およびグリシン作動性の[[微小シナプス後膜電流]](mIPSC)の大きさと頻度が減少することから、ニューロリギンがゲフィリンのシナプス局在に関わることが示唆されている<ref name=ref20><pubmed>19755106</pubmed></ref>。また、マウスの[[網膜]]、[[上丘]]、[[視床]]、[[脳幹]]、[[脊髄]]においては、ニューロリギン4がゲフィリンと共局在するという報告がある<ref name=ref21><pubmed>21282647</pubmed></ref>。 | ||
=== 輸送カーゴ補助タンパク質として === | === 輸送カーゴ補助タンパク質として === | ||
加えて、ゲフィリンが輸送カーゴ補助タンパク質として、グリシン受容体の[[細胞内輸送]]に関与することも示唆されている<ref name= | 加えて、ゲフィリンが輸送カーゴ補助タンパク質として、グリシン受容体の[[細胞内輸送]]に関与することも示唆されている<ref name=ref25 />。[[粗面小胞体]]-[[ゴルジ体]]を経て[[分泌]]小胞に包まれたグリシン受容体は、ゲフィリンを介して[[順行性輸送]]タンパク質である[[KIF5]]([[KIF1A]])に結合し、[[微小管]]に沿って輸送されることが報告されている<ref name=ref25 />。また、[[逆行性輸送]]タンパク質である[[ダイニン]]を構成する[[ダイニン軽鎖]](Dlc1/2)とゲフィリンが結合することも報告されている<ref name=ref28><pubmed>12097491</pubmed></ref>。 | ||
==関連項目== | ==関連項目== | ||
2015年3月1日 (日) 21:32時点における版
中畑 義久
大学共同利用機関法人 自然科学研究機構 生理学研究所
石橋 仁
北里大学 医療衛生学部 生理学教室
鍋倉 淳一
大学共同利用機関法人 自然科学研究機構 生理学研究所
DOI:10.14931/bsd.5595 原稿受付日:2015年2月26日 原稿完成日:2015年月日
担当編集委員:柚崎 通介(慶應義塾大学 医学部生理学)
英語名:gephyrin 英略称:GPHN
ゲフィリンは、抑制性シナプス後膜における足場タンパク質であり、グリシン受容体および一部のGABAA受容体のシナプス局在に関わっている(図1)。ゲフィリンの機能や局在は翻訳後修飾、関連タンパク質との結合、神経活動、受容体の活性など様々な要因によって制御される。この他、尿酸生成や造血作用に関わるMoCo(モリブデン補因子)の生合成における触媒作用も知られている[1]。
構造
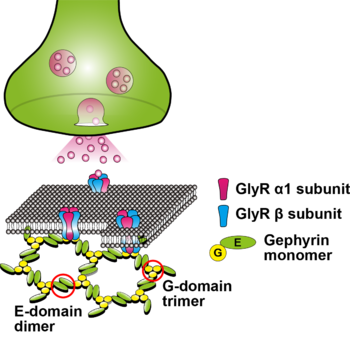
Gドメインの三量体形成とEドメインの二量体形成による六方格子(hexagonal lattice)モデルが仮定されている[2] [3]。
注: グリシン受容体のサブユニット構成比(3つのαサブユニットと2つのβサブユニット、もしくは2つのαサブユニットと3つのβサブユニット)については、まだ明確になっていない[4]。
ドメイン構造並びにタンパク質相互作用
93 kDaの表在性膜タンパク質として同定されたゲフィリンは[5] [6]、自己オリゴマー化によって凝集体を形成する[1]。G、C、Eの3ドメインから成り(図1)、GドメインN末端(20 kDa)とEドメインC末端(43 kDa)がCドメイン(リンカー領域: 18-21 kDa)に結合している[7]。Gドメインは安定した三量体を形成する一方、Eドメインは二量体を形成し、グリシン受容体βサブユニットの細胞内ループ(M3-M4)に高親和性を示す。グリシン受容体βサブユニットにおけるセリン残基403がプロテインキナーゼC (PKC)によってリン酸化されると、ゲフィリンとの結合が減少する[8]。また、結晶構造解析の結果から、ゲフィリンの二量体形成面におけるフェニルアラニン残基330、チロシン残基673、プロリン残基713残基がゲフィリンとの高い親和性(編集コメント:ゲフィリン同士の親和性でしょうか?)に重要であると考えられる[7]。「リンカー領域」とも呼ばれるCドメインにはゲフィリン結合タンパクの作用部位があり、peptidyl-prolyl isomerase NIMA interacting protein 1 (Pin1)は188-201配列に、ダイニン軽鎖1 (dynein light chain 1, Dlc1)およびダイニン軽鎖2 (dynein light chain 2, Dlc2)は203-212配列に、アクチン重合に関与するCdc42に選択的なコリビスチン(collybistin)は319-329配列に作用する。また、タンパク分解をされやすいのもCドメインである。
組み換えゲフィリンの過剰発現実験の結果から、様々な細胞株において凝集体を形成することが確認されており、現在はGドメインの三量体化とEドメインの二量体化による六方格子(hexagonal lattice)モデルが仮定されている[2] [3](図2)。
アイソフォーム
転写産物は複数のエクソンから選択的スプライシングされるため、多様なアイソフォームが存在すると考えられる。但し、ゲフィリンの各スプライシング変異体とそれらの名称は文献によって混在しており、異なるスプライシング変異体が同一の名称で呼ばれている場合があるので注意が必要である。こうしたことから、変異体の名称を統一することも提唱されている[7]。また、変異体の組織特異性と生物種特異性が報告されているが、後者については検討(検証)が不十分との指摘もある[7]。
なお、哺乳類と鳥類では1つのゲフィリン遺伝子が存在するが、ゼブラフィッシュでは2つの遺伝子(gphnaとgphnb)が存在する[9] [10]。
翻訳後修飾
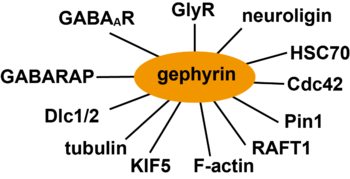
(GABAAR:GABAA受容体、GlyR:グリシン受容体、HSC70:HSP70熱ショックタンパク質、KIF5:キネシンスーパーファミリータンパク質5、Dlc1/2:ダイニン軽鎖1/2、GABARAP:GABAA receptor-associated protein)
ゲフィリンはリン酸化、パルミトイル化、アセチル化によってその機能と局在が変化する。例えば、ゲフィリンのシナプス局在は細胞接着分子であるβ1インテグリンの活性化により増加する一方、β3インテグリンの活性化によって減少する[11]。また、ゲフィリンのセリン残基268が分裂促進因子活性化タンパク質キナーゼであるERK1/2によって[12]、セリン残基270がグリコーゲン合成酵素キナーゼであるGSK3βによって[13]リン酸化されると、ゲフィリンのシナプス局在が減少する。これはCa2+/ERK依存性セリンプロテアーゼであるカルパイン1によるゲフィリンの分解によると考えられる[4]。この他、Cdk5によるセリン残基270のリン酸化[14]や熱ショックタンパク質であるHsc70[15]、アクチン結合タンパク質のプロフィリン1/2、mammalian Ena/VASP (enabled/vasodilator stimulated phosphoprotein)、Raft 1、チューブリンなどの因子が報告されている[7] [4](図3)。
発現
組織分布
ゲフィリンは脊髄や脳幹のグリシン作動性シナプスのみならず、中枢神経で広く発現が認められ、網膜、嗅球、海馬、大脳皮質のGABA作動性シナプスにおいても確認されている[1]。また、中枢神経系以外に肝臓、心臓、筋肉といった末梢組織でも多様なアイソフォームが確認されている[16]。
細胞局在
これまで、ゲフィリンはグリシン受容体に先行して抑制性シナプス後膜の細胞質側に凝集すると考えられてきた[17] [18]。そのため、抑制性シナプスの指標として用いられることも多い。超解像顕微鏡を用いた報告によれば、抑制性シナプス後膜領域にはゲフィリン分子が約5,000-10,000/μm2の密度で凝集している[19]。しかし、ライブセルイメージングによってマイクロメートルのスケールでみると、ゲフィリンはダイナミックに動いており、樹状突起の微小管に沿った移動も報告されている[20] [21] [22]。このことから、実際には動的平衡状態を維持していると考えられる。また、ゲフィリンの運動性は神経活動に応じて変化することが報告されており[23] [24]、これは細胞骨格であるFアクチンや微小管とゲフィリンとの結合がCA2+依存的に変化するためであると考えられる[23]。
機能
グリシン受容体/GABAA受容体の固定化
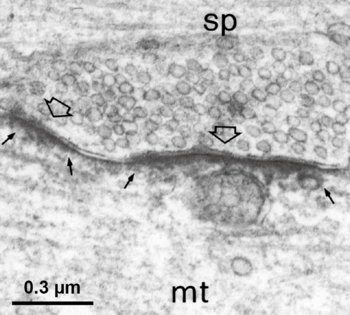
DAB染色による電子顕微鏡画像 (スケールバー 0.3 μm)[25]使用許諾 未取得
グリシン受容体が集積するマイクロドメインは、グリシン作動性シナプス前終末と対応したシナプス後膜に認められる[26](図4)。その際、グリシン受容体βサブユニットの細胞質ループに存在する18のアミノ酸モチーフにゲフィリンが結合することで、シナプス後膜におけるグリシン受容体の係留に関与している[27]。そのため、免疫組織化学法においては、しばしば(グリシン受容体βサブユニットとヘテロマーを形成する)グリシン受容体α1サブユニット特異的抗体を用い、ゲフィリン抗体と二重染色することでシナプス後膜に局在するグリシン受容体が標識される。
但し、ゲフィリンはグリシン受容体α2サブユニットにも低親和性結合を示すことから、α2ホモメリックグリシン受容体がシナプスに係留される可能性も示唆されている[28] [29]。
実際にアンチセンスオリゴヌクレオチドによってゲフィリンの発現を阻害すると、シナプスにおけるグリシン受容体の局在が減少する[17]。更に、相同組み換えによって全てのゲフィリンアイソフォームをノックアウトしたマウスでは、シナプスにおけるグリシン受容体の局在が減少する[30]。こうしたことから、グリシン受容体はゲフィリンと結合することで凝集体を形成し、解離することで拡散することが知られている[31] [32]。
GABAA受容体については、ゲフィリンとGABAA受容体α2サブユニット、γ2サブユニットの結合が示唆されている[33] [34]。また、GABARAPはゲフィリンCドメインと結合するものの、GABAA受容体とゲフィリンの輸送に必須ではない[35]。グリシン受容体に比べGABAA受容体のサブユニットは多様であり、GABAA受容体に対するゲフィリンの役割は未だ十分明らかになっていない。
また、ゲフィリンはシナプス後膜における細胞接着分子であるニューロリギンとの結合が知られている[4]。ニューロリギン2欠損マウスでは、ゲフィリンのシナプス局在が減少し、GABAおよびグリシン作動性の微小シナプス後膜電流(mIPSC)の大きさと頻度が減少することから、ニューロリギンがゲフィリンのシナプス局在に関わることが示唆されている[36]。また、マウスの網膜、上丘、視床、脳幹、脊髄においては、ニューロリギン4がゲフィリンと共局在するという報告がある[37]。
輸送カーゴ補助タンパク質として
加えて、ゲフィリンが輸送カーゴ補助タンパク質として、グリシン受容体の細胞内輸送に関与することも示唆されている[22]。粗面小胞体-ゴルジ体を経て分泌小胞に包まれたグリシン受容体は、ゲフィリンを介して順行性輸送タンパク質であるKIF5(KIF1A)に結合し、微小管に沿って輸送されることが報告されている[22]。また、逆行性輸送タンパク質であるダイニンを構成するダイニン軽鎖(Dlc1/2)とゲフィリンが結合することも報告されている[38]。
関連項目
参考文献
- ↑ 1.0 1.1 1.2
Kneussel, M., & Betz, H. (2000).
Receptors, gephyrin and gephyrin-associated proteins: novel insights into the assembly of inhibitory postsynaptic membrane specializations. The Journal of physiology, 525 Pt 1, 1-9. [PubMed:10811719] [PMC] [WorldCat] [DOI] - ↑ 2.0 2.1
Sola, M., Bavro, V.N., Timmins, J., Franz, T., Ricard-Blum, S., Schoehn, G., ..., & Weissenhorn, W. (2004).
Structural basis of dynamic glycine receptor clustering by gephyrin. The EMBO journal, 23(13), 2510-9. [PubMed:15201864] [PMC] [WorldCat] [DOI] - ↑ 3.0 3.1
Schwarz, G., Schrader, N., Mendel, R.R., Hecht, H.J., & Schindelin, H. (2001).
Crystal structures of human gephyrin and plant Cnx1 G domains: comparative analysis and functional implications. Journal of molecular biology, 312(2), 405-18. [PubMed:11554796] [WorldCat] [DOI] - ↑ 4.0 4.1 4.2 4.3 Resource not found in PubMed. 引用エラー: 無効な
<ref>タグ; name "ref19"が異なる内容で複数回定義されています - ↑
Schmitt, B., Knaus, P., Becker, C.M., & Betz, H. (1987).
The Mr 93,000 polypeptide of the postsynaptic glycine receptor complex is a peripheral membrane protein. Biochemistry, 26(3), 805-11. [PubMed:3032237] [WorldCat] [DOI] - ↑
Kirsch, J., Langosch, D., Prior, P., Littauer, U.Z., Schmitt, B., & Betz, H. (1991).
The 93-kDa glycine receptor-associated protein binds to tubulin. The Journal of biological chemistry, 266(33), 22242-5. [PubMed:1657993] [WorldCat] - ↑ 7.0 7.1 7.2 7.3 7.4
Fritschy, J.M., Harvey, R.J., & Schwarz, G. (2008).
Gephyrin: where do we stand, where do we go? Trends in neurosciences, 31(5), 257-64. [PubMed:18403029] [WorldCat] [DOI] - ↑
Specht, C.G., Grünewald, N., Pascual, O., Rostgaard, N., Schwarz, G., & Triller, A. (2011).
Regulation of glycine receptor diffusion properties and gephyrin interactions by protein kinase C. The EMBO journal, 30(18), 3842-53. [PubMed:21829170] [PMC] [WorldCat] [DOI] - ↑
David-Watine, B. (2001).
The human gephyrin (GPHN) gene: structure, chromosome localization and expression in non-neuronal cells. Gene, 271(2), 239-45. [PubMed:11418245] [WorldCat] [DOI] - ↑
Hirata, H., Takahashi, M., Yamada, K., & Ogino, K. (2011).
The biological role of the glycinergic synapse in early zebrafish motility. Neuroscience research, 71(1), 1-11. [PubMed:21712054] [WorldCat] [DOI] - ↑
Charrier, C., Machado, P., Tweedie-Cullen, R.Y., Rutishauser, D., Mansuy, I.M., & Triller, A. (2010).
A crosstalk between β1 and β3 integrins controls glycine receptor and gephyrin trafficking at synapses. Nature neuroscience, 13(11), 1388-95. [PubMed:20935643] [WorldCat] [DOI] - ↑
Tyagarajan, S.K., Ghosh, H., Yévenes, G.E., Imanishi, S.Y., Zeilhofer, H.U., Gerrits, B., & Fritschy, J.M. (2013).
Extracellular signal-regulated kinase and glycogen synthase kinase 3β regulate gephyrin postsynaptic aggregation and GABAergic synaptic function in a calpain-dependent mechanism. The Journal of biological chemistry, 288(14), 9634-47. [PubMed:23408424] [PMC] [WorldCat] [DOI] - ↑
Tyagarajan, S.K., Ghosh, H., Yévenes, G.E., Nikonenko, I., Ebeling, C., Schwerdel, C., ..., & Fritschy, J.M. (2011).
Regulation of GABAergic synapse formation and plasticity by GSK3beta-dependent phosphorylation of gephyrin. Proceedings of the National Academy of Sciences of the United States of America, 108(1), 379-84. [PubMed:21173228] [PMC] [WorldCat] [DOI] - ↑
Kuhse, J., Kalbouneh, H., Schlicksupp, A., Mükusch, S., Nawrotzki, R., & Kirsch, J. (2012).
Phosphorylation of gephyrin in hippocampal neurons by cyclin-dependent kinase CDK5 at Ser-270 is dependent on collybistin. The Journal of biological chemistry, 287(37), 30952-66. [PubMed:22778260] [PMC] [WorldCat] [DOI] - ↑
Machado, P., Rostaing, P., Guigonis, J.M., Renner, M., Dumoulin, A., Samson, M., ..., & Triller, A. (2011).
Heat shock cognate protein 70 regulates gephyrin clustering. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(1), 3-14. [PubMed:21209184] [PMC] [WorldCat] [DOI] - ↑
Bowery, N.G., & Smart, T.G. (2006).
GABA and glycine as neurotransmitters: a brief history. British journal of pharmacology, 147 Suppl 1, S109-19. [PubMed:16402094] [PMC] [WorldCat] [DOI] - ↑ 17.0 17.1
Kirsch, J., Wolters, I., Triller, A., & Betz, H. (1993).
Gephyrin antisense oligonucleotides prevent glycine receptor clustering in spinal neurons. Nature, 366(6457), 745-8. [PubMed:8264797] [WorldCat] [DOI] - ↑
Kneussel, M., & Betz, H. (2000).
Clustering of inhibitory neurotransmitter receptors at developing postsynaptic sites: the membrane activation model. Trends in neurosciences, 23(9), 429-35. [PubMed:10941193] [WorldCat] [DOI] - ↑
Specht, C.G., Izeddin, I., Rodriguez, P.C., El Beheiry, M., Rostaing, P., Darzacq, X., ..., & Triller, A. (2013).
Quantitative nanoscopy of inhibitory synapses: counting gephyrin molecules and receptor binding sites. Neuron, 79(2), 308-21. [PubMed:23889935] [WorldCat] [DOI] - ↑
Hanus, C., Vannier, C., & Triller, A. (2004).
Intracellular association of glycine receptor with gephyrin increases its plasma membrane accumulation rate. The Journal of neuroscience : the official journal of the Society for Neuroscience, 24(5), 1119-28. [PubMed:14762130] [PMC] [WorldCat] [DOI] - ↑
Maas, C., Tagnaouti, N., Loebrich, S., Behrend, B., Lappe-Siefke, C., & Kneussel, M. (2006).
Neuronal cotransport of glycine receptor and the scaffold protein gephyrin. The Journal of cell biology, 172(3), 441-51. [PubMed:16449194] [PMC] [WorldCat] [DOI] - ↑ 22.0 22.1 22.2
Maas, C., Belgardt, D., Lee, H.K., Heisler, F.F., Lappe-Siefke, C., Magiera, M.M., ..., & Kneussel, M. (2009).
Synaptic activation modifies microtubules underlying transport of postsynaptic cargo. Proceedings of the National Academy of Sciences of the United States of America, 106(21), 8731-6. [PubMed:19439658] [PMC] [WorldCat] [DOI] - ↑ 23.0 23.1
Hanus, C., Ehrensperger, M.V., & Triller, A. (2006).
Activity-dependent movements of postsynaptic scaffolds at inhibitory synapses. The Journal of neuroscience : the official journal of the Society for Neuroscience, 26(17), 4586-95. [PubMed:16641238] [PMC] [WorldCat] [DOI] - ↑
Kuriu, T., Yanagawa, Y., & Konishi, S. (2012).
Activity-dependent coordinated mobility of hippocampal inhibitory synapses visualized with presynaptic and postsynaptic tagged-molecular markers. Molecular and cellular neurosciences, 49(2), 184-95. [PubMed:22146684] [WorldCat] [DOI] - ↑
Giustetto, M., Kirsch, J., Fritschy, J.M., Cantino, D., & Sassoè-Pognetto, M. (1998).
Localization of the clustering protein gephyrin at GABAergic synapses in the main olfactory bulb of the rat. The Journal of comparative neurology, 395(2), 231-44. [PubMed:9603375] [WorldCat] [DOI] - ↑
Lévi, S., Logan, S.M., Tovar, K.R., & Craig, A.M. (2004).
Gephyrin is critical for glycine receptor clustering but not for the formation of functional GABAergic synapses in hippocampal neurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 24(1), 207-17. [PubMed:14715953] [PMC] [WorldCat] [DOI] - ↑
Meyer, G., Kirsch, J., Betz, H., & Langosch, D. (1995).
Identification of a gephyrin binding motif on the glycine receptor beta subunit. Neuron, 15(3), 563-72. [PubMed:7546736] [WorldCat] [DOI] - ↑
Takagi, T., Pribilla, I., Kirsch, J., & Betz, H. (1992).
Coexpression of the receptor-associated protein gephyrin changes the ligand binding affinities of alpha 2 glycine receptors. FEBS letters, 303(2-3), 178-80. [PubMed:1318846] [WorldCat] [DOI] - ↑
Muller, E., Le-Corronc, H., & Legendre, P. (2008).
Extrasynaptic and postsynaptic receptors in glycinergic and GABAergic neurotransmission: a division of labor? Frontiers in molecular neuroscience, 1, 3. [PubMed:18946536] [PMC] [WorldCat] [DOI] - ↑
Feng, G., Tintrup, H., Kirsch, J., Nichol, M.C., Kuhse, J., Betz, H., & Sanes, J.R. (1998).
Dual requirement for gephyrin in glycine receptor clustering and molybdoenzyme activity. Science (New York, N.Y.), 282(5392), 1321-4. [PubMed:9812897] [WorldCat] [DOI] - ↑
Meier, J., Meunier-Durmort, C., Forest, C., Triller, A., & Vannier, C. (2000).
Formation of glycine receptor clusters and their accumulation at synapses. Journal of cell science, 113 ( Pt 15), 2783-95. [PubMed:10893193] [WorldCat] - ↑
Meier, J., & Grantyn, R. (2004).
A gephyrin-related mechanism restraining glycine receptor anchoring at GABAergic synapses. The Journal of neuroscience : the official journal of the Society for Neuroscience, 24(6), 1398-405. [PubMed:14960612] [PMC] [WorldCat] [DOI] - ↑
Tretter, V., Jacob, T.C., Mukherjee, J., Fritschy, J.M., Pangalos, M.N., & Moss, S.J. (2008).
The clustering of GABA(A) receptor subtypes at inhibitory synapses is facilitated via the direct binding of receptor alpha 2 subunits to gephyrin. The Journal of neuroscience : the official journal of the Society for Neuroscience, 28(6), 1356-65. [PubMed:18256255] [PMC] [WorldCat] [DOI] - ↑
Günther, U., Benson, J., Benke, D., Fritschy, J.M., Reyes, G., Knoflach, F., ..., & Lüscher, B. (1995).
Benzodiazepine-insensitive mice generated by targeted disruption of the gamma 2 subunit gene of gamma-aminobutyric acid type A receptors. Proceedings of the National Academy of Sciences of the United States of America, 92(17), 7749-53. [PubMed:7644489] [PMC] [WorldCat] [DOI] - ↑
O'Sullivan, G.A., Kneussel, M., Elazar, Z., & Betz, H. (2005).
GABARAP is not essential for GABA receptor targeting to the synapse. The European journal of neuroscience, 22(10), 2644-8. [PubMed:16307606] [WorldCat] [DOI] - ↑
Poulopoulos, A., Aramuni, G., Meyer, G., Soykan, T., Hoon, M., Papadopoulos, T., ..., & Varoqueaux, F. (2009).
Neuroligin 2 drives postsynaptic assembly at perisomatic inhibitory synapses through gephyrin and collybistin. Neuron, 63(5), 628-42. [PubMed:19755106] [WorldCat] [DOI] - ↑
Hoon, M., Soykan, T., Falkenburger, B., Hammer, M., Patrizi, A., Schmidt, K.F., ..., & Varoqueaux, F. (2011).
Neuroligin-4 is localized to glycinergic postsynapses and regulates inhibition in the retina. Proceedings of the National Academy of Sciences of the United States of America, 108(7), 3053-8. [PubMed:21282647] [PMC] [WorldCat] [DOI] - ↑
Fuhrmann, J.C., Kins, S., Rostaing, P., El Far, O., Kirsch, J., Sheng, M., ..., & Kneussel, M. (2002).
Gephyrin interacts with Dynein light chains 1 and 2, components of motor protein complexes. The Journal of neuroscience : the official journal of the Society for Neuroscience, 22(13), 5393-402. [PubMed:12097491] [PMC] [WorldCat] [DOI]