先天性大脳白質形成不全症
井上 健
国立研究開発法人国立精神・神経医療研究センター
DOI:10.14931/bsd.6698 原稿受付日:2016年1月15日 原稿完成日:2016年1月19日
担当編集委員:漆谷 真(滋賀医科大学 医学部 脳神経内科)
英:congenital hypomyelinating leukodystrophy
同義語:ミエリン形成不全症
先天的な中枢神経系のミエリン形成不全を本態とする疾患群を総称して、先天性大脳白質形成不全症という。代表的疾患であるPelizaeus-Merzbacher病(PMD)をはじめ、現在11疾患が知られているが、PMD以外の疾患は極めて稀である。11疾患すべてにおいて、原因遺伝子が同定されている。臨床的には重度の精神運動発達遅滞、痙性四肢麻痺に加え様々な神経症状を呈する。診断には頭部MRI、電気生理学的検査、遺伝子解析を組み合わせて行う。PMDの原因は主要なミエリン膜タンパク質をコードするPLP1遺伝子の変異で、重複、点変異、欠失などが同定されている。オリゴデンドロサイト前駆細胞(OPC)から成熟オリゴデンドロサイトへの分化に伴うミエリン化の開始と同時に、オリゴデンドロサイトが急速に細胞死に陥ることがPLP1変異の共通の細胞病態である。一方、細胞死を引き起す分子病態はPLP1の変異の種類によって異なり、それに応じて臨床型や重症度も異なる。根治療法はなく、対症療法が現在の医療的ケアの中心である。研究レベルでは、いくつかの化合物や高脂肪食、幹細胞移植などの有効性が報告されている。
先天性大脳白質形成不全症とは
先天性大脳白質形成不全症は、ミエリン(髄鞘)の構成成分やミエリン化に必要な因子などの遺伝的な異常が原因でおこる、中枢神経系のミエリン化の広範かつ著明な低下あるいは停止を特徴とする疾患群である。いわゆる白質変性症 leukodystrophyという疾患概念は、神経病理学的に大脳白質が特異的に障害され、変性によって破壊される疾患を示す言葉として長く使われて来たが、実際にはミエリンが「破壊される疾患=demyelinating」と「最初からうまく出来ない疾患=hypomyelinating」に分類される。先天性大脳白質形成不全症は後者を示すものである。代表的疾患であるPelizaeus-Merzbacher病(PMD)をはじめ、現在11疾患が知られている(表1)が、PMD以外の疾患は極めて稀である。11疾患すべてにおいて、原因遺伝子が同定されている。
| 疾患名 | 略称 | 遺伝子座 | 遺伝子 |
|---|---|---|---|
| 第1群(末梢神経障害なし) | |||
| Pelizaeus-Merzbacher病 | PMD | Xq22.2 | PLP1 |
| Pelizaeus-Merzbacher-like病1 | PMLD1 | 1q42.13 | GJC2 |
| 基底核および小脳萎縮を伴う髄鞘形成不全症 Hypomyelination with atrophy of the basal ganglia and cerebellum | HABC | 19p13.3 | TUBB4A |
| 18q欠失症候群 | 18qDEL | 18q22→qter | MBP |
| Allan-Herndon-Dudleys症候群 | AHDS | Xq13.2 | SLC16A2 |
| Hsp60 chaperonopathy | MitChap60 | 2q33.1 | HSPD1 |
| Salla病 | SD | 6q13 | SLC17A5 |
| 小脳萎縮と脳梁低形成を伴うび漫性大脳白質形成不全症 Diffuse cerebral hypomyelination with cerebellar atrophy and hypoplasia of the corpus callosum | HCAHC | 12q23.3 | POLR3B |
| 第2群(末梢神経障害あり) | |||
| 先天性白内障を伴う髄鞘形成不全症 Hypomyelination and congenital cataract | HCC | 7p15.3 | FAM126A |
| 失調、歯牙低形成を伴う髄鞘形成不全症 Ataxia, delayed dentition, and hypomyelination | ADDH (or 4H) | 10q22.3 | POLR3A |
| 脱髄型ニューロパチー、中枢性髄鞘形成不全症、ワーデンバーグ症候群、ヒルシュスプルング病 Peripheral demyelinating neuropathy, central dysmyelination, Waardenburg syndrome, and Hirschsprung disease | PCWH | 22q13 | SOX10 |
先天性大脳白質形成不全症の症状
PMDを含めこれらの疾患は、臨床的に共通した検査所見および臨床症状を呈する。すべての疾患に共通する所見として
- 錐体路障害:痙性四肢(下肢)麻痺
- MRI画像所見:T2強調画像で、白質にび漫性の高信号領域(脱髄の所見は除外される)
の2つが挙げられ、随伴所見として
- 眼振
- 精神運動発達遅滞
- 小脳障害:体幹・四肢の失調症状、企図振戦、小児期には測定障害、変換障害、不明瞭言語など
- 大脳基底核障害:固縮、ジストニア
- てんかん
- 電気生理学的検査所見:誘発電位で中枢伝導障害
が挙げられる。
Pelizaeus-Merzbacher病
以下に、代表的な先天性大脳白質形成不全症であるPelizaeus-Merzbacher病について概説する。
疾患の概要
Pelizaeus-Merzbacher病 (PMD)は、出生直後より知的運動発達の著明な遅れ、眼振、低緊張、痙性四肢麻痺、小脳失調、ジストニアなどを呈する小児の難治性稀少性神経疾患である。原因遺伝子phospholipid protein 1 (PLP1)はXq22.2に存在する。X染色体連鎖性劣性遺伝形式をとり、患者は基本的に男児のみである。生直後から遅くとも1カ月程度までに眼振で気づかれることが多い。生後から半年程度までは筋緊張低下の症状を呈するが、原始反射の消失が遅れ、Babinski反射は半年を超えても陽性であり、やがて腱反射の亢進も明らかになり一次ニューロンの問題を示す。小脳症状としての企図振戦は1歳過ぎには、注意深く観察すると明らかであることが多い。また、2歳頃にはアテトーゼ様の異常肢位が発現してくる。
このように中枢神経系の運動、運動制御系、大脳基底核のすべての症状が相次いで出現するのがこの疾患の特徴であるが、後年眼振は目立たなくなり、関節拘縮が進むと小脳症状も気づかれず、年長児で痙性と固縮をもつ脳性麻痺として診断されている例も多い。通常10〜20歳代を過ぎると症状の退行が始まり、平均寿命は30歳前後と思われる。症状の退行と平行して、画像上の脳萎縮を認める。
臨床的亜型として、乳幼児期の運動知的発達がほぼ正常で、学童期以降にゆっくりと退行するX連鎖性痙性対麻痺の表現型をとることがある(痙性対麻痺2型;SPG2)。
診断
診断は、臨床所見に加え、画像および遺伝子検査、さらに電気生理学的検査を組み合わせて行う[1]。画像では頭部MRIが有用かつ必須である。T2強調画像で、大脳白質にびまん性の高信号領域を認める。T2強調画像での高信号がミエリン化の遅延・停止なのか、それとも脱髄なのかの鑑別が重要である。一般的に脱髄性疾患では、T2強調画像で著しい高信号を呈する部位を認めることが多く、同部位はT1強調画像では低信号を呈する。ミエリン化不全の判断には、正常小児のミエリン化パターンを知ることが必要である。MRスペクロスコピーではN-アセチルアスパラギン酸(NAA)とクレアチンの上昇、コリンの低下を認めるが、特にNAAの上昇はPelizaeus-Merzbacher病に特異的である[2]。Pelizaeus-Merzbacher病以外の先天性大脳白質形成不全症では、基底核萎縮、小脳萎縮などの所見を合併することがある。
PLP1遺伝子解析においては、変異の多様性を念頭に置き、異なる検査方法を組み合わせる必要がある。PLP1重複は、定量的PCR法や間期核FISH法などにより正常の2倍量のPLP1の存在により確認できる。また、新たな技術としてMLPA(multiplex ligation-dependent probe amplification)やアレイCGH(microarray-based comparative genomic hybridization)などでも診断可能である。MLPAはすべてのエクソンについての定量解析が可能であるため、部分重複も検出可能である。アレイCGHでは、網羅的な解析が可能である点が特徴である。高密度アレイを用いれば、重複のサイズも同定できるため、得られる情報量が多い。これらの方法は、保因者診断にも用いることができる。点変異の検出には、各エクソンをPCR増幅後に直接塩基配列決定法を用いて解析する。欠失はそのサイズによって検出の可否が異なるが、通常欠失領域のエクソンはMLPAやPCRで増幅されないため、比較的容易に同定できる。FISH、アレイCGHも有効であるが、小さな部分欠失は検出できないことがあるので注意が必要である。
電気生理学的検査は、画像診断や遺伝子解析に比べると特異性に劣るが、MRIでの髄鞘形成不全の描出が難しい生後6ヶ月までの時期には診断的有用性が高い。聴覚脳幹反応において、II波以降の潜時の延長が見られる。Pelizaeus-Merzbacher病ではニューロパチーの合併は通常認めないが、PLP1のnull変異の症例では軽度から中等度の神経伝導速度の低下を認めることが多い。また、イントロンのスプライス変異の症例では、比較的重度のPelizaeus-Merzbacher病例であっても神経伝導速度が低下することがある。Pelizaeus-Merzbacher病以外の先天性大脳白質形成不全症の症例では、ニューロパチーを合併する疾患もあるため(表1)、神経伝導速度の測定は積極的に実施していくことが望ましい。
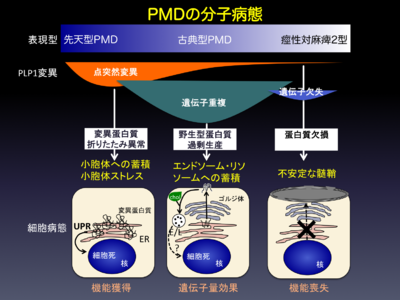
Pelizaeus-Merzbacher病の臨床像は重症の先天型から軽症の痙性対麻痺2型まで、幅広いスペクトラムを呈する。変異の種類と表現型の間にある程度の相関を有する。また変異の種類によって異なる細胞病態を呈する。点変異によりアミノ酸置換を来した変異PLP1タンパク質は、小胞体(ER)に蓄積することによって小胞体ストレスを誘導する。過剰な小胞体ストレスによりunfolded protein response(UPR)の細胞死シグナル経路が活性化されると、オリゴデンドロサイトは死に至る。遺伝子重複によって過剰産生された野生型PLP1タンパク質は、正常に膜輸送されるが、その後コレステロール(chol)に結合して後期エンドソーム・リソソーム(E/L)に蓄積するが、細胞死に至る細胞分子病態は不明である。遺伝子欠失などのnull変異は、疾患スペクトラムの中では軽症型となる痙性対麻痺を呈する。PLP1の欠損は、髄鞘化そのものには大きな影響を及ぼさないが、PLP1が欠落している髄鞘は脆弱で壊れやすい。
病態生理
中枢神経系のミエリンが広範かつび漫性に欠落することがPelizaeus-Merzbacher病の一次的な組織学的病因である。オリゴデンドロサイトは広く脱落する。一方で、軸索は比較的保たれている。一部、皮質直下のUファイバーに島状にミエリン化を認める(tigroidと呼ばれる)。
遺伝学的病因は、PLP1遺伝子の変異である。PLP1は四回貫通型構造をとる主要なミエリン膜タンパク質をコードする。17kbのゲノム領域に渡る7つのエクソンから構成される。PLP1とDM20という2つのスプライス多型を有する。DM20はエクソン3の後半35残基分が欠落している。このPLP1特異的領域に生じた変異は、DM20のアミノ酸配列には影響を及ぼさないため、臨床的には軽症のSPG2となる。PLP1の変異で最も頻度が高いのはPLP1全体を含むゲノム重複(60〜70%)である。点変異(20〜30%)はアミノ酸置換変異が多く、変異は全エクソンに均等に分布する。頻度は低いが、微小欠失挿入変異やナンセンス変異も見出される。エクソン以外にイントロン部位の変異も見出されている。遺伝子全体を含む欠失は、重複に比べて頻度は低い。
オリゴデンドロサイト前駆細胞から成熟オリゴデンドロサイトへの分化に伴うミエリン化の開始と同時に、オリゴデンドロサイトが急速に細胞死に陥ることが各PLP1変異の共通の細胞病態であるが、細胞死を引き起す分子病態はPLP1の変異の種類によって異なり、それに応じて臨床型や重症度も異なるので、その理解は重要である[3](図1)。
遺伝子重複はXq22.2付近の中間部重複により、PLP1のコピー数が増え、正常配列のPLP1の発現量が増加することによって、ミエリン形成不全をきたすと考えられる。この病態を遺伝子量効果 gene dosage effectと呼ぶ。重複ゲノム領域の大きさは、数十Kbから数Mbに及ぶが、最も頻度が高いのは500Kb前後の重複である。付近のPLP1以外の遺伝子も重複しているが、数Mbに渡る大きな重複でない限り、重症度や臨床症状への影響はない。PLP1重複の臨床表現型には幅があるものの、典型的には最も頻度が高い古典型Pelizaeus-Merzbacher病を呈する(図1)。稀に3重複の症例の報告があり、重症の表現型をとる。細胞病態の詳細は不明であるが、過剰発現したPLP1タンパク質は細胞内でコレステロールと結合したまま、後期エンドソーム/リソソームに蓄積することが明らかになっており、脂質に関連した分子病態が示唆されている[4]。
点変異は、重症(先天型)から軽症(SPG2)まで幅広い臨床像を呈する(図1)。変異はしばしば家系に特異的で、頻度の高い共通変異や創始者効果はない。アミノ酸置換の細胞病態として、 折りたたみ異常を来した変異体PLP1が小胞体に蓄積して惹起する小胞体ストレスの関与が知られている[5]。細胞は小胞体ストレスに対する防御機構 unfolded protein response (UPR)を誘導するが、過剰な蓄積によりUPRが破綻し、アポトーシス誘導経路が活性化され、最終的に死に陥る。また、PLP1以外の分泌・膜タンパク質の輸送障害を引き起すことも明らかになっている[6]。疾患の重症度と変異部位のアミノ酸残基の進化上の保存度の間に関連性が示唆されているが、生物学的な実証はされていない。
PLP1遺伝子の機能喪失型(null)変異は稀であるが、臨床症状が特徴的であるので、注意を要する。原因変異は、PLP1ゲノム領域の全長あるいは部分欠失、翻訳領域内のナンセンス変異や一部のスプライス変異などが含まれる。臨床症状は、軽症型でしばしばSPG2と診断される。軽度の脱髄型あるいは混合型ニューロパチーを合併する。保因者女性に幼児期発症の痙性対麻痺や成人期発症の歩行障害や認知障害などの症状を認める(症候性保因者)ため、一見、優性遺伝形式の様に見えることがある。PLP1の欠損はミエリン形成そのものへの影響は少ないが、PLP1が欠落したミエリンは不安定で壊れやすい。一方、より重症の表現型となる重複や点変異は、機能獲得型変異と考えられており、オリゴデンドロサイトの細胞死を誘導する結果、重度のミエリン形成不全を来す(図1)。
治療
リハビリテーションや適切な装具の使用、呼吸や栄養の管理、筋弛緩剤や抗痙攣薬などの対症療法が現在の医療的ケアの中心になっている。これらの対症療法の進歩により、Pelizaeus-Merzbacher病患者の予後は著明に改善している。全般的に先天性大脳白質形成不全症患者では、知的障害に運動障害を伴うことから、脳性麻痺児と同様の療育を受けることが実際的である。てんかん様発作は25%程度の患者に認めるが、Pelizaeus-Merzbacher病患者では実際に脳波異常を伴うことは少ない。治療は一般的な小児のてんかんの治療法に基づく。全身性のジストニアに関しては筋弛緩薬や抗痙縮剤、局所性のジストニアではボツリヌス毒素を用いる。股関節の痙性脱臼は、大腿骨が内転・内旋・屈位になりやすいためにおこる。外転位保持夜間装具が必要となる場合がある。高度例では整形外科的な腸腰筋延長・切離術をおこなう。呼吸障害に関しては、喉頭咽頭機能不全のために、誤嚥性肺炎を起こしやすい。また経口摂取が難しい症例では、経胃管あるいは胃瘻からの栄養補給が行われる。筋緊張亢進のために、胃食道逆流を伴う症例では、噴門形成術を併用する。
現在までに疾患に対する根治的な治療法はないが、基礎研究および治験レベルでは、疾患の分子細胞病態を標的とした治療法の試みが行われている。点変異に対しては、マウスモデルや培養細胞を用いた研究で、クルクミンやクロロキンなどが部分的に有効と報告された[7][8]。また、重複に対しては、高コレステール食がミエリン化を促進することが報告された[9]。幹細胞移植による再生医療は、先天性大脳白質形成不全症に対する有望な治療法として期待されている。モデルマウスを用いた報告はこれまでにもなされていたが、最近、米国において患者に対する神経幹細胞の移植治療が試験的に行われ、その安全性と部分的な治療効果が報告された[10]。
疫学
本邦における全国疫学調査によると、先天性大脳白質形成不全症の有病率は人口10万人(1~19歳)当たり0.78人である[11]。Pelizaeus-Merzbacher病の罹患率は男児10万出生当たり1.4人であった。また、この調査でもPelizaeus-Merzbacher病は最も頻度の高いことが明らとなり、その推定罹患率は男児10万出生当たり1.45人であった。遺伝学的検査を受けた先天性大脳白質形成不全症患者のうち、62%でPLP1遺伝子の変異が同定されていた。
モデル動物
数多くの動物モデルがPMDの病態解明と治療法開発のために用いられていおり、実際に主要な分子細胞機序はこれらの動物モデルを用いた解析から明らかになっている。自然発生モデルと遺伝子改変モデルの両方が確立しており、マウスをはじめ、イヌ、ウサギ、ラットなどのモデル動物が知られている。
自然発生モデルの多くは、タンパク質をコードするエクソンやスプライス・ジャンクションの変異によって、アミノ酸置換やエクソン欠失など構造変化を引き起す。これらのうちjimpy(jp)とmyelin synthesis deficit(msd)マウスは、重症型PMDのモデルとして用いられている[12][13]。どちらも重度の神経症状を呈し、生後1ヶ月ほどで死亡する。脳ではオリゴデンドロサイトのアポトーシスの増加により、成熟オリゴデンドロサイトの数は減少し、ミエリン鞘がほとんど形成されていない。一方、軽症型PMDあるいはSPG2のモデルとして、rumpshaker(rsh)マウス、shaking(sh)イヌ、paralytic tremor(pt)ウサギなどが知られている[14][15][16]。これらのモデル動物は、症状は比較的軽度で、成体まで生存する。脳ではミエリン形成不全の程度は軽く、成熟オリゴデンドロサイトも存在する。これらのモデル動物のうち、jp、msd、rshマウスの変異は、ヒトPMD/SPG2患者で全く同じ変異が見つかっており、表現型もこれらヒト患者の重症度にそぐうものであるため、これらのモデルマウスはヒト患者における重症度の多様性の分子細胞機序の研究のためのツールとして適している。
トランスジェニックおよびノックアウトマウスは、遺伝子改変モデルとして報告されている[17][18][19][20]。トランスジェニックマウスは、PMDの遺伝子重複変異のモデルとなる。コスミドクローンを用いたゲノム重複モデルは、PLP1とDM20の両方の転写産物の過剰発現を再現しているが、トランスジーンは常染色体からの発現となる。最近、リコンビニアリングの技術を用いたマウスPlp1遺伝子座のゲノム重複をもつマウスも作られている[21]。これら過剰発現マウスの表現型は、発現量の多いホモ接合体の方が発現量の低いヘテロ接合体よりも重症であることから、遺伝子量効果を呈していることが分かる。一方、ノックアウトマウスでは、正常に近いミエリン形成の量とオリゴデンドロサイトの数が観察されており、PLP1欠失あるいは機能欠損変異の疾患モデルとなる。ノックアウトマウスで他の他の疾患モデルと大きく異なる点は、ミエリン形成不全を伴わずに、遅発性軸索変性を来すことである。これはPLP1が軸索の維持に必要であることを示唆するが、その分子機序は依然不明である。
関連項目
参考文献
- ↑ 井上 健,岩城明子,黒澤健司,高梨潤一,出口貴美子,山本俊至,小坂 仁
先天性大脳白質形成不全症:Pelizaeus-Merzbacher病とその類縁疾患
脳と発達:2011;43(6):435-442 - ↑
Takanashi, J., Inoue, K., Tomita, M., Kurihara, A., Morita, F., Ikehira, H., ..., & Kohno, Y. (2002).
Brain N-acetylaspartate is elevated in Pelizaeus-Merzbacher disease with PLP1 duplication. Neurology, 58(2), 237-41. [PubMed:11805250] [WorldCat] [DOI] - ↑
Inoue, K. (2005).
PLP1-related inherited dysmyelinating disorders: Pelizaeus-Merzbacher disease and spastic paraplegia type 2. Neurogenetics, 6(1), 1-16. [PubMed:15627202] [WorldCat] [DOI] - ↑
Simons, M., Kramer, E.M., Macchi, P., Rathke-Hartlieb, S., Trotter, J., Nave, K.A., & Schulz, J.B. (2002).
Overexpression of the myelin proteolipid protein leads to accumulation of cholesterol and proteolipid protein in endosomes/lysosomes: implications for Pelizaeus-Merzbacher disease. The Journal of cell biology, 157(2), 327-36. [PubMed:11956232] [PMC] [WorldCat] [DOI] - ↑
Southwood, C.M., Garbern, J., Jiang, W., & Gow, A. (2002).
The unfolded protein response modulates disease severity in Pelizaeus-Merzbacher disease. Neuron, 36(4), 585-96. [PubMed:12441049] [PMC] [WorldCat] [DOI] - ↑
Numata, Y., Morimura, T., Nakamura, S., Hirano, E., Kure, S., Goto, Y.I., & Inoue, K. (2013).
Depletion of molecular chaperones from the endoplasmic reticulum and fragmentation of the Golgi apparatus associated with pathogenesis in Pelizaeus-Merzbacher disease. The Journal of biological chemistry, 288(11), 7451-66. [PubMed:23344956] [PMC] [WorldCat] [DOI] - ↑
Yu, L.H., Morimura, T., Numata, Y., Yamamoto, R., Inoue, N., Antalfy, B., ..., & Inoue, K. (2012).
Effect of curcumin in a mouse model of Pelizaeus-Merzbacher disease. Molecular genetics and metabolism, 106(1), 108-14. [PubMed:22436581] [WorldCat] [DOI] - ↑
Morimura, T., Numata, Y., Nakamura, S., Hirano, E., Gotoh, L., Goto, Y.I., ..., & Inoue, K. (2014).
Attenuation of endoplasmic reticulum stress in Pelizaeus-Merzbacher disease by an anti-malaria drug, chloroquine. Experimental biology and medicine (Maywood, N.J.), 239(4), 489-501. [PubMed:24521562] [WorldCat] [DOI] - ↑
Saher, G., Rudolphi, F., Corthals, K., Ruhwedel, T., Schmidt, K.F., Löwel, S., ..., & Nave, K.A. (2012).
Therapy of Pelizaeus-Merzbacher disease in mice by feeding a cholesterol-enriched diet. Nature medicine, 18(7), 1130-5. [PubMed:22706386] [WorldCat] [DOI] - ↑
Gupta, N., Henry, R.G., Strober, J., Kang, S.M., Lim, D.A., Bucci, M., ..., & Rowitch, D.H. (2012).
Neural stem cell engraftment and myelination in the human brain. Science translational medicine, 4(155), 155ra137. [PubMed:23052294] [PMC] [WorldCat] [DOI] - ↑
Numata, Y., Gotoh, L., Iwaki, A., Kurosawa, K., Takanashi, J., Deguchi, K., ..., & Inoue, K. (2014).
Epidemiological, clinical, and genetic landscapes of hypomyelinating leukodystrophies. Journal of neurology, 261(4), 752-8. [PubMed:24532200] [WorldCat] [DOI] - ↑
Dautigny, A., Mattei, M.G., Morello, D., Alliel, P.M., Pham-Dinh, D., Amar, L., ..., & Guenet, J.L. (1986).
The structural gene coding for myelin-associated proteolipid protein is mutated in jimpy mice. Nature, 321(6073), 867-9. [PubMed:2425262] [WorldCat] [DOI] - ↑
Gencic, S., & Hudson, L.D. (1990).
Conservative amino acid substitution in the myelin proteolipid protein of jimpymsd mice. The Journal of neuroscience : the official journal of the Society for Neuroscience, 10(1), 117-24. [PubMed:1688931] [WorldCat] - ↑
Griffiths, I.R., Scott, I., McCulloch, M.C., Barrie, J.A., McPhilemy, K., & Cattanach, B.M. (1990).
Rumpshaker mouse: a new X-linked mutation affecting myelination: evidence for a defect in PLP expression. Journal of neurocytology, 19(2), 273-83. [PubMed:1694232] [WorldCat] [DOI] - ↑
Nadon, N.L., & Duncan, I.D. (1996).
Molecular analysis of glial cell development in the canine 'shaking pup' mutant. Developmental neuroscience, 18(3), 174-84. [PubMed:8894446] [WorldCat] [DOI] - ↑
Tosic, M., Dolivo, M., Amiguet, P., Domanska-Janik, K., & Matthieu, J.M. (1993).
Paralytic tremor (pt) rabbit: a sex-linked mutation affecting proteolipid protein-gene expression. Brain research, 625(2), 307-12. [PubMed:8275312] [WorldCat] [DOI] - ↑
Kagawa, T., Ikenaka, K., Inoue, Y., Kuriyama, S., Tsujii, T., Nakao, J., ..., & Mikoshiba, K. (1994).
Glial cell degeneration and hypomyelination caused by overexpression of myelin proteolipid protein gene. Neuron, 13(2), 427-42. [PubMed:7520255] [WorldCat] [DOI] - ↑
Readhead, C., Schneider, A., Griffiths, I., & Nave, K.A. (1994).
Premature arrest of myelin formation in transgenic mice with increased proteolipid protein gene dosage. Neuron, 12(3), 583-95. [PubMed:7512350] [WorldCat] [DOI] - ↑
Klugmann, M., Schwab, M.H., Pühlhofer, A., Schneider, A., Zimmermann, F., Griffiths, I.R., & Nave, K.A. (1997).
Assembly of CNS myelin in the absence of proteolipid protein. Neuron, 18(1), 59-70. [PubMed:9010205] [WorldCat] [DOI] - ↑
Griffiths, I., Klugmann, M., Anderson, T., Yool, D., Thomson, C., Schwab, M.H., ..., & Nave, K.A. (1998).
Axonal swellings and degeneration in mice lacking the major proteolipid of myelin. Science (New York, N.Y.), 280(5369), 1610-3. [PubMed:9616125] [WorldCat] [DOI] - ↑
Clark, K., Sakowski, L., Sperle, K., Banser, L., Landel, C.P., Bessert, D.A., ..., & Hobson, G.M. (2013).
Gait abnormalities and progressive myelin degeneration in a new murine model of Pelizaeus-Merzbacher disease with tandem genomic duplication. The Journal of neuroscience : the official journal of the Society for Neuroscience, 33(29), 11788-99. [PubMed:23864668] [PMC] [WorldCat] [DOI]