「ソニック・ヘッジホッグ」の版間の差分
細 →疾患との関わり |
細編集の要約なし |
||
| (2人の利用者による、間の48版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">[http://researchmap.jp/read0118148 笹井紀明]</font><br> | <font size="+1">[http://researchmap.jp/read0118148 笹井紀明]</font><br> | ||
''奈良先端科学技術大学院大学''<br> | ''奈良先端科学技術大学院大学''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2017年1月17日 原稿完成日:2017年月日<br> | ||
担当編集委員:[http://researchmap.jp/ | 担当編集委員:[http://researchmap.jp/noriko1128 大隅 典子](東北大学 大学院医学系研究科 附属創生応用医学研究センター 脳神経科学コアセンター 発生発達神経科学分野)<br> | ||
</div> | </div> | ||
英語名:Sonic Hedgehog 英略称:Shh | 英語名:Sonic Hedgehog 英略称:Shh | ||
{{box|text= ソニック・ヘッジホッグは細胞外シグナル因子の1つで、胚発生において細胞の増殖や分化、四肢の発生、神経細胞の誘引に働くほか、成体期においては幹細胞性の維持や腫瘍形成などに関与する多機能タンパク質である<ref name=ref1><pubmed>23719536</pubmed></ref><ref | {{box|text= ソニック・ヘッジホッグは細胞外シグナル因子の1つで、胚発生において細胞の増殖や分化、四肢の発生、神経細胞の誘引に働くほか、成体期においては幹細胞性の維持や腫瘍形成などに関与する多機能タンパク質である<ref name=ref1><pubmed>23719536</pubmed></ref><ref><pubmed>25183867</pubmed></ref><ref name=ref3><pubmed>18794343</pubmed></ref> 。}} | ||
== 発見の歴史 == | == 発見の歴史 == | ||
1980年、ドイツの生物学者Christiane Nüsslein-Volhardは、[[ショウジョウバエ]]における変異体スクリーニングから、幼虫表面の剛毛(bristle)が規則正しく配置されずハリ[[ネズミ]]の毛のように体表面全体に散らばる変異個体を発見し、それにhedgehog変異体と命名した<ref><pubmed>6776413</pubmed></ref><ref><pubmed>17928586</pubmed></ref> 。その後の研究から、これは[[分泌]]因子をコードする遺伝子の変異によるものであることが明らかとなった<ref><pubmed>11731473</pubmed></ref> 。 | |||
一方、1990年の前半に[[脊椎動物]] | 一方、1990年の前半に[[脊椎動物]]においても3つのヘッジホッグ相同遺伝子が単離され、そのうちdesert hedgehog(Dhh)とindian hedgehog(Ihh)は実在するハリネズミの亜種から、sonic hedgehog(Shh)はテレビゲームのキャラクターからそれぞれ命名された。Dhhは精子形成に<ref><pubmed>11090455</pubmed></ref> 、Ihhが軟骨細胞の形成・増殖にそれぞれ重要な役割を果たす<ref><pubmed>21364421</pubmed></ref><ref><pubmed>10631175</pubmed></ref> 一方で、Shh<ref><pubmed>8269518</pubmed></ref><ref><pubmed>8269519</pubmed></ref><ref><pubmed>7916661</pubmed></ref> は中枢神経系や四肢形成をはじめとする胚発生(器官発生)の多くに重要であることが示され、現在ヘッジホッグ関連遺伝子の中で最も解析が進んでいる。その後、[[ヒト]]でShhは全[[前脳胞]]症(全[[前脳]]症;holoprosencephaly)の原因遺伝子として同定され<ref><pubmed>8896572</pubmed></ref> 、実際に遺伝子欠損[[マウス]]から神経発生とパターン形成に必須の役割を果たすことが証明された<ref><pubmed>8837770</pubmed></ref> 。 | ||
==ファミリー== | ==ファミリー== | ||
==構造== | ==構造== | ||
[[image: | [[image:Shh3.png|thumb|300px|'''図1.Gliタンパク質の構造'''<br>(<ref name=ref31><pubmed></pubmed></ref><ref name=ref34><pubmed></pubmed></ref>を改変した)アミノ酸番号は、マウスのものである。*はPKAによるリン酸化サイト、ZnF:Znフィンガー、矢頭は分解されて転写抑制型を生じるサイト<ref name=ref34><pubmed></pubmed></ref>。]] | ||
== | ==プロセシングと分泌 == | ||
[[image:Shh1.png|thumb|300px|'''図2.ソニック・ヘッジホッグタンパク質の修飾と分泌'']] | |||
[[image: | |||
ソニック・ヘッジホッグ遺伝子からはまず45kDa程度のポリペプチドが前駆体として転写・[[翻訳]]される。このポリペプチドは小胞体に運ばれ、アミノ末端とカルボキシル末端の2つの部分に分解され、分泌されてその活性を発揮するのはアミノ末端側のポリペプチド(ShhN; 19kDa程度)である<ref><pubmed>21357747</pubmed></ref> 。一方カルボキシル末端側(ShhC)はこの分解を制御するほか、[[コレステロール]]転移酵素としてアミノ末端側フラグメントの修飾に寄与する<ref><pubmed>15189162</pubmed></ref> 。ShhNにはパルミチン酸(アミノ末端)とコレ[[ステロール]](カルボキシル末端)が付加されるが、これらの修飾はShhNの効率的な分泌と、組織内での適切な分布に重要である<ref><pubmed>16611729</pubmed></ref><ref><pubmed>11486055</pubmed></ref><ref><pubmed>15075292</pubmed></ref><ref><pubmed>8824192</pubmed></ref><ref><pubmed>11389830</pubmed></ref><ref><pubmed>23112049</pubmed></ref> 。たとえば細胞内コレステロール輸送に関与する遺伝子NPC1/2に変異が生じると[[リソソーム]]にコレステロールが蓄積するためにShhNに十分なコレステロールが供給されずに修飾不全となり、効率的な分泌が不可能になってしまう。C型Niemann-Pick syndrome(C型ニーマン・ピック病)はこのNPC1/2遺伝子の変異に起因する遺伝性疾患であり、[[小脳]]の不完全形成や肝不全、[[発達障害]]や運動障害、新生児黄疸などの重篤な小児障害を引き起こす<ref><pubmed>9211850</pubmed></ref><ref name=ref24><pubmed>22902404</pubmed></ref> 。 | |||
分解と修飾によって成熟型となったShhNは細胞から分泌されるが、その分泌には[[膜タンパク質]]Dispatchedと、分泌因子Scubeの存在が必要である<ref name=ref24></ref> 。 | |||
この分泌経路のほかに最近、Shhタンパク質がサイトニーム(cytoneme)と呼ばれる突起上の[[細胞膜]]構造の先端まで運搬され、そこで小胞を形成して細胞外へ分泌されるという経路が提唱されている。サイトニームは糸状仮足(filopodia)が長く変形した形状をしており、内部には[[アクチン]]が含まれている。ショウジョウバエの翅原基(wing disc)ではヘッジホッグを産生する細胞がこのような構造を持っており<ref><pubmed>10367889</pubmed></ref> 、発現部位から遠い細胞までシグナルを届けている<ref name=ref1></ref><ref><pubmed>23276604</pubmed></ref><ref><pubmed>25483805</pubmed></ref><ref><pubmed>25472772</pubmed></ref> ほか、近年脊椎[[動物]]でもその存在が知られるようになった<ref><pubmed>23624372</pubmed></ref> 。 | |||
==シグナル経路== | |||
[[image:Shh2.png|thumb|300px|'''図3.ソニック・ヘッジホッグによる細胞内シグナル伝達経路''<br>(主に37,39,40を参考に作成)。PIP3:フォスファチジルイノシトール3リン酸、GliFL:全長Gli、GliRep:抑制型Gli、GliAct:活性化型Gli、Cul3:Cullin3。]] | |||
=== Ptc-Smo-Gli経路 === | |||
ソニック・ヘッジホッグによる主要な細胞内シグナル経路は、2つの膜タンパク質 – 12回膜貫通型Patched(Ptc)と7回膜貫通型のGタンパク質共役受容体(G-protein coupled receptor; [[GPCR]])の1つSmoothened(Smo) − によって仲介されている。Patchedは細胞膜の中でも特に1次繊毛と呼ばれる細胞の突起部分に局在し、Shhと直接結合する。いったんShhがPtcに結合するとShh/Ptc複合体は繊毛から細胞膜へと移動する<ref><pubmed>17641202</pubmed></ref> 。一方、もう1つの膜タンパク質Smoは、細胞がShhに暴露されていないときには繊毛の周辺の細胞膜上に存在するが、細胞がShhによって刺激され、Shh/Ptc複合体が繊毛から退去すると、代わりに繊毛内へと進入する。 | |||
細胞膜で受容されたシグナルを核に伝達するのは、Gli(ショウジョウバエではCubitus interruptus; Ci)と呼ばれるZnフィンガー型[[転写因子]]であり、脊椎動物に存在する3種類のGli(Gli1-3)<ref><pubmed>21801010</pubmed></ref> のうちShhのシグナルを1次的に伝達するのはGli2,3である。Gli2,3は繊毛内でSmoと何らかの相互作用をすることにより、シグナルを繊毛から核へと伝達する<ref><pubmed>16254602</pubmed></ref> 。Gli2/3は転写活性領域と抑制領域を併せ持つ転写因子で、Shhシグナルが存在しないときには翻訳されたポリペプチドが恒常的に分解(ユビキチン化)されてアミノ末端側だけの断片として存在し、転写抑制因子として働く。Gli2/3のユビキチン化は、まず[[PKA]]([[プロテインキナーゼA]])と[[Glycogen synthase kinase 3|Glycogen Synthase Kinase 3]]β([[GSK3β]])によって[[セリン]]残基がリン酸化され、それを、 βTrCP(E3ユビキチンリガーゼ)と[[足場タンパク質]]Cullin3を含むSCF βTrCP複合体がターゲットすることによって進む<ref><pubmed>16705181</pubmed></ref><ref><pubmed>16611981</pubmed></ref><ref><pubmed>16651270</pubmed></ref> 。 | |||
いったんShhシグナルが細胞に導入されるとPKAが不活化され<ref><pubmed>24336288</pubmed></ref><ref name=ref37><pubmed>27799542</pubmed></ref> 、Gli2/3のユビキチン分解が抑制されて全長型Gli2/3は繊毛内に移動する<ref><pubmed>16254602</pubmed></ref><ref><pubmed>20154143</pubmed></ref> 。その後、核に移動して遺伝子発現を誘導する<ref name=ref39><pubmed>23799571</pubmed></ref> 。この際にはGli2/3に対してSPOPと呼ばれるユビキチンリガーゼによるユビキチン化が起こってタンパク質自体の安定性が変化する<ref name=ref40><pubmed>20360384</pubmed></ref><ref><pubmed>20463034</pubmed></ref> ほか、さまざまな修飾(リン酸化、[[アセチル化]]、SUMO化)も関与してその転写活性を制御する<ref name=ref40><pubmed>20360384</pubmed></ref><ref><pubmed>20711444</pubmed></ref><ref><pubmed>23762415</pubmed></ref><ref><pubmed>24373970</pubmed></ref> 。Gliタンパク質の[[DNA]]結合配列にはGACCACCCAという配列が提唱されてきた<ref><pubmed>9118802</pubmed></ref> が、最近、解離定数(結合のアフィニティー)が異なる別の配列も見つかっている<ref><pubmed>23153497</pubmed></ref> 。 | |||
[[ | Gli1-3は多くの臓器に発現しているためにそれらの遺伝子変異マウスの表現型も多様であり<ref><pubmed>9731531</pubmed></ref> 、神経系で強い表現型が現れるものもある。Gli2変異マウスでは、Shhシグナルの影響を受ける[[底板]]とV3[[介在神経]]領域の[[分化]]が抑制され、パターン形成に異常が生じて出生直後に死亡する<ref><pubmed>9636069</pubmed></ref> 。一方、Gli3変異マウスでは、主に脳領域でShhシグナルがむしろ亢進した表現型になるため<ref><pubmed>8387379</pubmed></ref><ref><pubmed>11017169</pubmed></ref> 、Gli3が主に転写抑制型として働くことが示唆される。Gli1単独の変異マウスでは神経系では大きな表現型が見つかっていないが、Gli2変異による表現型をGli1のノックインによって相補することができるため、Gli2の転写活性型と同様の働きをしていると考えられる<ref><pubmed>10725236</pubmed></ref><ref><pubmed>11748151</pubmed></ref> 。 | ||
Shhシグナルのターゲット遺伝子として代表的なものは、[[神経前駆細胞]]におけるOlig2やNkx2.2, FoxA2のように細胞の個性付けに関与する転写因子、またShhシグナルに直接関与するもの(Ptc, Gli1)などである<ref name=ref1></ref><ref name=ref3></ref> 。 | |||
先に述べたようにShhシグナルには細胞膜上に形成される1次繊毛の存在が必須である。1次繊毛に形成不全が生じるとShhシグナルが細胞に導入されず、結果として[[神経管]]はShh遺伝子変異マウスに類似した表現型になる<ref name=ref39><pubmed>23799571</pubmed></ref> 。また、Gli3の不活性型を生じるプロセシングにはPKAが必要であり、PKA遺伝子のノックアウトはShhシグナルの異常亢進を反映した表現型となる<ref><pubmed>11886853</pubmed></ref> 。 | |||
Shh-Ptc-Smo- | Shh-Ptc-Smo-Gliを主軸とするShhシグナルを制御する調節因子の存在も知られている。SuFu(Suppressor of Fused)は[[cAMP]]依存的にGli2/3と結合して、タンパク質の安定化と抑制型を産出する<ref name=ref40><pubmed>20360384</pubmed></ref> 。そのほかにGPR161(Gタンパク質共役受容体)のように繊毛に局在してそのcAMP濃度を上昇させ、Shhシグナルを負に制御する因子の存在も知られている<ref><pubmed>16459298</pubmed></ref><ref><pubmed>20956384</pubmed></ref><ref><pubmed>23332756</pubmed></ref> 。さらに最近、Shhが細胞に到達すると[[カルシウムイオン]]がTRPチャネルを介して繊毛内に流入し、アデニルシクラーゼ(AC5/6)の活性が阻害されることによって繊毛内のcAMP濃度が低下し、結果的にGliが活性化されるという現象が報告された<ref><pubmed>24336288</pubmed></ref><ref name=ref37><pubmed>27799542</pubmed></ref> 。これらをはじめとして、20種類程度のタンパク質がShhシグナルの伝達を正または負に制御している<ref><pubmed>17662951</pubmed></ref> 。調節因子が多数存在する理由としては、Shhの活性が細胞依存的であることや、Shhは[[細胞増殖]]も制御するために細胞ががん化する危険があり、シグナル活性を厳密に制御する必要があることなどが考えられる<ref name=ref39><pubmed>23799571</pubmed></ref> 。 | ||
=== ほかの経路 === | |||
Shhは交連神経細胞のガイダンスに必須である<ref><pubmed>15746914</pubmed></ref><ref><pubmed>19447091</pubmed></ref><ref><pubmed>12679031</pubmed></ref> 。Shhは神経のガイダンス因子として知られるNetrinと協調して働き、交連神経が脊髄正中(midline)を交差するのに必要である<ref><pubmed>12679031</pubmed></ref> 。このガイダンスにはPtc/SmoではなくHIP(hedgehog interacting protein)がShhの受容体になっており<ref><pubmed>15746914</pubmed></ref> 、さらに細胞内ではSFKというキナーゼが活性化されている<ref><pubmed>19447091</pubmed></ref> 。また、繊維芽細胞の化学遊走にもShhが関与しているという報告があり、さらにこの現象においてはSmoが繊毛に局在しなくても細胞内シグナルが惹起されるため、従来とは異なるメカニズムが示唆されている<ref><pubmed>22912493</pubmed></ref> 。 | |||
==神経系での機能== | |||
Shhと神経系について最も研究が進んでいるのは神経分化における役割である。1991年、Thomas M Jessellと山田俊哉は、脊策(notochord)を神経管の別の場所に移植し、移植した周辺領域の細胞が底板(floor plate)や運動神経(motor neuron)に異所的に分化することを発見し、脊策と底板から分化誘導因子が分泌されていることを示した<ref><pubmed>1991324</pubmed></ref><ref><pubmed>8500163</pubmed></ref> 。その後、この分泌因子がShhであること<ref><pubmed>8124714</pubmed></ref> 、さらにShhが神経管内で濃度勾配を形成することが明らかとなった<ref><pubmed>7736596</pubmed></ref><ref><pubmed>20066087</pubmed></ref> 。Shhは中枢神経系の中でも底板(floor plate)やその下部に存在する中胚葉系の組織(脊索:notochord)の細胞で発現し、発現細胞の周辺で濃度勾配を形成、モルフォゲンとし働いて濃度依存的に運動神経や介在神経の前駆細胞を誘導する(詳細は別項で議論する)。 | |||
また生後の脳において、神経前駆細胞の存在が知られており、Shhシグナルが微小環境(ニッチ:niche)において活性化されて前駆細胞の幹細胞性を維持している<ref><pubmed>16208373</pubmed></ref><ref><pubmed>27666792</pubmed></ref> }。 | |||
== | == ソニック・ヘッジホッグシグナルを細胞レベルで解析する実験手法 == | ||
細胞レベルでの解析においてShhシグナルに反応する細胞は少なく、よく使われるのはマウスの繊維芽細胞NIH3T3細胞<ref><pubmed>25833741</pubmed></ref> やヒト角化細胞<ref><pubmed>16880536</pubmed></ref> 、ニワトリやマウスの神経前駆細胞([[胚性幹細胞]]から分化させたものや胚から単離したもの)である<ref><pubmed>26972603</pubmed></ref><ref><pubmed>25026549</pubmed></ref> 。Shhシグナルを受容する1次繊毛は、[[細胞周期]]のG0/G1期にのみ生じるため、特にNIH3T3でShhシグナルの実験を行う際にはあらかじめ血清飢餓状態にしてG0/G1期の細胞を多数得ることが重要である。細胞において実験的にShhシグナルを活性化する場合、大腸菌で作成した(つまりコレステロール修飾がされていない)リコンビナントタンパク質も活性は持っている<ref><pubmed>26972603</pubmed></ref><ref><pubmed>10564658</pubmed></ref><ref><pubmed>18046410</pubmed></ref> 。化合物としては、purmorphamineとSAGがSmoを標的とし<ref><pubmed>16408082</pubmed></ref> 、Shhのアゴニストとして用いられている。一方、cyclopamineとSANT-1は同じくSmoを標的とし、その活性を阻害することによりShhシグナルの[[アンタゴニスト]]として働くChen, 2002 #47;Dixit, 2013 #49}。 | |||
Shhシグナルの強度を計測する方法としては、luciferaseまたはGFPのレポーターコンストラクトが多用され<ref><pubmed>9118802</pubmed></ref><ref><pubmed>22265416</pubmed></ref> 、ほかの方法として、定量PCRを用いてShhシグナルのターゲット遺伝子であるGli1やPtc1の発現量を解析してもよい<ref><pubmed>25833741</pubmed></ref><ref><pubmed>18046410</pubmed></ref> 。NIH3T3では、Shhシグナルの添加時間とともにGli1やPtc1の発現量が増加する<ref><pubmed>25833741</pubmed></ref> 。一方、神経前駆細胞内ではShhシグナルは数時間以内にいったん活性化し、その後、負のフィードバックが起こって鎮静化する<ref><pubmed>18046410</pubmed></ref><ref><pubmed>22265416</pubmed></ref><ref><pubmed>20532235</pubmed></ref> 。この負のフィードバックが起きるメカニズムとしては、Ptcが細胞膜上に多数存在するようになってShhタンパク質が枯渇するというもの<ref><pubmed>18046410</pubmed></ref> や、活性型Gliタンパク質が不活性型に比べて不安定であるというもの<ref name=ref40><pubmed>20360384</pubmed></ref> などがあるが、全容はまだ明らかになっていない。 | |||
==疾患との関わり== | ==疾患との関わり== | ||
ヘッジホッグシグナルが抑制される疾患については、その代表的なもののいくつか([[ニーマン・ピック病]]、[[全前脳胞症]])を前述したが、逆にヘッジホッグシグナルが亢進しすぎると[[髄芽種]]([[medulloblastoma]])という[[wj:小児がん|小児がん]]を引き起こすことが知られている<ref><pubmed>25150496</pubmed></ref> 。この疾患は元来放射線治療や外科的手術による腫瘍の除去しか治療法がなかったが、最近、[[三量体Gタンパク質|Gタンパク質]]の一種[[Gαs]]を活性化させることによりShhシグナルをブロックする方法が検討されつつある<ref><pubmed>25150496</pubmed></ref> 。 | |||
==参考文献== | ==参考文献== | ||
<references/> | <references/> | ||
2017年1月18日 (水) 01:37時点における版
笹井紀明
奈良先端科学技術大学院大学
DOI:10.14931/bsd.7348 原稿受付日:2017年1月17日 原稿完成日:2017年月日
担当編集委員:大隅 典子(東北大学 大学院医学系研究科 附属創生応用医学研究センター 脳神経科学コアセンター 発生発達神経科学分野)
英語名:Sonic Hedgehog 英略称:Shh
ソニック・ヘッジホッグは細胞外シグナル因子の1つで、胚発生において細胞の増殖や分化、四肢の発生、神経細胞の誘引に働くほか、成体期においては幹細胞性の維持や腫瘍形成などに関与する多機能タンパク質である[1][2][3] 。
発見の歴史
1980年、ドイツの生物学者Christiane Nüsslein-Volhardは、ショウジョウバエにおける変異体スクリーニングから、幼虫表面の剛毛(bristle)が規則正しく配置されずハリネズミの毛のように体表面全体に散らばる変異個体を発見し、それにhedgehog変異体と命名した[4][5] 。その後の研究から、これは分泌因子をコードする遺伝子の変異によるものであることが明らかとなった[6] 。
一方、1990年の前半に脊椎動物においても3つのヘッジホッグ相同遺伝子が単離され、そのうちdesert hedgehog(Dhh)とindian hedgehog(Ihh)は実在するハリネズミの亜種から、sonic hedgehog(Shh)はテレビゲームのキャラクターからそれぞれ命名された。Dhhは精子形成に[7] 、Ihhが軟骨細胞の形成・増殖にそれぞれ重要な役割を果たす[8][9] 一方で、Shh[10][11][12] は中枢神経系や四肢形成をはじめとする胚発生(器官発生)の多くに重要であることが示され、現在ヘッジホッグ関連遺伝子の中で最も解析が進んでいる。その後、ヒトでShhは全前脳胞症(全前脳症;holoprosencephaly)の原因遺伝子として同定され[13] 、実際に遺伝子欠損マウスから神経発生とパターン形成に必須の役割を果たすことが証明された[14] 。
ファミリー
構造
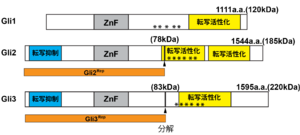
([15][16]を改変した)アミノ酸番号は、マウスのものである。*はPKAによるリン酸化サイト、ZnF:Znフィンガー、矢頭は分解されて転写抑制型を生じるサイト[16]。
プロセシングと分泌
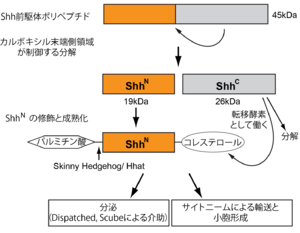
ソニック・ヘッジホッグ遺伝子からはまず45kDa程度のポリペプチドが前駆体として転写・翻訳される。このポリペプチドは小胞体に運ばれ、アミノ末端とカルボキシル末端の2つの部分に分解され、分泌されてその活性を発揮するのはアミノ末端側のポリペプチド(ShhN; 19kDa程度)である[17] 。一方カルボキシル末端側(ShhC)はこの分解を制御するほか、コレステロール転移酵素としてアミノ末端側フラグメントの修飾に寄与する[18] 。ShhNにはパルミチン酸(アミノ末端)とコレステロール(カルボキシル末端)が付加されるが、これらの修飾はShhNの効率的な分泌と、組織内での適切な分布に重要である[19][20][21][22][23][24] 。たとえば細胞内コレステロール輸送に関与する遺伝子NPC1/2に変異が生じるとリソソームにコレステロールが蓄積するためにShhNに十分なコレステロールが供給されずに修飾不全となり、効率的な分泌が不可能になってしまう。C型Niemann-Pick syndrome(C型ニーマン・ピック病)はこのNPC1/2遺伝子の変異に起因する遺伝性疾患であり、小脳の不完全形成や肝不全、発達障害や運動障害、新生児黄疸などの重篤な小児障害を引き起こす[25][26] 。
分解と修飾によって成熟型となったShhNは細胞から分泌されるが、その分泌には膜タンパク質Dispatchedと、分泌因子Scubeの存在が必要である[26] 。
この分泌経路のほかに最近、Shhタンパク質がサイトニーム(cytoneme)と呼ばれる突起上の細胞膜構造の先端まで運搬され、そこで小胞を形成して細胞外へ分泌されるという経路が提唱されている。サイトニームは糸状仮足(filopodia)が長く変形した形状をしており、内部にはアクチンが含まれている。ショウジョウバエの翅原基(wing disc)ではヘッジホッグを産生する細胞がこのような構造を持っており[27] 、発現部位から遠い細胞までシグナルを届けている[1][28][29][30] ほか、近年脊椎動物でもその存在が知られるようになった[31] 。
シグナル経路
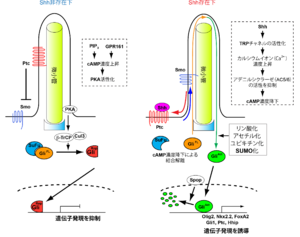
(主に37,39,40を参考に作成)。PIP3:フォスファチジルイノシトール3リン酸、GliFL:全長Gli、GliRep:抑制型Gli、GliAct:活性化型Gli、Cul3:Cullin3。
Ptc-Smo-Gli経路
ソニック・ヘッジホッグによる主要な細胞内シグナル経路は、2つの膜タンパク質 – 12回膜貫通型Patched(Ptc)と7回膜貫通型のGタンパク質共役受容体(G-protein coupled receptor; GPCR)の1つSmoothened(Smo) − によって仲介されている。Patchedは細胞膜の中でも特に1次繊毛と呼ばれる細胞の突起部分に局在し、Shhと直接結合する。いったんShhがPtcに結合するとShh/Ptc複合体は繊毛から細胞膜へと移動する[32] 。一方、もう1つの膜タンパク質Smoは、細胞がShhに暴露されていないときには繊毛の周辺の細胞膜上に存在するが、細胞がShhによって刺激され、Shh/Ptc複合体が繊毛から退去すると、代わりに繊毛内へと進入する。
細胞膜で受容されたシグナルを核に伝達するのは、Gli(ショウジョウバエではCubitus interruptus; Ci)と呼ばれるZnフィンガー型転写因子であり、脊椎動物に存在する3種類のGli(Gli1-3)[33] のうちShhのシグナルを1次的に伝達するのはGli2,3である。Gli2,3は繊毛内でSmoと何らかの相互作用をすることにより、シグナルを繊毛から核へと伝達する[34] 。Gli2/3は転写活性領域と抑制領域を併せ持つ転写因子で、Shhシグナルが存在しないときには翻訳されたポリペプチドが恒常的に分解(ユビキチン化)されてアミノ末端側だけの断片として存在し、転写抑制因子として働く。Gli2/3のユビキチン化は、まずPKA(プロテインキナーゼA)とGlycogen Synthase Kinase 3β(GSK3β)によってセリン残基がリン酸化され、それを、 βTrCP(E3ユビキチンリガーゼ)と足場タンパク質Cullin3を含むSCF βTrCP複合体がターゲットすることによって進む[35][36][37] 。
いったんShhシグナルが細胞に導入されるとPKAが不活化され[38][39] 、Gli2/3のユビキチン分解が抑制されて全長型Gli2/3は繊毛内に移動する[40][41] 。その後、核に移動して遺伝子発現を誘導する[42] 。この際にはGli2/3に対してSPOPと呼ばれるユビキチンリガーゼによるユビキチン化が起こってタンパク質自体の安定性が変化する[43][44] ほか、さまざまな修飾(リン酸化、アセチル化、SUMO化)も関与してその転写活性を制御する[43][45][46][47] 。Gliタンパク質のDNA結合配列にはGACCACCCAという配列が提唱されてきた[48] が、最近、解離定数(結合のアフィニティー)が異なる別の配列も見つかっている[49] 。
Gli1-3は多くの臓器に発現しているためにそれらの遺伝子変異マウスの表現型も多様であり[50] 、神経系で強い表現型が現れるものもある。Gli2変異マウスでは、Shhシグナルの影響を受ける底板とV3介在神経領域の分化が抑制され、パターン形成に異常が生じて出生直後に死亡する[51] 。一方、Gli3変異マウスでは、主に脳領域でShhシグナルがむしろ亢進した表現型になるため[52][53] 、Gli3が主に転写抑制型として働くことが示唆される。Gli1単独の変異マウスでは神経系では大きな表現型が見つかっていないが、Gli2変異による表現型をGli1のノックインによって相補することができるため、Gli2の転写活性型と同様の働きをしていると考えられる[54][55] 。
Shhシグナルのターゲット遺伝子として代表的なものは、神経前駆細胞におけるOlig2やNkx2.2, FoxA2のように細胞の個性付けに関与する転写因子、またShhシグナルに直接関与するもの(Ptc, Gli1)などである[1][3] 。
先に述べたようにShhシグナルには細胞膜上に形成される1次繊毛の存在が必須である。1次繊毛に形成不全が生じるとShhシグナルが細胞に導入されず、結果として神経管はShh遺伝子変異マウスに類似した表現型になる[42] 。また、Gli3の不活性型を生じるプロセシングにはPKAが必要であり、PKA遺伝子のノックアウトはShhシグナルの異常亢進を反映した表現型となる[56] 。
Shh-Ptc-Smo-Gliを主軸とするShhシグナルを制御する調節因子の存在も知られている。SuFu(Suppressor of Fused)はcAMP依存的にGli2/3と結合して、タンパク質の安定化と抑制型を産出する[43] 。そのほかにGPR161(Gタンパク質共役受容体)のように繊毛に局在してそのcAMP濃度を上昇させ、Shhシグナルを負に制御する因子の存在も知られている[57][58][59] 。さらに最近、Shhが細胞に到達するとカルシウムイオンがTRPチャネルを介して繊毛内に流入し、アデニルシクラーゼ(AC5/6)の活性が阻害されることによって繊毛内のcAMP濃度が低下し、結果的にGliが活性化されるという現象が報告された[60][39] 。これらをはじめとして、20種類程度のタンパク質がShhシグナルの伝達を正または負に制御している[61] 。調節因子が多数存在する理由としては、Shhの活性が細胞依存的であることや、Shhは細胞増殖も制御するために細胞ががん化する危険があり、シグナル活性を厳密に制御する必要があることなどが考えられる[42] 。
ほかの経路
Shhは交連神経細胞のガイダンスに必須である[62][63][64] 。Shhは神経のガイダンス因子として知られるNetrinと協調して働き、交連神経が脊髄正中(midline)を交差するのに必要である[65] 。このガイダンスにはPtc/SmoではなくHIP(hedgehog interacting protein)がShhの受容体になっており[66] 、さらに細胞内ではSFKというキナーゼが活性化されている[67] 。また、繊維芽細胞の化学遊走にもShhが関与しているという報告があり、さらにこの現象においてはSmoが繊毛に局在しなくても細胞内シグナルが惹起されるため、従来とは異なるメカニズムが示唆されている[68] 。
神経系での機能
Shhと神経系について最も研究が進んでいるのは神経分化における役割である。1991年、Thomas M Jessellと山田俊哉は、脊策(notochord)を神経管の別の場所に移植し、移植した周辺領域の細胞が底板(floor plate)や運動神経(motor neuron)に異所的に分化することを発見し、脊策と底板から分化誘導因子が分泌されていることを示した[69][70] 。その後、この分泌因子がShhであること[71] 、さらにShhが神経管内で濃度勾配を形成することが明らかとなった[72][73] 。Shhは中枢神経系の中でも底板(floor plate)やその下部に存在する中胚葉系の組織(脊索:notochord)の細胞で発現し、発現細胞の周辺で濃度勾配を形成、モルフォゲンとし働いて濃度依存的に運動神経や介在神経の前駆細胞を誘導する(詳細は別項で議論する)。
また生後の脳において、神経前駆細胞の存在が知られており、Shhシグナルが微小環境(ニッチ:niche)において活性化されて前駆細胞の幹細胞性を維持している[74][75] }。
ソニック・ヘッジホッグシグナルを細胞レベルで解析する実験手法
細胞レベルでの解析においてShhシグナルに反応する細胞は少なく、よく使われるのはマウスの繊維芽細胞NIH3T3細胞[76] やヒト角化細胞[77] 、ニワトリやマウスの神経前駆細胞(胚性幹細胞から分化させたものや胚から単離したもの)である[78][79] 。Shhシグナルを受容する1次繊毛は、細胞周期のG0/G1期にのみ生じるため、特にNIH3T3でShhシグナルの実験を行う際にはあらかじめ血清飢餓状態にしてG0/G1期の細胞を多数得ることが重要である。細胞において実験的にShhシグナルを活性化する場合、大腸菌で作成した(つまりコレステロール修飾がされていない)リコンビナントタンパク質も活性は持っている[80][81][82] 。化合物としては、purmorphamineとSAGがSmoを標的とし[83] 、Shhのアゴニストとして用いられている。一方、cyclopamineとSANT-1は同じくSmoを標的とし、その活性を阻害することによりShhシグナルのアンタゴニストとして働くChen, 2002 #47;Dixit, 2013 #49}。
Shhシグナルの強度を計測する方法としては、luciferaseまたはGFPのレポーターコンストラクトが多用され[84][85] 、ほかの方法として、定量PCRを用いてShhシグナルのターゲット遺伝子であるGli1やPtc1の発現量を解析してもよい[86][87] 。NIH3T3では、Shhシグナルの添加時間とともにGli1やPtc1の発現量が増加する[88] 。一方、神経前駆細胞内ではShhシグナルは数時間以内にいったん活性化し、その後、負のフィードバックが起こって鎮静化する[89][90][91] 。この負のフィードバックが起きるメカニズムとしては、Ptcが細胞膜上に多数存在するようになってShhタンパク質が枯渇するというもの[92] や、活性型Gliタンパク質が不活性型に比べて不安定であるというもの[43] などがあるが、全容はまだ明らかになっていない。
疾患との関わり
ヘッジホッグシグナルが抑制される疾患については、その代表的なもののいくつか(ニーマン・ピック病、全前脳胞症)を前述したが、逆にヘッジホッグシグナルが亢進しすぎると髄芽種(medulloblastoma)という小児がんを引き起こすことが知られている[93] 。この疾患は元来放射線治療や外科的手術による腫瘍の除去しか治療法がなかったが、最近、Gタンパク質の一種Gαsを活性化させることによりShhシグナルをブロックする方法が検討されつつある[94] 。
参考文献
- ↑ 1.0 1.1 1.2
Briscoe, J., & Thérond, P.P. (2013).
The mechanisms of Hedgehog signalling and its roles in development and disease. Nature reviews. Molecular cell biology, 14(7), 416-29. [PubMed:23719536] [WorldCat] [DOI] - ↑
Petrova, R., & Joyner, A.L. (2014).
Roles for Hedgehog signaling in adult organ homeostasis and repair. Development (Cambridge, England), 141(18), 3445-57. [PubMed:25183867] [PMC] [WorldCat] [DOI] - ↑ 3.0 3.1
Varjosalo, M., & Taipale, J. (2008).
Hedgehog: functions and mechanisms. Genes & development, 22(18), 2454-72. [PubMed:18794343] [WorldCat] [DOI] - ↑
Nüsslein-Volhard, C., & Wieschaus, E. (1980).
Mutations affecting segment number and polarity in Drosophila. Nature, 287(5785), 795-801. [PubMed:6776413] [WorldCat] [DOI] - ↑
van den Brink, G.R. (2007).
Hedgehog signaling in development and homeostasis of the gastrointestinal tract. Physiological reviews, 87(4), 1343-75. [PubMed:17928586] [WorldCat] [DOI] - ↑
Ingham, P.W., & McMahon, A.P. (2001).
Hedgehog signaling in animal development: paradigms and principles. Genes & development, 15(23), 3059-87. [PubMed:11731473] [WorldCat] [DOI] - ↑
Clark, A.M., Garland, K.K., & Russell, L.D. (2000).
Desert hedgehog (Dhh) gene is required in the mouse testis for formation of adult-type Leydig cells and normal development of peritubular cells and seminiferous tubules. Biology of reproduction, 63(6), 1825-38. [PubMed:11090455] [WorldCat] [DOI] - ↑
Levi, B., James, A.W., Nelson, E.R., Brugmann, S.A., Sorkin, M., Manu, A., & Longaker, M.T. (2011).
Role of Indian hedgehog signaling in palatal osteogenesis. Plastic and reconstructive surgery, 127(3), 1182-90. [PubMed:21364421] [PMC] [WorldCat] [DOI] - ↑
Karp, S.J., Schipani, E., St-Jacques, B., Hunzelman, J., Kronenberg, H., & McMahon, A.P. (2000).
Indian hedgehog coordinates endochondral bone growth and morphogenesis via parathyroid hormone related-protein-dependent and -independent pathways. Development (Cambridge, England), 127(3), 543-8. [PubMed:10631175] [WorldCat] - ↑
Riddle, R.D., Johnson, R.L., Laufer, E., & Tabin, C. (1993).
Sonic hedgehog mediates the polarizing activity of the ZPA. Cell, 75(7), 1401-16. [PubMed:8269518] [WorldCat] [DOI] - ↑
Krauss, S., Concordet, J.P., & Ingham, P.W. (1993).
A functionally conserved homolog of the Drosophila segment polarity gene hh is expressed in tissues with polarizing activity in zebrafish embryos. Cell, 75(7), 1431-44. [PubMed:8269519] [WorldCat] [DOI] - ↑
Echelard, Y., Epstein, D.J., St-Jacques, B., Shen, L., Mohler, J., McMahon, J.A., & McMahon, A.P. (1993).
Sonic hedgehog, a member of a family of putative signaling molecules, is implicated in the regulation of CNS polarity. Cell, 75(7), 1417-30. [PubMed:7916661] [WorldCat] [DOI] - ↑
Roessler, E., Belloni, E., Gaudenz, K., Jay, P., Berta, P., Scherer, S.W., ..., & Muenke, M. (1996).
Mutations in the human Sonic Hedgehog gene cause holoprosencephaly. Nature genetics, 14(3), 357-60. [PubMed:8896572] [WorldCat] [DOI] - ↑
Chiang, C., Litingtung, Y., Lee, E., Young, K.E., Corden, J.L., Westphal, H., & Beachy, P.A. (1996).
Cyclopia and defective axial patterning in mice lacking Sonic hedgehog gene function. Nature, 383(6599), 407-13. [PubMed:8837770] [WorldCat] [DOI] - ↑ Resource not found in PubMed.
- ↑ 16.0 16.1 Resource not found in PubMed.
- ↑
Chen, X., Tukachinsky, H., Huang, C.H., Jao, C., Chu, Y.R., Tang, H.Y., ..., & Salic, A. (2011).
Processing and turnover of the Hedgehog protein in the endoplasmic reticulum. The Journal of cell biology, 192(5), 825-38. [PubMed:21357747] [PMC] [WorldCat] [DOI] - ↑
Mann, R.K., & Beachy, P.A. (2004).
Novel lipid modifications of secreted protein signals. Annual review of biochemistry, 73, 891-923. [PubMed:15189162] [WorldCat] [DOI] - ↑
Li, Y., Zhang, H., Litingtung, Y., & Chiang, C. (2006).
Cholesterol modification restricts the spread of Shh gradient in the limb bud. Proceedings of the National Academy of Sciences of the United States of America, 103(17), 6548-53. [PubMed:16611729] [PMC] [WorldCat] [DOI] - ↑
Chamoun, Z., Mann, R.K., Nellen, D., von Kessler, D.P., Bellotto, M., Beachy, P.A., & Basler, K. (2001).
Skinny hedgehog, an acyltransferase required for palmitoylation and activity of the hedgehog signal. Science (New York, N.Y.), 293(5537), 2080-4. [PubMed:11486055] [WorldCat] [DOI] - ↑
Chen, M.H., Li, Y.J., Kawakami, T., Xu, S.M., & Chuang, P.T. (2004).
Palmitoylation is required for the production of a soluble multimeric Hedgehog protein complex and long-range signaling in vertebrates. Genes & development, 18(6), 641-59. [PubMed:15075292] [PMC] [WorldCat] [DOI] - ↑
Porter, J.A., Young, K.E., & Beachy, P.A. (1996).
Cholesterol modification of hedgehog signaling proteins in animal development. Science (New York, N.Y.), 274(5285), 255-9. [PubMed:8824192] [WorldCat] [DOI] - ↑
Lewis, P.M., Dunn, M.P., McMahon, J.A., Logan, M., Martin, J.F., St-Jacques, B., & McMahon, A.P. (2001).
Cholesterol modification of sonic hedgehog is required for long-range signaling activity and effective modulation of signaling by Ptc1. Cell, 105(5), 599-612. [PubMed:11389830] [WorldCat] [DOI] - ↑
Hardy, R.Y., & Resh, M.D. (2012).
Identification of N-terminal residues of Sonic Hedgehog important for palmitoylation by Hedgehog acyltransferase. The Journal of biological chemistry, 287(51), 42881-9. [PubMed:23112049] [PMC] [WorldCat] [DOI] - ↑
Loftus, S.K., Morris, J.A., Carstea, E.D., Gu, J.Z., Cummings, C., Brown, A., ..., & Pavan, W.J. (1997).
Murine model of Niemann-Pick C disease: mutation in a cholesterol homeostasis gene. Science (New York, N.Y.), 277(5323), 232-5. [PubMed:9211850] [WorldCat] [DOI] - ↑ 26.0 26.1
Tukachinsky, H., Kuzmickas, R.P., Jao, C.Y., Liu, J., & Salic, A. (2012).
Dispatched and scube mediate the efficient secretion of the cholesterol-modified hedgehog ligand. Cell reports, 2(2), 308-20. [PubMed:22902404] [PMC] [WorldCat] [DOI] - ↑
Ramírez-Weber, F.A., & Kornberg, T.B. (1999).
Cytonemes: cellular processes that project to the principal signaling center in Drosophila imaginal discs. Cell, 97(5), 599-607. [PubMed:10367889] [WorldCat] [DOI] - ↑
Bilioni, A., Sánchez-Hernández, D., Callejo, A., Gradilla, A.C., Ibáñez, C., Mollica, E., ..., & Guerrero, I. (2013).
Balancing Hedgehog, a retention and release equilibrium given by Dally, Ihog, Boi and shifted/DmWif. Developmental biology, 376(2), 198-212. [PubMed:23276604] [WorldCat] [DOI] - ↑
Vyas, N., Walvekar, A., Tate, D., Lakshmanan, V., Bansal, D., Lo Cicero, A., ..., & Dhawan, J. (2014).
Vertebrate Hedgehog is secreted on two types of extracellular vesicles with different signaling properties. Scientific reports, 4, 7357. [PubMed:25483805] [PMC] [WorldCat] [DOI] - ↑
Gradilla, A.C., González, E., Seijo, I., Andrés, G., Bischoff, M., González-Mendez, L., ..., & Guerrero, I. (2014).
Exosomes as Hedgehog carriers in cytoneme-mediated transport and secretion. Nature communications, 5, 5649. [PubMed:25472772] [WorldCat] [DOI] - ↑
Sanders, T.A., Llagostera, E., & Barna, M. (2013).
Specialized filopodia direct long-range transport of SHH during vertebrate tissue patterning. Nature, 497(7451), 628-32. [PubMed:23624372] [PMC] [WorldCat] [DOI] - ↑
Rohatgi, R., Milenkovic, L., & Scott, M.P. (2007).
Patched1 regulates hedgehog signaling at the primary cilium. Science (New York, N.Y.), 317(5836), 372-6. [PubMed:17641202] [WorldCat] [DOI] - ↑
Hui, C.C., & Angers, S. (2011).
Gli proteins in development and disease. Annual review of cell and developmental biology, 27, 513-37. [PubMed:21801010] [WorldCat] [DOI] - ↑
Haycraft, C.J., Banizs, B., Aydin-Son, Y., Zhang, Q., Michaud, E.J., & Yoder, B.K. (2005).
Gli2 and Gli3 localize to cilia and require the intraflagellar transport protein polaris for processing and function. PLoS genetics, 1(4), e53. [PubMed:16254602] [PMC] [WorldCat] [DOI] - ↑
Tempé, D., Casas, M., Karaz, S., Blanchet-Tournier, M.F., & Concordet, J.P. (2006).
Multisite protein kinase A and glycogen synthase kinase 3beta phosphorylation leads to Gli3 ubiquitination by SCFbetaTrCP. Molecular and cellular biology, 26(11), 4316-26. [PubMed:16705181] [PMC] [WorldCat] [DOI] - ↑
Pan, Y., Bai, C.B., Joyner, A.L., & Wang, B. (2006).
Sonic hedgehog signaling regulates Gli2 transcriptional activity by suppressing its processing and degradation. Molecular and cellular biology, 26(9), 3365-77. [PubMed:16611981] [PMC] [WorldCat] [DOI] - ↑
Bhatia, N., Thiyagarajan, S., Elcheva, I., Saleem, M., Dlugosz, A., Mukhtar, H., & Spiegelman, V.S. (2006).
Gli2 is targeted for ubiquitination and degradation by beta-TrCP ubiquitin ligase. The Journal of biological chemistry, 281(28), 19320-6. [PubMed:16651270] [WorldCat] [DOI] - ↑
Delling, M., DeCaen, P.G., Doerner, J.F., Febvay, S., & Clapham, D.E. (2013).
Primary cilia are specialized calcium signalling organelles. Nature, 504(7479), 311-4. [PubMed:24336288] [PMC] [WorldCat] [DOI] - ↑ 39.0 39.1
Moore, B.S., Stepanchick, A.N., Tewson, P.H., Hartle, C.M., Zhang, J., Quinn, A.M., ..., & Mirshahi, T. (2016).
Cilia have high cAMP levels that are inhibited by Sonic Hedgehog-regulated calcium dynamics. Proceedings of the National Academy of Sciences of the United States of America, 113(46), 13069-13074. [PubMed:27799542] [PMC] [WorldCat] [DOI] - ↑
Haycraft, C.J., Banizs, B., Aydin-Son, Y., Zhang, Q., Michaud, E.J., & Yoder, B.K. (2005).
Gli2 and Gli3 localize to cilia and require the intraflagellar transport protein polaris for processing and function. PLoS genetics, 1(4), e53. [PubMed:16254602] [PMC] [WorldCat] [DOI] - ↑
Wen, X., Lai, C.K., Evangelista, M., Hongo, J.A., de Sauvage, F.J., & Scales, S.J. (2010).
Kinetics of hedgehog-dependent full-length Gli3 accumulation in primary cilia and subsequent degradation. Molecular and cellular biology, 30(8), 1910-22. [PubMed:20154143] [PMC] [WorldCat] [DOI] - ↑ 42.0 42.1 42.2
Sasai, N., & Briscoe, J. (2013).
Primary cilia and graded Sonic Hedgehog signaling. Wiley interdisciplinary reviews. Developmental biology, 1(5), 753-72. [PubMed:23799571] [WorldCat] [DOI] - ↑ 43.0 43.1 43.2 43.3
Humke, E.W., Dorn, K.V., Milenkovic, L., Scott, M.P., & Rohatgi, R. (2010).
The output of Hedgehog signaling is controlled by the dynamic association between Suppressor of Fused and the Gli proteins. Genes & development, 24(7), 670-82. [PubMed:20360384] [PMC] [WorldCat] [DOI] - ↑
Wang, C., Pan, Y., & Wang, B. (2010).
Suppressor of fused and Spop regulate the stability, processing and function of Gli2 and Gli3 full-length activators but not their repressors. Development (Cambridge, England), 137(12), 2001-9. [PubMed:20463034] [PMC] [WorldCat] [DOI] - ↑
Cox, B., Briscoe, J., & Ulloa, F. (2010).
SUMOylation by Pias1 regulates the activity of the Hedgehog dependent Gli transcription factors. PloS one, 5(8), e11996. [PubMed:20711444] [PMC] [WorldCat] [DOI] - ↑
Coni, S., Antonucci, L., D'Amico, D., Di Magno, L., Infante, P., De Smaele, E., ..., & Canettieri, G. (2013).
Gli2 acetylation at lysine 757 regulates hedgehog-dependent transcriptional output by preventing its promoter occupancy. PloS one, 8(6), e65718. [PubMed:23762415] [PMC] [WorldCat] [DOI] - ↑
Niewiadomski, P., Kong, J.H., Ahrends, R., Ma, Y., Humke, E.W., Khan, S., ..., & Rohatgi, R. (2014).
Gli protein activity is controlled by multisite phosphorylation in vertebrate Hedgehog signaling. Cell reports, 6(1), 168-181. [PubMed:24373970] [PMC] [WorldCat] [DOI] - ↑
Sasaki, H., Hui, C., Nakafuku, M., & Kondoh, H. (1997).
A binding site for Gli proteins is essential for HNF-3beta floor plate enhancer activity in transgenics and can respond to Shh in vitro. Development (Cambridge, England), 124(7), 1313-22. [PubMed:9118802] [WorldCat] - ↑
Oosterveen, T., Kurdija, S., Alekseenko, Z., Uhde, C.W., Bergsland, M., Sandberg, M., ..., & Ericson, J. (2012).
Mechanistic differences in the transcriptional interpretation of local and long-range Shh morphogen signaling. Developmental cell, 23(5), 1006-19. [PubMed:23153497] [WorldCat] [DOI] - ↑
Motoyama, J., Liu, J., Mo, R., Ding, Q., Post, M., & Hui, C.C. (1998).
Essential function of Gli2 and Gli3 in the formation of lung, trachea and oesophagus. Nature genetics, 20(1), 54-7. [PubMed:9731531] [WorldCat] [DOI] - ↑
Ding, Q., Motoyama, J., Gasca, S., Mo, R., Sasaki, H., Rossant, J., & Hui, C.C. (1998).
Diminished Sonic hedgehog signaling and lack of floor plate differentiation in Gli2 mutant mice. Development (Cambridge, England), 125(14), 2533-43. [PubMed:9636069] [WorldCat] - ↑
Hui, C.C., & Joyner, A.L. (1993).
A mouse model of greig cephalopolysyndactyly syndrome: the extra-toesJ mutation contains an intragenic deletion of the Gli3 gene. Nature genetics, 3(3), 241-6. [PubMed:8387379] [WorldCat] [DOI] - ↑
Litingtung, Y., & Chiang, C. (2000).
Specification of ventral neuron types is mediated by an antagonistic interaction between Shh and Gli3. Nature neuroscience, 3(10), 979-85. [PubMed:11017169] [WorldCat] [DOI] - ↑
Park, H.L., Bai, C., Platt, K.A., Matise, M.P., Beeghly, A., Hui, C.C., ..., & Joyner, A.L. (2000).
Mouse Gli1 mutants are viable but have defects in SHH signaling in combination with a Gli2 mutation. Development (Cambridge, England), 127(8), 1593-605. [PubMed:10725236] [WorldCat] - ↑
Bai, C.B., & Joyner, A.L. (2001).
Gli1 can rescue the in vivo function of Gli2. Development (Cambridge, England), 128(24), 5161-72. [PubMed:11748151] [WorldCat] - ↑
Huang, Y., Roelink, H., & McKnight, G.S. (2002).
Protein kinase A deficiency causes axially localized neural tube defects in mice. The Journal of biological chemistry, 277(22), 19889-96. [PubMed:11886853] [WorldCat] [DOI] - ↑
Svärd, J., Heby-Henricson, K., Henricson, K.H., Persson-Lek, M., Rozell, B., Lauth, M., ..., & Teglund, S. (2006).
Genetic elimination of Suppressor of fused reveals an essential repressor function in the mammalian Hedgehog signaling pathway. Developmental cell, 10(2), 187-97. [PubMed:16459298] [WorldCat] [DOI] - ↑
Tukachinsky, H., Lopez, L.V., & Salic, A. (2010).
A mechanism for vertebrate Hedgehog signaling: recruitment to cilia and dissociation of SuFu-Gli protein complexes. The Journal of cell biology, 191(2), 415-28. [PubMed:20956384] [PMC] [WorldCat] [DOI] - ↑
Mukhopadhyay, S., Wen, X., Ratti, N., Loktev, A., Rangell, L., Scales, S.J., & Jackson, P.K. (2013).
The ciliary G-protein-coupled receptor Gpr161 negatively regulates the Sonic hedgehog pathway via cAMP signaling. Cell, 152(1-2), 210-23. [PubMed:23332756] [WorldCat] [DOI] - ↑
Delling, M., DeCaen, P.G., Doerner, J.F., Febvay, S., & Clapham, D.E. (2013).
Primary cilia are specialized calcium signalling organelles. Nature, 504(7479), 311-4. [PubMed:24336288] [PMC] [WorldCat] [DOI] - ↑
Chen, M.H., Wilson, C.W., & Chuang, P.T. (2007).
SnapShot: hedgehog signaling pathway. Cell, 130(2), 386. [PubMed:17662951] [WorldCat] [DOI] - ↑
Bourikas, D., Pekarik, V., Baeriswyl, T., Grunditz, A., Sadhu, R., Nardó, M., & Stoeckli, E.T. (2005).
Sonic hedgehog guides commissural axons along the longitudinal axis of the spinal cord. Nature neuroscience, 8(3), 297-304. [PubMed:15746914] [WorldCat] [DOI] - ↑
Yam, P.T., Langlois, S.D., Morin, S., & Charron, F. (2009).
Sonic hedgehog guides axons through a noncanonical, Src-family-kinase-dependent signaling pathway. Neuron, 62(3), 349-62. [PubMed:19447091] [WorldCat] [DOI] - ↑
Charron, F., Stein, E., Jeong, J., McMahon, A.P., & Tessier-Lavigne, M. (2003).
The morphogen sonic hedgehog is an axonal chemoattractant that collaborates with netrin-1 in midline axon guidance. Cell, 113(1), 11-23. [PubMed:12679031] [WorldCat] [DOI] - ↑
Charron, F., Stein, E., Jeong, J., McMahon, A.P., & Tessier-Lavigne, M. (2003).
The morphogen sonic hedgehog is an axonal chemoattractant that collaborates with netrin-1 in midline axon guidance. Cell, 113(1), 11-23. [PubMed:12679031] [WorldCat] [DOI] - ↑
Bourikas, D., Pekarik, V., Baeriswyl, T., Grunditz, A., Sadhu, R., Nardó, M., & Stoeckli, E.T. (2005).
Sonic hedgehog guides commissural axons along the longitudinal axis of the spinal cord. Nature neuroscience, 8(3), 297-304. [PubMed:15746914] [WorldCat] [DOI] - ↑
Yam, P.T., Langlois, S.D., Morin, S., & Charron, F. (2009).
Sonic hedgehog guides axons through a noncanonical, Src-family-kinase-dependent signaling pathway. Neuron, 62(3), 349-62. [PubMed:19447091] [WorldCat] [DOI] - ↑
Bijlsma, M.F., Damhofer, H., & Roelink, H. (2012).
Hedgehog-stimulated chemotaxis is mediated by smoothened located outside the primary cilium. Science signaling, 5(238), ra60. [PubMed:22912493] [PMC] [WorldCat] [DOI] - ↑
Yamada, T., Placzek, M., Tanaka, H., Dodd, J., & Jessell, T.M. (1991).
Control of cell pattern in the developing nervous system: polarizing activity of the floor plate and notochord. Cell, 64(3), 635-47. [PubMed:1991324] [WorldCat] [DOI] - ↑
Yamada, T., Pfaff, S.L., Edlund, T., & Jessell, T.M. (1993).
Control of cell pattern in the neural tube: motor neuron induction by diffusible factors from notochord and floor plate. Cell, 73(4), 673-86. [PubMed:8500163] [WorldCat] [DOI] - ↑
Roelink, H., Augsburger, A., Heemskerk, J., Korzh, V., Norlin, S., Ruiz i Altaba, A., ..., & Jessell, T.M. (1994).
Floor plate and motor neuron induction by vhh-1, a vertebrate homolog of hedgehog expressed by the notochord. Cell, 76(4), 761-75. [PubMed:8124714] [WorldCat] [DOI] - ↑
Roelink, H., Porter, J.A., Chiang, C., Tanabe, Y., Chang, D.T., Beachy, P.A., & Jessell, T.M. (1995).
Floor plate and motor neuron induction by different concentrations of the amino-terminal cleavage product of sonic hedgehog autoproteolysis. Cell, 81(3), 445-55. [PubMed:7736596] [WorldCat] [DOI] - ↑
Ribes, V., & Briscoe, J. (2009).
Establishing and interpreting graded Sonic Hedgehog signaling during vertebrate neural tube patterning: the role of negative feedback. Cold Spring Harbor perspectives in biology, 1(2), a002014. [PubMed:20066087] [PMC] [WorldCat] [DOI] - ↑
Ahn, S., & Joyner, A.L. (2005).
In vivo analysis of quiescent adult neural stem cells responding to Sonic hedgehog. Nature, 437(7060), 894-7. [PubMed:16208373] [WorldCat] [DOI] - ↑
Daynac, M., Tirou, L., Faure, H., Mouthon, M.A., Gauthier, L.R., Hahn, H., ..., & Ruat, M. (2016).
Hedgehog Controls Quiescence and Activation of Neural Stem Cells in the Adult Ventricular-Subventricular Zone. Stem cell reports, 7(4), 735-748. [PubMed:27666792] [PMC] [WorldCat] [DOI] - ↑
Cohen, M., Kicheva, A., Ribeiro, A., Blassberg, R., Page, K.M., Barnes, C.P., & Briscoe, J. (2015).
Ptch1 and Gli regulate Shh signalling dynamics via multiple mechanisms. Nature communications, 6, 6709. [PubMed:25833741] [PMC] [WorldCat] [DOI] - ↑
Kasper, M., Schnidar, H., Neill, G.W., Hanneder, M., Klingler, S., Blaas, L., ..., & Aberger, F. (2006).
Selective modulation of Hedgehog/GLI target gene expression by epidermal growth factor signaling in human keratinocytes. Molecular and cellular biology, 26(16), 6283-98. [PubMed:16880536] [PMC] [WorldCat] [DOI] - ↑
Kutejova, E., Sasai, N., Shah, A., Gouti, M., & Briscoe, J. (2016).
Neural Progenitors Adopt Specific Identities by Directly Repressing All Alternative Progenitor Transcriptional Programs. Developmental cell, 36(6), 639-53. [PubMed:26972603] [PMC] [WorldCat] [DOI] - ↑
Sasai, N., Kutejova, E., & Briscoe, J. (2014).
Integration of signals along orthogonal axes of the vertebrate neural tube controls progenitor competence and increases cell diversity. PLoS biology, 12(7), e1001907. [PubMed:25026549] [PMC] [WorldCat] [DOI] - ↑
Kutejova, E., Sasai, N., Shah, A., Gouti, M., & Briscoe, J. (2016).
Neural Progenitors Adopt Specific Identities by Directly Repressing All Alternative Progenitor Transcriptional Programs. Developmental cell, 36(6), 639-53. [PubMed:26972603] [PMC] [WorldCat] [DOI] - ↑
Williams, K.P., Rayhorn, P., Chi-Rosso, G., Garber, E.A., Strauch, K.L., Horan, G.S., ..., & Pepinsky, R.B. (1999).
Functional antagonists of sonic hedgehog reveal the importance of the N terminus for activity. Journal of cell science, 112 ( Pt 23), 4405-14. [PubMed:10564658] [WorldCat] - ↑
Dessaud, E., Yang, L.L., Hill, K., Cox, B., Ulloa, F., Ribeiro, A., ..., & Briscoe, J. (2007).
Interpretation of the sonic hedgehog morphogen gradient by a temporal adaptation mechanism. Nature, 450(7170), 717-20. [PubMed:18046410] [WorldCat] [DOI] - ↑
Briscoe, J. (2006).
Agonizing hedgehog. Nature chemical biology, 2(1), 10-1. [PubMed:16408082] [WorldCat] [DOI] - ↑
Sasaki, H., Hui, C., Nakafuku, M., & Kondoh, H. (1997).
A binding site for Gli proteins is essential for HNF-3beta floor plate enhancer activity in transgenics and can respond to Shh in vitro. Development (Cambridge, England), 124(7), 1313-22. [PubMed:9118802] [WorldCat] - ↑
Balaskas, N., Ribeiro, A., Panovska, J., Dessaud, E., Sasai, N., Page, K.M., ..., & Ribes, V. (2012).
Gene regulatory logic for reading the Sonic Hedgehog signaling gradient in the vertebrate neural tube. Cell, 148(1-2), 273-84. [PubMed:22265416] [PMC] [WorldCat] [DOI] - ↑
Cohen, M., Kicheva, A., Ribeiro, A., Blassberg, R., Page, K.M., Barnes, C.P., & Briscoe, J. (2015).
Ptch1 and Gli regulate Shh signalling dynamics via multiple mechanisms. Nature communications, 6, 6709. [PubMed:25833741] [PMC] [WorldCat] [DOI] - ↑
Dessaud, E., Yang, L.L., Hill, K., Cox, B., Ulloa, F., Ribeiro, A., ..., & Briscoe, J. (2007).
Interpretation of the sonic hedgehog morphogen gradient by a temporal adaptation mechanism. Nature, 450(7170), 717-20. [PubMed:18046410] [WorldCat] [DOI] - ↑
Cohen, M., Kicheva, A., Ribeiro, A., Blassberg, R., Page, K.M., Barnes, C.P., & Briscoe, J. (2015).
Ptch1 and Gli regulate Shh signalling dynamics via multiple mechanisms. Nature communications, 6, 6709. [PubMed:25833741] [PMC] [WorldCat] [DOI] - ↑
Dessaud, E., Yang, L.L., Hill, K., Cox, B., Ulloa, F., Ribeiro, A., ..., & Briscoe, J. (2007).
Interpretation of the sonic hedgehog morphogen gradient by a temporal adaptation mechanism. Nature, 450(7170), 717-20. [PubMed:18046410] [WorldCat] [DOI] - ↑
Balaskas, N., Ribeiro, A., Panovska, J., Dessaud, E., Sasai, N., Page, K.M., ..., & Ribes, V. (2012).
Gene regulatory logic for reading the Sonic Hedgehog signaling gradient in the vertebrate neural tube. Cell, 148(1-2), 273-84. [PubMed:22265416] [PMC] [WorldCat] [DOI] - ↑
Dessaud, E., Ribes, V., Balaskas, N., Yang, L.L., Pierani, A., Kicheva, A., ..., & Sasai, N. (2010).
Dynamic assignment and maintenance of positional identity in the ventral neural tube by the morphogen sonic hedgehog. PLoS biology, 8(6), e1000382. [PubMed:20532235] [PMC] [WorldCat] [DOI] - ↑
Dessaud, E., Yang, L.L., Hill, K., Cox, B., Ulloa, F., Ribeiro, A., ..., & Briscoe, J. (2007).
Interpretation of the sonic hedgehog morphogen gradient by a temporal adaptation mechanism. Nature, 450(7170), 717-20. [PubMed:18046410] [WorldCat] [DOI] - ↑
He, X., Zhang, L., Chen, Y., Remke, M., Shih, D., Lu, F., ..., & Lu, Q.R. (2014).
The G protein α subunit Gαs is a tumor suppressor in Sonic hedgehog-driven medulloblastoma. Nature medicine, 20(9), 1035-42. [PubMed:25150496] [PMC] [WorldCat] [DOI] - ↑
He, X., Zhang, L., Chen, Y., Remke, M., Shih, D., Lu, F., ..., & Lu, Q.R. (2014).
The G protein α subunit Gαs is a tumor suppressor in Sonic hedgehog-driven medulloblastoma. Nature medicine, 20(9), 1035-42. [PubMed:25150496] [PMC] [WorldCat] [DOI]