「神経堤」の版間の差分
細 →歴史 |
細編集の要約なし |
||
| (3人の利用者による、間の8版が非表示) | |||
| 1行目: | 1行目: | ||
英:neural crest、独:Neuralleiste、仏:crête neurale | 英:neural crest、独:Neuralleiste、仏:crête neurale | ||
同義語:神経冠 | 同義語:神経冠 | ||
[[Image:スライド1.PNG|thumb|300px|<b> | [[Image:スライド1.PNG|thumb|300px|<b>図1 神経堤の形成</b>]] [[Image:図2 神経堤からの分化.png|thumb|300px|<b>図2 神経堤からの分化</b>]] | ||
神経堤は、[[wikipedia:ja:脊椎動物|脊椎動物]]の初期発生において表皮[[外胚葉]]と[[神経板]]の間に一時的に形成される構造であり<ref name="ref1">'''C Kalcheim, N Le Douarin'''<br>The neural crest.<br>''Cambridge, UK: Cambridge University Press.'':1999</ref>、その重要性から脊椎動物が進化の過程で獲得した「第四の[[wikipedia:ja:胚葉|胚葉]]」とも呼ばれる(図1)。 | |||
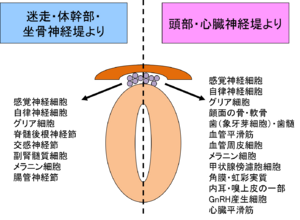
神経堤細胞(neural crest cells)は神経堤から脱上皮化(delamination)し、[[wikipedia:ja:上皮|上皮]]から[[wikipedia:ja:間葉|間葉]]への転換([[wikipedia:en:Epithelial-mesenchymal transition|epithelial-mesenchymal transition]], EMT)を行った後に胚体内の様々な部位に遊走する細胞群である。神経堤細胞は各種[[末梢神経]]系の[[神経細胞]]や[[シュワン細胞]]・[[wikipedia:ja:メラニン細胞|メラニン細胞]](メラノサイト)・[[副腎髄質]]などの[[クロム親和性細胞]]・[[wikipedia:ja:心臓|心臓]]の[[wikipedia:ja:平滑筋|平滑筋]]・顔面の[[wikipedia:ja:骨|骨]]や[[wikipedia:ja:軟骨|軟骨]]・[[wikipedia:ja:角膜|角膜]]や[[wikipedia:ja:虹彩|虹彩]]の実質・[[wikipedia:ja:歯髄|歯髄]]など多様な細胞種に分化する(図2)。神経堤細胞はその発生生物学的な観点からの研究のみならず、EMTの機序や高い移動能が癌研究の領域において注目されるとともに、多分化能を有する細胞として癌幹細胞生物学や再生医療の分野でも関心を集めている。<br> | |||
== 歴史 == | == 歴史 == | ||
神経堤は[[脊髄]][[後根神経節]] | 神経堤は[[脊髄]][[後根神経節]]の由来を調べる研究の中で発見された。19世紀後半において脊髄[[神経節]]は[[体節]]に由来すると考えられていたが、1868年にHisは[[ニワトリ]]胚の表皮外胚葉と[[神経上皮]]に介在する細胞群を神経節原基として同定し、間索(Zwischenstrang)と呼んだ。これは神経堤が文献的に記載された最初の報告である<ref name="ref2">'''W His'''<br>Untersuchungen über die erste Anlage des Wirbeltierleibes. Die erste Entwicklung des Hühnchens im Ei.<br>''Leipzig, Germany: F.C.W. Vogel.'':1868</ref>。その後1940年代まで、神経堤はメラニン細胞や脊髄神経節の供給源として、主に[[wikipedia:ja:両生類|両生類]][[wikipedia:ja:胚|胚]]を用いて研究が行われた。 | ||
1960年代に入り、[[ | 1960年代に入り、[[wikipedia:ja:鳥類|鳥類]]胚を用いて神経堤細胞の移動能を調べる実験が行われるようになった<ref name="ref3">'''B K Hall, S Hörstadius'''<br>The neural crest.<br>''London, UK: Oxford University Press.'':1988</ref>。そして1969年に、フランスのLe Douarinらのグループがニワトリ・[[wikipedia:ja:ウズラ|ウズラ]]の[[wikipedia:ja:キメラ|キメラ]]胚を作成し、神経堤細胞を本格的に標識可能にしたことで神経堤研究が大きく前進した<ref name="ref1" />。彼女らは、ニワトリに比較してウズラの細胞の[[wikipedia:ja:ヘテロクロマチン|ヘテロクロマチン]]の凝集が著明であることに着目し、神経外胚葉全体を除去したニワトリ胚にウズラ胚から摘出した神経外胚葉全体を移植し、ニワトリ体内の様々な部位に移動したウズラ由来細胞(つまり神経堤細胞)の挙動を観察した。この研究によって、神経堤細胞が脊髄後根神経節、[[交感神経節]]、[[腸管神経節]]などの末梢神経細胞やグリア細胞、心臓の平滑筋細胞、副腎や[[wikipedia:ja:甲状腺|甲状腺]]の内分泌細胞、メラニン細胞、頭部の骨軟部組織などの多種多様な組織を作り出していることが明らかになった。その後、[[wikipedia:DiI|DiI]]やDiOなどの脂溶性[[wikipedia:ja:蛍光色素|蛍光色素]]を注入し神経堤細胞を特異的に標識する方法が開発され<ref name="ref4"><pubmed> 2562671 </pubmed></ref><ref name="ref5"><pubmed> 8045344 </pubmed></ref>、鳥類胚ならびに[[wikipedia:ja:齧歯類|齧歯類]]胚において、神経堤の領域ごとに詳細な[[細胞系譜]]が明らかにされていった。 | ||
[[Image:図3 P0-Cre LacZ E12.5.png|thumb|225px|<b>図3 P0-Cre/LacZマウス(E12.5)</b>スケールバーを御願い致します。]] | |||
歴史的に神経堤の研究は鳥類胚や両生類胚を用いたものが多く、[[wikipedia:ja:哺乳類|哺乳類]]での解析は十分に行われてこなかったが、1990年代後半以降、[[Cre-loxPシステム]]を利用した[[マウス]]の神経堤研究が急速に発展した。神経堤細胞特異的な遺伝子[[プロモーター]]下流にCre遺伝子を接続したマウス(P0Cre<ref name="ref6"><pubmed> 10419695 </pubmed></ref>、Wnt1Cre<ref name="ref7"><pubmed> 10725237 </pubmed></ref>、Ht-PaCre<ref name="ref8"><pubmed> 12812797 </pubmed></ref>、S4FCre<ref name="ref9"><pubmed> 19830815 </pubmed></ref>)と、Creの存在下で[[wikipedia:Beta-galactosidase|β-galactosidase]]や[[蛍光タンパク質]]を発現するレポーターマウスを交配することにより、生後でも神経堤由来細胞(neural crest-derived cells, NCDCs)でこれらの酵素や色素を発現し続けるマウスが作製された(図3)。これらのマウスを用いた実験により、これまで報告されてきたニワトリ・ウズラのキメラ実験やDiI トレーサー実験の結果が確証された。また、成体においても、神経堤由来の組織中に多分化能を有する未分化な神経堤由来細胞(神経堤幹細胞:neural crest stem cells<ref name="ref10">'''Maya Seiber-Blum (Author, Editor)'''<br>Neural Crest Stem Cells: Breakthroughs and Applications.<br>''Singapore, Singapore: World Scientific.'':2012</ref>)が存在することが明らかになった ([[wikipedia:ja:骨髄|骨髄]]<ref name="ref11"><pubmed> 18397758 </pubmed></ref>、脊髄後根神経節<ref name="ref11" />、心臓<ref name="ref12"><pubmed> 16186259 </pubmed></ref>、角膜<ref name="ref13"><pubmed> 16888282 </pubmed></ref>、虹彩<ref name="ref14"><pubmed> 21306482 </pubmed></ref>、歯髄<ref name="ref15"><pubmed> 22087335 </pubmed></ref>、嗅粘膜<ref name="ref16"><pubmed> 21943152 </pubmed></ref>)。神経堤幹細胞は自己の組織から採取可能であり、免疫[[wikipedia:ja:拒絶反応|拒絶反応]]や[[胚性幹細胞|胚性幹細胞]]が有する倫理的問題を避けることができるため、再生医療の細胞ソースとしても注目されている。また、頸部・肩の筋骨格の形成に神経堤細胞と中胚葉由来の細胞が共に貢献することも明らかなった<ref name="ref17"><pubmed> 16034409 </pubmed></ref>。さらに、感覚器プラコードから形成されると考えられていた[[wikipedia:ja:内耳|内耳]]<ref name="ref18"><pubmed> 22110056 </pubmed></ref>や[[嗅上皮]]の構築<ref name="ref16" /><ref name="ref19"><pubmed> 21543621 </pubmed></ref>に、神経堤細胞が貢献することも明らかとなった。 | |||
[[Image:図3 P0-Cre LacZ E12.5.png|thumb|225px|<b> | |||
歴史的に神経堤の研究は鳥類胚や両生類胚を用いたものが多く、[[ | |||
== 分類 == | == 分類 == | ||
神経堤は前後軸に沿って五つの部位に大別され、その機能は各部位で大きく異なる。 | |||
==== 頭部神経堤 ==== | ==== 頭部神経堤 ==== | ||
背外側に移動し、顔面頭蓋の[[wikipedia:ja:間葉|間葉]]組織や[[wikipedia:ja:咽頭弓|咽頭弓]]・[[wikipedia:ja:咽頭嚢|咽頭嚢]]に侵入する。顔面頭蓋の間葉に移動した神経堤細胞より、[[脳神経]]節([[第V脳神経|Ⅴ]]・[[第VII脳神経|ⅤII]]・[[第IX脳神経|IX]]・[[第X脳神経|X]] | 背外側に移動し、顔面頭蓋の[[wikipedia:ja:間葉|間葉]]組織や[[wikipedia:ja:咽頭弓|咽頭弓]]・[[wikipedia:ja:咽頭嚢|咽頭嚢]]に侵入する。顔面頭蓋の間葉に移動した神経堤細胞より、[[脳神経]]節([[第V脳神経|Ⅴ]]・[[第VII脳神経|ⅤII]]・[[第IX脳神経|IX]]・[[第X脳神経|X]])の神経細胞、[[シュワン細胞]]、顔面頭蓋の[[wikipedia:ja:骨格筋|骨格筋]]・骨・軟骨、血管平滑筋や[[wikipedia:ja:血管周皮細胞|血管周皮細胞]]、角膜や虹彩の実質、[[くも膜]]や[[軟膜]]などが形成される。咽頭弓・咽頭嚢に侵入した神経堤細胞は、[[wikipedia:ja:甲状腺|甲状腺]][[wikipedia:ja:傍濾胞細胞|傍濾胞細胞]]、[[wikipedia:ja:耳小骨|耳小骨]]、[[wikipedia:ja:下顎骨|下顎骨]]、[[wikipedia:ja:象牙芽細胞|象牙芽細胞]]などを形成するとともに、[[wikipedia:ja:胸腺|胸腺]]や[[wikipedia:ja:副甲状腺|副甲状腺]]の形成を誘導する。 | ||
==== 心臓神経堤 ==== | ==== 心臓神経堤 ==== | ||
| 64行目: | 55行目: | ||
== 多分化能 == | == 多分化能 == | ||
移動を開始する前の神経堤細胞には、神経細胞や[[シュワン細胞]]、メラニン細胞など複数の細胞種に分化できる多能性を有した細胞が存在すると報告されている<ref name="ref32"><pubmed> 2457813 </pubmed></ref>。しかしながら、神経堤細胞の全てが多能性を有している訳ではなく、遊走前から分化の方向が決定されている細胞も存在する。初期に神経堤を離脱した細胞の多くは、神経細胞には分化するがメラニン細胞には分化せず、逆に後期に神経堤を離脱した細胞はメラニン細胞には分化するが神経細胞には分化できない<ref name="ref33"><pubmed> 9334283 </pubmed></ref>。これらの神経堤細胞の分化方向は、[[wikipedia:en:SOX9|Sox9]]や[[wikipedia:en:SOX10|Sox10]]によって活性化される[[wikipedia:en:Microphthalmia-associated transcription factor|Mitf]]・[[wikipedia:en:CD117|c-Kit]](メラニン細胞)や[[wikipedia:en:Myelin protein zero|P0]](シュワン細胞)などによって運命づけられる<ref name="ref20" />。一方、神経堤細胞の最終的な分化は移動後の環境にも大きく依存するとされる。例えば、脊髄神経節の形成には[[脳由来神経成長因子]](brain-derived neurotrophic factor, BDNF)が、シュワン細胞への分化にはグリア増殖因子である[[ニューレグリン]](neuregulin)が、平滑筋の形成には[[wikipedia:en:Transforming growth factor beta|TGF-β]]の存在が重要である。 | |||
== 神経堤症(neurocristopathy) == | == 神経堤症(neurocristopathy) == | ||
神経堤からは多様な細胞が分化するため、その特定の細胞系譜に発生・分化・遊走の異常が生じると様々な疾患が誘導される。ヒトにおいて、神経堤に由来するとされる組織の先天[[wikipedia:ja:奇形|奇形]]や[[wikipedia:ja:腫瘍|腫瘍]]などは神経堤症と総称される。代表的な疾患としては、腸管末端部における神経節細胞の先天的欠損に起因する[[wikipedia:ja:ヒルシュスプルング病|Hirschsprung病]](先天性巨大結腸症)、副腎髄質のクロム親和性細胞の腫瘍である[[wikipedia:ja:褐色細胞腫|褐色細胞腫]]、カフェオレ斑や神経線維腫を主徴とする全身性[[wikipedia:ja:母斑症|母斑症]]である[[神経線維腫症]]1型([[von Recklinghausen病]])、感音難聴・白髪・[[wikipedia:ja:虹彩異色症|虹彩異色症]]をきたす[[wikipedia:ja:ワールデンブルグ症候群|Waardenburg症候群]]、第3第4咽頭嚢の発生異常により心奇形・顔面異常・胸腺の低形成・[[wikipedia:ja:口唇口蓋裂|口蓋裂]]・低[[カルシウム]]血症などをきたす[[wikipedia:ja:22q11.2欠失症候群|22q11.2欠失症候群]]などがある。近年、[[CHARGE症候群]](虹彩欠損・心疾患・後鼻孔閉鎖・成長障害と精神発達障害・性器の低形成・耳介の変形・[[wikipedia:ja:難聴|難聴]]を特徴とする)の原因遺伝子であるCHD7遺伝子が、[[wikipedia:ja:ヒト|ヒト]]ならびに[[アフリカツメガエル]]の神経堤形成に必須であることが明らかになりCHARGE症候群が神経堤症であると実証された<ref name="ref34"><pubmed> 20130577 </pubmed></ref>。 | 神経堤からは多様な細胞が分化するため、その特定の細胞系譜に発生・分化・遊走の異常が生じると様々な疾患が誘導される。ヒトにおいて、神経堤に由来するとされる組織の先天[[wikipedia:ja:奇形|奇形]]や[[wikipedia:ja:腫瘍|腫瘍]]などは神経堤症と総称される。代表的な疾患としては、腸管末端部における神経節細胞の先天的欠損に起因する[[wikipedia:ja:ヒルシュスプルング病|Hirschsprung病]](先天性巨大結腸症)、副腎髄質のクロム親和性細胞の腫瘍である[[wikipedia:ja:褐色細胞腫|褐色細胞腫]]、カフェオレ斑や神経線維腫を主徴とする全身性[[wikipedia:ja:母斑症|母斑症]]である[[神経線維腫症]]1型([[von Recklinghausen病]])、感音難聴・白髪・[[wikipedia:ja:虹彩異色症|虹彩異色症]]をきたす[[wikipedia:ja:ワールデンブルグ症候群|Waardenburg症候群]]、第3第4咽頭嚢の発生異常により心奇形・顔面異常・胸腺の低形成・[[wikipedia:ja:口唇口蓋裂|口蓋裂]]・低[[カルシウム]]血症などをきたす[[wikipedia:ja:22q11.2欠失症候群|22q11.2欠失症候群]]などがある。近年、[[CHARGE症候群]](虹彩欠損・心疾患・後鼻孔閉鎖・成長障害と精神発達障害・性器の低形成・耳介の変形・[[wikipedia:ja:難聴|難聴]]を特徴とする)の原因遺伝子であるCHD7遺伝子が、[[wikipedia:ja:ヒト|ヒト]]ならびに[[アフリカツメガエル]]の神経堤形成に必須であることが明らかになりCHARGE症候群が神経堤症であると実証された<ref name="ref34"><pubmed> 20130577 </pubmed></ref>。<br> | ||
<br> | |||
== 参考文献 == | == 参考文献 == | ||
<references /> | <references /> | ||
<br> | |||
== 日本語総説・教科書 == | == 日本語総説・教科書 == | ||
| 79行目: | 75行目: | ||
#'''若松義雄'''<br>「神経堤細胞分化」第3章 細胞の分化過程<br>''『わかる実験医学シリーズ 発生生物学がわかる』 (上野直人/野地澄晴 編)羊土社(東京)'':2003 | #'''若松義雄'''<br>「神経堤細胞分化」第3章 細胞の分化過程<br>''『わかる実験医学シリーズ 発生生物学がわかる』 (上野直人/野地澄晴 編)羊土社(東京)'':2003 | ||
#'''若松義雄'''<br>「神経堤細胞のEMT過程の制御」<br>''『EMT研究がいま面白い 発生・癌・病態研究から見えてきた接点』 細胞工学:2008,27(4);332-336'' | #'''若松義雄'''<br>「神経堤細胞のEMT過程の制御」<br>''『EMT研究がいま面白い 発生・癌・病態研究から見えてきた接点』 細胞工学:2008,27(4);332-336'' | ||
#'''齋藤大介、田所竜介、高橋淑子'''<br>「神経冠細胞の移動メカニズム」<br>''『幹細胞研究の最新の進歩(後篇)多能性幹細胞』 最新医学:2009,64;1244-1258'' | #'''齋藤大介、田所竜介、高橋淑子'''<br>「神経冠細胞の移動メカニズム」<br>''『幹細胞研究の最新の進歩(後篇)多能性幹細胞』 最新医学:2009,64;1244-1258'' | ||
(執筆担当者: 鈴木 淳、大隅典子 担当編集委員: 村上富士夫) | |||
2012年6月12日 (火) 21:49時点における版
英:neural crest、独:Neuralleiste、仏:crête neurale
同義語:神経冠
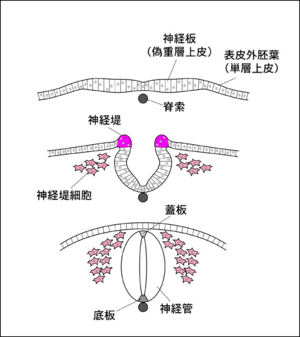
神経堤は、脊椎動物の初期発生において表皮外胚葉と神経板の間に一時的に形成される構造であり[1]、その重要性から脊椎動物が進化の過程で獲得した「第四の胚葉」とも呼ばれる(図1)。
神経堤細胞(neural crest cells)は神経堤から脱上皮化(delamination)し、上皮から間葉への転換(epithelial-mesenchymal transition, EMT)を行った後に胚体内の様々な部位に遊走する細胞群である。神経堤細胞は各種末梢神経系の神経細胞やシュワン細胞・メラニン細胞(メラノサイト)・副腎髄質などのクロム親和性細胞・心臓の平滑筋・顔面の骨や軟骨・角膜や虹彩の実質・歯髄など多様な細胞種に分化する(図2)。神経堤細胞はその発生生物学的な観点からの研究のみならず、EMTの機序や高い移動能が癌研究の領域において注目されるとともに、多分化能を有する細胞として癌幹細胞生物学や再生医療の分野でも関心を集めている。
歴史
神経堤は脊髄後根神経節の由来を調べる研究の中で発見された。19世紀後半において脊髄神経節は体節に由来すると考えられていたが、1868年にHisはニワトリ胚の表皮外胚葉と神経上皮に介在する細胞群を神経節原基として同定し、間索(Zwischenstrang)と呼んだ。これは神経堤が文献的に記載された最初の報告である[2]。その後1940年代まで、神経堤はメラニン細胞や脊髄神経節の供給源として、主に両生類胚を用いて研究が行われた。
1960年代に入り、鳥類胚を用いて神経堤細胞の移動能を調べる実験が行われるようになった[3]。そして1969年に、フランスのLe Douarinらのグループがニワトリ・ウズラのキメラ胚を作成し、神経堤細胞を本格的に標識可能にしたことで神経堤研究が大きく前進した[1]。彼女らは、ニワトリに比較してウズラの細胞のヘテロクロマチンの凝集が著明であることに着目し、神経外胚葉全体を除去したニワトリ胚にウズラ胚から摘出した神経外胚葉全体を移植し、ニワトリ体内の様々な部位に移動したウズラ由来細胞(つまり神経堤細胞)の挙動を観察した。この研究によって、神経堤細胞が脊髄後根神経節、交感神経節、腸管神経節などの末梢神経細胞やグリア細胞、心臓の平滑筋細胞、副腎や甲状腺の内分泌細胞、メラニン細胞、頭部の骨軟部組織などの多種多様な組織を作り出していることが明らかになった。その後、DiIやDiOなどの脂溶性蛍光色素を注入し神経堤細胞を特異的に標識する方法が開発され[4][5]、鳥類胚ならびに齧歯類胚において、神経堤の領域ごとに詳細な細胞系譜が明らかにされていった。
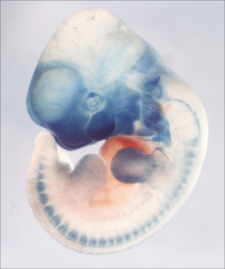
歴史的に神経堤の研究は鳥類胚や両生類胚を用いたものが多く、哺乳類での解析は十分に行われてこなかったが、1990年代後半以降、Cre-loxPシステムを利用したマウスの神経堤研究が急速に発展した。神経堤細胞特異的な遺伝子プロモーター下流にCre遺伝子を接続したマウス(P0Cre[6]、Wnt1Cre[7]、Ht-PaCre[8]、S4FCre[9])と、Creの存在下でβ-galactosidaseや蛍光タンパク質を発現するレポーターマウスを交配することにより、生後でも神経堤由来細胞(neural crest-derived cells, NCDCs)でこれらの酵素や色素を発現し続けるマウスが作製された(図3)。これらのマウスを用いた実験により、これまで報告されてきたニワトリ・ウズラのキメラ実験やDiI トレーサー実験の結果が確証された。また、成体においても、神経堤由来の組織中に多分化能を有する未分化な神経堤由来細胞(神経堤幹細胞:neural crest stem cells[10])が存在することが明らかになった (骨髄[11]、脊髄後根神経節[11]、心臓[12]、角膜[13]、虹彩[14]、歯髄[15]、嗅粘膜[16])。神経堤幹細胞は自己の組織から採取可能であり、免疫拒絶反応や胚性幹細胞が有する倫理的問題を避けることができるため、再生医療の細胞ソースとしても注目されている。また、頸部・肩の筋骨格の形成に神経堤細胞と中胚葉由来の細胞が共に貢献することも明らかなった[17]。さらに、感覚器プラコードから形成されると考えられていた内耳[18]や嗅上皮の構築[16][19]に、神経堤細胞が貢献することも明らかとなった。
分類
神経堤は前後軸に沿って五つの部位に大別され、その機能は各部位で大きく異なる。
頭部神経堤
背外側に移動し、顔面頭蓋の間葉組織や咽頭弓・咽頭嚢に侵入する。顔面頭蓋の間葉に移動した神経堤細胞より、脳神経節(Ⅴ・ⅤII・IX・X)の神経細胞、シュワン細胞、顔面頭蓋の骨格筋・骨・軟骨、血管平滑筋や血管周皮細胞、角膜や虹彩の実質、くも膜や軟膜などが形成される。咽頭弓・咽頭嚢に侵入した神経堤細胞は、甲状腺傍濾胞細胞、耳小骨、下顎骨、象牙芽細胞などを形成するとともに、胸腺や副甲状腺の形成を誘導する。
心臓神経堤
迷走神経堤の一部は第3-6咽頭弓や心臓原基に侵入し、心臓神経堤と呼ばれる。咽頭弓に侵入した神経堤細胞は神経細胞やメラニン細胞、動脈弓の平滑筋や結合組織などに分化する。心臓原基に侵入した神経堤細胞は大動脈肺動脈中隔の平滑筋を形成する。また、腹腔神経節などの大動脈前方に存在する神経節を形成する。
迷走神経堤
頸部の迷走神経堤から腹側に移動し、腸管壁に侵入する。この細胞群からは、副交感神経性の腸管神経節(アウエルバッハ神経叢とマイスナー神経叢)が生じる。
体幹部神経堤
背外側に移動して表皮と体節の間を通過し、腹側の正中部に向かう経路(背側経路)と、神経管外側を通過し腹側に移動する経路(腹側経路)の二つに大別される。背側経路を通過する神経堤細胞からはメラニン細胞、腹側経路を通過する神経堤細胞からは、脊髄後根神経節、交感神経節、副腎髄質などが形成される。
坐骨神経堤
尾部の坐骨神経堤から腹側に移動し、腸管壁に侵入する。この細胞群からは、副交感神経性の腸管神経節(アウエルバッハ神経叢とマイスナー神経叢)が生じる。
誘導
神経堤の成立には、表皮外胚葉、神経上皮、そしてその境界領域(神経堤の予定部位)における種々の誘導シグナルと、それによって引き起こされる遺伝子カスケードが必要とされる[20]。表皮外胚葉の運命決定は高濃度の骨形成因子(bone morphogenetic protein, BMP)の発現によってなされ[21]、ケラチンといった表皮特異的な遺伝子を発現するようになる。神経上皮ではBMPの発現が抑制されるとともに中胚葉からの誘導シグナルを受け、Zic、Sox2、Neurod、proneural bHLH転写制御因子、N-CAM、N-チュブリンなどを発現するようになる。表皮外胚葉と神経上皮の境界領域では、WNT[22]、中濃度のBMP(脊椎動物)、沿軸中胚葉より分泌される線維芽細胞成長因子(fibroblast growth factor, FGF)[23]などの誘導シグナルによりPax3/7、Msx1/2、Zicなどの遺伝子が発現し、神経堤特異的な遺伝子群(Snail、Slug、FoxD3、AP-2)の発現が誘導される[20]。また、境界領域の細胞と神経上皮細胞間のNotchシグナリングを介した細胞間相互作用も神経堤の誘導に重要とされる[24] 。
脱上皮化
誘導された神経堤細胞は転写制御因子であるSlugなどを発現し[25]、EMTを行い脱上皮化する。脱上皮化の過程において、細胞骨格の制御を行うRho GTPaseと細胞接着因子であるカドヘリン(cadherin)の発現が変化することにより、細胞形態や細胞接着に変化が生じる[26]。特にカドヘリン-6Bの発現が失われることがEMTに重要とされる[27]。他に基底膜を破壊する酵素などの発現が重要な役割を果たす。
移動能力
神経堤細胞の胚内での移動は厳密に制御されており、フィブロネクチン(fibronectin)やラミニン(laminin)などの細胞外マトリックスと、神経堤細胞が発現するインテグリン(integrin)の相互作用が必要とされる[28]。神経堤細胞が移動する経路は、神経細胞やグリア細胞に分化する細胞が通過する「腹側経路」と、メラニン細胞が通過する「背側経路」の二つに大別される。フィブロネクチンやラミニンといった細胞外マトリックスは神経堤細胞の移動経路全般に発現しており、経路の選択には神経堤細胞と移動経路の組織に発現する誘引因子・反発因子の相互作用が重要である。代表的なものとして、腹側経路の選択に関わる反発性のEph受容体/エフリン[29]およびロボ/スリットシグナル[30]、背側経路の選択に関わる誘引性のEph受容体/エフリンシグナル[29]、エンドセリンB2受容体/エンドセリン3シグナル[31]などがある。
多分化能
移動を開始する前の神経堤細胞には、神経細胞やシュワン細胞、メラニン細胞など複数の細胞種に分化できる多能性を有した細胞が存在すると報告されている[32]。しかしながら、神経堤細胞の全てが多能性を有している訳ではなく、遊走前から分化の方向が決定されている細胞も存在する。初期に神経堤を離脱した細胞の多くは、神経細胞には分化するがメラニン細胞には分化せず、逆に後期に神経堤を離脱した細胞はメラニン細胞には分化するが神経細胞には分化できない[33]。これらの神経堤細胞の分化方向は、Sox9やSox10によって活性化されるMitf・c-Kit(メラニン細胞)やP0(シュワン細胞)などによって運命づけられる[20]。一方、神経堤細胞の最終的な分化は移動後の環境にも大きく依存するとされる。例えば、脊髄神経節の形成には脳由来神経成長因子(brain-derived neurotrophic factor, BDNF)が、シュワン細胞への分化にはグリア増殖因子であるニューレグリン(neuregulin)が、平滑筋の形成にはTGF-βの存在が重要である。
神経堤症(neurocristopathy)
神経堤からは多様な細胞が分化するため、その特定の細胞系譜に発生・分化・遊走の異常が生じると様々な疾患が誘導される。ヒトにおいて、神経堤に由来するとされる組織の先天奇形や腫瘍などは神経堤症と総称される。代表的な疾患としては、腸管末端部における神経節細胞の先天的欠損に起因するHirschsprung病(先天性巨大結腸症)、副腎髄質のクロム親和性細胞の腫瘍である褐色細胞腫、カフェオレ斑や神経線維腫を主徴とする全身性母斑症である神経線維腫症1型(von Recklinghausen病)、感音難聴・白髪・虹彩異色症をきたすWaardenburg症候群、第3第4咽頭嚢の発生異常により心奇形・顔面異常・胸腺の低形成・口蓋裂・低カルシウム血症などをきたす22q11.2欠失症候群などがある。近年、CHARGE症候群(虹彩欠損・心疾患・後鼻孔閉鎖・成長障害と精神発達障害・性器の低形成・耳介の変形・難聴を特徴とする)の原因遺伝子であるCHD7遺伝子が、ヒトならびにアフリカツメガエルの神経堤形成に必須であることが明らかになりCHARGE症候群が神経堤症であると実証された[34]。
参考文献
- ↑ 1.0 1.1 C Kalcheim, N Le Douarin
The neural crest.
Cambridge, UK: Cambridge University Press.:1999 - ↑ W His
Untersuchungen über die erste Anlage des Wirbeltierleibes. Die erste Entwicklung des Hühnchens im Ei.
Leipzig, Germany: F.C.W. Vogel.:1868 - ↑ B K Hall, S Hörstadius
The neural crest.
London, UK: Oxford University Press.:1988 - ↑
Serbedzija, G.N., Bronner-Fraser, M., & Fraser, S.E. (1989).
A vital dye analysis of the timing and pathways of avian trunk neural crest cell migration. Development (Cambridge, England), 106(4), 809-16. [PubMed:2562671] [WorldCat] - ↑
Osumi-Yamashita, N., Ninomiya, Y., Doi, H., & Eto, K. (1994).
The contribution of both forebrain and midbrain crest cells to the mesenchyme in the frontonasal mass of mouse embryos. Developmental biology, 164(2), 409-19. [PubMed:8045344] [WorldCat] [DOI] - ↑
Yamauchi, Y., Abe, K., Mantani, A., Hitoshi, Y., Suzuki, M., Osuzu, F., ..., & Yamamura, K. (1999).
A novel transgenic technique that allows specific marking of the neural crest cell lineage in mice. Developmental biology, 212(1), 191-203. [PubMed:10419695] [WorldCat] [DOI] - ↑
Jiang, X., Rowitch, D.H., Soriano, P., McMahon, A.P., & Sucov, H.M. (2000).
Fate of the mammalian cardiac neural crest. Development (Cambridge, England), 127(8), 1607-16. [PubMed:10725237] [WorldCat] - ↑
Pietri, T., Eder, O., Blanche, M., Thiery, J.P., & Dufour, S. (2003).
The human tissue plasminogen activator-Cre mouse: a new tool for targeting specifically neural crest cells and their derivatives in vivo. Developmental biology, 259(1), 176-87. [PubMed:12812797] [WorldCat] [DOI] - ↑
Stine, Z.E., Huynh, J.L., Loftus, S.K., Gorkin, D.U., Salmasi, A.H., Novak, T., ..., & McCallion, A.S. (2009).
Oligodendroglial and pan-neural crest expression of Cre recombinase directed by Sox10 enhancer. Genesis (New York, N.Y. : 2000), 47(11), 765-70. [PubMed:19830815] [PMC] [WorldCat] [DOI] - ↑ Maya Seiber-Blum (Author, Editor)
Neural Crest Stem Cells: Breakthroughs and Applications.
Singapore, Singapore: World Scientific.:2012 - ↑ 11.0 11.1
Nagoshi, N., Shibata, S., Kubota, Y., Nakamura, M., Nagai, Y., Satoh, E., ..., & Okano, H. (2008).
Ontogeny and multipotency of neural crest-derived stem cells in mouse bone marrow, dorsal root ganglia, and whisker pad. Cell stem cell, 2(4), 392-403. [PubMed:18397758] [WorldCat] [DOI] - ↑
Tomita, Y., Matsumura, K., Wakamatsu, Y., Matsuzaki, Y., Shibuya, I., Kawaguchi, H., ..., & Fukuda, K. (2005).
Cardiac neural crest cells contribute to the dormant multipotent stem cell in the mammalian heart. The Journal of cell biology, 170(7), 1135-46. [PubMed:16186259] [PMC] [WorldCat] [DOI] - ↑
Yoshida, S., Shimmura, S., Nagoshi, N., Fukuda, K., Matsuzaki, Y., Okano, H., & Tsubota, K. (2006).
Isolation of multipotent neural crest-derived stem cells from the adult mouse cornea. Stem cells (Dayton, Ohio), 24(12), 2714-22. [PubMed:16888282] [WorldCat] [DOI] - ↑
Kikuchi, M., Hayashi, R., Kanakubo, S., Ogasawara, A., Yamato, M., Osumi, N., & Nishida, K. (2011).
Neural crest-derived multipotent cells in the adult mouse iris stroma. Genes to cells : devoted to molecular & cellular mechanisms, 16(3), 273-81. [PubMed:21306482] [WorldCat] [DOI] - ↑
Janebodin, K., Horst, O.V., Ieronimakis, N., Balasundaram, G., Reesukumal, K., Pratumvinit, B., & Reyes, M. (2011).
Isolation and characterization of neural crest-derived stem cells from dental pulp of neonatal mice. PloS one, 6(11), e27526. [PubMed:22087335] [PMC] [WorldCat] [DOI] - ↑ 16.0 16.1
Katoh, H., Shibata, S., Fukuda, K., Sato, M., Satoh, E., Nagoshi, N., ..., & Okano, H. (2011).
The dual origin of the peripheral olfactory system: placode and neural crest. Molecular brain, 4, 34. [PubMed:21943152] [PMC] [WorldCat] [DOI] - ↑
Matsuoka, T., Ahlberg, P.E., Kessaris, N., Iannarelli, P., Dennehy, U., Richardson, W.D., ..., & Koentges, G. (2005).
Neural crest origins of the neck and shoulder. Nature, 436(7049), 347-55. [PubMed:16034409] [PMC] [WorldCat] [DOI] - ↑
Freyer, L., Aggarwal, V., & Morrow, B.E. (2011).
Dual embryonic origin of the mammalian otic vesicle forming the inner ear. Development (Cambridge, England), 138(24), 5403-14. [PubMed:22110056] [PMC] [WorldCat] [DOI] - ↑
Forni, P.E., Taylor-Burds, C., Melvin, V.S., Williams, T., Williams, T., & Wray, S. (2011).
Neural crest and ectodermal cells intermix in the nasal placode to give rise to GnRH-1 neurons, sensory neurons, and olfactory ensheathing cells. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(18), 6915-27. [PubMed:21543621] [PMC] [WorldCat] [DOI] - ↑ 20.0 20.1 20.2
Meulemans, D., & Bronner-Fraser, M. (2004).
Gene-regulatory interactions in neural crest evolution and development. Developmental cell, 7(3), 291-9. [PubMed:15363405] [WorldCat] [DOI] - ↑
Liem, K.F., Tremml, G., Roelink, H., & Jessell, T.M. (1995).
Dorsal differentiation of neural plate cells induced by BMP-mediated signals from epidermal ectoderm. Cell, 82(6), 969-79. [PubMed:7553857] [WorldCat] [DOI] - ↑
García-Castro, M.I., Marcelle, C., & Bronner-Fraser, M. (2002).
Ectodermal Wnt function as a neural crest inducer. Science (New York, N.Y.), 297(5582), 848-51. [PubMed:12161657] [WorldCat] - ↑
Mayor, R., Guerrero, N., & Martínez, C. (1997).
Role of FGF and noggin in neural crest induction. Developmental biology, 189(1), 1-12. [PubMed:9281332] [WorldCat] [DOI] - ↑
Endo, Y., Osumi, N., & Wakamatsu, Y. (2002).
Bimodal functions of Notch-mediated signaling are involved in neural crest formation during avian ectoderm development. Development (Cambridge, England), 129(4), 863-73. [PubMed:11861470] [WorldCat] - ↑
Nieto, M.A., Sargent, M.G., Wilkinson, D.G., & Cooke, J. (1994).
Control of cell behavior during vertebrate development by Slug, a zinc finger gene. Science (New York, N.Y.), 264(5160), 835-9. [PubMed:7513443] [WorldCat] [DOI] - ↑
Fukata, M., & Kaibuchi, K. (2001).
Rho-family GTPases in cadherin-mediated cell-cell adhesion. Nature reviews. Molecular cell biology, 2(12), 887-97. [PubMed:11733768] [WorldCat] [DOI] - ↑
Coles, E.G., Taneyhill, L.A., & Bronner-Fraser, M. (2007).
A critical role for Cadherin6B in regulating avian neural crest emigration. Developmental biology, 312(2), 533-44. [PubMed:17991460] [PMC] [WorldCat] [DOI] - ↑
Lallier, T., & Bronner-Fraser, M. (1993).
Inhibition of neural crest cell attachment by integrin antisense oligonucleotides. Science (New York, N.Y.), 259(5095), 692-5. [PubMed:8430321] [WorldCat] [DOI] - ↑ 29.0 29.1
Santiago, A., & Erickson, C.A. (2002).
Ephrin-B ligands play a dual role in the control of neural crest cell migration. Development (Cambridge, England), 129(15), 3621-32. [PubMed:12117812] [WorldCat] - ↑
Jia, L., Cheng, L., & Raper, J. (2005).
Slit/Robo signaling is necessary to confine early neural crest cells to the ventral migratory pathway in the trunk. Developmental biology, 282(2), 411-21. [PubMed:15950606] [WorldCat] [DOI] - ↑
Pla, P., Alberti, C., Solov'eva, O., Pasdar, M., Kunisada, T., & Larue, L. (2005).
Ednrb2 orients cell migration towards the dorsolateral neural crest pathway and promotes melanocyte differentiation. Pigment cell research, 18(3), 181-7. [PubMed:15892714] [WorldCat] [DOI] - ↑
Bronner-Fraser, M., & Fraser, S.E. (1988).
Cell lineage analysis reveals multipotency of some avian neural crest cells. Nature, 335(6186), 161-4. [PubMed:2457813] [WorldCat] [DOI] - ↑
Henion, P.D., & Weston, J.A. (1997).
Timing and pattern of cell fate restrictions in the neural crest lineage. Development (Cambridge, England), 124(21), 4351-9. [PubMed:9334283] [WorldCat] - ↑
Bajpai, R., Chen, D.A., Rada-Iglesias, A., Zhang, J., Xiong, Y., Helms, J., ..., & Wysocka, J. (2010).
CHD7 cooperates with PBAF to control multipotent neural crest formation. Nature, 463(7283), 958-62. [PubMed:20130577] [PMC] [WorldCat] [DOI]
日本語総説・教科書
- 倉谷滋、大隅典子
『神経堤細胞 脊椎動物のボディプランを支えるもの』
東京大学出版会(東京):1997 - Jonathan Slack 著、大隅典子 訳
『エッセンシャル発生生物学(改訂第2版)』
羊土社(東京):2007 - 若松義雄
「神経堤細胞分化」第3章 細胞の分化過程
『わかる実験医学シリーズ 発生生物学がわかる』 (上野直人/野地澄晴 編)羊土社(東京):2003 - 若松義雄
「神経堤細胞のEMT過程の制御」
『EMT研究がいま面白い 発生・癌・病態研究から見えてきた接点』 細胞工学:2008,27(4);332-336 - 齋藤大介、田所竜介、高橋淑子
「神経冠細胞の移動メカニズム」
『幹細胞研究の最新の進歩(後篇)多能性幹細胞』 最新医学:2009,64;1244-1258
(執筆担当者: 鈴木 淳、大隅典子 担当編集委員: 村上富士夫)