「Rabファミリー低分子量Gタンパク質」の版間の差分
細編集の要約なし |
細 RabをRabファミリー低分子量Gタンパク質へ移動 |
||
| (2人の利用者による、間の2版が非表示) | |||
| 1行目: | 1行目: | ||
Rabは[[Ras]]スーパーファミリーに属する[[低分子量GTP結合タンパク質]](グアニンヌクレオチド結合タンパク質)であり、[[wikipedia:JA:GTP|GTP]](グアニンヌクレオチド三リン酸)を結合した活性化型と[[wikipedia:JA:GDP|GDP]](グアニンヌクレオチド二リン酸)を結合した不活性化型とをサイクルすることで、[[小胞輸送]](メンブレントラフィックあるいは膜トラフィッキング)を制御する分子スイッチとして機能している<ref name=ref1><pubmed>11697911</pubmed></ref><ref name=ref2><pubmed>11252952</pubmed></ref><ref name=ref3><pubmed>19603039</pubmed></ref>。Rabは小胞輸送を介して細胞内で起こる様々な物質輸送を時空間的に制御しており、神経機能をはじめとする様々な生命現象において重要な役割を果たしている。 | Rabは[[Ras]]スーパーファミリーに属する[[低分子量GTP結合タンパク質]](グアニンヌクレオチド結合タンパク質)であり、[[wikipedia:JA:GTP|GTP]](グアニンヌクレオチド三リン酸)を結合した活性化型と[[wikipedia:JA:GDP|GDP]](グアニンヌクレオチド二リン酸)を結合した不活性化型とをサイクルすることで、[[小胞輸送]](メンブレントラフィックあるいは膜トラフィッキング)を制御する分子スイッチとして機能している<ref name=ref1><pubmed>11697911</pubmed></ref><ref name=ref2><pubmed>11252952</pubmed></ref><ref name=ref3><pubmed>19603039</pubmed></ref>。Rabは小胞輸送を介して細胞内で起こる様々な物質輸送を時空間的に制御しており、神経機能をはじめとする様々な生命現象において重要な役割を果たしている。 | ||
== 小胞輸送の分子スイッチRab == | == 小胞輸送の分子スイッチRab == | ||
[[image:Rab図1.png|thumb|png|330px|''' | [[image:Rab図1.png|thumb|png|330px|'''図1 Rabによる小胞輸送の制御メカニズム'''<br>RabはGTPを結合した活性化型とGDPを結合した不活性化型とをサイクルすることで、小胞輸送の分子スイッチとして機能している。Rabの活性化と不活性化は、活性化因子GEFと不活性化因子GAPにより制御されている。活性化型のRabはRabエフェクターと呼ばれるパートナー分子をオルガネラ上へとリクルートすることで小胞輸送を促進する。]] | ||
RabはRasスーパーファミリーに属する低分子量Gタンパク質で、GTPを結合した活性化型とGDPを結合した不活性化型とをサイクルする細胞内の分子スイッチである<ref name=ref1><pubmed>11697911</pubmed></ref><ref name=ref2><pubmed>11252952</pubmed></ref><ref name=ref3><pubmed>19603039</pubmed></ref>(図1)。細胞質で合成されたRabは、C末端領域が[[wikipedia:Rab geranylgeranyltransferase|Rabゲラニルゲラニル転移酵素]](Rab-GGT)によって[[脂質化修飾]](ゲラニルゲラニル化)されたのち、細胞内の特定のオルガネラ膜に局在することが可能となる。しかし、不活性化型のRabは細胞質で[[wikipedia:Rab GDP dissociation inhibitors|Rab GDP-dissociation inhibitor]](Rab-GDI)と結合するため、[[wikipedia:Geranylgeranylation|ゲラニルゲラニル基]]が覆い隠されている。このため、Rabは不活性化型のときには細胞質に留まり、活性化されたときにのみオルガネラ膜に局在し、小胞輸送を促進する分子スイッチとして機能する。 | RabはRasスーパーファミリーに属する低分子量Gタンパク質で、GTPを結合した活性化型とGDPを結合した不活性化型とをサイクルする細胞内の分子スイッチである<ref name=ref1><pubmed>11697911</pubmed></ref><ref name=ref2><pubmed>11252952</pubmed></ref><ref name=ref3><pubmed>19603039</pubmed></ref>(図1)。細胞質で合成されたRabは、C末端領域が[[wikipedia:Rab geranylgeranyltransferase|Rabゲラニルゲラニル転移酵素]](Rab-GGT)によって[[脂質化修飾]](ゲラニルゲラニル化)されたのち、細胞内の特定のオルガネラ膜に局在することが可能となる。しかし、不活性化型のRabは細胞質で[[wikipedia:Rab GDP dissociation inhibitors|Rab GDP-dissociation inhibitor]](Rab-GDI)と結合するため、[[wikipedia:Geranylgeranylation|ゲラニルゲラニル基]]が覆い隠されている。このため、Rabは不活性化型のときには細胞質に留まり、活性化されたときにのみオルガネラ膜に局在し、小胞輸送を促進する分子スイッチとして機能する。 | ||
| 26行目: | 17行目: | ||
== Rabの活性化・不活性化を担うRab-GEF・Rab-GAP == | == Rabの活性化・不活性化を担うRab-GEF・Rab-GAP == | ||
Rabの活性化と不活性化は、Rab活性化因子である[[wikipedia:RABGEF1|Rab グアニンヌクレオチド交換因子]] (Rab guanine-nucleotide exchange factor, Rab-GEF) とRab不活性化因子である[[wikipedia:RAB3GAP1|Rab GTPアーゼ活性化タンパク質]] (Rab GTPase activating protein, Rab-GAP)によって制御されている<ref name=ref13><pubmed>19706500</pubmed></ref><ref name=ref14><pubmed>20466531</pubmed></ref><ref name=ref15><pubmed>21250943</pubmed></ref> | Rabの活性化と不活性化は、Rab活性化因子である[[wikipedia:RABGEF1|Rab グアニンヌクレオチド交換因子]] (Rab guanine-nucleotide exchange factor, Rab-GEF) とRab不活性化因子である[[wikipedia:RAB3GAP1|Rab GTPアーゼ活性化タンパク質]] (Rab GTPase activating protein, Rab-GAP)によって制御されている<ref name=ref13><pubmed>19706500</pubmed></ref><ref name=ref14><pubmed>20466531</pubmed></ref><ref name=ref15><pubmed>21250943</pubmed></ref>(図1)。 | ||
Rab-GEFは不活性化型のRab に結合したGDPを取り除きGTPに置き換えることでRabを活性化型へと移行させる。Rab-GEFの機能を果たすドメインとしては、[[wikipedia:DENN domain|DENNドメイン]]や[[wikipedia:VPS9 domain|VPS9ドメイン]]などが報告されている。 | Rab-GEFは不活性化型のRab に結合したGDPを取り除きGTPに置き換えることでRabを活性化型へと移行させる。Rab-GEFの機能を果たすドメインとしては、[[wikipedia:DENN domain|DENNドメイン]]や[[wikipedia:VPS9 domain|VPS9ドメイン]]などが報告されている。 | ||
| 36行目: | 27行目: | ||
==Rabと神経機能 == | ==Rabと神経機能 == | ||
[[image:Rab図2.png|thumb|png|400px|''' | [[image:Rab図2.png|thumb|png|400px|'''図2 神経機能・神経疾患に関与するRab'''<br>*2012年4月1日の時点でPubMedに収録されている文献を参照。今後さらに増えるものと予想される。]] | ||
Rabは小胞輸送を介して、神経細胞の移動・神経細胞の形態形成・神経細胞間の情報伝達など様々な神経機能を制御することが明らかになってきている<ref name=ref20><pubmed>18485483</pubmed></ref> | Rabは小胞輸送を介して、神経細胞の移動・神経細胞の形態形成・神経細胞間の情報伝達など様々な神経機能を制御することが明らかになってきている<ref name=ref20><pubmed>18485483</pubmed></ref>(図2)。 | ||
=== 神経細胞移動=== | === 神経細胞移動=== | ||
神経細胞が複雑なネットワークを形成するためには、適切な位置への神経細胞の移動・配置が重要である。例えば、[[wikipedia:JA:哺乳類|哺乳類]]の[[大脳皮質]](新皮質)は、形態や機能の異なる六つの神経細胞の層により成り立っており、その発生の過程で、[[脳室]]側で新しく生まれた神経細胞が表層の適切な位置まで移動する。大脳皮質の神経細胞の多くは、[[放射状グリア細胞]]の突起に沿って移動するが、その際細胞の後方から[[細胞接着因子]]がエンドサイトーシスによって取り込まれ、細胞の前方へと輸送されることが必要である。実際、Rab5はN-[[カドヘリン]] | 神経細胞が複雑なネットワークを形成するためには、適切な位置への神経細胞の移動・配置が重要である。例えば、[[wikipedia:JA:哺乳類|哺乳類]]の[[大脳皮質]](新皮質)は、形態や機能の異なる六つの神経細胞の層により成り立っており、その発生の過程で、[[脳室]]側で新しく生まれた神経細胞が表層の適切な位置まで移動する。大脳皮質の神経細胞の多くは、[[放射状グリア細胞]]の突起に沿って移動するが、その際細胞の後方から[[細胞接着因子]]がエンドサイトーシスによって取り込まれ、細胞の前方へと輸送されることが必要である。実際、Rab5はN-[[カドヘリン]]のエンドサイトーシスを制御することで、放射状突起に沿った神経細胞移動を制御することが報告されている<ref name=ref21><pubmed>20797536</pubmed></ref>。 | ||
=== 神経細胞の形態形成=== | === 神経細胞の形態形成=== | ||
| 56行目: | 47行目: | ||
==神経疾患との関わり== | ==神経疾患との関わり== | ||
一部のRabは神経機能において必須の役割を果たすため、その機能の破綻はヒトやマウスの遺伝病を引き起こす<ref name=ref35><pubmed>11796263</pubmed></ref> | 一部のRabは神経機能において必須の役割を果たすため、その機能の破綻はヒトやマウスの遺伝病を引き起こす<ref name=ref35><pubmed>11796263</pubmed></ref>。図2に示すように、Rab18、Rab39Bなどの変異により精神遅延を含む神経疾患を伴う遺伝病が発症することが報告されている<ref name=ref36><pubmed>20159109</pubmed></ref><ref name=ref37><pubmed>21473985</pubmed></ref>。また、Rabのみならず、Rabの制御因子、例えばRab-GDIやRab3-GAP p130 の変異によっても神経疾患を伴う遺伝病が発症することが知られている<ref name=ref35><pubmed>11796263</pubmed></ref><ref name=ref38><pubmed>15696165</pubmed></ref>。 | ||
== 参考文献 == | == 参考文献 == | ||
<references/> | <references/> | ||
(執筆者:小林穂高、福田光則 担当編集者:柚崎通介) | |||
2012年11月14日 (水) 16:15時点における版
RabはRasスーパーファミリーに属する低分子量GTP結合タンパク質(グアニンヌクレオチド結合タンパク質)であり、GTP(グアニンヌクレオチド三リン酸)を結合した活性化型とGDP(グアニンヌクレオチド二リン酸)を結合した不活性化型とをサイクルすることで、小胞輸送(メンブレントラフィックあるいは膜トラフィッキング)を制御する分子スイッチとして機能している[1][2][3]。Rabは小胞輸送を介して細胞内で起こる様々な物質輸送を時空間的に制御しており、神経機能をはじめとする様々な生命現象において重要な役割を果たしている。
小胞輸送の分子スイッチRab
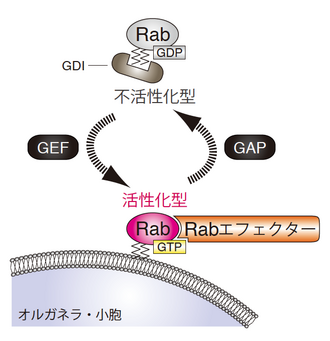
RabはGTPを結合した活性化型とGDPを結合した不活性化型とをサイクルすることで、小胞輸送の分子スイッチとして機能している。Rabの活性化と不活性化は、活性化因子GEFと不活性化因子GAPにより制御されている。活性化型のRabはRabエフェクターと呼ばれるパートナー分子をオルガネラ上へとリクルートすることで小胞輸送を促進する。
RabはRasスーパーファミリーに属する低分子量Gタンパク質で、GTPを結合した活性化型とGDPを結合した不活性化型とをサイクルする細胞内の分子スイッチである[1][2][3](図1)。細胞質で合成されたRabは、C末端領域がRabゲラニルゲラニル転移酵素(Rab-GGT)によって脂質化修飾(ゲラニルゲラニル化)されたのち、細胞内の特定のオルガネラ膜に局在することが可能となる。しかし、不活性化型のRabは細胞質でRab GDP-dissociation inhibitor(Rab-GDI)と結合するため、ゲラニルゲラニル基が覆い隠されている。このため、Rabは不活性化型のときには細胞質に留まり、活性化されたときにのみオルガネラ膜に局在し、小胞輸送を促進する分子スイッチとして機能する。
Rabは全ての真核生物に普遍的に保存されており、出芽酵母では約10種類、線虫やショウジョウバエでは約30種類、ヒトやマウスでは約60種類の異なるRabアイソフォームが存在する[1]。Rabアイソフォームによって局在するオルガネラは異なるため、局在するオルガネラに依存してRabは様々なタイプの小胞輸送を制御する。例えば、シナプス小胞に局在するRab3はシナプス小胞のエクソサイトーシス(開口分泌)を[4]、初期エンドソームに局在するRab5はエンドサイトーシスを[5]、リサイクリングエンドソームに局在するRab11はエンドサイトーシスにより取り込まれた分子のリサイクリング(endocytic recycling)を[6]制御することが知られている。しかし、それぞれのRabが局在するオルガネラをどのようなメカニズムで決めているのかについては、未だよく分かっていない。
小胞輸送を実行するRabエフェクター
活性化型のRabは、活性化型のRab特異的に結合するパートナー分子をオルガネラ上へとリクルートすることで、小胞輸送を促進する[2][3](図1)。Rabの活性化と小胞輸送の促進を結びつけるこのパートナー分子はRabエフェクターと呼ばれている。Rabエフェクターは多種多様に富み、多くの場合、Rabと結合するだけでなく他の小胞輸送の制御因子とさらに結合し、複合体を形成して小胞輸送を促進する。例えば、小胞の形成過程を促進するコートタンパク質と結合するもの、小胞の輸送過程を促進するモータータンパク質と結合するもの、小胞の融合過程を促進するSNAREタンパク質と結合するものなどが報告されている。
Rabアイソフォームによって相互作用するRabエフェクターが異なるため、あるRabが小胞輸送のどの過程を制御しているかは、結合するRabエフェクターに依存して様々である。例えば、Rab5はSNAREタンパク質に結合するEarly Endosome Antigen 1 (EEA1)をエフェクターとして用いることで、エンドサイトーシス小胞の初期エンドソームへの融合過程を制御しており[7]、一方、Rab11はダイニンモーターに結合するRab11-FIP3をエフェクターとして用いることで、初期エンドソームからリサイクリングエンドソームへの小胞の輸送過程を制御している[8]。また、一つのRabアイソフォームが複数の異なるRabエフェクターと相互作用する例も知られており、Rab27はSNAREタンパク質の一種SNAP-25と結合するラブフィリン(rabphilin)をエフェクターとして用いることで、ホルモン顆粒のエクソサイトーシス(ホルモン分泌)を促進するが[9]、閉じた構造のシンタキシン (syntaxin-1)と相互作用するSynaptotagmin-like protein 4a (Slp4a)をエフェクターとして用いると逆にホルモン分泌を抑制する[10]。近年、こういった複数のRabエフェクターに結合するRabに加え、複数のRabに結合するRabエフェクターも多数同定されてきており、RabとRabエフェクターの対応関係は必ずしも1対1ではないことが明らかになっている[11][12]。
Rabの活性化・不活性化を担うRab-GEF・Rab-GAP
Rabの活性化と不活性化は、Rab活性化因子であるRab グアニンヌクレオチド交換因子 (Rab guanine-nucleotide exchange factor, Rab-GEF) とRab不活性化因子であるRab GTPアーゼ活性化タンパク質 (Rab GTPase activating protein, Rab-GAP)によって制御されている[13][14][15](図1)。
Rab-GEFは不活性化型のRab に結合したGDPを取り除きGTPに置き換えることでRabを活性化型へと移行させる。Rab-GEFの機能を果たすドメインとしては、DENNドメインやVPS9ドメインなどが報告されている。
一方、Rab-GAPはRabに本来備わっているGTP加水分解活性 (GTPase活性)を亢進し、活性化型のRabに結合したGTPをGDPへと加水分解することでRabを不活性化型へと移行させる。Rab-GAPの機能を果たすドメインとしてはTBCドメインがよく知られているが[15]、TBCドメインを持たないRab-GAPも例外的に存在する。
Rab-GEFとRab-GAPはRabの活性化・不活性化を介して小胞輸送を制御しており、例えばRab3-GEFのRab3GEP/DENN/MADDとRab3-GAPのp130はRab3同様にいずれもシナプス小胞のエクソサイトーシスを制御することが報告されている[16][17]。ただし近年、複数のRabを活性化するRab-GEFや、複数のRab-GAPによって不活性化されるRabなどが同定されてきており、RabとRabエフェクターの関係と同様に、RabとRab-GEF・Rab-GAPの対応関係も必ずしも1対1ではないことが明らかになっている[18][19]。
Rabと神経機能
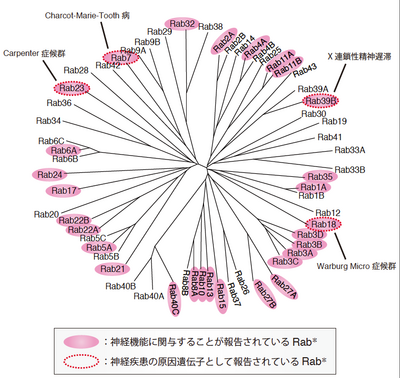
*2012年4月1日の時点でPubMedに収録されている文献を参照。今後さらに増えるものと予想される。
Rabは小胞輸送を介して、神経細胞の移動・神経細胞の形態形成・神経細胞間の情報伝達など様々な神経機能を制御することが明らかになってきている[20](図2)。
神経細胞移動
神経細胞が複雑なネットワークを形成するためには、適切な位置への神経細胞の移動・配置が重要である。例えば、哺乳類の大脳皮質(新皮質)は、形態や機能の異なる六つの神経細胞の層により成り立っており、その発生の過程で、脳室側で新しく生まれた神経細胞が表層の適切な位置まで移動する。大脳皮質の神経細胞の多くは、放射状グリア細胞の突起に沿って移動するが、その際細胞の後方から細胞接着因子がエンドサイトーシスによって取り込まれ、細胞の前方へと輸送されることが必要である。実際、Rab5はN-カドヘリンのエンドサイトーシスを制御することで、放射状突起に沿った神経細胞移動を制御することが報告されている[21]。
神経細胞の形態形成
典型的な神経細胞は細胞体から軸索と樹状突起が伸びた特徴的な形態を示すが、軸索や樹状突起が伸長するためには、脂質膜や接着因子が小胞輸送によって伸長部位へと輸送される必要がある。このため、神経細胞の形態形成においてもRabは重要な役割を担っており、例えばRab11は軸索先端へのβ1-インテグリンの輸送を制御することで、海馬神経細胞における軸索伸長を制御する[22]。神経突起の形成や伸長過程には、他にもRab6,Rab21,Rab35など複数のRabの関与が示唆されており[23] [24] [25] [26]、最近では、樹状突起のみに局在し、樹状突起の形態形成を制御するRabとしてRab17 が報告されている[27]。
神経細胞間情報伝達
神経細胞間の情報伝達が正しく行われるためには、シナプス前終末のシナプス小胞から神経伝達物質がエクソサイトーシスによってシナプス間隙へと放出されること、放出された神経伝達物質をシナプス後細胞に存在する特異的な受容体で受容することが不可欠である。いずれの過程にも小胞輸送が関与しており、Rabが重要な役割を担うことが知られている。シナプス小胞上には少なくとも10 種類以上のRabアイソフォームが存在しており[28]、このうちRab3やRab27に関しては、シナプス小胞の輸送やエクソサイトーシスを制御することが報告されている[29][30][31]。
一方、シナプス後部においてRabは、シナプス後膜における神経伝達物質受容体の量を小胞輸送(エンドサイトーシスとリサイクリング)により制御することで、長期増強などの記憶・学習にも関与することが報告されている[32][33]。例えば、長期増強の過程では、Rab11依存的にAMPA型グルタミン酸受容体がシナプス後膜に輸送されることが知られている[34]。
神経疾患との関わり
一部のRabは神経機能において必須の役割を果たすため、その機能の破綻はヒトやマウスの遺伝病を引き起こす[35]。図2に示すように、Rab18、Rab39Bなどの変異により精神遅延を含む神経疾患を伴う遺伝病が発症することが報告されている[36][37]。また、Rabのみならず、Rabの制御因子、例えばRab-GDIやRab3-GAP p130 の変異によっても神経疾患を伴う遺伝病が発症することが知られている[35][38]。
参考文献
- ↑ 1.0 1.1 1.2
Pereira-Leal, J.B., & Seabra, M.C. (2001).
Evolution of the Rab family of small GTP-binding proteins. Journal of molecular biology, 313(4), 889-901. [PubMed:11697911] [WorldCat] [DOI] - ↑ 2.0 2.1 2.2
Zerial, M., & McBride, H. (2001).
Rab proteins as membrane organizers. Nature reviews. Molecular cell biology, 2(2), 107-17. [PubMed:11252952] [WorldCat] [DOI] - ↑ 3.0 3.1 3.2
Stenmark, H. (2009).
Rab GTPases as coordinators of vesicle traffic. Nature reviews. Molecular cell biology, 10(8), 513-25. [PubMed:19603039] [WorldCat] [DOI] - ↑
Fukuda, M. (2008).
Regulation of secretory vesicle traffic by Rab small GTPases. Cellular and molecular life sciences : CMLS, 65(18), 2801-13. [PubMed:18726178] [WorldCat] [DOI] - ↑
Somsel Rodman, J., & Wandinger-Ness, A. (2000).
Rab GTPases coordinate endocytosis. Journal of cell science, 113 Pt 2, 183-92. [PubMed:10633070] [WorldCat] - ↑
Maxfield, F.R., & McGraw, T.E. (2004).
Endocytic recycling. Nature reviews. Molecular cell biology, 5(2), 121-32. [PubMed:15040445] [WorldCat] [DOI] - ↑
McBride, H.M., Rybin, V., Murphy, C., Giner, A., Teasdale, R., & Zerial, M. (1999).
Oligomeric complexes link Rab5 effectors with NSF and drive membrane fusion via interactions between EEA1 and syntaxin 13. Cell, 98(3), 377-86. [PubMed:10458612] [WorldCat] [DOI] - ↑
Horgan, C.P., Hanscom, S.R., Jolly, R.S., Futter, C.E., & McCaffrey, M.W. (2010).
Rab11-FIP3 links the Rab11 GTPase and cytoplasmic dynein to mediate transport to the endosomal-recycling compartment. Journal of cell science, 123(Pt 2), 181-91. [PubMed:20026645] [WorldCat] [DOI] - ↑
Tsuboi, T., & Fukuda, M. (2005).
The C2B domain of rabphilin directly interacts with SNAP-25 and regulates the docking step of dense core vesicle exocytosis in PC12 cells. The Journal of biological chemistry, 280(47), 39253-9. [PubMed:16203731] [WorldCat] [DOI] - ↑
Tsuboi, T., & Fukuda, M. (2006).
The Slp4-a linker domain controls exocytosis through interaction with Munc18-1.syntaxin-1a complex. Molecular biology of the cell, 17(5), 2101-12. [PubMed:16481396] [PMC] [WorldCat] [DOI] - ↑
Fukuda, M., Kanno, E., Ishibashi, K., & Itoh, T. (2008).
Large scale screening for novel rab effectors reveals unexpected broad Rab binding specificity. Molecular & cellular proteomics : MCP, 7(6), 1031-42. [PubMed:18256213] [WorldCat] [DOI] - ↑
Kanno, E., Ishibashi, K., Kobayashi, H., Matsui, T., Ohbayashi, N., & Fukuda, M. (2010).
Comprehensive screening for novel rab-binding proteins by GST pull-down assay using 60 different mammalian Rabs. Traffic (Copenhagen, Denmark), 11(4), 491-507. [PubMed:20070612] [WorldCat] [DOI] - ↑
Nottingham, R.M., & Pfeffer, S.R. (2009).
Defining the boundaries: Rab GEFs and GAPs. Proceedings of the National Academy of Sciences of the United States of America, 106(34), 14185-6. [PubMed:19706500] [PMC] [WorldCat] [DOI] - ↑
Barr, F., & Lambright, D.G. (2010).
Rab GEFs and GAPs. Current opinion in cell biology, 22(4), 461-70. [PubMed:20466531] [PMC] [WorldCat] [DOI] - ↑ 15.0 15.1
Fukuda, M. (2011).
TBC proteins: GAPs for mammalian small GTPase Rab? Bioscience reports, 31(3), 159-68. [PubMed:21250943] [WorldCat] [DOI] - ↑
Miyoshi, J., & Takai, Y. (2004).
Dual role of DENN/MADD (Rab3GEP) in neurotransmission and neuroprotection. Trends in molecular medicine, 10(10), 476-80. [PubMed:15464446] [WorldCat] [DOI] - ↑
Sakane, A., Manabe, S., Ishizaki, H., Tanaka-Okamoto, M., Kiyokage, E., Toida, K., ..., & Sasaki, T. (2006).
Rab3 GTPase-activating protein regulates synaptic transmission and plasticity through the inactivation of Rab3. Proceedings of the National Academy of Sciences of the United States of America, 103(26), 10029-34. [PubMed:16782817] [PMC] [WorldCat] [DOI] - ↑
Itoh, T., Satoh, M., Kanno, E., & Fukuda, M. (2006).
Screening for target Rabs of TBC (Tre-2/Bub2/Cdc16) domain-containing proteins based on their Rab-binding activity. Genes to cells : devoted to molecular & cellular mechanisms, 11(9), 1023-37. [PubMed:16923123] [WorldCat] [DOI] - ↑
Yoshimura, S., Gerondopoulos, A., Linford, A., Rigden, D.J., & Barr, F.A. (2010).
Family-wide characterization of the DENN domain Rab GDP-GTP exchange factors. The Journal of cell biology, 191(2), 367-81. [PubMed:20937701] [PMC] [WorldCat] [DOI] - ↑
Ng, E.L., & Tang, B.L. (2008).
Rab GTPases and their roles in brain neurons and glia. Brain research reviews, 58(1), 236-46. [PubMed:18485483] [WorldCat] [DOI] - ↑
Kawauchi, T., Sekine, K., Shikanai, M., Chihama, K., Tomita, K., Kubo, K., ..., & Hoshino, M. (2010).
Rab GTPases-dependent endocytic pathways regulate neuronal migration and maturation through N-cadherin trafficking. Neuron, 67(4), 588-602. [PubMed:20797536] [WorldCat] [DOI] - ↑
Eva, R., Dassie, E., Caswell, P.T., Dick, G., ffrench-Constant, C., Norman, J.C., & Fawcett, J.W. (2010).
Rab11 and its effector Rab coupling protein contribute to the trafficking of beta 1 integrins during axon growth in adult dorsal root ganglion neurons and PC12 cells. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(35), 11654-69. [PubMed:20810886] [PMC] [WorldCat] [DOI] - ↑
Schlager, M.A., Kapitein, L.C., Grigoriev, I., Burzynski, G.M., Wulf, P.S., Keijzer, N., ..., & Hoogenraad, C.C. (2010).
Pericentrosomal targeting of Rab6 secretory vesicles by Bicaudal-D-related protein 1 (BICDR-1) regulates neuritogenesis. The EMBO journal, 29(10), 1637-51. [PubMed:20360680] [PMC] [WorldCat] [DOI] - ↑
Burgo, A., Sotirakis, E., Simmler, M.C., Verraes, A., Chamot, C., Simpson, J.C., ..., & Galli, T. (2009).
Role of Varp, a Rab21 exchange factor and TI-VAMP/VAMP7 partner, in neurite growth. EMBO reports, 10(10), 1117-24. [PubMed:19745841] [PMC] [WorldCat] [DOI] - ↑
Wang, L., Liang, Z., & Li, G. (2011).
Rab22 controls NGF signaling and neurite outgrowth in PC12 cells. Molecular biology of the cell, 22(20), 3853-60. [PubMed:21849477] [PMC] [WorldCat] [DOI] - ↑
Kobayashi, H., & Fukuda, M. (2012).
Rab35 regulates Arf6 activity through centaurin-β2 (ACAP2) during neurite outgrowth. Journal of cell science, 125(Pt 9), 2235-43. [PubMed:22344257] [WorldCat] [DOI] - ↑
Mori, Y., Matsui, T., Furutani, Y., Yoshihara, Y., & Fukuda, M. (2012).
Small GTPase Rab17 regulates dendritic morphogenesis and postsynaptic development of hippocampal neurons. The Journal of biological chemistry, 287(12), 8963-73. [PubMed:22291024] [PMC] [WorldCat] [DOI] - ↑
Takamori, S., Holt, M., Stenius, K., Lemke, E.A., Grønborg, M., Riedel, D., ..., & Jahn, R. (2006).
Molecular anatomy of a trafficking organelle. Cell, 127(4), 831-46. [PubMed:17110340] [WorldCat] [DOI] - ↑
Schlüter, O.M., Schmitz, F., Jahn, R., Rosenmund, C., & Südhof, T.C. (2004).
A complete genetic analysis of neuronal Rab3 function. The Journal of neuroscience : the official journal of the Society for Neuroscience, 24(29), 6629-37. [PubMed:15269275] [PMC] [WorldCat] [DOI] - ↑
Yu, E., Kanno, E., Choi, S., Sugimori, M., Moreira, J.E., Llinás, R.R., & Fukuda, M. (2008).
Role of Rab27 in synaptic transmission at the squid giant synapse. Proceedings of the National Academy of Sciences of the United States of America, 105(41), 16003-8. [PubMed:18840683] [PMC] [WorldCat] [DOI] - ↑
Pavlos, N.J., Grønborg, M., Riedel, D., Chua, J.J., Boyken, J., Kloepper, T.H., ..., & Jahn, R. (2010).
Quantitative analysis of synaptic vesicle Rabs uncovers distinct yet overlapping roles for Rab3a and Rab27b in Ca2+-triggered exocytosis. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(40), 13441-53. [PubMed:20926670] [PMC] [WorldCat] [DOI] - ↑
Park, M., Penick, E.C., Edwards, J.G., Kauer, J.A., & Ehlers, M.D. (2004).
Recycling endosomes supply AMPA receptors for LTP. Science (New York, N.Y.), 305(5692), 1972-5. [PubMed:15448273] [WorldCat] [DOI] - ↑
Brown, T.C., Tran, I.C., Backos, D.S., & Esteban, J.A. (2005).
NMDA receptor-dependent activation of the small GTPase Rab5 drives the removal of synaptic AMPA receptors during hippocampal LTD. Neuron, 45(1), 81-94. [PubMed:15629704] [WorldCat] [DOI] - ↑
Wang, Z., Edwards, J.G., Riley, N., Provance, D.W., Karcher, R., Li, X.D., ..., & Ehlers, M.D. (2008).
Myosin Vb mobilizes recycling endosomes and AMPA receptors for postsynaptic plasticity. Cell, 135(3), 535-48. [PubMed:18984164] [PMC] [WorldCat] [DOI] - ↑ 35.0 35.1
Seabra, M.C., Mules, E.H., & Hume, A.N. (2002).
Rab GTPases, intracellular traffic and disease. Trends in molecular medicine, 8(1), 23-30. [PubMed:11796263] [WorldCat] - ↑
Giannandrea, M., Bianchi, V., Mignogna, M.L., Sirri, A., Carrabino, S., D'Elia, E., ..., & D'Adamo, P. (2010).
Mutations in the small GTPase gene RAB39B are responsible for X-linked mental retardation associated with autism, epilepsy, and macrocephaly. American journal of human genetics, 86(2), 185-95. [PubMed:20159109] [PMC] [WorldCat] [DOI] - ↑
Bem, D., Yoshimura, S., Nunes-Bastos, R., Bond, F.C., Bond, F.F., Kurian, M.A., ..., & Aligianis, I.A. (2011).
Loss-of-function mutations in RAB18 cause Warburg micro syndrome. American journal of human genetics, 88(4), 499-507. [PubMed:21473985] [PMC] [WorldCat] [DOI] - ↑
Aligianis, I.A., Johnson, C.A., Gissen, P., Chen, D., Hampshire, D., Hoffmann, K., ..., & Maher, E.R. (2005).
Mutations of the catalytic subunit of RAB3GAP cause Warburg Micro syndrome. Nature genetics, 37(3), 221-3. [PubMed:15696165] [WorldCat] [DOI]
(執筆者:小林穂高、福田光則 担当編集者:柚崎通介)