「脳梁の発生」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (3人の利用者による、間の6版が非表示) | |||
| 1行目: | 1行目: | ||
英:development of corpus callosum 独:Entwicklung des Corpus Callosum 仏:développement du corps calleux | |||
(編集コメント:抄録をお願い致します) [[Image:Corpus callosum.gif|thumb|right|300px|<b>図 脳梁(赤)</b><br />Wikipediaより]] | |||
== 脳梁とは == | == 脳梁とは == | ||
[[ | [[wikipedia:ja:哺乳類|哺乳類]]([[wikipedia:ja:単孔類|単孔類]]や[[wikipedia:ja:有袋類|有袋類]]では脳梁を欠く)において左右の[[大脳半球]]をつなぐ[[交連線維]]の束であり、両大脳半球間の情報連絡を行う。脳を頭頂から観察すると大脳縦列の底に存在する。矢状方向の断面でみると[[大脳皮質]][[帯状回]]と[[側脳室]]もしくは正中では[[透明中隔]]に挟まれた位置にあり、各領域は前方から[[脳梁吻]]、[[脳梁膝]]、[[脳梁幹]]、[[脳梁膨大]]と呼ばれている(編集コメント:この部分、図があればと思います)。[[wikipedia:ja:ヒト|ヒト]]の脳では約2億本の神経線維([[軸索]])からなる。[[自閉症スペクトラム障害]]において再現性よく交連ニューロンの低形成による脳梁形成不全が観察される<ref><pubmed> 17620483</pubmed></ref><ref><pubmed> 19409535</pubmed></ref><ref><pubmed> 16460701 </pubmed></ref><ref><pubmed> 7639631 </pubmed></ref>(Mcalonan et al., 2009)(編集コメント:該当するのが複数あり、どれか判りませんでした)。脳梁の形成不全や外科的な脳梁切断によって[[認知障害]]、[[高次脳機能障害]]が生じる<ref><pubmed> 17375041 </pubmed></ref>。主に脳梁は左右の大脳皮質[[灰白質]]に含まれる交連ニューロンの軸索とそれをとりまく[[髄鞘]]からなる。 | ||
== 交連ニューロンの分化 == | == 交連ニューロンの分化 == | ||
| 17行目: | 11行目: | ||
大脳皮質を構成する興奮性投射ニューロンは初期には[[脳室帯]](ventricular zone)から、大脳皮質の発生が進むにつれ[[脳室下帯]](subventricular zone)から産生され、これらニューロン産生帯における[[神経前駆細胞]]はそれぞれ[[Apical progenitor]], [[Basal progenitor]]と呼ばれる。大脳皮質の興奮性ニューロンは放射方向に6層の細胞層をなすが、室帯側の[[神経幹細胞]]から産生されるニューロンはより早く分化したニューロンがより脳室側(深層)に、より遅く分化したニューロンは軟膜側(浅層)に配置されるinside-outパターンを取る。交連ニューロンはより遅く産まれるニューロン群であり、そのほとんどが大脳皮質II/III層に位置し、一部はV層、VI層にも見られる<ref><pubmed> 12700818 </pubmed></ref>。よって交連ニューロンは皮質形成期を通じて産生される。VI層に位置する交連ニューロンはマウスではE (embryonic day)12.5に、V層に位置する交連ニューロンはE13.5に産まれる。しかしほとんどの交連ニューロンは浅層に位置し、これらはE15.5-E17.5に産生される<ref><pubmed>17533671</pubmed></ref>。この様に交連ニューロンの産生が大脳皮質発生過程のほとんどの時期にわたることは交連ニューロンが広汎な神経前駆細胞から生み出されることを意味するのみでなく、進化過程で大脳皮質の増大と交連ニューロンの産生量が増えることが関連していることを示唆している。 | 大脳皮質を構成する興奮性投射ニューロンは初期には[[脳室帯]](ventricular zone)から、大脳皮質の発生が進むにつれ[[脳室下帯]](subventricular zone)から産生され、これらニューロン産生帯における[[神経前駆細胞]]はそれぞれ[[Apical progenitor]], [[Basal progenitor]]と呼ばれる。大脳皮質の興奮性ニューロンは放射方向に6層の細胞層をなすが、室帯側の[[神経幹細胞]]から産生されるニューロンはより早く分化したニューロンがより脳室側(深層)に、より遅く分化したニューロンは軟膜側(浅層)に配置されるinside-outパターンを取る。交連ニューロンはより遅く産まれるニューロン群であり、そのほとんどが大脳皮質II/III層に位置し、一部はV層、VI層にも見られる<ref><pubmed> 12700818 </pubmed></ref>。よって交連ニューロンは皮質形成期を通じて産生される。VI層に位置する交連ニューロンはマウスではE (embryonic day)12.5に、V層に位置する交連ニューロンはE13.5に産まれる。しかしほとんどの交連ニューロンは浅層に位置し、これらはE15.5-E17.5に産生される<ref><pubmed>17533671</pubmed></ref>。この様に交連ニューロンの産生が大脳皮質発生過程のほとんどの時期にわたることは交連ニューロンが広汎な神経前駆細胞から生み出されることを意味するのみでなく、進化過程で大脳皮質の増大と交連ニューロンの産生量が増えることが関連していることを示唆している。 | ||
哺乳類の浅層ニューロンは基本的に脳室下帯から産生され、[[ | 哺乳類の浅層ニューロンは基本的に脳室下帯から産生され、[[wikipedia:ja:霊長類|霊長類]]では内側脳室下帯と外側脳室下帯とに分けることができる<ref><pubmed>13181005</pubmed></ref><ref><pubmed> 11734531 </pubmed></ref>。ヒトではとくにSVZが著しく拡張されて外側脳室下帯となり、交連ニューロンの数を更に増大させることで、皮質全体のサイズ、神経回路やニューロン種の複雑さを作り、脳機能の発達の進化発生学的原因となっている可能性がある<ref><pubmed> 20154730 </pubmed></ref>。 | ||
== 交連線維の形成 == | == 交連線維の形成 == | ||
交連ニューロンの軸索は前脳正中部にむかった後、反対側の大脳皮質へ投射する。この線維の束が脳梁となる。発生初期([[ | 交連ニューロンの軸索は前脳正中部にむかった後、反対側の大脳皮質へ投射する。この線維の束が脳梁となる。発生初期([[wikipedia:ja:マウス|マウス]]の場合、胎生期E14-E15)における正中部での左右半球の融合が起きない場合は脳梁形成が障害される<ref><pubmed> 17275286 </pubmed></ref>。この融合には正中部の[[グリア細胞]]が必要であると考えられている<ref><pubmed> 8087547 </pubmed></ref><ref><pubmed> 11306627 </pubmed></ref>。マウスではE15頃になると帯状皮質領域深層に位置する早生まれ交連ユーロンの軸索が正中部に到達する。この軸索は後に続く交連軸索の投射のための[[パイオニア線維]]として働くと考えられている<ref><pubmed> 7130467 </pubmed></ref>。E16頃には交連ニューロンの軸索は正中域を通過し反対側大脳皮質に侵入する。[[Fgfr1]]変異マウスでみられるような[[灰白層グリア]](indusium griseum glia)とglial wedgeと言ったグリア性の構造の欠損によって交連線維は正中を超える事ができなくなる<ref><pubmed> 16715082 </pubmed></ref>。 | ||
== 脳梁形成に関わる分子 == | == 脳梁形成に関わる分子 == | ||
| 40行目: | 34行目: | ||
== 関連項目 == | == 関連項目 == | ||
(編集コメント:ございましたらご指摘下さい) | |||
== 参考文献 == | == 参考文献 == | ||
<references /> | <references /> | ||
<br> (執筆者:勝山裕 担当編集委員:大隅典子) | |||
2013年2月16日 (土) 21:23時点における版
英:development of corpus callosum 独:Entwicklung des Corpus Callosum 仏:développement du corps calleux
(編集コメント:抄録をお願い致します)
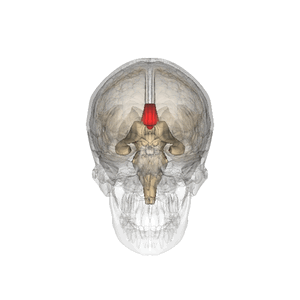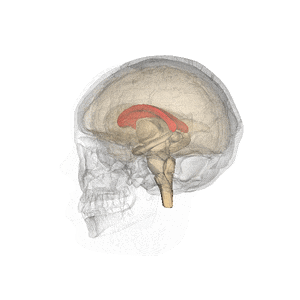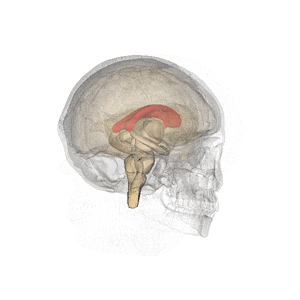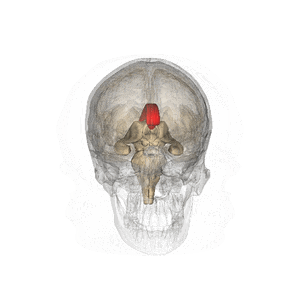
Wikipediaより
脳梁とは
哺乳類(単孔類や有袋類では脳梁を欠く)において左右の大脳半球をつなぐ交連線維の束であり、両大脳半球間の情報連絡を行う。脳を頭頂から観察すると大脳縦列の底に存在する。矢状方向の断面でみると大脳皮質帯状回と側脳室もしくは正中では透明中隔に挟まれた位置にあり、各領域は前方から脳梁吻、脳梁膝、脳梁幹、脳梁膨大と呼ばれている(編集コメント:この部分、図があればと思います)。ヒトの脳では約2億本の神経線維(軸索)からなる。自閉症スペクトラム障害において再現性よく交連ニューロンの低形成による脳梁形成不全が観察される[1][2][3][4](Mcalonan et al., 2009)(編集コメント:該当するのが複数あり、どれか判りませんでした)。脳梁の形成不全や外科的な脳梁切断によって認知障害、高次脳機能障害が生じる[5]。主に脳梁は左右の大脳皮質灰白質に含まれる交連ニューロンの軸索とそれをとりまく髄鞘からなる。
交連ニューロンの分化
大脳皮質を構成する興奮性投射ニューロンは初期には脳室帯(ventricular zone)から、大脳皮質の発生が進むにつれ脳室下帯(subventricular zone)から産生され、これらニューロン産生帯における神経前駆細胞はそれぞれApical progenitor, Basal progenitorと呼ばれる。大脳皮質の興奮性ニューロンは放射方向に6層の細胞層をなすが、室帯側の神経幹細胞から産生されるニューロンはより早く分化したニューロンがより脳室側(深層)に、より遅く分化したニューロンは軟膜側(浅層)に配置されるinside-outパターンを取る。交連ニューロンはより遅く産まれるニューロン群であり、そのほとんどが大脳皮質II/III層に位置し、一部はV層、VI層にも見られる[6]。よって交連ニューロンは皮質形成期を通じて産生される。VI層に位置する交連ニューロンはマウスではE (embryonic day)12.5に、V層に位置する交連ニューロンはE13.5に産まれる。しかしほとんどの交連ニューロンは浅層に位置し、これらはE15.5-E17.5に産生される[7]。この様に交連ニューロンの産生が大脳皮質発生過程のほとんどの時期にわたることは交連ニューロンが広汎な神経前駆細胞から生み出されることを意味するのみでなく、進化過程で大脳皮質の増大と交連ニューロンの産生量が増えることが関連していることを示唆している。
哺乳類の浅層ニューロンは基本的に脳室下帯から産生され、霊長類では内側脳室下帯と外側脳室下帯とに分けることができる[8][9]。ヒトではとくにSVZが著しく拡張されて外側脳室下帯となり、交連ニューロンの数を更に増大させることで、皮質全体のサイズ、神経回路やニューロン種の複雑さを作り、脳機能の発達の進化発生学的原因となっている可能性がある[10]。
交連線維の形成
交連ニューロンの軸索は前脳正中部にむかった後、反対側の大脳皮質へ投射する。この線維の束が脳梁となる。発生初期(マウスの場合、胎生期E14-E15)における正中部での左右半球の融合が起きない場合は脳梁形成が障害される[11]。この融合には正中部のグリア細胞が必要であると考えられている[12][13]。マウスではE15頃になると帯状皮質領域深層に位置する早生まれ交連ユーロンの軸索が正中部に到達する。この軸索は後に続く交連軸索の投射のためのパイオニア線維として働くと考えられている[14]。E16頃には交連ニューロンの軸索は正中域を通過し反対側大脳皮質に侵入する。Fgfr1変異マウスでみられるような灰白層グリア(indusium griseum glia)とglial wedgeと言ったグリア性の構造の欠損によって交連線維は正中を超える事ができなくなる[15]。
脳梁形成に関わる分子
交連線維の交差には以下の様な多くのガイダンス分子が関わっている事が実験的に示されている。
- FGF
FGF受容体Fgfr1ノックアウトマウスのヘテロ変異体では正中グリア構造に異常はみられないが、交連線維は正中を超える事ができない。よってFGFシグナルはグリア性構造を作るのみでなく、脳梁線維の走行に直接に働いている可能性が示唆される[16]。
- Slit
Slit2連合軸索が交差する領域に多く発現しており、交連軸索にはSlitの受容体であるRobo1/Robo2ダブルノックアウトマウスでは交差せず正中付近で腹側へ延びる交連軸索が観察される[17]。
- Netrin
Netrin1ノックアウトマウスでは脳梁が形成されない[18]。受容体であるDCCは交連ニューロンで発現している[19]。Draxinノックアウトマウスでは脳梁が形成されない。またIGGが形成されない。Draxinは正中域グリア細胞で発現しており、とくにGlial wedgeが発現するDraxinよる神経線維の伸張抑制効果が交連線維の交差に必要であると考えられる(Islam et al., 2009)。DraxinはDCCと結合することから、この受容体をNetrinと共用して軸索ガイダンスに関わっていると考えられる[20]。
- Ephrin
EphB2, EphB3ノックアウトマウスでは脳梁線維の走行に異常が見られる。EphA5の細胞内ドメインを欠損させたマウスでは交連線維の交差しなくなる。EphrinB3ノックアウトマウスでも交連線維が交差しなくなり、軸索は正中手前で絡み合った神経線維の束(Probst’s bundle)を生じる[21]。
- Semaphorin/Neuropilin
Neuropilin1のドミナントネガティブ分子を交連ニューロンに発現させると、軸索は正中に向かわなくなる[22]。Neuropilin1は帯状皮質ニューロンにおいて発現しており、脳梁形成域ではクラス3 Semaphorinが発現している。帯状皮質から投射されるNeuropilin1陽性線維は脳梁形成のパイオニア軸索と考えられる[23]。
関連項目
(編集コメント:ございましたらご指摘下さい)
参考文献
- ↑
Minshew, N.J., & Williams, D.L. (2007).
The new neurobiology of autism: cortex, connectivity, and neuronal organization. Archives of neurology, 64(7), 945-50. [PubMed:17620483] [PMC] [WorldCat] [DOI] - ↑
Freitag, C.M., Luders, E., Hulst, H.E., Narr, K.L., Thompson, P.M., Toga, A.W., ..., & Konrad, C. (2009).
Total brain volume and corpus callosum size in medication-naïve adolescents and young adults with autism spectrum disorder. Biological psychiatry, 66(4), 316-9. [PubMed:19409535] [PMC] [WorldCat] [DOI] - ↑
Vidal, C.N., Nicolson, R., DeVito, T.J., Hayashi, K.M., Geaga, J.A., Drost, D.J., ..., & Thompson, P.M. (2006).
Mapping corpus callosum deficits in autism: an index of aberrant cortical connectivity. Biological psychiatry, 60(3), 218-25. [PubMed:16460701] [WorldCat] [DOI] - ↑
Egaas, B., Courchesne, E., & Saitoh, O. (1995).
Reduced size of corpus callosum in autism. Archives of neurology, 52(8), 794-801. [PubMed:7639631] [WorldCat] [DOI] - ↑
Paul, L.K., Brown, W.S., Adolphs, R., Tyszka, J.M., Richards, L.J., Mukherjee, P., & Sherr, E.H. (2007).
Agenesis of the corpus callosum: genetic, developmental and functional aspects of connectivity. Nature reviews. Neuroscience, 8(4), 287-99. [PubMed:17375041] [WorldCat] [DOI] - ↑
Aboitiz, F., & Montiel, J. (2003).
One hundred million years of interhemispheric communication: the history of the corpus callosum. Brazilian journal of medical and biological research = Revista brasileira de pesquisas medicas e biologicas, 36(4), 409-20. [PubMed:12700818] [WorldCat] [DOI] - ↑
Angevine, J.B., & Sidman, R.L. (1961).
Autoradiographic study of cell migration during histogenesis of cerebral cortex in the mouse. Nature, 192, 766-8. [PubMed:17533671] [WorldCat] [DOI] - ↑
TOMASCH, J. (1954).
Size, distribution, and number of fibres in the human corpus callosum. The Anatomical record, 119(1), 119-35. [PubMed:13181005] [WorldCat] [DOI] - ↑
Smart, I.H., Dehay, C., Giroud, P., Berland, M., & Kennedy, H. (2002).
Unique morphological features of the proliferative zones and postmitotic compartments of the neural epithelium giving rise to striate and extrastriate cortex in the monkey. Cerebral cortex (New York, N.Y. : 1991), 12(1), 37-53. [PubMed:11734531] [PMC] [WorldCat] [DOI] - ↑
Hansen, D.V., Lui, J.H., Parker, P.R., & Kriegstein, A.R. (2010).
Neurogenic radial glia in the outer subventricular zone of human neocortex. Nature, 464(7288), 554-561. [PubMed:20154730] [WorldCat] [DOI] - ↑
Lindwall, C., Fothergill, T., & Richards, L.J. (2007).
Commissure formation in the mammalian forebrain. Current opinion in neurobiology, 17(1), 3-14. [PubMed:17275286] [WorldCat] [DOI] - ↑
Silver, J. (1993).
Glia-neuron interactions at the midline of the developing mammalian brain and spinal cord. Perspectives on developmental neurobiology, 1(4), 227-36. [PubMed:8087547] [WorldCat] - ↑
Shu, T., & Richards, L.J. (2001).
Cortical axon guidance by the glial wedge during the development of the corpus callosum. The Journal of neuroscience : the official journal of the Society for Neuroscience, 21(8), 2749-58. [PubMed:11306627] [PMC] [WorldCat] - ↑
Silver, J., Lorenz, S.E., Wahlsten, D., & Coughlin, J. (1982).
Axonal guidance during development of the great cerebral commissures: descriptive and experimental studies, in vivo, on the role of preformed glial pathways. The Journal of comparative neurology, 210(1), 10-29. [PubMed:7130467] [WorldCat] [DOI] - ↑
Smith, K.M., Ohkubo, Y., Maragnoli, M.E., Rasin, M.R., Schwartz, M.L., Sestan, N., & Vaccarino, F.M. (2006).
Midline radial glia translocation and corpus callosum formation require FGF signaling. Nature neuroscience, 9(6), 787-97. [PubMed:16715082] [WorldCat] [DOI] - ↑
Tole, S., Gutin, G., Bhatnagar, L., Remedios, R., & Hébert, J.M. (2006).
Development of midline cell types and commissural axon tracts requires Fgfr1 in the cerebrum. Developmental biology, 289(1), 141-51. [PubMed:16309667] [WorldCat] [DOI] - ↑
López-Bendito, G., Flames, N., Ma, L., Fouquet, C., Di Meglio, T., Chedotal, A., ..., & Marín, O. (2007).
Robo1 and Robo2 cooperate to control the guidance of major axonal tracts in the mammalian forebrain. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(13), 3395-407. [PubMed:17392456] [PMC] [WorldCat] [DOI] - ↑
Serafini, T., Colamarino, S.A., Leonardo, E.D., Wang, H., Beddington, R., Skarnes, W.C., & Tessier-Lavigne, M. (1996).
Netrin-1 is required for commissural axon guidance in the developing vertebrate nervous system. Cell, 87(6), 1001-14. [PubMed:8978605] [WorldCat] [DOI] - ↑
Shu, T., Valentino, K.M., Seaman, C., Cooper, H.M., & Richards, L.J. (2000).
Expression of the netrin-1 receptor, deleted in colorectal cancer (DCC), is largely confined to projecting neurons in the developing forebrain. The Journal of comparative neurology, 416(2), 201-12. [PubMed:10581466] [WorldCat] [DOI] - ↑
Ahmed, G., Shinmyo, Y., Ohta, K., Islam, S.M., Hossain, M., Naser, I.B., ..., & Tanaka, H. (2011).
Draxin inhibits axonal outgrowth through the netrin receptor DCC. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(39), 14018-23. [PubMed:21957262] [PMC] [WorldCat] [DOI] - ↑
Mendes, S.W., Henkemeyer, M., & Liebl, D.J. (2006).
Multiple Eph receptors and B-class ephrins regulate midline crossing of corpus callosum fibers in the developing mouse forebrain. The Journal of neuroscience : the official journal of the Society for Neuroscience, 26(3), 882-92. [PubMed:16421308] [PMC] [WorldCat] [DOI] - ↑
Hatanaka, Y., Matsumoto, T., Yanagawa, Y., Fujisawa, H., Murakami, F., & Masu, M. (2009).
Distinct roles of neuropilin 1 signaling for radial and tangential extension of callosal axons. The Journal of comparative neurology, 514(3), 215-25. [PubMed:19296474] [WorldCat] [DOI] - ↑
Piper, M., Plachez, C., Zalucki, O., Fothergill, T., Goudreau, G., Erzurumlu, R., ..., & Richards, L.J. (2009).
Neuropilin 1-Sema signaling regulates crossing of cingulate pioneering axons during development of the corpus callosum. Cerebral cortex (New York, N.Y. : 1991), 19 Suppl 1, i11-21. [PubMed:19357391] [PMC] [WorldCat] [DOI]
(執筆者:勝山裕 担当編集委員:大隅典子)