Slit
金山 武司、白崎 竜一
大阪大学大学院生命機能研究科
DOI:10.14931/bsd.6974 原稿受付日:2016年2月29日 原稿完成日:2016年7月24日
担当編集委員:大隅 典子(東北大学 大学院医学系研究科 附属創生応用医学研究センター 脳神経科学コアセンター 発生発達神経科学分野)
英語名:Slit 英略語:slit (Drosophila)、SLIT (Homo sapiens)
スリットは分泌性のタンパク質であり、全長のタンパク質が合成された後にアミノ末端(N末)、カルボキシル末端(C末)に切断される性質を持つ。スリットの機能解析はN末断片について進んでおり、その受容体はロボである。スリットはロボと直接結合することにより細胞内にシグナルを伝達する。無脊椎・脊椎動物の中枢神経系の発達過程において重要な役割を果たしており、軸索ガイダンス、樹状突起の分枝形成、細胞移動などを制御している。
| Slit guidance ligand 1 | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Identifiers | |||||||||||||
| Symbols | SLIT1; MEGF4; SLIL1; SLIT-1; SLIT3 | ||||||||||||
| External IDs | OMIM: 603742 MGI: 1315203 HomoloGene: 2302 GeneCards: SLIT1 Gene | ||||||||||||
| |||||||||||||
| Orthologs | |||||||||||||
| Species | Human | Mouse | |||||||||||
| Entrez | 6585 | 20562 | |||||||||||
| Ensembl | ENSG00000187122 | ENSMUSG00000025020 | |||||||||||
| UniProt | O75093 | Q80TR4 | |||||||||||
| RefSeq (mRNA) | NM_003061 | NM_015748 | |||||||||||
| RefSeq (protein) | NP_003052 | NP_056563 | |||||||||||
| Location (UCSC) |
Chr 10: 97 – 97.19 Mb |
Chr 19: 41.6 – 41.74 Mb | |||||||||||
| PubMed search | [1] | [2] | |||||||||||
| Slit guidance ligand 3 | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Identifiers | |||||||||||||
| Symbols | SLIT3; MEGF5; SLIL2; SLIT1; Slit-3; slit2 | ||||||||||||
| External IDs | OMIM: 603745 MGI: 1315202 HomoloGene: 2303 GeneCards: SLIT3 Gene | ||||||||||||
| |||||||||||||
| RNA expression pattern | |||||||||||||
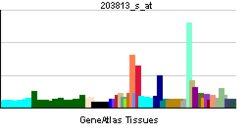 | |||||||||||||
| More reference expression data | |||||||||||||
| Orthologs | |||||||||||||
| Species | Human | Mouse | |||||||||||
| Entrez | 6586 | 20564 | |||||||||||
| Ensembl | ENSG00000184347 | ENSMUSG00000056427 | |||||||||||
| UniProt | O75094 | Q9WVB4 | |||||||||||
| RefSeq (mRNA) | NM_001271946 | NM_011412 | |||||||||||
| RefSeq (protein) | NP_001258875 | NP_035542 | |||||||||||
| Location (UCSC) |
Chr 5: 168.66 – 169.3 Mb |
Chr 11: 35.12 – 35.71 Mb | |||||||||||
| PubMed search | [5] | [6] | |||||||||||
研究の歴史
スリットは当初、ショウジョウバエの遺伝学的解析から見出された。中枢神経系における交連ニューロン軸索の投射異常を示す変異体のスクリーニングからスリットが同定された[1]。スリットの変異体においては正中部の細胞に異常が見られるようになり、交連ニューロン軸索が正常な投射を行わなくなる[2]。スリットは正中部の細胞に発現している分泌性のタンパク質であることは明らかとなったが、その機能については長年不明のままであった。
その後、遺伝学的解析、生化学的な解析、in vitroでの機能アッセイによりスリットが、ロボ受容体に対するリガンドであることが明らかとなった[3] [4]。スリットはロボと直接結合することで反発活性を示し、同側性投射軸索と、一度正中交差をした交連ニューロンの軸索を正中部から反発させる。また脊椎動物におけるスリットのホモログとしてSlit1、Slit2、Slit3が同定された[4] [5] [6] [7]。
構造
スリットは無脊椎動物から脊椎動物まで種を越えて保存されており、共通の基本構造を持つ。アミノ末端(N末)に4つのLRR(leucine-rich repeat)ドメインと、6~9つのEGF(epidermal growth factor)リピート配列を持つ。また脊椎動物のスリットのホモログの1つであるSlit2は、全長のタンパク質が合成された後にN末のSlit2N、カルボキシル末端(C末)のSlit2Cの2つに分解される[4]。Slit2NのレセプターとしてはRobo1、Robo2が知られており、軸索の伸長において反発の活性を示す[4] [8]。一方、Slit2Cについてはその機能が不明であったが、最近PlexinA1を受容体としてSlit2Nと同様に反発活性を示すことが報告された[9]。
ファミリー
脊椎動物にはSlit1、Slit2、Slit3の3つのメンバーが存在している。Slit1、Slit2の受容体としてはRobo1、Robo2が、Slit3の受容体としてはRobo1、Robo4が知られている[10]。なお、Slit1、Slit2、Slit3は、Robo3(Rig-1)には結合せず、NELL2がそのリガンドとして結合することで反発活性を示すことが最近報告されている[11]。
Slit1、Slit2、Slit3は中枢神経系の正中部付近における軸索ガイダンスの制御に重要な役割を果たしており、同側性投射軸索を腹側正中部の底板に近づくのを阻害し、一度底板で正中交差した交連ニューロンの軸索の再交差を防ぐことに必要であることが報告されている[4] [12] [13]。またSlit3は甲状腺、ヒト臍帯静脈内皮細胞 (human umbilical vein endothelial cells, HUVECs)、マウスにおける肺や横隔膜の内皮細胞に発現しており、血管新生誘導因子としても働くことが知られている[14]。
発現
脊椎動物の発達期および成熟期の中枢神経系などにスリットは強く発現している[5] [7] [15]。
胎生期の脊髄において、底板にSlit1、Slit2、Slit3が発現している。蓋板には一過的にSlit1、Slit2が発現しているが、発達に伴い発現が失われる。また脊髄運動ニューロンにおいては分化の初期過程では発現していないが、分化が進むにつれSlit1、Slit2、Slit3が発現するようになる。
大脳においては、胎生期の皮質板にSlit1が発現し、胎生期の後期になるとSlit1、Slit2が発現する。また生後には大脳皮質Ⅱ-Ⅲ層にSlit3が、Ⅴ層にはSlit1、Slit2、Slit3、Ⅵ層にはSlit1、Slit3が発現している。
海馬のCA1領域においては、胎生期ではSlit1、Slit3が発現している。生後ではSlit3は成熟期まで発現し続け、Slit1の発現は一過的に減少した後に成熟期まで発現し続ける。またSlit2は生後一過的に発現するが成熟期においては発現していない。CA3領域においては胎生期から成熟期までSlit1、Slit2、Slit3が発現し続ける。歯状回では胎生期よりSlit2が発現し、発達とともにSlit3も発現するようになる。生後になるとSlit2、Slit3に加えてSlit1も発現するようになり、成熟期にはSli1、Slit2、Slit3が発現し続けている。
背側視床の外側膝状体においては、生後一過的にSlit3を発現するようになるが、成熟期には発現していない。
赤核では胎生期から成熟期までSlit2を発現し続ける。また、上丘、下丘ではSlit1が胎生期から成熟期まで発現し続けている。橋核では生後から成熟期までSlit3が発現し続ける。後脳の三叉神経節細胞では、胎生期にSlit1、Slit2、Slit3を発現し、発達ととものSlit1の発現は失われるが、Slit2、Slit3は発現し続ける。
小脳のプルキンエ細胞においては胎生期から成熟期までSlit2を発現し続けている。また小脳核ニューロンでは、胎生期にSlit1を、生後から成熟期にかけてSlit1、Slit2、Slit3を発現する。小脳の顆粒細胞においては生後から成熟期までSlit3を発現し続ける。後脳の下オリーブ核においては胎生期にSlit1を発現し、生後になるとSlit1、Slit3を発現し続ける。
機能
軸索ガイダンス
脊椎動物においてスリットは脊髄交連ニューロンの軸索伸長を底板付近で制御している[10]。底板から分泌されるスリットは、交連ニューロンの軸索に発現するRobo1、Robo2と直接結合することで反発作用を及ぼす。正中交差前の交連ニューロンの軸索にはRobo3(Robo3.1)が発現しているが、Robo3はRobo1、Robo2の活性を抑えることでスリットに対する応答性を消失させ、それにより軸索正中交差が可能となる。
正中交差後の交連ニューロンの軸索においてはRobo3の発現が失われることで、底板由来スリットがRobo1、Robo2を介して反発活性をもつようになる。この正中交差後に起こる底板からの反発により、底板における軸索再交差が妨げられている[16]。また、ショウジョウバエにおいてもスリットはロボと直接結合し、シグナル伝達を行うことで反発作用を示す[3]。脊椎動物のSlit1、Slit2、Slit3のトリプルノックアウトマウスの表現型はショウジョウバエにおけるスリットの変異体における表現型と一致する[10]。
脊椎動物の視神経の発達過程においてもSlit1、Slit2は、視神経軸索に対して反発作用を示している。またSlit1、Slit2それぞれのノックアウトにおける表現型はSlit1、Slit2のダブルノックアウトの表現型と異なることから、Slit1、Slit2は視神経軸索が伸長していく領域に応じて相補的に働いていると考えられている[17]。
軸索・樹状突起の分枝形成
Slit1、Slit2は神経回路形成における軸索分枝形成にも関与している。三叉神経節細胞、後根神経節細胞においてSlit2のN末断片であるSlit2Nは分枝形成を促進している[18] [19]。また、皮質ニューロンにおいてもSlit1が樹状突起の伸長と分枝の形成に促進的に作用していることが知られている[20]。
細胞移動
スリットは神経細胞、グリア細胞、白血球、内皮細胞の細胞移動にも影響を与えている。Slit1、Slit2は吻側移動経路 (rostral migratory stream, RMS)の脳室下帯 (subventricular zone, SVZ)に存在する未分化の細胞が嗅球へと細胞移動する際に、反発活性を示す[21]。また、後脳の小脳前核細胞である下オリーブ核ニューロンの腹側正中部付近への細胞移動に関与している[22]。
細胞増殖
近年、胎生期マウス大脳の神経前駆細胞に発現しているスリット、ロボがNotchのエフェクターであるHes1を活性化させることにより、細胞増殖のバランスを制御していることが報告されている[23]。
関連語
参考文献
- ↑
Rothberg, J.M., Hartley, D.A., Walther, Z., & Artavanis-Tsakonas, S. (1988).
slit: an EGF-homologous locus of D. melanogaster involved in the development of the embryonic central nervous system. Cell, 55(6), 1047-59. [PubMed:3144436] [WorldCat] [DOI] - ↑
Rothberg, J.M., Jacobs, J.R., Goodman, C.S., & Artavanis-Tsakonas, S. (1990).
slit: an extracellular protein necessary for development of midline glia and commissural axon pathways contains both EGF and LRR domains. Genes & development, 4(12A), 2169-87. [PubMed:2176636] [WorldCat] [DOI] - ↑ 3.0 3.1
Kidd, T., Bland, K.S., & Goodman, C.S. (1999).
Slit is the midline repellent for the robo receptor in Drosophila. Cell, 96(6), 785-94. [PubMed:10102267] [WorldCat] [DOI] - ↑ 4.0 4.1 4.2 4.3 4.4
Brose, K., Bland, K.S., Wang, K.H., Arnott, D., Henzel, W., Goodman, C.S., ..., & Kidd, T. (1999).
Slit proteins bind Robo receptors and have an evolutionarily conserved role in repulsive axon guidance. Cell, 96(6), 795-806. [PubMed:10102268] [WorldCat] [DOI] - ↑ 5.0 5.1
Holmes, G.P., Negus, K., Burridge, L., Raman, S., Algar, E., Yamada, T., & Little, M.H. (1998).
Distinct but overlapping expression patterns of two vertebrate slit homologs implies functional roles in CNS development and organogenesis. Mechanisms of development, 79(1-2), 57-72. [PubMed:10349621] [WorldCat] [DOI] - ↑
Itoh, A., Miyabayashi, T., Ohno, M., & Sakano, S. (1998).
Cloning and expressions of three mammalian homologues of Drosophila slit suggest possible roles for Slit in the formation and maintenance of the nervous system. Brain research. Molecular brain research, 62(2), 175-86. [PubMed:9813312] [WorldCat] [DOI] - ↑ 7.0 7.1
Yuan, W., Zhou, L., Chen, J.H., Wu, J.Y., Rao, Y., & Ornitz, D.M. (1999).
The mouse SLIT family: secreted ligands for ROBO expressed in patterns that suggest a role in morphogenesis and axon guidance. Developmental biology, 212(2), 290-306. [PubMed:10433822] [WorldCat] [DOI] - ↑
Nguyen Ba-Charvet, K.T., Brose, K., Ma, L., Wang, K.H., Marillat, V., Sotelo, C., ..., & Chédotal, A. (2001).
Diversity and specificity of actions of Slit2 proteolytic fragments in axon guidance. The Journal of neuroscience : the official journal of the Society for Neuroscience, 21(12), 4281-9. [PubMed:11404413] [PMC] [WorldCat] - ↑
Delloye-Bourgeois, C., Jacquier, A., Charoy, C., Reynaud, F., Nawabi, H., Thoinet, K., ..., & Castellani, V. (2015).
PlexinA1 is a new Slit receptor and mediates axon guidance function of Slit C-terminal fragments. Nature neuroscience, 18(1), 36-45. [PubMed:25485759] [WorldCat] [DOI] - ↑ 10.0 10.1 10.2
Dickson, B.J., & Gilestro, G.F. (2006).
Regulation of commissural axon pathfinding by slit and its Robo receptors. Annual review of cell and developmental biology, 22, 651-75. [PubMed:17029581] [WorldCat] [DOI] - ↑
Jaworski, A., Tom, I., Tong, R.K., Gildea, H.K., Koch, A.W., Gonzalez, L.C., & Tessier-Lavigne, M. (2015).
Operational redundancy in axon guidance through the multifunctional receptor Robo3 and its ligand NELL2. Science (New York, N.Y.), 350(6263), 961-5. [PubMed:26586761] [WorldCat] [DOI] - ↑
Zou, Y., Stoeckli, E., Chen, H., & Tessier-Lavigne, M. (2000).
Squeezing axons out of the gray matter: a role for slit and semaphorin proteins from midline and ventral spinal cord. Cell, 102(3), 363-75. [PubMed:10975526] [WorldCat] [DOI] - ↑
Long, H., Sabatier, C., Ma, L., Plump, A., Yuan, W., Ornitz, D.M., ..., & Tessier-Lavigne, M. (2004).
Conserved roles for Slit and Robo proteins in midline commissural axon guidance. Neuron, 42(2), 213-23. [PubMed:15091338] [WorldCat] [DOI] - ↑
Liao, W.X., Wing, D.A., Geng, J.G., & Chen, D.B. (2010).
Perspectives of SLIT/ROBO signaling in placental angiogenesis. Histology and histopathology, 25(9), 1181-90. [PubMed:20607660] [WorldCat] [DOI] - ↑
Marillat, V., Cases, O., Nguyen-Ba-Charvet, K.T., Tessier-Lavigne, M., Sotelo, C., & Chédotal, A. (2002).
Spatiotemporal expression patterns of slit and robo genes in the rat brain. The Journal of comparative neurology, 442(2), 130-55. [PubMed:11754167] [WorldCat] [DOI] - ↑
Sabatier, C., Plump, A.S., Le Ma, Brose, K., Tamada, A., Murakami, F., ..., & Tessier-Lavigne, M. (2004).
The divergent Robo family protein rig-1/Robo3 is a negative regulator of slit responsiveness required for midline crossing by commissural axons. Cell, 117(2), 157-69. [PubMed:15084255] [WorldCat] [DOI] - ↑
Plump, A.S., Erskine, L., Sabatier, C., Brose, K., Epstein, C.J., Goodman, C.S., ..., & Tessier-Lavigne, M. (2002).
Slit1 and Slit2 cooperate to prevent premature midline crossing of retinal axons in the mouse visual system. Neuron, 33(2), 219-32. [PubMed:11804570] [WorldCat] [DOI] - ↑
Ozdinler, P.H., & Erzurumlu, R.S. (2002).
Slit2, a branching-arborization factor for sensory axons in the Mammalian CNS. The Journal of neuroscience : the official journal of the Society for Neuroscience, 22(11), 4540-9. [PubMed:12040061] [PMC] [WorldCat] [DOI] - ↑
Wang, K.H., Brose, K., Arnott, D., Kidd, T., Goodman, C.S., Henzel, W., & Tessier-Lavigne, M. (1999).
Biochemical purification of a mammalian slit protein as a positive regulator of sensory axon elongation and branching. Cell, 96(6), 771-84. [PubMed:10102266] [WorldCat] [DOI] - ↑
Whitford, K.L., Marillat, V., Stein, E., Goodman, C.S., Tessier-Lavigne, M., Chédotal, A., & Ghosh, A. (2002).
Regulation of cortical dendrite development by Slit-Robo interactions. Neuron, 33(1), 47-61. [PubMed:11779479] [WorldCat] [DOI] - ↑
Nguyen-Ba-Charvet, K.T., Picard-Riera, N., Tessier-Lavigne, M., Baron-Van Evercooren, A., Sotelo, C., & Chédotal, A. (2004).
Multiple roles for slits in the control of cell migration in the rostral migratory stream. The Journal of neuroscience : the official journal of the Society for Neuroscience, 24(6), 1497-506. [PubMed:14960623] [PMC] [WorldCat] [DOI] - ↑
Causeret, F., Danne, F., Ezan, F., Sotelo, C., & Bloch-Gallego, E. (2002).
Slit antagonizes netrin-1 attractive effects during the migration of inferior olivary neurons. Developmental biology, 246(2), 429-40. [PubMed:12051827] [WorldCat] [DOI] - ↑
Borrell, V., Cárdenas, A., Ciceri, G., Galcerán, J., Flames, N., Pla, R., ..., & Marín, O. (2012).
Slit/Robo signaling modulates the proliferation of central nervous system progenitors. Neuron, 76(2), 338-52. [PubMed:23083737] [PMC] [WorldCat] [DOI]