ROBO
權田 裕子、花嶋 かりな
独立行政法人理化学研究所 発生・再生科学総合研究センター
DOI:10.14931/bsd.2532 原稿受付日:2012年9月17日 原稿完成日:2013年3月25日
担当編集委員:大隅 典子(東北大学 大学院医学系研究科 附属創生応用医学研究センター 脳神経科学コアセンター 発生発達神経科学分野)
英語名:Roundabout 英略語:robo (Drosophila), ROBO (Homo sapiens)
同義語:roundabout (Drosophila), roundabout homolog (Mus musculus), roundabout, axon guidance receptor, homolog (Homo sapiens)
Roboは膜貫通型受容体の1つであり、一般的にリガンドであるSlitが結合することにより細胞内にシグナルを伝達する。脊椎・無脊椎動物の中枢神経系の発生と発達過程において重要な役割を果たしており、軸索誘導や細胞増殖、細胞移動、細胞接着、樹状突起形成などの様々な現象を調節している。
Roboとは
Roboはショウジョウバエの交連軸索投射異常を示す変異体のスクリーニングから発見されたタンパク質である[1]。膜貫通型受容体の1つであり、主としてRoboの細胞外領域の免疫グロブリン様ドメインにリガンドであるSlitが結合することにより[2] [3]、細胞内にシグナルを伝達する。ショウジョウバエの正中線ではRoboは交連神経の軸索(commissural axon) に発現し[4]、一方Slitは正中部のグリア細胞 (midline glia)から分泌され、通常、1度だけ正中線を交差する交連軸索がrobo 変異体では、何度も正中線を交差する現象が見られることから、roundabout (robo)と名づけられた。Robo-Slitを介したシグナル伝達は脊椎・無脊椎動物の中枢神経系の発生と発達過程において重要な役割を果たしており、軸索誘導以外に細胞移動、細胞接着、細胞極性や細胞骨格などの様々な現象を調節している。
ファミリー
Roboは線虫からヒトまで保存されている分子で、脊椎動物では4つのサブファミリー (Robo1/DUTT1, Robo2, Robo3/ Rig-1, Robo4/ Magic roundabout) が同定されている。線虫ではRobo (SAX-3)、ショウジョウバエではRobo1, Robo2, Robo3が同定されている。
構造
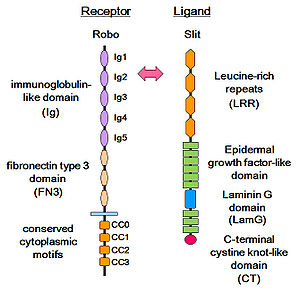
細胞接着因子の1つである免疫グロブリンスーパーファミリーに属し、その構造は細胞外領域に免疫グロブリン様ドメイン(immunogloubulin-like, Ig domain) とフィブロネクチンタイプⅢドメイン(fibronectin type 3, FN3 domain) を有し、細胞内領域に保存された細胞内モチーフ(conserved cytoplasmic motif, CC)をもつ[4] [5] [6](図1)。Slit-Roboの相互作用に重要であるSlitの2番目のロイシンリッチリピート(leucine-rich repeats, LRR)とRoboのIg1ドメイン, Ig2ドメイン はRobo1からRobo3まで保存されているが[7]、Robo4ではIg1ドメインのSlit結合部位が保存されていない[5]。このため、Robo4はSlitの受容体として機能しないと考えられていたが、近年、Slit2を介したRobo4によるシグナル伝達が報告されている[8]。
細胞内シグナル
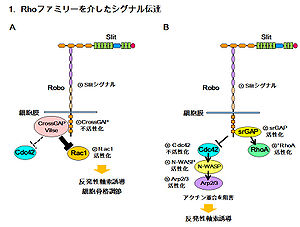
Rhoファミリーを介したシグナル伝達
ショウジョウバエではRoboのIgドメインにSlitのLRRドメインが結合すると、RhoGAPの1つであるCrossGAP (CrGAP)と相互作用することによりCrGAPを不活性化し、下流のRac1の活性化により正中線の反発性軸索誘導を生じるシグナル伝達系が知られている[9](図2. 1-A)。また、ヒト由来培養細胞を用いた実験では、同様にRoboのIgドメインへのSlitの結合により、Roboの細胞内領域にあるCC3モチーフとsrGAP (SLIT-ROBO Rho-GTPase-activating protein)の相互作用が促進され、その結果、内在性GTPase 活性の増加によるCdc42の不活性化経路が知られている。この経路ではCdc42不活性化により、Arp2/3複合体(アクチン関連タンパク質: actin related protein, Arp)とアクチン重合調節タンパク質であるNeuronal Wiskott-Aldrich Syndrome protein (N-WASP)の活性化がおさえられることで、アクチン重合が減少し、反発性の軸索誘導や細胞移動阻害を引き起こす[10](図2 1-B)。
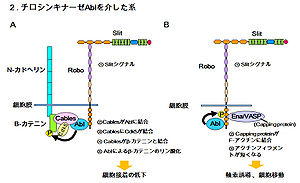
チロシンキナーゼAbelsonを介したシグナル伝達
ニワトリの網膜神経細胞を用いた実験では、Roboによるβ-カテニンを介した1) カドヘリン接着性の減少、2) 転写持続、を担う経路が知られている[11] [12]。この系ではRoboへのSlitの結合により、CablesがAbelson (Abl)に結合して、その後、Cablesはp35を介してβ-カテニンに結合していたCdk5(N-カドへリン-β-カテニン-p35-Cdk5複合体)と結合し、さらにβ-カテニンと結合する。この複合体では、Ablによるβ-カテニンのチロシンリン酸化によりβ-カテニン- N-カドへリンの親和性が低下し、N-カドへリンを介した接着性が消失する。リン酸化されたβ-カテニンは核内へと移行し、転写因子Tcf/Lefと結合することで、転写を活性化する(図2 2-A)。
一方ショウジョウバエでは、Roboの細胞内領域のCC3モチーフにAblが結合することでRoboをリン酸化し、Robo下流シグナルを阻害する経路も知られている。Ablの基質であるEnaはRoboの細胞内領域のCC1,CC2に結合し、キャッピングタンパク質のF-アクチンへの結合を調節することで細胞移動や反発性軸索誘導の一部を担うことが知られており、両者が相補的な役割を果たすことで反発性の軸索誘導を調節する[13] [14](図2 2-B)。
発現と機能
軸索誘導・軸索伸長
前述したように、ショウジョウバエでは Roboは交連神経細胞の軸索に発現し、midline gliaに発現するSlitとともに正中交差を調節する[4] [15] [16]。その機構は、正中線を交差する前の交連神経ではCommissureless (Comm) が発現して、成長円錐へのRoboの蓄積を妨げることでRoboの機能を阻害し、Slitへの反応性を失った軸索が正中線を交差する[17]。
一方脊椎動物ではCommのホモログは同定されておらず、マウス脊髄ではRobo3のスプライスバリアントであるRobo3.1が脊髄交連軸索に発現しRobo1/Robo2の活性をおさえてSlitに対する反発性を減少させ、脊髄の正中線を交差した後にRobo3の別のスプライスバリアントであるRobo3.2と Robo1, Robo2を共発現することで反対側への投射を阻害している[18] [19]。また、ノックアウトマウスを用いた解析から前脳においてはRobo1とRobo2が海馬交連、脳梁、視床皮質路、皮質脊髄路といった投射経路を制御することが報告されている[20] [21] [22] [23]。特に視床皮質路では、視床神経細胞の自発活動によりRobo1が転写活性化されることで、軸索伸張の速度を制御する機構が報告されている[24]。
また、小脳前核神経細胞の軸索の正中線交差では、Musashi1がRNA認識モチーフを介してRobo3 mRNAに結合して、Robo3タンパク質の翻訳を促進することが示されている[25]。
一方、匂い情報が約1000種類の嗅神経細胞により検出され、2次元的な神経地図として表現されている嗅球では、胎生期に嗅上皮背内側に高い濃度勾配を示すRobo2と嗅球の腹側に発現するSlit1との相互作用により、背内側の嗅神経細胞から嗅球の背側へと軸索投射し、神経地図の形成に関わっている[26] [27] [28]。
これらのことから、Slit/Roboによるシグナル伝達は発生期の様々な投射経路調節に用いられ、その過程でRobo自身の発現がダイナミックに調節されることで緻密な神経回路形成を行っている。一方、Xenopusの脊髄を用いた実験では、Roboがネトリン受容体の1つであるDCCと直接結合することにより、ネトリンの誘引性軸索誘導を阻害し[29]、またマウスにおいてRoboとセマフォリン受容体のNrp1と相互作用して、セマフォリンシグナル伝達経路を調節することが報告されている[30]。このことよりRoboはSlit以外の軸索ガイダンス分子や、他の受容体と相互作用することにより、反発性や誘導性の軸索誘導を阻害する作用をもつことがわかってきた。
細胞移動
脳スライスを用いた実験やノックアウトマウスの解析より、Roboは脳の様々な神経細胞集団の移動を制御することが明らかになってきた。特に大脳皮質では複数のRoboホモログの発現が知られており、抑制性の介在ニューロン[20] [21] [22] [31]と興奮性の錐体細胞[32] [33]の双方の移動を制御する。このうちマウス大脳皮質の錐体細胞に発現しているRobo1とRobo4は、胎生期の錐体神経細胞の中間帯から皮質板への放射状移動を正に制御し、またRobo1は神経細胞が辺縁帯直下まで移動した後のインサイド・アウトの層形成にも関わっている[33]。一方成体脳でも、Robo2, Robo3を発現するアストロサイトのトンネルを側脳室前方上衣下層(SVZ)で産生された新生神経細胞がSlit1を分泌しながら維持することで 、嗅球への選択的な高速移動を制御することがマウスで報告されている[34]。
細胞骨格
近年Roboを介したシグナルが神経細胞の軸索経路選択だけではなく、樹状突起伸張や分岐形成をも制御することが報告されている。ショウジョウバエの腹側正中線では、Roboが運動ニューロンの軸索投射や樹状突起形成に関わり[35]、Xenopusの網膜神経節細胞では、Roboが樹状突起の伸張と分岐形成を調節している[36]。
Roboと疾患
ROBOはヒトの脳形成においても重要な遺伝子であり、近年ROBOと神経疾患との関連性が示されている。失読症患者では染色体転座によるROBO1遺伝子の欠失もしくは発現減少が報告されており[37]、ROBO3, ROBO4の一塩基多型と自閉症の関連性や、自閉症患者群での血中ROBO1, ROBO2遺伝子発現の減少も報告されている[38]。また、動眼神経および滑車神経麻痺を伴う水平注視麻痺症候群(HGPPS)の患者では、ROBO3遺伝子変異により、体性感覚路と運動路の交連投射異常が示されている[39] [40] [41]。さらに、ROBO1遺伝子の発現低下を伴うハプロタイプを継承するフィンランド人家系の解析から、ROBO1遺伝子の発現減少により、聴覚経路の軸索投射が減弱して、聴覚の異常が生じることが示されている[42]。
関連語
参考文献
- ↑
Seeger, M., Tear, G., Ferres-Marco, D., & Goodman, C.S. (1993).
Mutations affecting growth cone guidance in Drosophila: genes necessary for guidance toward or away from the midline. Neuron, 10(3), 409-26. [PubMed:8461134] [WorldCat] [DOI] - ↑
Brose, K., Bland, K.S., Wang, K.H., Arnott, D., Henzel, W., Goodman, C.S., ..., & Kidd, T. (1999).
Slit proteins bind Robo receptors and have an evolutionarily conserved role in repulsive axon guidance. Cell, 96(6), 795-806. [PubMed:10102268] [WorldCat] [DOI] - ↑
Liu, Z., Patel, K., Schmidt, H., Andrews, W., Pini, A., & Sundaresan, V. (2004).
Extracellular Ig domains 1 and 2 of Robo are important for ligand (Slit) binding. Molecular and cellular neurosciences, 26(2), 232-40. [PubMed:15207848] [WorldCat] [DOI] - ↑ 4.0 4.1 4.2
Kidd, T., Brose, K., Mitchell, K.J., Fetter, R.D., Tessier-Lavigne, M., Goodman, C.S., & Tear, G. (1998).
Roundabout controls axon crossing of the CNS midline and defines a novel subfamily of evolutionarily conserved guidance receptors. Cell, 92(2), 205-15. [PubMed:9458045] [WorldCat] [DOI] - ↑ 5.0 5.1
Huminiecki, L., Gorn, M., Suchting, S., Poulsom, R., & Bicknell, R. (2002).
Magic roundabout is a new member of the roundabout receptor family that is endothelial specific and expressed at sites of active angiogenesis. Genomics, 79(4), 547-52. [PubMed:11944987] [WorldCat] [DOI] - ↑
Sundaresan, V., Roberts, I., Bateman, A., Bankier, A., Sheppard, M., Hobbs, C., ..., & Rabbitts, P. (1998).
The DUTT1 gene, a novel NCAM family member is expressed in developing murine neural tissues and has an unusually broad pattern of expression. Molecular and cellular neurosciences, 11(1-2), 29-35. [PubMed:9608531] [WorldCat] [DOI] - ↑
Morlot, C., Thielens, N.M., Ravelli, R.B., Hemrika, W., Romijn, R.A., Gros, P., ..., & McCarthy, A.A. (2007).
Structural insights into the Slit-Robo complex. Proceedings of the National Academy of Sciences of the United States of America, 104(38), 14923-8. [PubMed:17848514] [PMC] [WorldCat] [DOI] - ↑
Jones, C.A., London, N.R., Chen, H., Park, K.W., Sauvaget, D., Stockton, R.A., ..., & Li, D.Y. (2008).
Robo4 stabilizes the vascular network by inhibiting pathologic angiogenesis and endothelial hyperpermeability. Nature medicine, 14(4), 448-53. [PubMed:18345009] [PMC] [WorldCat] [DOI] - ↑
Hu, H., Li, M., Labrador, J.P., McEwen, J., Lai, E.C., Goodman, C.S., & Bashaw, G.J. (2005).
Cross GTPase-activating protein (CrossGAP)/Vilse links the Roundabout receptor to Rac to regulate midline repulsion. Proceedings of the National Academy of Sciences of the United States of America, 102(12), 4613-8. [PubMed:15755809] [PMC] [WorldCat] [DOI] - ↑
Wong, K., Ren, X.R., Huang, Y.Z., Xie, Y., Liu, G., Saito, H., ..., & Rao, Y. (2001).
Signal transduction in neuronal migration: roles of GTPase activating proteins and the small GTPase Cdc42 in the Slit-Robo pathway. Cell, 107(2), 209-21. [PubMed:11672528] [WorldCat] [DOI] - ↑
Rhee, J., Mahfooz, N.S., Arregui, C., Lilien, J., Balsamo, J., & VanBerkum, M.F. (2002).
Activation of the repulsive receptor Roundabout inhibits N-cadherin-mediated cell adhesion. Nature cell biology, 4(10), 798-805. [PubMed:12360290] [WorldCat] [DOI] - ↑
Rhee, J., Buchan, T., Zukerberg, L., Lilien, J., & Balsamo, J. (2007).
Cables links Robo-bound Abl kinase to N-cadherin-bound beta-catenin to mediate Slit-induced modulation of adhesion and transcription. Nature cell biology, 9(8), 883-92. [PubMed:17618275] [WorldCat] [DOI] - ↑
Bashaw, G.J., Kidd, T., Murray, D., Pawson, T., & Goodman, C.S. (2000).
Repulsive axon guidance: Abelson and Enabled play opposing roles downstream of the roundabout receptor. Cell, 101(7), 703-15. [PubMed:10892742] [WorldCat] [DOI] - ↑
Bear, J.E., Svitkina, T.M., Krause, M., Schafer, D.A., Loureiro, J.J., Strasser, G.A., ..., & Gertler, F.B. (2002).
Antagonism between Ena/VASP proteins and actin filament capping regulates fibroblast motility. Cell, 109(4), 509-21. [PubMed:12086607] [WorldCat] [DOI] - ↑
Battye, R., Stevens, A., & Jacobs, J.R. (1999).
Axon repulsion from the midline of the Drosophila CNS requires slit function. Development (Cambridge, England), 126(11), 2475-81. [PubMed:10226006] [WorldCat] - ↑
Kidd, T., Bland, K.S., & Goodman, C.S. (1999).
Slit is the midline repellent for the robo receptor in Drosophila. Cell, 96(6), 785-94. [PubMed:10102267] [WorldCat] [DOI] - ↑
Keleman, K., Rajagopalan, S., Cleppien, D., Teis, D., Paiha, K., Huber, L.A., ..., & Dickson, B.J. (2002).
Comm sorts robo to control axon guidance at the Drosophila midline. Cell, 110(4), 415-27. [PubMed:12202032] [WorldCat] [DOI] - ↑
Chen, Z., Gore, B.B., Long, H., Ma, L., & Tessier-Lavigne, M. (2008).
Alternative splicing of the Robo3 axon guidance receptor governs the midline switch from attraction to repulsion. Neuron, 58(3), 325-32. [PubMed:18466743] [WorldCat] [DOI] - ↑
Tamada, A., Kumada, T., Zhu, Y., Matsumoto, T., Hatanaka, Y., Muguruma, K., ..., & Murakami, F. (2008).
Crucial roles of Robo proteins in midline crossing of cerebellofugal axons and lack of their up-regulation after midline crossing. Neural development, 3, 29. [PubMed:18986510] [PMC] [WorldCat] [DOI] - ↑ 20.0 20.1
Andrews, W., Liapi, A., Plachez, C., Camurri, L., Zhang, J., Mori, S., ..., & Richards, L.J. (2006).
Robo1 regulates the development of major axon tracts and interneuron migration in the forebrain. Development (Cambridge, England), 133(11), 2243-52. [PubMed:16690755] [WorldCat] [DOI] - ↑ 21.0 21.1
Andrews, W., Barber, M., Hernadez-Miranda, L.R., Xian, J., Rakic, S., Sundaresan, V., ..., & Parnavelas, J.G. (2008).
The role of Slit-Robo signaling in the generation, migration and morphological differentiation of cortical interneurons. Developmental biology, 313(2), 648-58. [PubMed:18054781] [WorldCat] [DOI] - ↑ 22.0 22.1
Barber, M., Di Meglio, T., Andrews, W.D., Hernández-Miranda, L.R., Murakami, F., Chédotal, A., & Parnavelas, J.G. (2009).
The role of Robo3 in the development of cortical interneurons. Cerebral cortex (New York, N.Y. : 1991), 19 Suppl 1, i22-31. [PubMed:19366869] [PMC] [WorldCat] [DOI] - ↑
López-Bendito, G., Flames, N., Ma, L., Fouquet, C., Di Meglio, T., Chedotal, A., ..., & Marín, O. (2007).
Robo1 and Robo2 cooperate to control the guidance of major axonal tracts in the mammalian forebrain. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(13), 3395-407. [PubMed:17392456] [PMC] [WorldCat] [DOI] - ↑
Mire, E., Mezzera, C., Leyva-Díaz, E., Paternain, A.V., Squarzoni, P., Bluy, L., ..., & López-Bendito, G. (2012).
Spontaneous activity regulates Robo1 transcription to mediate a switch in thalamocortical axon growth. Nature neuroscience, 15(8), 1134-43. [PubMed:22772332] [WorldCat] [DOI] - ↑
Kuwako, K., Kakumoto, K., Imai, T., Igarashi, M., Hamakubo, T., Sakakibara, S., ..., & Okano, H. (2010).
Neural RNA-binding protein Musashi1 controls midline crossing of precerebellar neurons through posttranscriptional regulation of Robo3/Rig-1 expression. Neuron, 67(3), 407-21. [PubMed:20696379] [WorldCat] [DOI] - ↑
Cho, J.H., Lépine, M., Andrews, W., Parnavelas, J., & Cloutier, J.F. (2007).
Requirement for Slit-1 and Robo-2 in zonal segregation of olfactory sensory neuron axons in the main olfactory bulb. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(34), 9094-104. [PubMed:17715346] [PMC] [WorldCat] [DOI] - ↑
Nguyen-Ba-Charvet, K.T., Di Meglio, T., Fouquet, C., & Chédotal, A. (2008).
Robos and slits control the pathfinding and targeting of mouse olfactory sensory axons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 28(16), 4244-9. [PubMed:18417704] [PMC] [WorldCat] [DOI] - ↑
Cho, J.H., Prince, J.E., Cutforth, T., & Cloutier, J.F. (2011).
The pattern of glomerular map formation defines responsiveness to aversive odorants in mice. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(21), 7920-6. [PubMed:21613506] [PMC] [WorldCat] [DOI] - ↑
Stein, E., & Tessier-Lavigne, M. (2001).
Hierarchical organization of guidance receptors: silencing of netrin attraction by slit through a Robo/DCC receptor complex. Science (New York, N.Y.), 291(5510), 1928-38. [PubMed:11239147] [WorldCat] [DOI] - ↑
Hernández-Miranda, L.R., Cariboni, A., Faux, C., Ruhrberg, C., Cho, J.H., Cloutier, J.F., ..., & Andrews, W.D. (2011).
Robo1 regulates semaphorin signaling to guide the migration of cortical interneurons through the ventral forebrain. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(16), 6174-87. [PubMed:21508241] [PMC] [WorldCat] [DOI] - ↑
Zhu, Y., Li, H., Zhou, L., Wu, J.Y., & Rao, Y. (1999).
Cellular and molecular guidance of GABAergic neuronal migration from an extracortical origin to the neocortex. Neuron, 23(3), 473-85. [PubMed:10433260] [WorldCat] [DOI] - ↑
Zheng, W., Geng, A.Q., Li, P.F., Wang, Y., & Yuan, X.B. (2012).
Robo4 regulates the radial migration of newborn neurons in developing neocortex. Cerebral cortex (New York, N.Y. : 1991), 22(11), 2587-601. [PubMed:22123939] [PMC] [WorldCat] [DOI] - ↑ 33.0 33.1
Gonda, Y., Andrews, W.D., Tabata, H., Namba, T., Parnavelas, J.G., Nakajima, K., ..., & Uchino, S. (2013).
Robo1 regulates the migration and laminar distribution of upper-layer pyramidal neurons of the cerebral cortex. Cerebral cortex (New York, N.Y. : 1991), 23(6), 1495-508. [PubMed:22661412] [PMC] [WorldCat] [DOI] - ↑
Kaneko, N., Marín, O., Koike, M., Hirota, Y., Uchiyama, Y., Wu, J.Y., ..., & Sawamoto, K. (2010).
New neurons clear the path of astrocytic processes for their rapid migration in the adult brain. Neuron, 67(2), 213-23. [PubMed:20670830] [PMC] [WorldCat] [DOI] - ↑
Furrer, M.P., Kim, S., Wolf, B., & Chiba, A. (2003).
Robo and Frazzled/DCC mediate dendritic guidance at the CNS midline. Nature neuroscience, 6(3), 223-30. [PubMed:12592406] [WorldCat] [DOI] - ↑
Hocking, J.C., Hehr, C.L., Bertolesi, G.E., Wu, J.Y., & McFarlane, S. (2009).
Distinct roles for Robo2 in the regulation of axon and dendrite growth by retinal ganglion cells. Mechanisms of development, 127(1-2), 36-48. [PubMed:19961927] [WorldCat] [DOI] - ↑
Hannula-Jouppi, K., Kaminen-Ahola, N., Taipale, M., Eklund, R., Nopola-Hemmi, J., Kääriäinen, H., & Kere, J. (2005).
The axon guidance receptor gene ROBO1 is a candidate gene for developmental dyslexia. PLoS genetics, 1(4), e50. [PubMed:16254601] [PMC] [WorldCat] [DOI] - ↑
Anitha, A., Nakamura, K., Yamada, K., Suda, S., Thanseem, I., Tsujii, M., ..., & Mori, N. (2008).
Genetic analyses of roundabout (ROBO) axon guidance receptors in autism. American journal of medical genetics. Part B, Neuropsychiatric genetics : the official publication of the International Society of Psychiatric Genetics, 147B(7), 1019-27. [PubMed:18270976] [WorldCat] [DOI] - ↑
Jen, J.C., Chan, W.M., Bosley, T.M., Wan, J., Carr, J.R., Rüb, U., ..., & Engle, E.C. (2004).
Mutations in a human ROBO gene disrupt hindbrain axon pathway crossing and morphogenesis. Science (New York, N.Y.), 304(5676), 1509-13. [PubMed:15105459] [PMC] [WorldCat] [DOI] - ↑
Renier, N., Schonewille, M., Giraudet, F., Badura, A., Tessier-Lavigne, M., Avan, P., ..., & Chédotal, A. (2010).
Genetic dissection of the function of hindbrain axonal commissures. PLoS biology, 8(3), e1000325. [PubMed:20231872] [PMC] [WorldCat] [DOI] - ↑
Sicotte, N.L., Salamon, G., Shattuck, D.W., Hageman, N., Rüb, U., Salamon, N., ..., & Jen, J.C. (2006).
Diffusion tensor MRI shows abnormal brainstem crossing fibers associated with ROBO3 mutations. Neurology, 67(3), 519-21. [PubMed:16894121] [WorldCat] [DOI] - ↑
Lamminmäki, S., Massinen, S., Nopola-Hemmi, J., Kere, J., & Hari, R. (2012).
Human ROBO1 regulates interaural interaction in auditory pathways. The Journal of neuroscience : the official journal of the Society for Neuroscience, 32(3), 966-71. [PubMed:22262894] [PMC] [WorldCat] [DOI]