「前後軸」の版間の差分
細 →前脳 |
細 →神経板の後方化 |
||
| (2人の利用者による、間の9版が非表示) | |||
| 1行目: | 1行目: | ||
英語名:antero-posterior axis、rostral-caudal axis 独:anteroposterioren Achse、rostrokaudalen Achse 仏:axe antéro-postérieur、axe rostro-caudal | 英語名:antero-posterior axis、rostral-caudal axis 独:anteroposterioren Achse、rostrokaudalen Achse 仏:axe antéro-postérieur、axe rostro-caudal | ||
[[オーガナイザー]]により[[wikipedia:ja:外胚葉|外胚葉]]から誘導された初期[[神経板]]の性質は、[[後方化シグナル分子]]の濃度勾配にしたがって、前後軸に沿った異なる性質をもつ領域へと変換される。さらに、二次シグナリングセンターからのシグナル分子の作用により、各脳領域には特徴的な前後軸パターンが形成される。 | [[オーガナイザー]]により[[wikipedia:ja:外胚葉|外胚葉]]から誘導された初期[[神経板]]の性質は、[[後方化シグナル分子]]の濃度勾配にしたがって、前後軸に沿った異なる性質をもつ領域へと変換される。さらに、二次シグナリングセンターからのシグナル分子の作用により、各脳領域には特徴的な前後軸パターンが形成される。 | ||
== 神経誘導と前後軸パターン形成モデル == | == 神経誘導と前後軸パターン形成モデル == | ||
| 16行目: | 7行目: | ||
前後軸は、神経の発生において最も早く確立される軸である。シュペーマンらによる神経外胚葉の誘導現象の発見は、その後の前後軸形成機構の研究に大きな影響を与えた。 | 前後軸は、神経の発生において最も早く確立される軸である。シュペーマンらによる神経外胚葉の誘導現象の発見は、その後の前後軸形成機構の研究に大きな影響を与えた。 | ||
1920年代後半、[[wikipedia:ja:シュペーマン|シュペーマン]]と[[wikipedia:Hilde Mangold|ヒルデ・マンゴルト]]は[[wikipedia:ja:両生類|両生類]]胚を用いて、[[中枢神経系]]の前後軸パターン形成に関わる重要な領域を明らかにした<ref name=ref1><pubmed>11252999</pubmed></ref>。[[wikipedia:ja:イモリ|イモリ]]初期[[wikipedia:ja:原腸胚|原腸胚]]の[[原口背唇部]]を本来神経組織に分化しない表皮外胚葉に移植すると、完全な頭部と胴部を含む二次軸が誘導された。後期原腸胚の原口背唇部を表皮外胚葉に移植すると、頭部が欠損した胴尾部組織が異所的に生じた。シュペーマンらはこのような実験結果に基づき、外胚葉から神経組織([[神経外胚葉]])を誘導する活性をもつ原口背唇部を、オーガナイザー(形成体)と名付けた。特に、初期原腸胚の原口背唇部は頭部オーガナイザー、後期原腸胚の原口背唇部は尾部オーガナイザーと呼ばれている。神経外胚葉は中枢神経系の原基である神経板を形成し、原口背唇部からは、その後神経外胚葉下を前方向に移動する[[wikipedia:ja:中内胚葉|中内胚葉]](mesendoderm)細胞および[[wikipedia:ja:中胚葉|中胚葉]] (mesoderm) 細胞が派生する。先に移動する中内胚葉細胞は[[脊索前板]]を形成し、それに続き移動する中胚葉細胞は[[脊索]]を形成する。 | 1920年代後半、[[wikipedia:ja:シュペーマン|シュペーマン]]と[[wikipedia:Hilde Mangold|ヒルデ・マンゴルト]]は[[wikipedia:ja:両生類|両生類]]胚を用いて、[[中枢神経系]]の前後軸パターン形成に関わる重要な領域を明らかにした<ref name=ref1><pubmed>11252999</pubmed></ref>。[[wikipedia:ja:イモリ|イモリ]]初期[[wikipedia:ja:原腸胚|原腸胚]]の[[wikipedia:ja:原口背唇部|原口背唇部]]を本来神経組織に分化しない表皮外胚葉に移植すると、完全な頭部と胴部を含む二次軸が誘導された。後期原腸胚の原口背唇部を表皮外胚葉に移植すると、頭部が欠損した胴尾部組織が異所的に生じた。シュペーマンらはこのような実験結果に基づき、外胚葉から神経組織([[神経外胚葉]])を誘導する活性をもつ原口背唇部を、オーガナイザー(形成体)と名付けた。特に、初期原腸胚の原口背唇部は頭部オーガナイザー、後期原腸胚の原口背唇部は尾部オーガナイザーと呼ばれている。神経外胚葉は中枢神経系の原基である神経板を形成し、原口背唇部からは、その後神経外胚葉下を前方向に移動する[[wikipedia:ja:中内胚葉|中内胚葉]](mesendoderm)細胞および[[wikipedia:ja:中胚葉|中胚葉]] (mesoderm) 細胞が派生する。先に移動する中内胚葉細胞は[[脊索前板]]を形成し、それに続き移動する中胚葉細胞は[[脊索]]を形成する。 | ||
オットー・マンゴルトは1930年代前半に、前方神経板下の中内胚葉細胞を表皮外胚葉領域に移植すると頭部が誘導され、後方神経板下の中胚葉細胞を表皮外胚葉領域に移植すると胴体および尾部が誘導されることを示した。このようなことから、初期原腸胚の原口背唇部は頭部オーガナイザー、後期原腸胚の原口背唇部は尾部オーガナイザーと呼ばれている。これら一連の実験から、原口背唇部の神経誘導活性は時間とともに性質が変化し、オーガナイザー細胞が前方へ移動する過程において、オーガナイザーとの接触により異なるシグナルを受け取った外胚葉には、前後軸に沿って異なる性質をもつ領域が形成されると考えられた。 | オットー・マンゴルトは1930年代前半に、前方神経板下の中内胚葉細胞を表皮外胚葉領域に移植すると頭部が誘導され、後方神経板下の中胚葉細胞を表皮外胚葉領域に移植すると胴体および尾部が誘導されることを示した。このようなことから、初期原腸胚の原口背唇部は頭部オーガナイザー、後期原腸胚の原口背唇部は尾部オーガナイザーと呼ばれている。これら一連の実験から、原口背唇部の神経誘導活性は時間とともに性質が変化し、オーガナイザー細胞が前方へ移動する過程において、オーガナイザーとの接触により異なるシグナルを受け取った外胚葉には、前後軸に沿って異なる性質をもつ領域が形成されると考えられた。 | ||
| 39行目: | 30行目: | ||
== 神経板の後方化 == | == 神経板の後方化 == | ||
[[file:masanoritakahashi_fig2. | [[file:masanoritakahashi_fig2.png|thumb|250px|'''図2 Hox遺伝子と前後軸'''<br>(A) 菱脳の分節構造(ロンボメア)ラット胎齢10.75日胚の切片(DAPI染色)<br>(B) Hox遺伝子の発現境界と分節境界との関係]] | ||
ニワトリ胚やマウス胚において、両生類胚の尾部オーガナイザーに相当する領域は、原始線条の先端部から時期を追って形成される[[結節]]([[ノード]] [[node]])と呼ばれる領域である。 | |||
原始線条や結節には[[線維芽細胞増殖因子]]8([[fibroblast growth factor 8]]: [[FGF8]]) が発現している。ニワトリ初期神経板前方領域の組織片にFGF8を添加し、しばらく培養すると、FGF8の濃度依存的に中脳や[[菱脳]]前方領域の性質が誘導される<ref name=ref6><pubmed>12006981</pubmed></ref>。このような脳の領域は、前後軸に沿って発現する[[転写制御因子]]の発現を指標にすることで区別可能である。例えば、前脳では[[Pax6]]、中脳では[[Engrailed 1]]/[[Engrailed 2|2]] ([[En1]]/[[En2|2]])、菱脳では[[Krox20]]、菱脳・脊髄では各種[[Hox遺伝子群|ホックス(Hox) 遺伝子]]が発現する(図1)。このような一連の実験から、初期神経板には前後軸に沿ってFGF8の濃度勾配が形成され、FGF8は神経板の後方化シグナル分子として機能することが明らかとなった。 | 原始線条や結節には[[線維芽細胞増殖因子]]8([[fibroblast growth factor 8]]: [[FGF8]]) が発現している。ニワトリ初期神経板前方領域の組織片にFGF8を添加し、しばらく培養すると、FGF8の濃度依存的に中脳や[[菱脳]]前方領域の性質が誘導される<ref name=ref6><pubmed>12006981</pubmed></ref>。このような脳の領域は、前後軸に沿って発現する[[転写制御因子]]の発現を指標にすることで区別可能である。例えば、前脳では[[Pax6]]、中脳では[[Engrailed 1]]/[[Engrailed 2|2]] ([[En1]]/[[En2|2]])、菱脳では[[Krox20]]、菱脳・脊髄では各種[[Hox遺伝子群|ホックス(Hox) 遺伝子]]が発現する(図1)。このような一連の実験から、初期神経板には前後軸に沿ってFGF8の濃度勾配が形成され、FGF8は神経板の後方化シグナル分子として機能することが明らかとなった。 | ||
| 51行目: | 44行目: | ||
=== 菱脳 === | === 菱脳 === | ||
[[image:前後軸図2.jpg|thumb|300px|''' | [[image:前後軸図2.jpg|thumb|300px|'''図2.脳原基の前後軸パターン化'''<br>マウス胚胎齢8.5日と10.5日における脳の区画化<br> | ||
p1-3, prosomere 1-3; mb, midbrain; r1-7, rhombomere 1-7; ANR, anterior neural ridge; MHB, midbrain hindbrain boundary; Zli, zona limitance intrathalamica | p1-3, prosomere 1-3; mb, midbrain; r1-7, rhombomere 1-7; ANR, anterior neural ridge; MHB, midbrain hindbrain boundary; Zli, zona limitance intrathalamica | ||
]] | ]] | ||
神経板の前後軸極性の確立にともない、初期脳原基には[[ニューロメア]]([[neuromere]])と呼ばれる分節構造が形成される。分節の形成は、神経管を構成する神経上皮細胞の形態変化によって引き起こされ、神経管の基底膜側におけるくびれとして認識される。そのくびれの位置における神経管の脳室面側では、逆に隆起が見られる。菱脳ではロンボメア(rhombomere)と呼ばれる分節が存在する(図2)<ref name=ref5 /> | 神経板の前後軸極性の確立にともない、初期脳原基には[[ニューロメア]]([[neuromere]])と呼ばれる分節構造が形成される。分節の形成は、神経管を構成する神経上皮細胞の形態変化によって引き起こされ、神経管の基底膜側におけるくびれとして認識される。そのくびれの位置における神経管の脳室面側では、逆に隆起が見られる。菱脳ではロンボメア(rhombomere)と呼ばれる分節が存在する(図2)<ref name=ref5 />。Hox遺伝子群の発現は、第一分節には見られないが、第二分節より後方では、Hox遺伝子群の発現前方境界が、ロンボメア間の境界と一致している(図2)。発生初期段階のマウス胚やニワトリ胚にレチノイン酸を投与すると、菱脳におけるHox遺伝子の発現境界が前方へシフトする(もともとHox遺伝子の発現がロンボメアの境界と符号しているとの説明がないので解りにくいかも知れません。村上)。またレチノイン酸が欠乏した胚では、菱脳におけるHox遺伝子の発現境界が後方にシフトする。これらのことから、生体内では、菱脳後方から前方に向かって形成されるレチノイン酸の濃度勾配が、菱脳の前後パターン形成に関与すると考えられている<ref name=ref5 />。 | ||
また、[[中脳・後脳境界]](midbrain hindbrain boundary: MHB)の後脳側に発現するFGF8の作用により、菱脳第一分節は小脳へと運命づけられる<ref name=ref5 />。各ロンボメア間では、[[エフリン]] ([[ephrin]]) や[[エフリン受容体]] ([[Eph]]) による反発作用により境界を超えて前後に細胞が混じり合わない(注: 細胞移動が起こらない境界で囲まれた領域はコンパートメントと呼ばれ、コンパートメント間の境界はコンパートメント境界と呼ばれている)。さらに、ロンボメア境界付近の細胞は、[[ロンボメア境界細胞]](rhombomere boundary cell)と呼ばれる特殊化した細胞群に変化し、FGFやWntなどのシグナル分子を前後軸方向に分泌し、近接する細胞の神経分化を制御するシグナリングセンターとして機能することが示唆されている<ref name=ref5 />。 | また、[[中脳・後脳境界]](midbrain hindbrain boundary: MHB)の後脳側に発現するFGF8の作用により、菱脳第一分節は小脳へと運命づけられる<ref name=ref5 />。各ロンボメア間では、[[エフリン]] ([[ephrin]]) や[[エフリン受容体]] ([[Eph]]) による反発作用により境界を超えて前後に細胞が混じり合わない(注: 細胞移動が起こらない境界で囲まれた領域はコンパートメントと呼ばれ、コンパートメント間の境界はコンパートメント境界と呼ばれている)。さらに、ロンボメア境界付近の細胞は、[[ロンボメア境界細胞]](rhombomere boundary cell)と呼ばれる特殊化した細胞群に変化し、FGFやWntなどのシグナル分子を前後軸方向に分泌し、近接する細胞の神経分化を制御するシグナリングセンターとして機能することが示唆されている<ref name=ref5 />。 | ||
| 65行目: | 58行目: | ||
=== 前脳 === | === 前脳 === | ||
[[image:前後軸図3.jpg|thumb|300px|''' | [[image:前後軸図3.jpg|thumb|300px|'''図3.大脳皮質原基の前後軸パターン化'''<br>大脳皮質原基における遺伝子発現 (<ref name=ref14><pubmed>18524571</pubmed></ref>を基に作成) F/M, prefrontal/motor cortex (前頭前皮質/運動野); S1, primary somatosensory cortex (一次体性感覚野); A1,primary auditory cortex (一次聴覚野); V1, primary visual cortex (一次視覚野)]] | ||
前脳は間脳と終脳に分けられる。予定前脳領域神経板において非神経外胚葉と接する狭い領域は、前方神経境界領域 (anterior neural boundary: ANBまたはanterior neural ridge: ANR) と呼ばれている。この領域に発現するシグナリング分子FGF8は、近接する側方前脳領域において、脳形成に重要な転写因子BF1の発現を誘導する。したがって、前方神経境界領域は、前後軸が決定された後、さらに前脳をパターン化するためのシグナリングセンターとして重要である [5]。 | 前脳は間脳と終脳に分けられる。予定前脳領域神経板において非神経外胚葉と接する狭い領域は、前方神経境界領域 (anterior neural boundary: ANBまたはanterior neural ridge: ANR) と呼ばれている。この領域に発現するシグナリング分子FGF8は、近接する側方前脳領域において、脳形成に重要な転写因子BF1の発現を誘導する。したがって、前方神経境界領域は、前後軸が決定された後、さらに前脳をパターン化するためのシグナリングセンターとして重要である [5]。 | ||
ロンボメア形成や各々のHox遺伝子の発現境界が前後にずれていることは、菱脳の前後軸に沿った機能の違いを生み出すための重要なメカニズムであるが、前脳にも分節構造が存在するのかどうかは、前脳の多様な機能を考える上で、重要な問題であった。ルービンシュタインらは、ショウジョウバエの頭部形成に関わるホメオボックス転写因子の脊椎動物ホモログ遺伝子の発現をマウス胚前脳において調べ、個々遺伝子が前後軸に沿っていくつかの決まった位置に発現境界を示すことを発見した。このような遺伝子発現様式に基づき、前脳には前後軸に沿って6つの分節(プロソメア)(p1からp6) が存在するとするプロソメアモデル(prosomeric model)が提唱された<ref name=ref11><pubmed>7939711</pubmed></ref>。このモデルでは、p1-p3は視床を形成する間脳後方領域に相当し、p4-p6は間脳前方領域(視床下部)と終脳を形成する二次前脳胞(secondary procencephalon)に相当する。その後、視床と視床下部の区画に関する研究が進展し、p3に含まれる領域の変更と視床下部におけるプロソメア境界が再検討され、初期モデルのp4-p6領域は一区画に修正されている<ref name=ref12><pubmed>12948657</pubmed></ref>(図2)。p2/p3境界は、Six3およびFezf1/2の後方発現境界とIrx3の前方発現境界に一致している<ref name=ref5 />。Six3や[[Fezf1]]/[[Fezf2|2]]はp2/3境界形成に必須の遺伝子である(図2)<ref name=ref5 />。p2/p3境界には[[ソニックヘッジホッグ]]([[sonic hedgehog]]: [[Shh]]) を発現する[[Zli 領域]] ([[zona limitance intrathalamica]])が形成され、[[間脳原基]]から生じる[[視床]]の前後軸パターン化に関与している<ref name=ref5 />(図2)。間脳・中脳境界は、間脳後部に発現するPax6と中脳に発現するEn2の相互抑制機構により確立される(図2)。 | |||
ロンボメア形成や各々のHox遺伝子の発現境界が前後にずれていることは、菱脳の前後軸に沿った機能の違いを生み出すための重要なメカニズムであるが、前脳にも分節構造が存在するのかどうかは、前脳の多様な機能を考える上で、重要な問題であった。ルービンシュタインらは、ショウジョウバエの頭部形成に関わるホメオボックス転写因子の脊椎動物ホモログ遺伝子の発現をマウス胚前脳において調べ、個々遺伝子が前後軸に沿っていくつかの決まった位置に発現境界を示すことを発見した。このような遺伝子発現様式に基づき、前脳には前後軸に沿って6つの分節(プロソメア)(p1からp6) が存在するとするプロソメアモデル(prosomeric model)が提唱された<ref name=ref11><pubmed>7939711</pubmed></ref>。このモデルでは、p1-p3は視床を形成する間脳後方領域に相当し、p4-p6は間脳前方領域(視床下部)と終脳を形成する二次前脳胞(secondary procencephalon)に相当する。その後、視床と視床下部の区画に関する研究が進展し、p3に含まれる領域の変更と視床下部におけるプロソメア境界が再検討され、初期モデルのp4-p6領域は一区画に修正されている<ref name=ref12><pubmed>12948657</pubmed></ref> | |||
二次前脳胞の背側から腹側にかけての領域からは、将来の[[大脳皮質]]、[[線条体]]、[[淡蒼球]]、[[視床下部]]が派生する。脳胞形成後の終脳先端正中部に位置するcommissural plateにはFGF8が発現している (図2)。FGF8をマウス大脳皮質原基の前方領域に発現させると、本来前方に位置する領野が後方へとシフトする。一方、FGF8を大脳皮質原基の後方領域に発現させると鏡像対称な[[体性感覚野]][[バレル構造]]が形成される。これらの結果から、commissural plate から分泌されるFGF8の濃度勾配が大脳皮質原基の前後軸パターン化を制御していることが示唆された<ref name=ref13><pubmed>11567107</pubmed></ref>。 | 二次前脳胞の背側から腹側にかけての領域からは、将来の[[大脳皮質]]、[[線条体]]、[[淡蒼球]]、[[視床下部]]が派生する。脳胞形成後の終脳先端正中部に位置するcommissural plateにはFGF8が発現している (図2)。FGF8をマウス大脳皮質原基の前方領域に発現させると、本来前方に位置する領野が後方へとシフトする。一方、FGF8を大脳皮質原基の後方領域に発現させると鏡像対称な[[体性感覚野]][[バレル構造]]が形成される。これらの結果から、commissural plate から分泌されるFGF8の濃度勾配が大脳皮質原基の前後軸パターン化を制御していることが示唆された<ref name=ref13><pubmed>11567107</pubmed></ref>。 | ||
| 82行目: | 74行目: | ||
== 参考文献 == | == 参考文献 == | ||
<references /> | <references /> | ||
(執筆者:高橋将文 担当編集委員:村上富士夫) | |||
2013年3月23日 (土) 23:31時点における版
英語名:antero-posterior axis、rostral-caudal axis 独:anteroposterioren Achse、rostrokaudalen Achse 仏:axe antéro-postérieur、axe rostro-caudal
オーガナイザーにより外胚葉から誘導された初期神経板の性質は、後方化シグナル分子の濃度勾配にしたがって、前後軸に沿った異なる性質をもつ領域へと変換される。さらに、二次シグナリングセンターからのシグナル分子の作用により、各脳領域には特徴的な前後軸パターンが形成される。
神経誘導と前後軸パターン形成モデル
前後軸は、神経の発生において最も早く確立される軸である。シュペーマンらによる神経外胚葉の誘導現象の発見は、その後の前後軸形成機構の研究に大きな影響を与えた。
1920年代後半、シュペーマンとヒルデ・マンゴルトは両生類胚を用いて、中枢神経系の前後軸パターン形成に関わる重要な領域を明らかにした[1]。イモリ初期原腸胚の原口背唇部を本来神経組織に分化しない表皮外胚葉に移植すると、完全な頭部と胴部を含む二次軸が誘導された。後期原腸胚の原口背唇部を表皮外胚葉に移植すると、頭部が欠損した胴尾部組織が異所的に生じた。シュペーマンらはこのような実験結果に基づき、外胚葉から神経組織(神経外胚葉)を誘導する活性をもつ原口背唇部を、オーガナイザー(形成体)と名付けた。特に、初期原腸胚の原口背唇部は頭部オーガナイザー、後期原腸胚の原口背唇部は尾部オーガナイザーと呼ばれている。神経外胚葉は中枢神経系の原基である神経板を形成し、原口背唇部からは、その後神経外胚葉下を前方向に移動する中内胚葉(mesendoderm)細胞および中胚葉 (mesoderm) 細胞が派生する。先に移動する中内胚葉細胞は脊索前板を形成し、それに続き移動する中胚葉細胞は脊索を形成する。
オットー・マンゴルトは1930年代前半に、前方神経板下の中内胚葉細胞を表皮外胚葉領域に移植すると頭部が誘導され、後方神経板下の中胚葉細胞を表皮外胚葉領域に移植すると胴体および尾部が誘導されることを示した。このようなことから、初期原腸胚の原口背唇部は頭部オーガナイザー、後期原腸胚の原口背唇部は尾部オーガナイザーと呼ばれている。これら一連の実験から、原口背唇部の神経誘導活性は時間とともに性質が変化し、オーガナイザー細胞が前方へ移動する過程において、オーガナイザーとの接触により異なるシグナルを受け取った外胚葉には、前後軸に沿って異なる性質をもつ領域が形成されると考えられた。
1990年代前半、ついに、二次軸を誘導するオーガナイザー因子として、ノギン(Noggin)、コーディン(Chordin) およびフォリスタチン(Follistatin) が同定された。これらの分子は、頭部・尾部オーガナイザーやそれらに由来する中内胚葉細胞や中胚葉細胞に発現し、表皮外胚葉から分泌される骨形成タンパク質(bone morphogenetic protein: BMP) がもつ神経抑制作用を打ち消すことで、外胚葉から神経外胚葉を誘導することができる[1]。
また、頭部オーガナイザーおよびそれに由来する前方内胚葉細胞には、頭部誘導活性をもつCerberusやDkkが発現することが明らかにされた。CerberusはNodalシグナル、Wntシグナル、およびBMPシグナルの阻害分子であり、DkkはWntシグナル阻害分子である。これらは、前方神経板に作用し、神経板の後方化を抑制している。ChordinとDkkを共に表皮外胚葉に発現させたときのみ、頭部と胴部を含む二次軸が形成されることから、両生類では、頭部誘導に関しては、Wntシグナル阻害分子とBMP阻害分子との協調的作用が必要であると考えられている。
ニューコープは1950年代前半に、両生類胚を用いた前後軸形成に関する移植実験を行った。外胚葉断片を初期原腸胚の神経板の前後の様々な場所に挿入したところ、移植片において、前方の性質(前脳)はどの位置に挿入した場合でも誘導された。一方、移植片を神経板の後方部に挿入した場合にのみ、移植片に後方の性質が誘導された。これらのことから、ニューコープは中枢神経系の前後軸パターン化に関する活性化-形質変換(activation-transformation)モデルを提唱した[1]。第一段階として、原口背唇部の細胞が分泌するシグナル分子が、外胚葉を神経外胚葉へと活性化し、神経板に前脳に相当する領域の性質を与える。第二段階として、トランスフォーマーと呼ばれる後方化分子が、胚の後方領域から分泌される。そして、後方化分子は神経板内を平行に移動し、その濃度勾配が神経板の前後軸に沿って形成される。その結果、初期神経板の性質は後方化分子の濃度に依存して、中脳、後脳および脊髄の性質へと変換されるという考え方である。
現在では、Wntなどのトランスフォーマーの性質を満たす後方化分子が同定されており、シュペーマンらのオーガナイザーとニュークープのモデルの両者を重ね合わせたものが、現代の神経発生生学における前後軸形成機構の基礎となっている[1]。
神経板の前方化
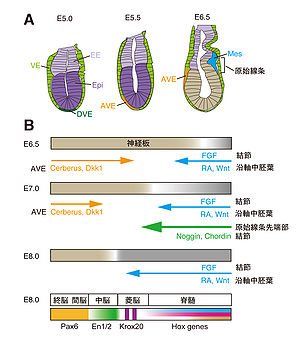
(A) マウス初期胚におけるシグナリングセンター ([2]を基に作成) (B) マウス神経板における前後軸パターン形成 ([3]を参考に作成) VE, visceral endoderm; DVE, distal visceral endoderm; Epi, epiblast; EE, extra embryonic endoderm; AVE, anterior visceral endoderm; Mes, mesoderm
ニワトリ胚やマウス胚においは、原腸陥入以前の胚盤葉上層(エピブラスト epiblast)には、神経系マーカー遺伝子(Sox3、Sox1)と前脳および中脳マーカー遺伝子(Otx2)が発現している[1]。したがって、これらの種における初期神経板は前方神経の性質をもつと考えられており、ニューコープのモデルにおける活性化の段階に相当するように思われる[1]。
胚盤葉上層の神経前方化に関わる領域として、ニワトリ胚の胚盤葉下層(hypoblast)やマウス胚の前方臓側内胚葉(anterior visceral endoderm:AVE)が重要である。ニワトリ胚の胚盤葉下層の細胞を別の胚に異所的に移植すると、エピブラストにOtx2やSox3の発現が一過的に誘導される[1]。マウス胚においてAVE細胞(図1)を除去すると、神経板における前脳マーカー遺伝子の発現が消失する。また、AVE細胞に発現するHex、Hesx1、Otx2、Lim1遺伝子は、正常な前脳形成に必須である[1] [2](注:AVEは遠位臓側内胚葉 (distal visceral endoderm: DVE) が前方へ移動したものであると考えられてきたが、AVEはDVEと異なる細胞系譜をもつことが最近明らかになった[4]。DVE はAVEの前方移動をガイドするために必要とされる。)。AVE細胞は両生類の頭部オーガナイザーと同様に、CerberusやDkk1 を発現する。Cerberusは後方から分泌されるNodalによって、前方に原始線条が形成されないように抑制的に働く。また、CerberusやDkk1は後方化シグナルとして働くWntシグナルを阻害することで、前方神経板の確立や維持に関わっている[2] [3]。
ニワトリ胚やマウス胚において、二次軸誘導能をもち、両生類のオーガナイザー領域に相当する場所は、原始線条 (primitive streak) 先端部および原始線条の先端部から時期を追って形成される結節(ノードnode)と呼ばれる領域である。これらの領域にはBMPシグナル阻害分子であるNogginやChordinが発現している。NogginとChordinの二重変異マウス胚においては、DKK1の変異マウスで見られる頭部欠損と類似し、前脳領域が形成されない。したがって、マウス胚においては、AVE領域とオーガナイザー領域の両者が、前方神経領域の確立に必要であると考えられる。また、CerberusやDkk1は、オーガナイザー領域に由来する中内胚葉細胞(脊索前板 prechordal plate)にも発現しており、中内胚葉細胞からのシグナルも、前方神経板のパターン化に寄与している[5]。
神経板の後方化
(A) 菱脳の分節構造(ロンボメア)ラット胎齢10.75日胚の切片(DAPI染色)
(B) Hox遺伝子の発現境界と分節境界との関係
ニワトリ胚やマウス胚において、両生類胚の尾部オーガナイザーに相当する領域は、原始線条の先端部から時期を追って形成される結節(ノード node)と呼ばれる領域である。
原始線条や結節には線維芽細胞増殖因子8(fibroblast growth factor 8: FGF8) が発現している。ニワトリ初期神経板前方領域の組織片にFGF8を添加し、しばらく培養すると、FGF8の濃度依存的に中脳や菱脳前方領域の性質が誘導される[6]。このような脳の領域は、前後軸に沿って発現する転写制御因子の発現を指標にすることで区別可能である。例えば、前脳ではPax6、中脳ではEngrailed 1/2 (En1/2)、菱脳ではKrox20、菱脳・脊髄では各種ホックス(Hox) 遺伝子が発現する(図1)。このような一連の実験から、初期神経板には前後軸に沿ってFGF8の濃度勾配が形成され、FGF8は神経板の後方化シグナル分子として機能することが明らかとなった。
また、後方沿軸中胚葉(paraxial mesoderm)で合成されるレチノイン酸(retinoic acid: RA)は、初期神経板に菱脳後方および脊髄の性質を誘導する後方化シグナル分子である[6]。また、レチノイン酸は、胚後方部からのFGF8と拮抗することで、ニューロン分化を促進し、FGF8は後方部の未分化領域(stem cell zone)の維持においても必要である[7]。初期神経板に近接する沿軸中胚葉から分泌されるWntは、初期神経板の性質を濃度依存的に中脳・菱脳・脊髄の全ての性質に変換することができる後方化シグナル分子である(図1)[6]。
Hox遺伝子群はショウジョウバエで見いだされた一連の体軸形成制御遺伝子群(ホメオティック遺伝子)の相同遺伝子であり、頭尾方向の体軸を形成する根幹的な遺伝子である[8]。これらの遺伝子は菱脳・脊髄原基においても、前後軸に沿った発現境界を示し、前後軸に沿ったパターン化に関与している(図1, 2) [9]。FGF8は、Cdxの発現誘導を介して、Hox遺伝子の発現を制御している[9]。また、レチノイン酸は前後軸に沿ったHox遺伝子の発現誘導やそれらの発現境界の確立に関与している[9]。WntはFGFやレチノイン酸との協調的作用によりHox遺伝子の発現制御に関わる[9]。
各脳領域における前後パターン形成
菱脳
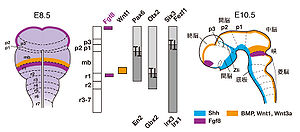
マウス胚胎齢8.5日と10.5日における脳の区画化
p1-3, prosomere 1-3; mb, midbrain; r1-7, rhombomere 1-7; ANR, anterior neural ridge; MHB, midbrain hindbrain boundary; Zli, zona limitance intrathalamica
神経板の前後軸極性の確立にともない、初期脳原基にはニューロメア(neuromere)と呼ばれる分節構造が形成される。分節の形成は、神経管を構成する神経上皮細胞の形態変化によって引き起こされ、神経管の基底膜側におけるくびれとして認識される。そのくびれの位置における神経管の脳室面側では、逆に隆起が見られる。菱脳ではロンボメア(rhombomere)と呼ばれる分節が存在する(図2)[5]。Hox遺伝子群の発現は、第一分節には見られないが、第二分節より後方では、Hox遺伝子群の発現前方境界が、ロンボメア間の境界と一致している(図2)。発生初期段階のマウス胚やニワトリ胚にレチノイン酸を投与すると、菱脳におけるHox遺伝子の発現境界が前方へシフトする(もともとHox遺伝子の発現がロンボメアの境界と符号しているとの説明がないので解りにくいかも知れません。村上)。またレチノイン酸が欠乏した胚では、菱脳におけるHox遺伝子の発現境界が後方にシフトする。これらのことから、生体内では、菱脳後方から前方に向かって形成されるレチノイン酸の濃度勾配が、菱脳の前後パターン形成に関与すると考えられている[5]。
また、中脳・後脳境界(midbrain hindbrain boundary: MHB)の後脳側に発現するFGF8の作用により、菱脳第一分節は小脳へと運命づけられる[5]。各ロンボメア間では、エフリン (ephrin) やエフリン受容体 (Eph) による反発作用により境界を超えて前後に細胞が混じり合わない(注: 細胞移動が起こらない境界で囲まれた領域はコンパートメントと呼ばれ、コンパートメント間の境界はコンパートメント境界と呼ばれている)。さらに、ロンボメア境界付近の細胞は、ロンボメア境界細胞(rhombomere boundary cell)と呼ばれる特殊化した細胞群に変化し、FGFやWntなどのシグナル分子を前後軸方向に分泌し、近接する細胞の神経分化を制御するシグナリングセンターとして機能することが示唆されている[5]。
中脳
鳥類胚において、間脳背側の組織を中脳・後脳境界の前方へ移植すると、移植片は中脳へ分化する。また、中脳・後脳境界の組織を間脳に移植すると移植片の周囲の組織が中脳へ転換する。このような一連の実験から、中脳・後脳境界は中脳をパターン化するシグナリングセンターであり、FGF8がその機能を担うことが明らかとなった[5]。中脳・後脳境界の中脳側に発現するWnt1も小脳領域の形成に重要である(図2)[5]。中脳の前後極性形成には転写因子En1/2 の発現勾配が重要であり、その勾配は、網膜から中脳視蓋への視神経の投射パターンの決定に重要な位置情報を与えている[10]。中脳・後脳境界は中脳側に発現する転写因子Otx2と菱脳側に発現する転写因子Gbx2による相互抑制作用によって決定され、シャープな発現境界が形成される(図2)[5]。
前脳
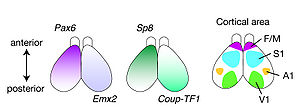
大脳皮質原基における遺伝子発現 ([11]を基に作成) F/M, prefrontal/motor cortex (前頭前皮質/運動野); S1, primary somatosensory cortex (一次体性感覚野); A1,primary auditory cortex (一次聴覚野); V1, primary visual cortex (一次視覚野)
前脳は間脳と終脳に分けられる。予定前脳領域神経板において非神経外胚葉と接する狭い領域は、前方神経境界領域 (anterior neural boundary: ANBまたはanterior neural ridge: ANR) と呼ばれている。この領域に発現するシグナリング分子FGF8は、近接する側方前脳領域において、脳形成に重要な転写因子BF1の発現を誘導する。したがって、前方神経境界領域は、前後軸が決定された後、さらに前脳をパターン化するためのシグナリングセンターとして重要である [5]。 ロンボメア形成や各々のHox遺伝子の発現境界が前後にずれていることは、菱脳の前後軸に沿った機能の違いを生み出すための重要なメカニズムであるが、前脳にも分節構造が存在するのかどうかは、前脳の多様な機能を考える上で、重要な問題であった。ルービンシュタインらは、ショウジョウバエの頭部形成に関わるホメオボックス転写因子の脊椎動物ホモログ遺伝子の発現をマウス胚前脳において調べ、個々遺伝子が前後軸に沿っていくつかの決まった位置に発現境界を示すことを発見した。このような遺伝子発現様式に基づき、前脳には前後軸に沿って6つの分節(プロソメア)(p1からp6) が存在するとするプロソメアモデル(prosomeric model)が提唱された[12]。このモデルでは、p1-p3は視床を形成する間脳後方領域に相当し、p4-p6は間脳前方領域(視床下部)と終脳を形成する二次前脳胞(secondary procencephalon)に相当する。その後、視床と視床下部の区画に関する研究が進展し、p3に含まれる領域の変更と視床下部におけるプロソメア境界が再検討され、初期モデルのp4-p6領域は一区画に修正されている[13](図2)。p2/p3境界は、Six3およびFezf1/2の後方発現境界とIrx3の前方発現境界に一致している[5]。Six3やFezf1/2はp2/3境界形成に必須の遺伝子である(図2)[5]。p2/p3境界にはソニックヘッジホッグ(sonic hedgehog: Shh) を発現するZli 領域 (zona limitance intrathalamica)が形成され、間脳原基から生じる視床の前後軸パターン化に関与している[5](図2)。間脳・中脳境界は、間脳後部に発現するPax6と中脳に発現するEn2の相互抑制機構により確立される(図2)。
二次前脳胞の背側から腹側にかけての領域からは、将来の大脳皮質、線条体、淡蒼球、視床下部が派生する。脳胞形成後の終脳先端正中部に位置するcommissural plateにはFGF8が発現している (図2)。FGF8をマウス大脳皮質原基の前方領域に発現させると、本来前方に位置する領野が後方へとシフトする。一方、FGF8を大脳皮質原基の後方領域に発現させると鏡像対称な体性感覚野バレル構造が形成される。これらの結果から、commissural plate から分泌されるFGF8の濃度勾配が大脳皮質原基の前後軸パターン化を制御していることが示唆された[14]。
また、大脳皮質原基の前方ではPax6, Sp8の発現が高く、後方ではEmx2, Couptf1の発現が高く、FGF8 はEmx2の発現を抑制する。これらの転写因子の遺伝子変異マウスの大脳皮質では、領野の位置や大きさが前後軸に沿って変化することから、これらの転写因子は、大脳皮質における各領野の位置を決定するパターン化因子として機能している (図3) [11]。
関連項目
参考文献
- ↑ 1.0 1.1 1.2 1.3 1.4 1.5 1.6 1.7
Stern, C.D. (2001).
Initial patterning of the central nervous system: how many organizers? Nature reviews. Neuroscience, 2(2), 92-8. [PubMed:11252999] [WorldCat] [DOI] - ↑ 2.0 2.1 2.2
Arkell, R.M., & Tam, P.P. (2012).
Initiating head development in mouse embryos: integrating signalling and transcriptional activity. Open biology, 2(3), 120030. [PubMed:22754658] [PMC] [WorldCat] [DOI] - ↑ 3.0 3.1
Rallu, M., Corbin, J.G., & Fishell, G. (2002).
Parsing the prosencephalon. Nature reviews. Neuroscience, 3(12), 943-51. [PubMed:12461551] [WorldCat] [DOI] - ↑
Takaoka, K., Yamamoto, M., & Hamada, H. (2011).
Origin and role of distal visceral endoderm, a group of cells that determines anterior-posterior polarity of the mouse embryo. Nature cell biology, 13(7), 743-52. [PubMed:21623358] [WorldCat] [DOI] - ↑ 5.00 5.01 5.02 5.03 5.04 5.05 5.06 5.07 5.08 5.09 5.10
Kiecker, C., & Lumsden, A. (2012).
The role of organizers in patterning the nervous system. Annual review of neuroscience, 35, 347-67. [PubMed:22462542] [WorldCat] [DOI] - ↑ 6.0 6.1 6.2
Nordström, U., Jessell, T.M., & Edlund, T. (2002).
Progressive induction of caudal neural character by graded Wnt signaling. Nature neuroscience, 5(6), 525-32. [PubMed:12006981] [WorldCat] [DOI] - ↑
Diez del Corral, R., & Storey, K.G. (2004).
Opposing FGF and retinoid pathways: a signalling switch that controls differentiation and patterning onset in the extending vertebrate body axis. BioEssays : news and reviews in molecular, cellular and developmental biology, 26(8), 857-69. [PubMed:15273988] [WorldCat] [DOI] - ↑
Young, T., & Deschamps, J. (2009).
Hox, Cdx, and anteroposterior patterning in the mouse embryo. Current topics in developmental biology, 88, 235-55. [PubMed:19651307] [WorldCat] [DOI] - ↑ 9.0 9.1 9.2 9.3
Nordström, U., Maier, E., Jessell, T.M., & Edlund, T. (2006).
An early role for WNT signaling in specifying neural patterns of Cdx and Hox gene expression and motor neuron subtype identity. PLoS biology, 4(8), e252. [PubMed:16895440] [PMC] [WorldCat] [DOI] - ↑
Itasaki, N., & Nakamura, H. (1992).
Rostrocaudal polarity of the tectum in birds: correlation of en gradient and topographic order in retinotectal projection. Neuron, 8(4), 787-98. [PubMed:1348950] [WorldCat] [DOI] - ↑ 11.0 11.1
O'Leary, D.D., & Sahara, S. (2008).
Genetic regulation of arealization of the neocortex. Current opinion in neurobiology, 18(1), 90-100. [PubMed:18524571] [PMC] [WorldCat] [DOI] - ↑
Rubenstein, J.L., Martinez, S., Shimamura, K., & Puelles, L. (1994).
The embryonic vertebrate forebrain: the prosomeric model. Science (New York, N.Y.), 266(5185), 578-80. [PubMed:7939711] [WorldCat] [DOI] - ↑
Puelles, L., & Rubenstein, J.L. (2003).
Forebrain gene expression domains and the evolving prosomeric model. Trends in neurosciences, 26(9), 469-76. [PubMed:12948657] [WorldCat] [DOI] - ↑
Fukuchi-Shimogori, T., & Grove, E.A. (2001).
Neocortex patterning by the secreted signaling molecule FGF8. Science (New York, N.Y.), 294(5544), 1071-4. [PubMed:11567107] [WorldCat] [DOI]
(執筆者:高橋将文 担当編集委員:村上富士夫)