「シナプス前終末」の版間の差分
細編集の要約なし |
|||
| (他の1人の利用者による、間の1版が非表示) | |||
| 4行目: | 4行目: | ||
<font size="+1">[http://researchmap.jp/tomohirano 平野 丈夫]</font><br> | <font size="+1">[http://researchmap.jp/tomohirano 平野 丈夫]</font><br> | ||
''京都大学 大学院理学研究科''<br> | ''京都大学 大学院理学研究科''<br> | ||
DOI XXXX/XXXX 原稿受付日:2012年4月4日 原稿完成日:2013年9月10日<br> | |||
担当編集委員:[http://researchmap.jp/2rikenbsi 林 康紀](独立行政法人理化学研究所 脳科学総合研究センター)<br> | 担当編集委員:[http://researchmap.jp/2rikenbsi 林 康紀](独立行政法人理化学研究所 脳科学総合研究センター)<br> | ||
</div> | </div> | ||
| 66行目: | 66行目: | ||
例えば、シナプス後細胞に入力する[[興奮性]]シナプス前終末上に[[抑制性]]シナプスが作られ、興奮性シナプスからの伝達物質放出を抑制することで、シナプス伝達を調節する[[シナプス前抑制]]が知られている。 | 例えば、シナプス後細胞に入力する[[興奮性]]シナプス前終末上に[[抑制性]]シナプスが作られ、興奮性シナプスからの伝達物質放出を抑制することで、シナプス伝達を調節する[[シナプス前抑制]]が知られている。 | ||
シナプス後細胞から放出される[[逆行性伝達物質]]によっても、シナプス前終末からの伝達物質放出は制御される<ref><pubmed>19640475</pubmed></ref>。逆行性シナプス伝達制御の1つに[[ | シナプス後細胞から放出される[[逆行性伝達物質]]によっても、シナプス前終末からの伝達物質放出は制御される<ref><pubmed>19640475</pubmed></ref>。逆行性シナプス伝達制御の1つに[[DSI]] ([[Depolarization-induced suppression of inhibition]])がある。DSIは、シナプス後細胞が脱分極することにより、そこから[[エンドカンナビノイド]]が放出され、抑制性シナプス前終末にある[[カンナビノイド受容体]]に作用することで、シナプス前終末からのシナプス小胞の放出確率が低下する現象である。 | ||
==関連項目== | ==関連項目== | ||
2013年9月11日 (水) 09:33時点における版
山下 愛美
同志社大学 脳科学研究科シナプス分子機能部門
平野 丈夫
京都大学 大学院理学研究科
DOI XXXX/XXXX 原稿受付日:2012年4月4日 原稿完成日:2013年9月10日
担当編集委員:林 康紀(独立行政法人理化学研究所 脳科学総合研究センター)
英語名;presynaptic terminal 独:präsynaptische Endigung 仏:terminaison présynaptique
同義語:シナプス終末、シナプス末端、シナプス前部、軸索終末、軸索終止
神経細胞の軸索の先端は、他の細胞と接触してシナプスを形成する。軸索終末のシナプス結合部はやや膨大しており、これをシナプス前終末と呼ぶ。シナプス前終末には神経伝達物質を貯蔵しているシナプス小胞、伝達物質の放出にかかわるSNAREタンパク質、電位依存性のカルシウムチャネル、神経伝達物質を回収するためのトランスポーター等が存在する。こうした分子の働きにより、シナプス前終末に活動電位が到達すると、神経伝達物質が放出される。
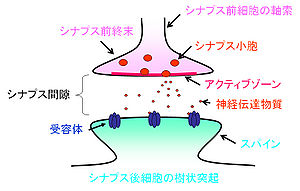
軸索のシナプス前終末から、シナプス後細胞の樹状突起にあるスパインへ情報が伝えられる。シナプス前細胞と後細胞の間にはシナプス間隙(20 nm)があり、情報伝達の場を形成している。神経伝達物質を含んだシナプス小胞(50 nm)がシナプス前終末内には集積しており、シナプス小胞はアクティブゾーンの細胞膜と融合し、内在する神経伝達物質を放出する。
構造
神経細胞はシナプスという構造を介して情報の伝達を行っている[1]。神経細胞は情報を受容する細胞体と樹状突起、情報を出力する軸索から成る。軸索のシナプス結合部はやや膨大しており、シナプス前終末と呼ばれる。グルタミン酸を神経伝達物質とする興奮性シナプスでは、シナプス前終末からシナプス後細胞の樹状突起上のスパインへ情報が伝えられる(図1)。一方、GABAを伝達物質とする抑制性シナプス前終末は、樹状突起の幹および細胞体に接合する。シナプス前細胞と後細胞の間にはシナプス間隙(20 nm)があり、情報伝達の場を形成している。
シナプス前終末の中には数百のシナプス小胞(50 nm)が存在する。シナプス小胞がシナプス前終末の細胞膜と融合し、その中の神経伝達物質を開口放出(エクソサイトーシス;exocytosis)する領域はアクティブゾーンと呼ばれる。中枢シナプスにおけるアクティブゾーンは0.03-0.14 μm2の広さで[2][3]、膜が肥厚しており、5-10個のシナプス小胞が結合している(図2)。
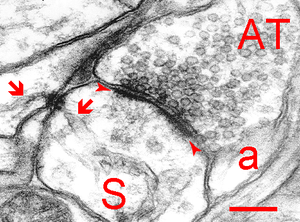
AT:軸索終末、a:星状膠細胞、矢頭間:PSD、S:樹状突起棘、矢印:小胞体、スケールバー:200 nm。ヒト大脳皮質。Synapsewebより。許可を得て転載。

活動電位がシナプス前終末に到達すると、シナプス前終末の膜電位は脱分極し、電位依存性カルシウムチャネルからカルシウムイオンが流入する。それが引き金となり、アクティブゾーン上のシナプス小胞が膜融合して、神経伝達物質がシナプス間隙に開口放出される。放出された神経伝達物質はシナプス後細胞にある受容体に結合する。シナプス間隙に残存した神経伝達物質はトランスポーターによってシナプス前終末に再取り込みされ、シナプス小胞に充填される。
伝達物質放出過程

シナプス小胞にはシナプトブレビンが(v-SNARE)、細胞膜にはシンタキシンとSNAP-25が(t-SNARE)あり、それらが複合体を形成し、膜融合を促す。
シナプス小胞の形成
シナプス小胞は、小胞膜上のトランスポーターのはたらきで神経伝達物質を内部に取り込む。まず液胞型プロトンポンプが小胞内を酸性にし、膜を介した電気化学的勾配を作る。これが伝達物質取り込みのためのエネルギー源となり、選択的トランスポーターにより伝達物質は小胞内部に取り込まれる。シナプス前終末細胞質に存在する神経伝達物質は、低親和性の小胞型トランスポーターによりシナプス小胞に充填される。例えばグルタミン酸およびGABAの場合は、それぞれの小胞型トランスポーターであるvglut、vgatが各々のシナプス小胞膜に局在している。
シナプス小胞は、その状態に応じて、即時放出可能プール(readily releasable pool, RRP)・再循環プール(recycling pool)・静止プール(resting pool, RP)に分類される。即時放出可能プールと再循環プールを合わせて、全放出可能プールあるいは全リサイクリングプール(total recycling pool, TRP)と呼ばれる。また、再循環プールと静止プールを貯蔵プール(reserve pool)と呼ぶこともある。
詳細は「放出可能プール」の項目参照。
アクティブゾーンへの移動とドッキング
神経伝達物質が詰め込まれた小胞はアクティブゾーンに移動し、細胞膜に結合した状態になる(docking)。アクティブゾーン特異的質として、RIM1(Rab3-interacting molecules 1), Munc13等が知られている。Munc13はシナプス小胞のprimingに関与し、カルシウムイオンとRIM1によって制御を受ける。RIM1は、アクティブゾーンに存在する多くのタンパク質と直接あるいは間接的に結合し、アクティブゾーンの形成や機能において重要な役割を担っている[4]。次に、結合したシナプス小胞は、カルシウム依存的に細胞膜と融合できる状態になる(priming)。
アクティブゾーンには他に、RIM結合タンパク質 (RIMs binding protein)、α-リプリン、ピッコロ、バソン、ELKS (Rab6-interacting protein, CAST, ERC)、CASK、Mintなどのタンパク質も局在している。また、辺縁には細胞接着分子であるニューレキシン・カドヘリン・エフリン・SynCAMなどがあり、それぞれシナプス後部にあるニューロリジン・カドヘリン・Eph受容体・SynCAM等と結合することにより、シナプス構造の形成および神経伝達物質の放出機能の発現と制御に関与していると考えられる[5]。
カルシウム流入
シナプス前細胞の細胞体からシナプス前終末へ活動電位が到達すると、膜電位が脱分極して電位依存性カルシウムチャネルが開き、シナプス前終末内へカルシウムイオンが流入し、それが引き金となってシナプス小胞内の神経伝達物質が開口放出される。
シナプス前終末には複数種の電位依存性カルシウムチャネルが集積している。P/Q (Cav2.1)、N (Cav2.2)、R (Cav2.3)タイプのカルシウムチャネルがシナプス伝達に寄与すると考えられている[6]。しかし、シナプスによって各カルシウムチャネルのシナプス伝達への寄与率は異なり、また発生に伴って変化する[7]。
シナプス前終末内に流入したカルシウムイオンは、シナプス小胞膜上のカルシウム作動性タンパク質であるシナプトタグミンに結合する。
膜融合と開口放出
カルシウムイオンと結合したシナプトタグミンの構造変化が、アクティブゾーンに接しているシナプス小胞の膜融合を促し、シナプス小胞内の神経伝達物質がシナプス間隙へ開口放出される。シナプス前終末にある即時放出可能プールのシナプス小胞は、活動電位の発生に応じて、各々が確率的に放出されると考えられる。神経伝達物質は拡散によりシナプス後部にある受容体に到達して結合し、情報が伝達される。
膜融合に関して、SNARE仮説が提唱されている。これまでN-ethylmaleimide-sensitive fusion protein (NSF)とsoluble NSF attachment protein (SNAP)は、ゴルジ体膜間の小胞輸送に必須な細胞質タンパク質と知られてきていた。これらのタンパク質は、2つの対峙した生体膜上に存在する受容体であるSNAREタンパク質(SNAP受容体)と相互作用することで、膜の融合を促すと考えられている。SNAREタンパク質は、融合する双方の膜表面に分かれた形で存在し、複合体を形成することによって膜間の距離を縮め、その結果として膜融合が引き起こされる。一方、小胞、細胞膜に存在するSNAREタンパク質は、各々v-SNARE、t-SNAREと名づけられた。
シナプス前終末においては、シナプス小胞上のシナプトブレビン(VAMP; vesicle-associated membrane protein)がv-SNAREであり、アクティブゾーン細胞膜にあるシンタキシンとSNAP-25(synaptosomal associated protein-25)がt-SNAREに相当する[8]。SNARE複合体が、シナプスでの開口放出に中心的かつ必須な役割を果たすが、個々のSNAREタンパク質やSNARE複合体に相互作用するさまざまなタンパク質群が、いかに開口放出の時間的空間的制御に関わっているのかはまだよくわからない。前述したシナプス小胞上のシナプトタグミンは、開口放出のカルシウムセンサーとしてはたらいて開口放出を制御するが、そのメカニズムは明確ではない[9]。
リサイクリング
開口放出により細胞膜へ移行したシナプス小胞膜は、その後エンドサイトーシスによりシナプス前終末に取り込まれ、シナプス小胞として再利用される。また、シナプス間隙に残存する神経伝達物質は、高親和性の細胞膜トランスポーターによりシナプス前終末へ再取り込みされる。
シナプス小胞放出の調節
シナプス小胞の放出確率は、シナプス前終末に存在する種々の受容体によって制御を受ける。
例えば、シナプス後細胞に入力する興奮性シナプス前終末上に抑制性シナプスが作られ、興奮性シナプスからの伝達物質放出を抑制することで、シナプス伝達を調節するシナプス前抑制が知られている。
シナプス後細胞から放出される逆行性伝達物質によっても、シナプス前終末からの伝達物質放出は制御される[10]。逆行性シナプス伝達制御の1つにDSI (Depolarization-induced suppression of inhibition)がある。DSIは、シナプス後細胞が脱分極することにより、そこからエンドカンナビノイドが放出され、抑制性シナプス前終末にあるカンナビノイド受容体に作用することで、シナプス前終末からのシナプス小胞の放出確率が低下する現象である。
関連項目
- シナプス
- 神経伝達物質
- シナプス小胞
- カルシウムチャネル
- トランスポーター
- 活動電位
- エクソサイトーシス
- アクティブゾーン
- RIM1
- シナプトタグミン
- 放出可能プール
- 放出確率
- ニューレキシン
- シナプス前抑制
- Depolarization-induced suppression of inhibition
参考文献
- ↑ D Purves, GJ Augustine, D Fitzpatrick, WC Hall, AS LaMantia, JO McNamara, and LE White
Neuroscience, Fourth Edition
Sinauer:2011
- ↑
Sätzler, K., Söhl, L.F., Bollmann, J.H., Borst, J.G., Frotscher, M., Sakmann, B., & Lübke, J.H. (2002).
Three-dimensional reconstruction of a calyx of Held and its postsynaptic principal neuron in the medial nucleus of the trapezoid body. The Journal of neuroscience : the official journal of the Society for Neuroscience, 22(24), 10567-79. [PubMed:12486149] [PMC] [WorldCat] - ↑
Schikorski, T., & Stevens, C.F. (1999).
Quantitative fine-structural analysis of olfactory cortical synapses. Proceedings of the National Academy of Sciences of the United States of America, 96(7), 4107-12. [PubMed:10097171] [PMC] [WorldCat] [DOI] - ↑
Südhof, T.C., & Rizo, J. (2011).
Synaptic vesicle exocytosis. Cold Spring Harbor perspectives in biology, 3(12). [PubMed:22026965] [PMC] [WorldCat] [DOI] - ↑
Südhof, T.C. (2012).
The presynaptic active zone. Neuron, 75(1), 11-25. [PubMed:22794257] [PMC] [WorldCat] [DOI] - ↑
Catterall, W.A., & Few, A.P. (2008).
Calcium channel regulation and presynaptic plasticity. Neuron, 59(6), 882-901. [PubMed:18817729] [WorldCat] [DOI] - ↑
Iwasaki, S., Momiyama, A., Uchitel, O.D., & Takahashi, T. (2000).
Developmental changes in calcium channel types mediating central synaptic transmission. The Journal of neuroscience : the official journal of the Society for Neuroscience, 20(1), 59-65. [PubMed:10627581] [PMC] [WorldCat] - ↑
Lin, R.C., & Scheller, R.H. (2000).
Mechanisms of synaptic vesicle exocytosis. Annual review of cell and developmental biology, 16, 19-49. [PubMed:11031229] [WorldCat] [DOI] - ↑
Kochubey, O., Lou, X., & Schneggenburger, R. (2011).
Regulation of transmitter release by Ca(2+) and synaptotagmin: insights from a large CNS synapse. Trends in neurosciences, 34(5), 237-46. [PubMed:21439657] [WorldCat] [DOI] - ↑
Regehr, W.G., Carey, M.R., & Best, A.R. (2009).
Activity-dependent regulation of synapses by retrograde messengers. Neuron, 63(2), 154-70. [PubMed:19640475] [PMC] [WorldCat] [DOI]