「足場タンパク質」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (同じ利用者による、間の2版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">清水 夕貴、[http://researchmap.jp/tanakasj 田中 慎二]、[http://researchmap.jp/shigeookabe 岡部 繁男]</font><br> | <font size="+1">清水 夕貴、[http://researchmap.jp/tanakasj 田中 慎二]、[http://researchmap.jp/shigeookabe 岡部 繁男]</font><br> | ||
''東京大学大学院医学系研究科''<br> | ''東京大学大学院医学系研究科''<br> | ||
DOI [[XXXX]]/XXXX 原稿受付日:2013年10月24日 原稿完成日:2013年月日<br> | |||
担当編集委員:[http://researchmap.jp/2rikenbsi 林 康紀](独立行政法人理化学研究所 脳科学総合研究センター)<br> | 担当編集委員:[http://researchmap.jp/2rikenbsi 林 康紀](独立行政法人理化学研究所 脳科学総合研究センター)<br> | ||
</div> | </div> | ||
| 50行目: | 50行目: | ||
===Munc13=== | ===Munc13=== | ||
Munc13-1から-4まで4種類のアイソフォームがあり、[[MUNC13相同性ドメイン]]が2つの[[C2ドメイン]]に挟まれた構造、二次メッセンジャーの[[ジアシルグリセロール]]や[[β−ホルボールエステル]]と結合するC1ドメインおよび[[カルモジュリン]]結合領域は全てに共通している | Munc13-1から-4まで4種類のアイソフォームがあり、[[MUNC13相同性ドメイン]]が2つの[[C2ドメイン]]に挟まれた構造、二次メッセンジャーの[[ジアシルグリセロール]]や[[β−ホルボールエステル]]と結合するC1ドメインおよび[[カルモジュリン]]結合領域は全てに共通している(ref)。短期の[[シナプス可塑性]]において神経伝達物質の放出を促進する働きがある(ref)。 | ||
===RIM=== | ===RIM=== | ||
RIMファミリーには[[Znフィンガー]]ドメイン、PDZドメイン、高プロリンSH3ドメイン結合領域の有無やC2ドメインの個数の違いにより6種類のアイソフォームが存在し、これらは様々なシナプスタンパク質と相互作用する事が知られている | RIMファミリーには[[Znフィンガー]]ドメイン、PDZドメイン、高プロリンSH3ドメイン結合領域の有無やC2ドメインの個数の違いにより6種類のアイソフォームが存在し、これらは様々なシナプスタンパク質と相互作用する事が知られている(ref)。ジンクフィンガードメインにはMunc13とシナプス小胞上に結合している[[Gタンパク質]]の[[Rab3]]が結合する部位がそれぞれ分かれて存在し、3つのタンパク質からなる複合体を形成する(ref)。この複合体はシナプス小胞を[[プライミング]]領域に運ぶ際に重要と考えられている(ref)。 | ||
===Bassoon、Piccolo=== | ===Bassoon、Piccolo=== | ||
BassoonおよびPiccoloはアクティブゾーンの中で最も大きなタンパク質である | BassoonおよびPiccoloはアクティブゾーンの中で最も大きなタンパク質である(ref)。ジンクフィンガードメイン、[[PBHドメイン|Piccolo bassoon homology (PBH)ドメイン]]、コルドコイルドメインが共通の配置で並んだよく似た構造を持ち、ともに[[ELKS]]と相互作用す(ref)る。Piccoloのみに見られる構造としては、高プロリン領域、PDZドメイン、C2ドメインがあり、PDZドメインとC2ドメインはそれぞれ[[cAMP-GEF2]]、[[L型電位依存性カルシウムチャネル]][[Cav 1.2]]と相互作用する事が知られている(ref)。この事からPiccoloはシナプス小胞のエンドサイトーシスとエキソサイトーシスを制御するシグナルをまとめる働きがあると考えられる(ref)。 | ||
===ELKS/CAST/ERC=== | ===ELKS/CAST/ERC=== | ||
| 63行目: | 63行目: | ||
<ref name=ref12><pubmed>15643447</pubmed></ref>より許可を得て転載。]] | <ref name=ref12><pubmed>15643447</pubmed></ref>より許可を得て転載。]] | ||
哺乳類では[[ELKS1A]]、[[ELKS1B]]、[[ELKS2]]の3種類がこのファミリーに含まれる(ref)。ELKSはという名称はこのタンパク質が多く含む[[グルタミン酸]](E)、[[wj:ロイシン|ロイシン]](L)、[[wj:リシン|リシン]](K)、[[wj:セリン|セリン]](S)から命名されている。いずれも4つのコイルドコイルドメインを持ち、この部分でリプリンα、Piccolo、Bassoonと結合する(ref)。またELKS1BとELKS2はC末端にRIM1αのPDZドメインと結合する領域が存在し、RIMを局在化させるのに必要なタンパク質であると考えられている(ref)。 | |||
==シナプス以外での足場タンパク質の機能== | ==シナプス以外での足場タンパク質の機能== | ||
受容体などの輸送においてそのタンパク質とモータータンパク質をつなぎ、アダプタータンパク質として機能する足場タンパク質が存在する。AMPA型グルタミン酸受容体のサブユニットである[[GluR2]]は[[KIF5]]によってシナプスに運ばれるが、このときGRIP1が二つをつないで複合体を形成しており、PSDに運ばれてからはAMPA型グルタミン酸受容体をシナプス後膜に固定する足場となる<ref | 受容体などの輸送においてそのタンパク質とモータータンパク質をつなぎ、アダプタータンパク質として機能する足場タンパク質が存在する。AMPA型グルタミン酸受容体のサブユニットである[[GluR2]]は[[KIF5]]によってシナプスに運ばれるが、このときGRIP1が二つをつないで複合体を形成しており、PSDに運ばれてからはAMPA型グルタミン酸受容体をシナプス後膜に固定する足場となる<ref ><pubmed>11986669</pubmed></ref>。またGRIP1はKIF5の方向性を定めて輸送をコントロールする働きがあるとも考えられている(ref)。 | ||
同様に抑制性シナプスの足場タンパク質であるゲフィリンもグリシン受容体が[[微小管]]を伝って膜上から取り除かれる際に、[[モータータンパク質]]である[[ダイニン軽鎖1]] ([[dynein light chain1]], [[Dlc1]])や[[ダイニン軽鎖2]] ([[dynein light chain2]], [[Dlc2]])との結合を仲介する役目がある<ref name=ref12 />。 | 同様に抑制性シナプスの足場タンパク質であるゲフィリンもグリシン受容体が[[微小管]]を伝って膜上から取り除かれる際に、[[モータータンパク質]]である[[ダイニン軽鎖1]] ([[dynein light chain1]], [[Dlc1]])や[[ダイニン軽鎖2]] ([[dynein light chain2]], [[Dlc2]])との結合を仲介する役目がある<ref name=ref12 />。 | ||
2013年11月11日 (月) 22:50時点における版
清水 夕貴、田中 慎二、岡部 繁男
東京大学大学院医学系研究科
DOI XXXX/XXXX 原稿受付日:2013年10月24日 原稿完成日:2013年月日
担当編集委員:林 康紀(独立行政法人理化学研究所 脳科学総合研究センター)
英語名:scaffold protein 独:Gerüstprotein 仏:protéine d'échafaudage
足場タンパク質とは、タンパク質複合体形成の足場となるタンパク質のことである。多くの場合、PDZドメインやSH3ドメインなどタンパク質同士の結合に関わる複数のドメインで構成される。シグナル伝達に関わる分子を結びつける機能があり、シグナル伝達経路の混線を防ぐとともに、構成するタンパク質の活性を触媒するなど細胞内シグナルの調節に重要な役割を果たす。また、タンパク質を適切に配置する足場として働く場合もある。特にシナプスには受容体、接着分子、シグナル分子など多様なタンパク質が存在するが、足場タンパク質が多様なタンパク質で構成される複合体を形成することで、シナプス構造や適切なシグナル伝達に重要な役割を果たしている。
足場タンパク質とは
足場タンパク質とは、タンパク質複合体形成の足場となるタンパク質のことである。多くの場合、PDZドメインやSH3ドメインなどタンパク質同士の結合に関わる複数のドメインで構成される。
主にシグナル伝達に関わる分子を結びつける機能があり、これによりシグナル伝達経路の混線を防ぐとともに構成するタンパク質の活性を触媒するなど細胞内シグナルの調節に重要な役割を果たす。また、シグナルの調節とは直接は関係なくタンパク質を適切に配置する足場として働く場合もある。ただし足場としての働きと触媒作用を併せ持つタンパク質が存在する事や適切な配置そのものがシグナルの伝達効率を上げるという事もあり、この二つの側面の厳密な区別は難しい[1]。
神経細胞同士の情報伝達を担う構造であるシナプスには受容体、接着分子、シグナル分子など多様なタンパク質が存在する。これらの分子は、足場タンパク質の働きで多様なタンパク質で構成される複合体を形成することで、シナプス構造や適切なシグナル伝達に重要な役割を果たしている。例えば、シナプス後部にはタンパク質が密集したシナプス後肥厚部(postsynaptic dendsity; PSD)が存在し、多くの足場タンパク質が集積している。シナプス後部における足場タンパク質は特に神経伝達物質受容体の配置を決めるうえで重要な役割を果たすと考えられている。
近年、光褪色後蛍光回復法(fluorescence recovery after photobleaching; FRAP)や単一粒子追跡法(single particle tracking; SPT)などの手法を用いたイメージング実験により、受容体タンパク質はシナプス外の膜上では早く拡散するが、シナプスでは固定されやすいことが示されている。この際、足場タンパク質が受容体の拡散速度を緩めて位置を定める事で受容体の安定性が保たれると考えられている[2]。
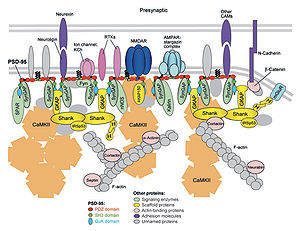
Reprinted, with permission, from the Annual Review of Biochemistry, Volume 76 © 2007 by Annual Reviews www.annualreviews.org
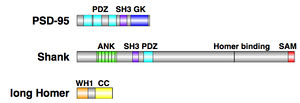
GK: グアニル酸キナーゼ相同性ドメイン、ANK: アンキリンリピートドメイン、SAM: Sterile alpha motifドメイン、CC: コイルドコイルドメイン
興奮性シナプス後部
興奮性シナプスのシナプス後部には抑制性シナプスの後部と比べて厚く複雑なPSDがあり、様々な足場タンパク質を含む(図1, 2)。興奮性ポストシナプスに含まれる主な足場タンパク質にはPSD-95、PSD-93、SAP97、SAP102、SHANK、CASK、GKAP、Homer、 GRIP1、densin-180などがある[4] [5]。
PSD-95
MAGUK(membrane-associated guanylate kinase homologs)ファミリー分子に属し、興奮性シナプスの主要な足場タンパク質の一つである。MAGUKファミリーの多くはPDZドメイン3つとSH3ドメイン、GKドメインから成るが、PSD-95もこの構造を持つ。興奮性シナプスのPSDに広く分布し、ニューロリギンやNMDA型グルタミン酸受容体、AMPA型グルタミン酸受容体など多くのタンパク質の足場となっている。
詳細はPSD-95の項を参照。
Shank
PSD-95と同じくPSDで多く見られ、PSD−95よりも細胞膜から離れた位置で広範囲に局在する足場タンパク質である。アンキリンリピートドメイン、SH3ドメイン、PDZドメイン、高プロリン領域、SAM(sterile alpha motif)ドメインからなり、それぞれのドメインを介してGKAP、Homer、GRIPといった足場タンパク質と結合しPSDの主要な構成要素となっている。また高プロリン領域でコルタクチン、αフォドリン、ABP1といったアクチン結合タンパク質と相互作用することでアクチン細胞骨格ともつながっている[6]。
詳細はShankの項を参照。
Homer
HomerはPDZドメインを持たない足場タンパク質である。EVH1ドメイン(WHドメイン)とロイシンジッパーのコルドコイルドメインから成るlong Homerとコルドコイルドメインを持たないshort Homerがあり、long HomerはCCドメインにより四量体を形成する[7]。HomerはEVH1ドメインを介してShankと結合しPSDの網目構造を複雑化してスパインの形態を維持する働きがある[8]。
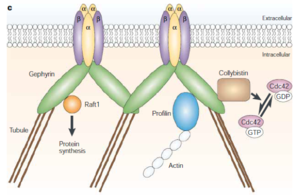
[9]より許可を得て転載。
抑制性シナプス後部
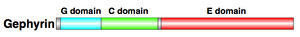
抑制性シナプス後部の主要な足場タンパク質としてゲフィリンが知られている(図3, 4)。ゲフィリンはEドメイン、Cドメイン、Gドメインの3つのドメインから成り、抑制性シナプスの後膜でグリシン受容体やGABA受容体のクラスターを形成している[10]。
シナプス前部
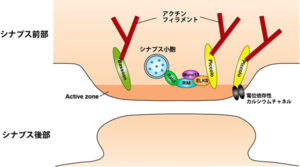
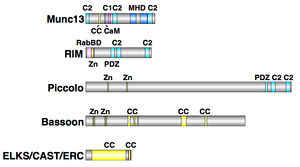
MHD: MUNC13相同性ドメイン、CaM: カルモジュリン結合領域、RabBD: Rab結合ドメイン、Zn: Znフィンガードメイン
シナプス前部に存在するアクティブゾーンも多くの足場タンパク質が含まれる[11] [12] [13](図5, 6)。これまでに解析されてきた主な足場タンパク質にはMunc13、RIM、Bassoon、Piccolo、ELKS/CAST/ERC、リプリンαがある。シナプス前膜ではシナプス小胞の放出と使用済みの小胞の回収が行われているが、足場タンパク質は小胞のエキソサイトーシスとエンドサイトーシスの制御に重要な役割を果たす。
Munc13
Munc13-1から-4まで4種類のアイソフォームがあり、MUNC13相同性ドメインが2つのC2ドメインに挟まれた構造、二次メッセンジャーのジアシルグリセロールやβ−ホルボールエステルと結合するC1ドメインおよびカルモジュリン結合領域は全てに共通している(ref)。短期のシナプス可塑性において神経伝達物質の放出を促進する働きがある(ref)。
RIM
RIMファミリーにはZnフィンガードメイン、PDZドメイン、高プロリンSH3ドメイン結合領域の有無やC2ドメインの個数の違いにより6種類のアイソフォームが存在し、これらは様々なシナプスタンパク質と相互作用する事が知られている(ref)。ジンクフィンガードメインにはMunc13とシナプス小胞上に結合しているGタンパク質のRab3が結合する部位がそれぞれ分かれて存在し、3つのタンパク質からなる複合体を形成する(ref)。この複合体はシナプス小胞をプライミング領域に運ぶ際に重要と考えられている(ref)。
Bassoon、Piccolo
BassoonおよびPiccoloはアクティブゾーンの中で最も大きなタンパク質である(ref)。ジンクフィンガードメイン、Piccolo bassoon homology (PBH)ドメイン、コルドコイルドメインが共通の配置で並んだよく似た構造を持ち、ともにELKSと相互作用す(ref)る。Piccoloのみに見られる構造としては、高プロリン領域、PDZドメイン、C2ドメインがあり、PDZドメインとC2ドメインはそれぞれcAMP-GEF2、L型電位依存性カルシウムチャネルCav 1.2と相互作用する事が知られている(ref)。この事からPiccoloはシナプス小胞のエンドサイトーシスとエキソサイトーシスを制御するシグナルをまとめる働きがあると考えられる(ref)。
ELKS/CAST/ERC
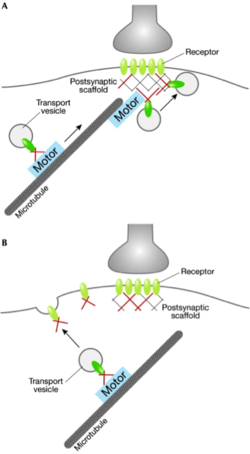
モータータンパク質と輸送小胞のアダプターとして機能する足場タンパク質。モーターからシナプスへの移行は直接(A)あるいは間接的(B)な経路が想定されている。
[14]より許可を得て転載。
哺乳類ではELKS1A、ELKS1B、ELKS2の3種類がこのファミリーに含まれる(ref)。ELKSはという名称はこのタンパク質が多く含むグルタミン酸(E)、ロイシン(L)、リシン(K)、セリン(S)から命名されている。いずれも4つのコイルドコイルドメインを持ち、この部分でリプリンα、Piccolo、Bassoonと結合する(ref)。またELKS1BとELKS2はC末端にRIM1αのPDZドメインと結合する領域が存在し、RIMを局在化させるのに必要なタンパク質であると考えられている(ref)。
シナプス以外での足場タンパク質の機能
受容体などの輸送においてそのタンパク質とモータータンパク質をつなぎ、アダプタータンパク質として機能する足場タンパク質が存在する。AMPA型グルタミン酸受容体のサブユニットであるGluR2はKIF5によってシナプスに運ばれるが、このときGRIP1が二つをつないで複合体を形成しており、PSDに運ばれてからはAMPA型グルタミン酸受容体をシナプス後膜に固定する足場となる[15]。またGRIP1はKIF5の方向性を定めて輸送をコントロールする働きがあるとも考えられている(ref)。
同様に抑制性シナプスの足場タンパク質であるゲフィリンもグリシン受容体が微小管を伝って膜上から取り除かれる際に、モータータンパク質であるダイニン軽鎖1 (dynein light chain1, Dlc1)やダイニン軽鎖2 (dynein light chain2, Dlc2)との結合を仲介する役目がある[14]。
関連項目
参考文献
- ↑
Burack, W.R., & Shaw, A.S. (2000).
Signal transduction: hanging on a scaffold. Current opinion in cell biology, 12(2), 211-6. [PubMed:10712921] [WorldCat] [DOI] - ↑
Renner, M., Specht, C.G., & Triller, A. (2008).
Molecular dynamics of postsynaptic receptors and scaffold proteins. Current opinion in neurobiology, 18(5), 532-40. [PubMed:18832033] [WorldCat] [DOI] - ↑
Sheng, M., & Hoogenraad, C.C. (2007).
The postsynaptic architecture of excitatory synapses: a more quantitative view. Annual review of biochemistry, 76, 823-47. [PubMed:17243894] [WorldCat] [DOI] - ↑
Kreienkamp, H.J. (2002).
Organisation of G-protein-coupled receptor signalling complexes by scaffolding proteins. Current opinion in pharmacology, 2(5), 581-6. [PubMed:12324263] [WorldCat] - ↑
Vessey, J.P., & Karra, D. (2007).
More than just synaptic building blocks: scaffolding proteins of the post-synaptic density regulate dendritic patterning. Journal of neurochemistry, 102(2), 324-32. [PubMed:17596209] [WorldCat] [DOI] - ↑
Sheng, M., & Kim, E. (2000).
The Shank family of scaffold proteins. Journal of cell science, 113 ( Pt 11), 1851-6. [PubMed:10806096] [WorldCat] - ↑
Hayashi, M.K., Ames, H.M., & Hayashi, Y. (2006).
Tetrameric hub structure of postsynaptic scaffolding protein homer. The Journal of neuroscience : the official journal of the Society for Neuroscience, 26(33), 8492-501. [PubMed:16914674] [PMC] [WorldCat] [DOI] - ↑
Hayashi, M.K., Tang, C., Verpelli, C., Narayanan, R., Stearns, M.H., Xu, R.M., ..., & Hayashi, Y. (2009).
The postsynaptic density proteins Homer and Shank form a polymeric network structure. Cell, 137(1), 159-71. [PubMed:19345194] [PMC] [WorldCat] [DOI] - ↑
Choquet, D., & Triller, A. (2003).
The role of receptor diffusion in the organization of the postsynaptic membrane. Nature reviews. Neuroscience, 4(4), 251-65. [PubMed:12671642] [WorldCat] [DOI] - ↑
Fritschy, J.M., Harvey, R.J., & Schwarz, G. (2008).
Gephyrin: where do we stand, where do we go? Trends in neurosciences, 31(5), 257-64. [PubMed:18403029] [WorldCat] [DOI] - ↑
Schoch, S., & Gundelfinger, E.D. (2006).
Molecular organization of the presynaptic active zone. Cell and tissue research, 326(2), 379-91. [PubMed:16865347] [WorldCat] [DOI] - ↑
Dresbach, T., Qualmann, B., Kessels, M.M., Garner, C.C., & Gundelfinger, E.D. (2001).
The presynaptic cytomatrix of brain synapses. Cellular and molecular life sciences : CMLS, 58(1), 94-116. [PubMed:11229820] [WorldCat] [DOI] - ↑
Garner, C.C., Kindler, S., & Gundelfinger, E.D. (2000).
Molecular determinants of presynaptic active zones. Current opinion in neurobiology, 10(3), 321-7. [PubMed:10851173] [WorldCat] [DOI] - ↑ 14.0 14.1
Kneussel, M. (2005).
Postsynaptic scaffold proteins at non-synaptic sites. The role of postsynaptic scaffold proteins in motor-protein-receptor complexes. EMBO reports, 6(1), 22-7. [PubMed:15643447] [PMC] [WorldCat] [DOI] - ↑
Setou, M., Seog, D.H., Tanaka, Y., Kanai, Y., Takei, Y., Kawagishi, M., & Hirokawa, N. (2002).
Glutamate-receptor-interacting protein GRIP1 directly steers kinesin to dendrites. Nature, 417(6884), 83-7. [PubMed:11986669] [WorldCat] [DOI]