「抑制性シナプス」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (3人の利用者による、間の49版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">中畑 義久、稲田 浩之、加藤 剛、鍋倉 淳一</font><br> | <font size="+1">中畑 義久、稲田 浩之、加藤 剛、鍋倉 淳一</font><br> | ||
''自然科学研究機構生理学研究所''<br> | ''自然科学研究機構生理学研究所''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2012年12月20日 原稿完成日:2015年月日<br> | ||
担当編集委員:[http://researchmap.jp/michisukeyuzaki 柚崎 通介](慶應義塾大学 医学部生理学)<br> | 担当編集委員:[http://researchmap.jp/michisukeyuzaki 柚崎 通介](慶應義塾大学 医学部生理学)<br> | ||
</div> | </div> | ||
| 8行目: | 8行目: | ||
英:inhibitory synapse 独:hemmende Synapse 仏:synapse inhibitrice | 英:inhibitory synapse 独:hemmende Synapse 仏:synapse inhibitrice | ||
{{box|text= | {{box|text= | ||
抑制性シナプスとは、シナプス伝達によってシナプス後細胞を過分極させ、活動電位の発生を抑制するシナプス結合のことである。抑制性シナプスを形成するシナプス前細胞は、抑制性神経細胞(ニューロン)と呼ばれる。(抑制性の化学シナプスにおいては、)GABAやグリシンなどの神経伝達物質を放出する抑制性ニューロンの軸索終末とシナプス後細胞が抑制性シナプスを構成する。主な抑制性シナプスは、GABA作動性シナプスとグリシン作動性シナプスであり、複数の神経伝達物質を共放出するシナプスも存在する。 | |||
}} | |||
== 基本構造 == | == 基本構造 == | ||
[[image:抑制性シナプス1.png|thumb| | [[image:抑制性シナプス1.png|thumb|300px|'''図1.Gray II型シナプス(対称性シナプス)'''<br>矢印はシナプス前終末側から抑制性シナプスを示している。SynapseWeb ※使用許諾未取得]] | ||
多くの抑制性シナプスは、形態学的分類におけるGray Ⅱ型シナプス(対称性シナプス)に相当する(図1)。抑制性シナプス前終末およびシナプス後膜を捉えた電子顕微鏡像によると、Gray I型シナプス(対称性シナプス)とは異なり顕著な電子高密度構造は認められない(Gray, 1959)。また、Gray I型シナプスに比べてシナプス間隙(synaptic cleft)が狭く、シナプス小胞が楕円形(扁平)である(Kandel et al., 2012)。Gray II型シナプスは、主に樹状突起シャフト部や細胞体に形成されるが、棘突起(スパイン)を標的とするGABAを含んだシナプス前終末も存在する(Beaulieu et al., 1992; Kubota et al., 2007)。 | |||
抑制性シナプスにおいても、シナプス前膜とシナプス後膜を繋ぐ接着分子が存在する。シナプス前膜にはニューレキシン(neurexin: NRXもしくはNRXN)が局在し、シナプス後膜にはニューロリギン(neuroligin: NLもしくはNLGN)が局在することが知られており、これらの接着分子の結合によってシナプスの安定化に寄与していると考えられる(Südhof, 2008; Bang & Owczarek, 2013)。 | |||
=== | ===シナプス前部(プレシナプス)=== | ||
====GABA作動性シナプス==== | ====GABA作動性シナプス==== | ||
GABA作動性ニューロンには、グルタミン酸からGABAを合成するグルタミン酸脱炭酸酵素(glutamic acid decarboxylase: GAD)が存在する。GADには、GAD65とGAD67の二つのアイソフォームがあり、GABA作動性ニューロン特異的に発現している(Dupuy & Houser, 1996)。GAD65は神経終末部に限局している一方、GAD67は細胞体などにも存在し、GABA合成において主要な役割を担っている(Asada et al., 1997)。また、GAD67はパルブアルブミン陽性の介在ニューロンに強い発現がみられる(Fukuda et al., 1997)。合成されたGABAは、液胞型ATPアーゼ(vacuolar-type H+‐ATPase: V-ATPase)によってできるH+濃度勾配および電位勾配に従い、小胞抑制性アミノ酸輸送体(vesicular inhibitory amino acid transporter: VIAAT)注1によって、シナプス小胞に充填される(Chaudhry et al., 1998; Wajcik et al., 2006)。そして、シナプス間隙に開口放出されたGABAは、ニューロンおよびグリア細胞の細胞膜に存在するGABA輸送体(GABA transporter: GAT)によって回収される(Conti et al., 2004)。また、Gタンパク質共役型受容体であるGABAB受容体は、K+チャネルを開口させて神経終末を過分極させると共に、Ca2+チャネルを閉口させて伝達物質の放出を抑制する(2.4にて詳述)。 | |||
====グリシン作動性シナプス==== | ====グリシン作動性シナプス==== | ||
グリシンはセリンヒドロキシメチルトランスフェラーゼ(serine hydroxymethyltransferase: SHMT)によってセリンから可逆的に変換される。GABA同様にグリシンも小胞抑制性アミノ酸輸送体によってシナプス小胞に充填されるが、充填効率はGABAに比べて低い(Christensen et al., 1991; McIntire et al., 1997)。シナプスに放出されたグリシンは、ニューロンとアストロサイトの細胞膜上に発現するグリシン輸送体(glycine transporter: GlyT)によって回収される(Zafra & Giménez, 2008)。グリシン輸送体の働きはNa+(ナトリウムイオン: sodium ion)とCl-(塩化物イオン: chloride ion)注2に依存しており、2つのアイソフォームが知られている。アストロサイト特異的に発現するGlyT1は、グリシンを細胞内外の両方向へ輸送する。一方、グリシン作動性シナプス前終末において特異的に認められる GlyT2は、細胞内外のNa+濃度勾配によって細胞外から細胞内へ一方向性の輸送を行い、シナプス小胞へのグリシン充填に不可欠である(Gomeza, 2003; Rousseau et al., 2008)。 | |||
===シナプス後部(ポストシナプス)=== | |||
[[image:抑制性シナプス2.png|thumb|300px|'''図2.抑制性シナプスを構成する分子'''<br>(GABA:ガンマアミノ酪酸、GAD67:グルタミン酸脱炭酸酵素67、GAD65:グルタミン酸脱炭酸酵素65、VIAAT(VGAT):小胞抑制性アミノ酸輸送体(小胞GABA輸送体)、SHMT:セリンヒドロキシメチルトランスフェラーゼ)]] | |||
シナプス後膜にはGABAA受容体やグリシン受容体などのイオンチャネルが集積し、GABAB受容体も存在している。シナプス前終末から開口放出されたGABAやグリシンなどの神経伝達物質は、それぞれに対応した受容体に結合する。抑制性神経伝達物質で開くClイオンチャネルはGABAA受容体およびグリシン受容体があり、これらは各々複数のサブタイプを持っている(Macdonald & Olsen, 1994; Lynch, 2004)。これらのイオンチャネル型受容体は陰イオンを選択的に透過させるチャネル構造を持ち、活性化に伴ってClイオンの透過性(コンダクタンス)注3を上昇させる。 | |||
これらの受容体は細胞内の粗面小胞体(rER)で合成され、ゴルジ体にて分泌小胞に包まれて細胞質へ移行する(Jacob et al., 2008)。そして、GABAA受容体はGABARAP(GABAA receptor-associated protein)、グリシン受容体は足場タンパク質であるゲフィリン(gephyrin)を介して順行性モータータンパク質であるキネシンスーパーファミリータンパク質(kinesin superfamily protein: KIF)に結合し、微小管(microtubule)に沿って輸送される(Nakajima et al., 2012; Maas et al., 2009)。その後、受容体はエキソサイトーシス(exocytosis)によって細胞膜へ移行して側方拡散(lateral diffusion)し、ゲフィリンを介してシナプスへ集積すると考えられている(Renner et al., 2008; Tyagarajan & Fritchy, 2014)注4.。また、シナプスでは受容体の凝集するサブドメイン(ナノドメイン)を形成していることが示唆されている(Specht et al., 2013; Choquet & Triller, 2013)。しかし、細胞膜上の受容体は側方拡散によってシナプス内外を移動すると共に、クラスリン(clathrin)やダイナミン(dynamin)依存的なエンドサイトーシス(endocytosis)によってエンドソームに取り込まれ、細胞内へ移行する。微小管に沿った逆行性輸送はダイニン(dynein)によって行われ、リソソームでの分解、もしくは再度エキソサイトーシスされて再利用されると考えられる(Jacob et al., 2008)。 | |||
== 生理機能 == | == 生理機能 == | ||
=== | ===GABAA受容体・グリシン受容体を介した抑制作用=== | ||
神経終末から放出されたGABAやグリシンによって、それぞれに対応したイオンチャネル型受容体であるGABAA受容体およびグリシン受容体が活性化し、受容体内部のチャネルが開口する。これによって、Clイオンの透過性が上昇すると、負の電荷をもつClイオンが細胞内に流入し、膜電位の過分極作用をもたらす。通常、哺乳類の成体における細胞外Clイオン濃度はおよそ150 mMであるのに対し、細胞内はおよそ10 mM程度である(Rhee et al., 1994; Kakazu et al., 1999)。そのため、通常Clイオンの平衡電位は-70~-80 mV付近であり、静止膜電位よりも僅かにマイナス側にある。このように、膜電位が静止電位付近の場合には電位勾配が小さく、GABAA受容体やグリシン受容体の活性化によってチャネルの透過性が上昇しても、細胞内へClイオンの大量流入は生じない。その上、短絡効果(後述2.3)も相まって、膜電位に与える影響は比較的小さい。しかし、興奮性入力によって膜が脱分極している状況では、Clイオンの電位勾配が大きくなり、より多くのClイオンが細胞内へ流入することから、膜電位は静止電位付近へ引き戻される。その結果、興奮性の入力によって生じた脱分極が減弱し、活動電位の発生を抑制する。 | |||
===発達期および傷害回復期におけるGABA・グリシンに対する応答変化=== | |||
[[image:抑制性シナプス3.png|thumb| | [[image:抑制性シナプス3.png|thumb|300px|'''図3.発達に伴うGABA応答の変化'''<br>(Ben-Ari, 2007より ※使用許諾未取得]] | ||
GABAA受容体やグリシン受容体のチャネルを流れるClイオンの向きと量は、細胞内外におけるClイオンの濃度勾配と膜電位に依存している(Ueno et al., 2002)。そのため、細胞内Clイオン濃度が高い状態である幼若期のニューロンでは、GABAA受容体(もしくはグリシン受容体)の活性化に伴ってClイオンの流出をもたらし、脱分極することも知られている(Ben-Ari, 2007)(図3)。 | |||
こうした細胞内Clイオン濃度は、細胞膜上に発現するNa+-K+-Cl-共輸送体(NKCC) 、K+-Cl-共輸送体(KCC) およびCl-/HCO3-交換輸送体など、多数のClイオン輸送体によって制御されている(Price et al., 2005; Stauber et al., 2012)。NKCCはClイオンを細胞内へ汲み入れ、KCCはClイオンを細胞外へ汲み出す働きを担っており、これらのバランスによって細胞内のClイオン濃度が決定される(Payne et al., 2003)。発達初期はKCC2に比べてNKCC1の機能発現が高く、細胞内Clイオン濃度が高い状態である。一方、成熟したニューロンではNKCC1に比べてKCC2の機能発現が上昇することから、細胞内Clイオン濃度が低い状態に保たれている(Kakazu et al., 1999; Ben-Ari, 2007)(図3)。しかし、成熟したニューロンにおいても、細胞ストレスや神経損傷を受けると、KCC2の機能が低下することから、GABAA受容体の活性化に伴って脱分極することが報告されている(Nabekura et al., 2002; Toyoda et al., 2003; Wake et al., 2007)。 | |||
つまり、GABAもしくはグリシン作動性入力が標的細胞に対して抑制性もしくは興奮性のいずれの作用をもたらすどうかは、標的細胞内のClイオン濃度に依存している。そのため、GABAやグリシン作動性シナプスであっても、幼若期や傷害回復期においては、必ずしも抑制作用を持つシナプスではない。 | |||
=== | ===短絡効果(シャント効果)=== | ||
シナプス後細胞の興奮性を抑えるメカニズムとして、短絡効果(シャント効果) | シナプス後細胞の興奮性を抑えるメカニズムとして、短絡効果(シャント効果) も知られている(Staley & Mody, 1992)。抑制性入力によってGABAA受容体やグリシン受容体が活性化すると、それらのチャネルのコンダクタンスが大きくなり、膜抵抗が局所的に減少する。すると、オームの法則に従って電流の変化量に対する電位の変化量が低下する。その結果、(仮にClイオンの平衡電位が静止膜電位付近のため、抑制性シナプス入力が過分極をもたらさない場合であっても、)近傍の興奮性シナプスでは興奮性シナプス後電位(EPSP)の振幅が減少し、結果としてシナプス後細胞の興奮性が抑えられる。 | ||
=== | ===GABAB受容体を介した抑制作用=== | ||
Gi/o共役型受容体であるGABAB受容体は、興奮性と抑制性を問わず、シナプス前終末、シナプス後膜、シナプス外領域のいずれの細胞膜にも存在しており、抑制性シナプスでは特にシナプス後膜に強い発現がみられる(Gonchar et al., 2001)。GABAB受容体はGタンパク質を介してK+チャネルを開口させることで、細胞膜を過分極させる。また、Gタンパク質を介して電位依存性Ca2+チャネルを閉口させる。そのため、神経終末では活動電位が到達しても伝達物質の放出が起こりにくくなり、GABA作動性神経終末においては、自ら放出したGABAによってその後の放出を抑制する自己受容体(autoreceptor)として働く。また、GABAB受容体を介した応答は、GABAA受容体やグリシン受容体などのイオンチャネル型受容体よりも遅く、長い時間スケールでの抑制作用を持つことが知られている(Gassmann & Bettler, 2012)。 | |||
=== | ===GABAおよびグリシン作動性シナプスの相違点=== | ||
GABA作動性シナプスは中枢神経系全般に広く分布し、大脳新皮質、海馬、視床、小脳などにおいて主要な抑制性伝達を担う(Pirker et al., 2000)。一方、グリシン作動性シナプスは脳幹、脊髄における主要な抑制性伝達を担い、小脳や網膜においても機能している(Dieudonné., 1995; Kirsch., 2006)。また、脊髄や脳幹などでは、単一神経終末において、同一のシナプス小胞からGABAとグリシンの共放出が確認されている(Jonas et al., 1998)。加えて、これらのシナプスでは未熟期においてGABA優位であった神経伝達が、発達に従ってグリシン優位に変化(スイッチング)することが知られているが(Kotak et al., 1998; Nabekura et al., 2004)、成熟後もGABAとグリシンの共放出が認められる(Dufour et al., 2010)。 | |||
GABAA受容体およびグリシン受容体は、いずれもClイオンを選択的に透過させる点で共通している。しかし、GABAA受容体を介した抑制性シナプス後電流(inhibitory post synaptic current: IPSC)は、グリシン受容体のそれに比べて減衰時間が長い(Jonas et al., 1998)。また、先述の通り、GABA作動性シナプスではGABAB受容体が自己受容体として働くことも特徴的である。 | |||
==シナプス外受容体による持続性抑制=== | |||
GABAA受容体およびグリシン受容体は、シナプスに高密度で集積するだけでなく、シナプス外においても低密度で存在し、持続性抑制(tonic inhibition)に関わることが知られている(Farrant & Nusser, 2005)。こうしたシナプス外の受容体は、シナプス間隙から漏出(spillover)したリガンドや細胞外に低濃度で存在するリガンドによって活性化することで、細胞の興奮性を調節していると考えられている。そのため、脱感作しにくい特徴を持っており、δサブユニットを含むGABAA受容体など、受容体のサブユニット構成によって機能的特徴が異なると考えられる(Jacob et al., 2008)。 | |||
==電気シナプスによる抑制== | |||
上述の化学シナプスとは別に、電気シナプス(electric synapse / electrical synapse)を介した抑制も知られている。電気シナプスの場合、ギャップ結合(gap junction)を介して異なるニューロン同士の細胞質が直接連結しており、細胞間のイオンの移動が容易である。そのため、あるニューロンにおける過分極が、他のニューロンへ瞬時に伝播して過分極させる。例えば、マウス小脳皮質に存在する抑制性ニューロンの一種であるゴルジ細胞は、互いにギャップ結合を形成して同期発火している。しかし、苔状線維から興奮性入力を受けると、直接入力を受けた細胞とその周囲の細胞の間で脱同期化が生じることが知られている(Vervaeke et al., 2010)。これはギャップ結合を介して周囲のゴルジ細胞に後過分極(after-hyperpolarization)が伝播するためであり、ギャップ結合が抑制性の電気シナプスとして機能している例である(Bennet & Zukin, 2004)。 | |||
== | ==抑制性シナプスにおける長期増強(iLTP)と長期抑圧(iLTD)== | ||
[[image:抑制性シナプス4.png|thumb|300px|'''図4.プレシナプスによる抑制性LTP(iLTP)とLTD(iLTD)モデル'''<br>((a)内因性カンナビノイド(eCB)を介したiLTD, (b)脳由来神経成長因子(BDNF)を介したiLTP, (c)一酸化窒素(NO)を介したiLTP, (d)プレシナプスのNMDA受容体を介したiLTPおよびiLTD Castillo et al., 2011 ※使用許諾未取得]] | |||
長期増強(long-term potentiation:LTP)と長期抑圧(long-term depression:LTD)は、刺激の頻度とタイミングによって、その後のシナプス伝達効率の変化が長時間に渡って持続する現象である。前者は伝達効率が上昇する一方、後者は伝達効率が減少する。このLTPとLTDは興奮性シナプスにおいてよく知られているが、抑制性シナプスにおいても生じることが報告されている(iLTP/iLTD)(Stelzer et al., 1987; Korn et al., 1992; Kano et al., 1992; Komatsu & Iwakiri, 1993)。いずれの現象についても、前シナプスと後シナプスそれぞれにおける様々な機序によって生じることが報告されている(Gaiarsa et al., 2002)。前シナプスについては、内因性カンナビノイド、脳由来神経成長因子(BDNF)、一酸化窒素(NO)などの逆行性シグナルや神経前終末のNMDA受容体を介して、伝達物質の放出確率を調節するメカニズムが考えられている(図4)。一方、後シナプスについては、GABARAPなど受容体の輸送に関わる分子やGABAA受容体自体のリン酸化‐脱リン酸化によって、シナプスにおける受容体の数や局在、イオン透過性などの構造的・機能的修飾が生じることが報告されている(Castillo et al., 2011)。また、この他にはKCC2やNKCC1などの細胞内Clイオン濃度調節機構への作用によって細胞内Clイオン濃度が変化し、その結果GABAやグリシンによる応答の振幅が変化することも示唆されている(Wang et al., 2006)。 | |||
==注釈== | ==注釈== | ||
注1. 小胞GABA輸送体(VGAT)とも呼ばれる。 | 注1. 小胞GABA輸送体(VGAT)とも呼ばれる。 | ||
注2. | 注2. クロールイオン、クロライドイオン、塩化物(塩素)イオンとも呼ばれ、「Cl-」と表記される。 | ||
注3. チャネルの開閉に伴う細胞内外のイオンの出入りを考えるとき、しばしば「透過性(permeability)」と「コンダクタンス(conductance)」という語が使用される。 前者はイオンの通りやすさを指しているのに対し、後者はイオンの電気的な伝導性を指している。 | |||
注4. ゲフィリンはグリシン受容体βサブユニットと結合し、足場タンパク質として働くことがよく知られている。しかし、GABAA受容体のサブタイプは、構成するサブユニットの種類によって非常に多様であり、ゲフィリンが足場タンパクとして働くものはそれらの一部であると考えられている(Tyagarajan & Fritschy, 2014)。 | |||
== 関連項目 == | == 関連項目 == | ||
*[[抑制性アミノ酸]] | |||
*[[GABA受容体]] | |||
*[[グリシン受容体]] | |||
*[[シナプス伝達]] | *[[シナプス伝達]] | ||
*[[ | *[[抑制性神経細胞]] | ||
*[[GABA]] | *[[GABA]] | ||
*[[グリシン]] | *[[グリシン]] | ||
*[[ | *[[化学シナプス]] | ||
*[[対称性シナプス]] | |||
*[[シナプス間隙]] | |||
*[[棘突起(スパイン)]] | |||
*[[接着分子]] | |||
*[[ニューレキシン]] | |||
*[[ニューロリギン]] | |||
*[[グルタミン酸脱炭酸酵素]] | |||
*[[パルブアルブミン]] | |||
*[[液胞型ATPアーゼ]] | |||
*[[小胞抑制性アミノ酸輸送体]] | |||
*[[シナプス小胞]] | |||
*[[グリア細胞]] | |||
*[[GABA輸送体]] | |||
*[[Gタンパク質共役型受容体]] | |||
*[[Ca2+チャネル]] | |||
*[[K+チャネル]] | |||
*[[グリシン]] | |||
*[[セリンヒドロキシメチルトランスフェラーゼ]] | |||
*[[アストロサイト]] | |||
*[[グリシン輸送体]] | |||
*[[GABAA受容体]] | |||
*[[グリシン受容体]] | *[[グリシン受容体]] | ||
*[[ | *[[イオンチャネル]] | ||
*[[ | *[[GABAB受容体]] | ||
*[[開口放出]] | |||
*[[神経伝達物質]] | |||
*[[Clイオンチャネル]] | |||
*[[粗面小胞体]] | |||
*[[ゴルジ体]] | |||
*[[分泌小胞]] | |||
*[[GABARAP]] | |||
*[[キネシンスーパーファミリータンパク質]] | |||
*[[微小管]] | |||
*[[エキソサイトーシス]] | |||
*[[細胞膜]] | |||
*[[側方拡散]] | |||
*[[クラスリン]] | |||
*[[ダイナミン]] | |||
*[[エンドサイトーシス]] | |||
*[[エンドソーム]] | |||
*[[リソソーム]] | |||
*[[ダイニン]] | |||
*[[膜電位]] | |||
*[[過分極]] | |||
*[[平衡電位]] | |||
*[[静止膜電位]] | |||
*[[短絡効果]] | *[[短絡効果]] | ||
*[[脱分極]] | |||
*[[Cl-/HCO3-交換輸送体]] | |||
*[ | *[[K+-Cl-共輸送体(KCC) ]] | ||
*[[Na+-K+-Cl-共輸送体(NKCC)]] | |||
*[[興奮性シナプス後電位(EPSP)]] | |||
*[[Gi/o共役型受容体]] | |||
*[[Gタンパク質]] | |||
*[[K+チャネル]] | |||
*[[電位依存性Ca2+チャネル]] | |||
*[[自己受容体(autoreceptor)]] | |||
*[[中枢神経系]] | |||
*[[大脳新皮質]] | |||
*[[海馬]] | |||
*[[視床]] | |||
*[[小脳]] | |||
*[[脳幹]] | |||
*[[脊髄]] | |||
*[[網膜]] | |||
*[[脳幹]] | |||
*[[抑制性シナプス後電流]] | |||
*[[持続性抑制(tonic inhibition)]] | |||
*[[電気シナプス]] | |||
*[[ギャップ結合]] | |||
*[[ゴルジ細胞]] | |||
*[[同期発火]] | |||
*[[苔状線維 | |||
*[[後過分極(after-hyperpolarization)]] | |||
*[[長期増強]] | |||
*[[長期抑圧]] | |||
*[[脳由来神経成長因子(BDNF)]] | |||
*[[一酸化窒素(NO)]] | |||
*[[逆行性シグナル]] | |||
*[[NMDA受容体]] | |||
*[[放出確率]] | |||
*[[リン酸]] | |||
*[[脱リン酸化]] | |||
*[[GABARAP]] | |||
== 参考文献 == | == 参考文献 == | ||
<references /> | <references /> | ||
2015年2月26日 (木) 10:58時点における版
中畑 義久、稲田 浩之、加藤 剛、鍋倉 淳一
自然科学研究機構生理学研究所
DOI:10.14931/bsd.3012 原稿受付日:2012年12月20日 原稿完成日:2015年月日
担当編集委員:柚崎 通介(慶應義塾大学 医学部生理学)
英:inhibitory synapse 独:hemmende Synapse 仏:synapse inhibitrice
抑制性シナプスとは、シナプス伝達によってシナプス後細胞を過分極させ、活動電位の発生を抑制するシナプス結合のことである。抑制性シナプスを形成するシナプス前細胞は、抑制性神経細胞(ニューロン)と呼ばれる。(抑制性の化学シナプスにおいては、)GABAやグリシンなどの神経伝達物質を放出する抑制性ニューロンの軸索終末とシナプス後細胞が抑制性シナプスを構成する。主な抑制性シナプスは、GABA作動性シナプスとグリシン作動性シナプスであり、複数の神経伝達物質を共放出するシナプスも存在する。
基本構造
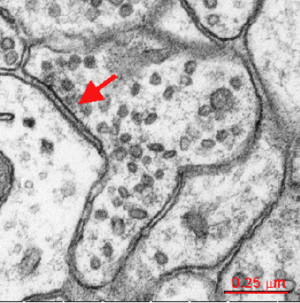
矢印はシナプス前終末側から抑制性シナプスを示している。SynapseWeb ※使用許諾未取得
多くの抑制性シナプスは、形態学的分類におけるGray Ⅱ型シナプス(対称性シナプス)に相当する(図1)。抑制性シナプス前終末およびシナプス後膜を捉えた電子顕微鏡像によると、Gray I型シナプス(対称性シナプス)とは異なり顕著な電子高密度構造は認められない(Gray, 1959)。また、Gray I型シナプスに比べてシナプス間隙(synaptic cleft)が狭く、シナプス小胞が楕円形(扁平)である(Kandel et al., 2012)。Gray II型シナプスは、主に樹状突起シャフト部や細胞体に形成されるが、棘突起(スパイン)を標的とするGABAを含んだシナプス前終末も存在する(Beaulieu et al., 1992; Kubota et al., 2007)。
抑制性シナプスにおいても、シナプス前膜とシナプス後膜を繋ぐ接着分子が存在する。シナプス前膜にはニューレキシン(neurexin: NRXもしくはNRXN)が局在し、シナプス後膜にはニューロリギン(neuroligin: NLもしくはNLGN)が局在することが知られており、これらの接着分子の結合によってシナプスの安定化に寄与していると考えられる(Südhof, 2008; Bang & Owczarek, 2013)。
シナプス前部(プレシナプス)
GABA作動性シナプス
GABA作動性ニューロンには、グルタミン酸からGABAを合成するグルタミン酸脱炭酸酵素(glutamic acid decarboxylase: GAD)が存在する。GADには、GAD65とGAD67の二つのアイソフォームがあり、GABA作動性ニューロン特異的に発現している(Dupuy & Houser, 1996)。GAD65は神経終末部に限局している一方、GAD67は細胞体などにも存在し、GABA合成において主要な役割を担っている(Asada et al., 1997)。また、GAD67はパルブアルブミン陽性の介在ニューロンに強い発現がみられる(Fukuda et al., 1997)。合成されたGABAは、液胞型ATPアーゼ(vacuolar-type H+‐ATPase: V-ATPase)によってできるH+濃度勾配および電位勾配に従い、小胞抑制性アミノ酸輸送体(vesicular inhibitory amino acid transporter: VIAAT)注1によって、シナプス小胞に充填される(Chaudhry et al., 1998; Wajcik et al., 2006)。そして、シナプス間隙に開口放出されたGABAは、ニューロンおよびグリア細胞の細胞膜に存在するGABA輸送体(GABA transporter: GAT)によって回収される(Conti et al., 2004)。また、Gタンパク質共役型受容体であるGABAB受容体は、K+チャネルを開口させて神経終末を過分極させると共に、Ca2+チャネルを閉口させて伝達物質の放出を抑制する(2.4にて詳述)。
グリシン作動性シナプス
グリシンはセリンヒドロキシメチルトランスフェラーゼ(serine hydroxymethyltransferase: SHMT)によってセリンから可逆的に変換される。GABA同様にグリシンも小胞抑制性アミノ酸輸送体によってシナプス小胞に充填されるが、充填効率はGABAに比べて低い(Christensen et al., 1991; McIntire et al., 1997)。シナプスに放出されたグリシンは、ニューロンとアストロサイトの細胞膜上に発現するグリシン輸送体(glycine transporter: GlyT)によって回収される(Zafra & Giménez, 2008)。グリシン輸送体の働きはNa+(ナトリウムイオン: sodium ion)とCl-(塩化物イオン: chloride ion)注2に依存しており、2つのアイソフォームが知られている。アストロサイト特異的に発現するGlyT1は、グリシンを細胞内外の両方向へ輸送する。一方、グリシン作動性シナプス前終末において特異的に認められる GlyT2は、細胞内外のNa+濃度勾配によって細胞外から細胞内へ一方向性の輸送を行い、シナプス小胞へのグリシン充填に不可欠である(Gomeza, 2003; Rousseau et al., 2008)。
シナプス後部(ポストシナプス)
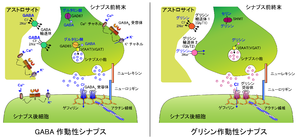
(GABA:ガンマアミノ酪酸、GAD67:グルタミン酸脱炭酸酵素67、GAD65:グルタミン酸脱炭酸酵素65、VIAAT(VGAT):小胞抑制性アミノ酸輸送体(小胞GABA輸送体)、SHMT:セリンヒドロキシメチルトランスフェラーゼ)
シナプス後膜にはGABAA受容体やグリシン受容体などのイオンチャネルが集積し、GABAB受容体も存在している。シナプス前終末から開口放出されたGABAやグリシンなどの神経伝達物質は、それぞれに対応した受容体に結合する。抑制性神経伝達物質で開くClイオンチャネルはGABAA受容体およびグリシン受容体があり、これらは各々複数のサブタイプを持っている(Macdonald & Olsen, 1994; Lynch, 2004)。これらのイオンチャネル型受容体は陰イオンを選択的に透過させるチャネル構造を持ち、活性化に伴ってClイオンの透過性(コンダクタンス)注3を上昇させる。
これらの受容体は細胞内の粗面小胞体(rER)で合成され、ゴルジ体にて分泌小胞に包まれて細胞質へ移行する(Jacob et al., 2008)。そして、GABAA受容体はGABARAP(GABAA receptor-associated protein)、グリシン受容体は足場タンパク質であるゲフィリン(gephyrin)を介して順行性モータータンパク質であるキネシンスーパーファミリータンパク質(kinesin superfamily protein: KIF)に結合し、微小管(microtubule)に沿って輸送される(Nakajima et al., 2012; Maas et al., 2009)。その後、受容体はエキソサイトーシス(exocytosis)によって細胞膜へ移行して側方拡散(lateral diffusion)し、ゲフィリンを介してシナプスへ集積すると考えられている(Renner et al., 2008; Tyagarajan & Fritchy, 2014)注4.。また、シナプスでは受容体の凝集するサブドメイン(ナノドメイン)を形成していることが示唆されている(Specht et al., 2013; Choquet & Triller, 2013)。しかし、細胞膜上の受容体は側方拡散によってシナプス内外を移動すると共に、クラスリン(clathrin)やダイナミン(dynamin)依存的なエンドサイトーシス(endocytosis)によってエンドソームに取り込まれ、細胞内へ移行する。微小管に沿った逆行性輸送はダイニン(dynein)によって行われ、リソソームでの分解、もしくは再度エキソサイトーシスされて再利用されると考えられる(Jacob et al., 2008)。
生理機能
GABAA受容体・グリシン受容体を介した抑制作用
神経終末から放出されたGABAやグリシンによって、それぞれに対応したイオンチャネル型受容体であるGABAA受容体およびグリシン受容体が活性化し、受容体内部のチャネルが開口する。これによって、Clイオンの透過性が上昇すると、負の電荷をもつClイオンが細胞内に流入し、膜電位の過分極作用をもたらす。通常、哺乳類の成体における細胞外Clイオン濃度はおよそ150 mMであるのに対し、細胞内はおよそ10 mM程度である(Rhee et al., 1994; Kakazu et al., 1999)。そのため、通常Clイオンの平衡電位は-70~-80 mV付近であり、静止膜電位よりも僅かにマイナス側にある。このように、膜電位が静止電位付近の場合には電位勾配が小さく、GABAA受容体やグリシン受容体の活性化によってチャネルの透過性が上昇しても、細胞内へClイオンの大量流入は生じない。その上、短絡効果(後述2.3)も相まって、膜電位に与える影響は比較的小さい。しかし、興奮性入力によって膜が脱分極している状況では、Clイオンの電位勾配が大きくなり、より多くのClイオンが細胞内へ流入することから、膜電位は静止電位付近へ引き戻される。その結果、興奮性の入力によって生じた脱分極が減弱し、活動電位の発生を抑制する。
発達期および傷害回復期におけるGABA・グリシンに対する応答変化
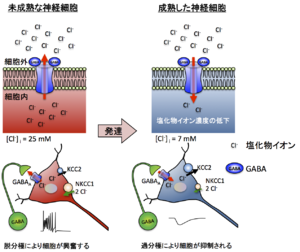
(Ben-Ari, 2007より ※使用許諾未取得
GABAA受容体やグリシン受容体のチャネルを流れるClイオンの向きと量は、細胞内外におけるClイオンの濃度勾配と膜電位に依存している(Ueno et al., 2002)。そのため、細胞内Clイオン濃度が高い状態である幼若期のニューロンでは、GABAA受容体(もしくはグリシン受容体)の活性化に伴ってClイオンの流出をもたらし、脱分極することも知られている(Ben-Ari, 2007)(図3)。
こうした細胞内Clイオン濃度は、細胞膜上に発現するNa+-K+-Cl-共輸送体(NKCC) 、K+-Cl-共輸送体(KCC) およびCl-/HCO3-交換輸送体など、多数のClイオン輸送体によって制御されている(Price et al., 2005; Stauber et al., 2012)。NKCCはClイオンを細胞内へ汲み入れ、KCCはClイオンを細胞外へ汲み出す働きを担っており、これらのバランスによって細胞内のClイオン濃度が決定される(Payne et al., 2003)。発達初期はKCC2に比べてNKCC1の機能発現が高く、細胞内Clイオン濃度が高い状態である。一方、成熟したニューロンではNKCC1に比べてKCC2の機能発現が上昇することから、細胞内Clイオン濃度が低い状態に保たれている(Kakazu et al., 1999; Ben-Ari, 2007)(図3)。しかし、成熟したニューロンにおいても、細胞ストレスや神経損傷を受けると、KCC2の機能が低下することから、GABAA受容体の活性化に伴って脱分極することが報告されている(Nabekura et al., 2002; Toyoda et al., 2003; Wake et al., 2007)。
つまり、GABAもしくはグリシン作動性入力が標的細胞に対して抑制性もしくは興奮性のいずれの作用をもたらすどうかは、標的細胞内のClイオン濃度に依存している。そのため、GABAやグリシン作動性シナプスであっても、幼若期や傷害回復期においては、必ずしも抑制作用を持つシナプスではない。
短絡効果(シャント効果)
シナプス後細胞の興奮性を抑えるメカニズムとして、短絡効果(シャント効果) も知られている(Staley & Mody, 1992)。抑制性入力によってGABAA受容体やグリシン受容体が活性化すると、それらのチャネルのコンダクタンスが大きくなり、膜抵抗が局所的に減少する。すると、オームの法則に従って電流の変化量に対する電位の変化量が低下する。その結果、(仮にClイオンの平衡電位が静止膜電位付近のため、抑制性シナプス入力が過分極をもたらさない場合であっても、)近傍の興奮性シナプスでは興奮性シナプス後電位(EPSP)の振幅が減少し、結果としてシナプス後細胞の興奮性が抑えられる。
GABAB受容体を介した抑制作用
Gi/o共役型受容体であるGABAB受容体は、興奮性と抑制性を問わず、シナプス前終末、シナプス後膜、シナプス外領域のいずれの細胞膜にも存在しており、抑制性シナプスでは特にシナプス後膜に強い発現がみられる(Gonchar et al., 2001)。GABAB受容体はGタンパク質を介してK+チャネルを開口させることで、細胞膜を過分極させる。また、Gタンパク質を介して電位依存性Ca2+チャネルを閉口させる。そのため、神経終末では活動電位が到達しても伝達物質の放出が起こりにくくなり、GABA作動性神経終末においては、自ら放出したGABAによってその後の放出を抑制する自己受容体(autoreceptor)として働く。また、GABAB受容体を介した応答は、GABAA受容体やグリシン受容体などのイオンチャネル型受容体よりも遅く、長い時間スケールでの抑制作用を持つことが知られている(Gassmann & Bettler, 2012)。
GABAおよびグリシン作動性シナプスの相違点
GABA作動性シナプスは中枢神経系全般に広く分布し、大脳新皮質、海馬、視床、小脳などにおいて主要な抑制性伝達を担う(Pirker et al., 2000)。一方、グリシン作動性シナプスは脳幹、脊髄における主要な抑制性伝達を担い、小脳や網膜においても機能している(Dieudonné., 1995; Kirsch., 2006)。また、脊髄や脳幹などでは、単一神経終末において、同一のシナプス小胞からGABAとグリシンの共放出が確認されている(Jonas et al., 1998)。加えて、これらのシナプスでは未熟期においてGABA優位であった神経伝達が、発達に従ってグリシン優位に変化(スイッチング)することが知られているが(Kotak et al., 1998; Nabekura et al., 2004)、成熟後もGABAとグリシンの共放出が認められる(Dufour et al., 2010)。
GABAA受容体およびグリシン受容体は、いずれもClイオンを選択的に透過させる点で共通している。しかし、GABAA受容体を介した抑制性シナプス後電流(inhibitory post synaptic current: IPSC)は、グリシン受容体のそれに比べて減衰時間が長い(Jonas et al., 1998)。また、先述の通り、GABA作動性シナプスではGABAB受容体が自己受容体として働くことも特徴的である。
シナプス外受容体による持続性抑制=
GABAA受容体およびグリシン受容体は、シナプスに高密度で集積するだけでなく、シナプス外においても低密度で存在し、持続性抑制(tonic inhibition)に関わることが知られている(Farrant & Nusser, 2005)。こうしたシナプス外の受容体は、シナプス間隙から漏出(spillover)したリガンドや細胞外に低濃度で存在するリガンドによって活性化することで、細胞の興奮性を調節していると考えられている。そのため、脱感作しにくい特徴を持っており、δサブユニットを含むGABAA受容体など、受容体のサブユニット構成によって機能的特徴が異なると考えられる(Jacob et al., 2008)。
電気シナプスによる抑制
上述の化学シナプスとは別に、電気シナプス(electric synapse / electrical synapse)を介した抑制も知られている。電気シナプスの場合、ギャップ結合(gap junction)を介して異なるニューロン同士の細胞質が直接連結しており、細胞間のイオンの移動が容易である。そのため、あるニューロンにおける過分極が、他のニューロンへ瞬時に伝播して過分極させる。例えば、マウス小脳皮質に存在する抑制性ニューロンの一種であるゴルジ細胞は、互いにギャップ結合を形成して同期発火している。しかし、苔状線維から興奮性入力を受けると、直接入力を受けた細胞とその周囲の細胞の間で脱同期化が生じることが知られている(Vervaeke et al., 2010)。これはギャップ結合を介して周囲のゴルジ細胞に後過分極(after-hyperpolarization)が伝播するためであり、ギャップ結合が抑制性の電気シナプスとして機能している例である(Bennet & Zukin, 2004)。
抑制性シナプスにおける長期増強(iLTP)と長期抑圧(iLTD)
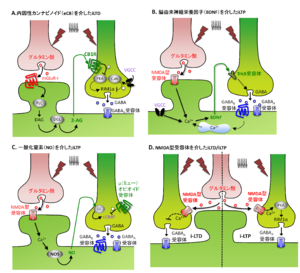
((a)内因性カンナビノイド(eCB)を介したiLTD, (b)脳由来神経成長因子(BDNF)を介したiLTP, (c)一酸化窒素(NO)を介したiLTP, (d)プレシナプスのNMDA受容体を介したiLTPおよびiLTD Castillo et al., 2011 ※使用許諾未取得
長期増強(long-term potentiation:LTP)と長期抑圧(long-term depression:LTD)は、刺激の頻度とタイミングによって、その後のシナプス伝達効率の変化が長時間に渡って持続する現象である。前者は伝達効率が上昇する一方、後者は伝達効率が減少する。このLTPとLTDは興奮性シナプスにおいてよく知られているが、抑制性シナプスにおいても生じることが報告されている(iLTP/iLTD)(Stelzer et al., 1987; Korn et al., 1992; Kano et al., 1992; Komatsu & Iwakiri, 1993)。いずれの現象についても、前シナプスと後シナプスそれぞれにおける様々な機序によって生じることが報告されている(Gaiarsa et al., 2002)。前シナプスについては、内因性カンナビノイド、脳由来神経成長因子(BDNF)、一酸化窒素(NO)などの逆行性シグナルや神経前終末のNMDA受容体を介して、伝達物質の放出確率を調節するメカニズムが考えられている(図4)。一方、後シナプスについては、GABARAPなど受容体の輸送に関わる分子やGABAA受容体自体のリン酸化‐脱リン酸化によって、シナプスにおける受容体の数や局在、イオン透過性などの構造的・機能的修飾が生じることが報告されている(Castillo et al., 2011)。また、この他にはKCC2やNKCC1などの細胞内Clイオン濃度調節機構への作用によって細胞内Clイオン濃度が変化し、その結果GABAやグリシンによる応答の振幅が変化することも示唆されている(Wang et al., 2006)。
注釈
注1. 小胞GABA輸送体(VGAT)とも呼ばれる。
注2. クロールイオン、クロライドイオン、塩化物(塩素)イオンとも呼ばれ、「Cl-」と表記される。
注3. チャネルの開閉に伴う細胞内外のイオンの出入りを考えるとき、しばしば「透過性(permeability)」と「コンダクタンス(conductance)」という語が使用される。 前者はイオンの通りやすさを指しているのに対し、後者はイオンの電気的な伝導性を指している。
注4. ゲフィリンはグリシン受容体βサブユニットと結合し、足場タンパク質として働くことがよく知られている。しかし、GABAA受容体のサブタイプは、構成するサブユニットの種類によって非常に多様であり、ゲフィリンが足場タンパクとして働くものはそれらの一部であると考えられている(Tyagarajan & Fritschy, 2014)。
関連項目
- 抑制性アミノ酸
- GABA受容体
- グリシン受容体
- シナプス伝達
- 抑制性神経細胞
- GABA
- グリシン
- 化学シナプス
- 対称性シナプス
- シナプス間隙
- 棘突起(スパイン)
- 接着分子
- ニューレキシン
- ニューロリギン
- グルタミン酸脱炭酸酵素
- パルブアルブミン
- 液胞型ATPアーゼ
- 小胞抑制性アミノ酸輸送体
- シナプス小胞
- グリア細胞
- GABA輸送体
- Gタンパク質共役型受容体
- Ca2+チャネル
- K+チャネル
- グリシン
- セリンヒドロキシメチルトランスフェラーゼ
- アストロサイト
- グリシン輸送体
- GABAA受容体
- グリシン受容体
- イオンチャネル
- GABAB受容体
- 開口放出
- 神経伝達物質
- Clイオンチャネル
- 粗面小胞体
- ゴルジ体
- 分泌小胞
- GABARAP
- キネシンスーパーファミリータンパク質
- 微小管
- エキソサイトーシス
- 細胞膜
- 側方拡散
- クラスリン
- ダイナミン
- エンドサイトーシス
- エンドソーム
- リソソーム
- ダイニン
- 膜電位
- 過分極
- 平衡電位
- 静止膜電位
- 短絡効果
- 脱分極
- Cl-/HCO3-交換輸送体
- K+-Cl-共輸送体(KCC)
- Na+-K+-Cl-共輸送体(NKCC)
- 興奮性シナプス後電位(EPSP)
- Gi/o共役型受容体
- Gタンパク質
- K+チャネル
- 電位依存性Ca2+チャネル
- 自己受容体(autoreceptor)
- 中枢神経系
- 大脳新皮質
- 海馬
- 視床
- 小脳
- 脳幹
- 脊髄
- 網膜
- 脳幹
- 抑制性シナプス後電流
- 持続性抑制(tonic inhibition)
- 電気シナプス
- ギャップ結合
- ゴルジ細胞
- 同期発火
- [[苔状線維
- 後過分極(after-hyperpolarization)
- 長期増強
- 長期抑圧
- 脳由来神経成長因子(BDNF)
- 一酸化窒素(NO)
- 逆行性シグナル
- NMDA受容体
- 放出確率
- リン酸
- 脱リン酸化
- GABARAP