「ZOファミリー」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (2人の利用者による、間の16版が非表示) | |||
| 1行目: | 1行目: | ||
<div align="right"> | <div align="right"> | ||
<font size="+1"> | <font size="+1">[http://researchmap.jp/kosodo 小曽戸 陽一]</font><br> | ||
''Korea Brain Research Institute(韓国)Mechanoneuroscience Lab''<br> | ''Korea Brain Research Institute(韓国)Mechanoneuroscience Lab''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2016年3月21日 原稿完成日:2016年月日<br> | ||
担当編集委員:[http://researchmap.jp/noriko1128 大隅 典子](東北大学 大学院医学系研究科 附属創生応用医学研究センター 脳神経科学コアセンター 発生発達神経科学分野)<br> | 担当編集委員:[http://researchmap.jp/noriko1128 大隅 典子](東北大学 大学院医学系研究科 附属創生応用医学研究センター 脳神経科学コアセンター 発生発達神経科学分野)<br> | ||
</div> | </div> | ||
名称の由来:Zonula | 名称の由来:Zonula occludens-1 | ||
{{box|text= | |||
ZO-1はタイトジャンクションを構成する主要な分子である。細胞や組織のアピカル側に局在し、細胞極性形成に関わると考えられている。また、タイトジャンクションだけでなく、アドヘレンスジャンクションやギャップジャンクションにも局在が見られることから、広く細胞間接着構造の維持に関与する分子であると考えられる。近年では、ZO-1が細胞内シグナル伝達分子や転写調節因子として働き、細胞増殖を調節するという報告もなされている。 | |||
脳神経系では、ZO-1は発生期の神経上皮組織において神経前駆細胞の極性形成に関わる。また、ギャップ結合を介したグリア細胞どうしの細胞間コミュニケーションへの関与も示唆されている。一方、血液脳関門や血液脳脊髄液関門などの組織と体液の境界領域において、様々な物質の透過を調節するバリアとして機能し、脳神経系の恒常性の維持に寄与している。 | |||
}} | |||
== | ==ZOタンパク質== | ||
[[image:zo-1-1.png|thumb|350px|'''図1.ZOタンパク質構造'''<ref name=ref4><pubmed></pubmed></ref>]] | |||
[[image:zo-1-2.png|thumb|350px|'''図2.ZO-1タンパク質の構造'''<br>N末端側にPD domain(1,2,3の数字で示す)、SH3 domain、GUK(GK)domainが存在する。C末端側にはプロリンリッチな領域(P)、選択的スプライシング部位(α、β、γ)が存在する。+、-はそれぞれ塩基性領域、酸性領域を表す<ref name=ref11><pubmed></pubmed></ref>。]] | |||
== | ZOタンパク質(図1)は、membrane-associated guanylate kinase(MAGUK)ファミリーに分類され、Tight junction protein(Tjp)とも呼ばれる。ZOタンパク質には、分子量220kDaのZO-1<ref name=ref29><pubmed></pubmed></ref> <ref name=ref18><pubmed></pubmed></ref>、160kDaのZO-2<ref name=ref12><pubmed></pubmed></ref> <ref name=ref20><pubmed></pubmed></ref>、130kDaの ZO-3<ref name=ref13><pubmed></pubmed></ref>の3種類がある。これらに共通の構造として、3個の[[PDZ]] domain, 1個の[[Src]] homology 3(SH3)domain, 1個のguanylated kinase(GUKまたはGK)domainが挙げられる。また、[[プロリン]]リッチ領域が、ZO-1, ZO-2ではカルボキシル末端側、ZO-3では2nd PDZ domainと 3rd PDZ domainの間に存在する<ref name=ref11><pubmed></pubmed></ref>。3種のZOタンパク質を区別するのはC末端領域の構造である。ZO-1のC末領域は他の2種よりも長い。また、ZO-1では選択的スプライシング部位が3カ所あるが、ZO-2では2カ所、ZO-3にはない<ref name=ref11 />。これらの違いが、3種のタンパク質の機能の違いを生み出すと考えられている。 | ||
[[ | |||
多細胞生物の上皮組織では、上皮細胞が単層あるいは重層に配列し、互いに接着したシート状構造を呈する。上皮シート構造の形成・維持には、頂端側に存在する密着結合・接着結合・接着斑からなる接着複合体が重要な役割を果たしている。ZOタンパク質は、[[細胞膜]]側で密着結合や接着結合を構成するタンパク質群と結合し、細胞質側で[[細胞骨格]]と結合する。これにより、細胞間接着構造を細胞の適切な位置に維持している。また、密着結合の形成により[[膜タンパク質]]の拡散が抑えられ、細胞の頂端側と基底側で膜組成に差が生まれることから、細胞[[極性]]形成にも関与すると考えられる。近年では、ZOタンパク質が核内に移動することにより、細胞内シグナル伝達や転写調節を担うことも報告されている<ref name=ref3><pubmed></pubmed></ref>。 | |||
===ZO-1の概要=== | |||
ZO-1は、ZOタンパク質のひとつで、peripheral membrane protein表在性膜タンパク質に分類される<ref name=ref11 />。1986年に、密着結合に含まれるタンパク質として同定された<ref name=ref29 />。また、非上皮性の細胞や密着結合を欠く細胞では、接着結合部位でcadherinやcateninと結合する<ref name=ref18><pubmed></pubmed></ref> <ref name=ref28><pubmed></pubmed></ref>。さらに、ギャップ結合において、connexinファミリータンパク質との結合が報告されている<ref name=ref9><pubmed></pubmed></ref>。これらの細胞間結合部位において、ZO-1は細胞膜側で細胞間結合を構成するタンパク質群と、細胞質側で細胞骨格成分と結合する。密着結合形成において、ZO-1はZO-2とともにclaudinsを細胞膜へ集積させる役割をもつ<ref name=ref30><pubmed></pubmed></ref>。 | |||
== | ===タンパク質構造の特徴=== | ||
ZOタンパク質に共通する構造(PDZ domain, SH3 domain, GUK domain)の他に、ZO-1は他2つのZOタンパク質に比べて長いC末領域を持つ(図2)。この領域にはactin binding regionがあり、細胞質側で細胞骨格系であるF-actinと結合する<ref name=ref6><pubmed></pubmed></ref> <ref name=ref19><pubmed></pubmed></ref>。さらに、C末端側には3カ所の選択的スプライシング部位α、β、γがあり、多様な[[スプライスバリアント]]が存在する<ref name=ref11 /> <ref name=ref5><pubmed></pubmed></ref>。また、ZO-1は1st PDZ domainおよびGUK領域に核移行シグナル領域をもつ<ref name=ref10><pubmed></pubmed></ref>。これらのことから、核内で遺伝子発現を調節する働きもあると考えられる。 | |||
==神経組織における発現と機能== | |||
===神経系形成初期における発現と機能=== | |||
発生期の神経上皮では、[[脳室]]面が頂端(apical)側となる。ZO-1は神経系形成初期に[[神経板]]の脳室面において発現が見られる。神経板ではZO-1はoccludinと結合し、機能的な密着結合を形成している。[[神経管]]閉鎖時には脳室面におけるoccludinの発現が消失するが、ZO-1の発現は維持される<ref name=ref1><pubmed></pubmed></ref>。脳室面では、接着結合の構成タンパク質であるN-cadherin<ref name=ref14><pubmed></pubmed></ref>が発現してくる。 | |||
===神経発生期における発現と機能=== | |||
神経管閉鎖後の神経上皮組織では、[[神経前駆細胞]]から神経細胞が産生されるようになる。このとき、ZO-1は脳室面に発現が見られ<ref name=ref21><pubmed></pubmed></ref>、細胞レベルでは神経前駆細胞のapical processに発現している。神経前駆細胞が分裂するとき、ZO-1陽性のapical processが2つの娘細胞に分配される。apical processとbasal processを受け継いだ娘細胞は、自己複製能をもつ神経前駆細胞となる。一方で、apical processのみ受け継いだ娘細胞は、神経細胞もしくはbasal progenitorとなってSVZで分裂し、2つの神経細胞を産生する<ref name=ref22><pubmed></pubmed></ref>。したがって、ZO-1は、神経前駆細胞のapical-basalの極性形成に寄与すると考えられる。 | |||
===グリア細胞における発現と機能=== | |||
[[アストロサイト]]や[[オリゴデンドロサイト]]において、ZO-1はギャップ結合に局在が見られる<ref name=ref17><pubmed></pubmed></ref> <ref name=ref27><pubmed></pubmed></ref> <ref name=ref15><pubmed></pubmed></ref> <ref name=ref24><pubmed></pubmed></ref>。ギャップ結合では、connexin ファミリーに属するタンパク質(Cx-)と結合する<ref name=ref8><pubmed></pubmed></ref> 。アストロサイトのギャップ結合では、ZO-1はCx30, Cx43と結合する<ref name=ref9 /> <ref name=ref27 />。オリゴデンドロサイトのギャップ結合では、ZO-1はCx47と結合する<ref name=ref24 />。しかし、ギャップ結合形成におけるZO-1の役割は明らかになっていない。ZO-1がconnexinのmembrane traffic細胞内膜輸送に関与し、ギャップ結合のターンオーバーを担うという報告もあるが、まだ検証の余地を残している<ref name=ref23><pubmed></pubmed></ref> <ref name=ref7><pubmed></pubmed></ref> <ref name=ref16><pubmed></pubmed></ref>。 | |||
===血液脳関門における発現と機能=== | |||
血液脳関門[[Blood-Brain Barrier|Blood-brain barrier]]([[BBB]])は、血管内皮細胞endothelial cell、アストロサイトastrocyte 、周皮細胞pericyteから構成される。最も内腔に位置する血管内皮細胞同士は密着結合で強固につながっている<ref name=ref2><pubmed></pubmed></ref>。この構造により、不要な物質や薬物、病原体の中枢神経系への進入を防いでいる。BBBにおける密着結合にはoccludin, claudins-1およびclaudins-5が局在する<ref name=ref26><pubmed></pubmed></ref> <ref name=ref25><pubmed></pubmed></ref>。ZO-1は細胞質側からこれらに結合し、密着結合を支えている。また、ZO-1は[[アクチン]]とも結合し、内皮細胞の形態保持に関わっている<ref name=ref13 />。 | |||
=== | ===脈絡叢における発現と機能=== | ||
脈絡叢は一層の上皮細胞からなる。[[側脳室]]、[[第3脳室]]、[[第4脳室]]に存在し、[[脳脊髄液]](CSF)を産生・[[分泌]]する。頂端膜側は脳脊[[髄液]]に接し、[[基底膜]]側で血管に接している。脈絡叢の頂端膜側には密着結合が存在し、血液脳脊髄液関門blood-CSF barrierを形成する。密着結合の細胞質側でZO-1はClaudins-1, 2,11およびoccludinと結合し<ref name=ref31><pubmed></pubmed></ref>、血液-脳脊髄液間の物質の移動を制御することで脳の恒常性を維持している。 | |||
==関連項目== | ==関連項目== | ||
2016年3月22日 (火) 17:06時点における版
小曽戸 陽一
Korea Brain Research Institute(韓国)Mechanoneuroscience Lab
DOI:10.14931/bsd.7030 原稿受付日:2016年3月21日 原稿完成日:2016年月日
担当編集委員:大隅 典子(東北大学 大学院医学系研究科 附属創生応用医学研究センター 脳神経科学コアセンター 発生発達神経科学分野)
名称の由来:Zonula occludens-1
ZO-1はタイトジャンクションを構成する主要な分子である。細胞や組織のアピカル側に局在し、細胞極性形成に関わると考えられている。また、タイトジャンクションだけでなく、アドヘレンスジャンクションやギャップジャンクションにも局在が見られることから、広く細胞間接着構造の維持に関与する分子であると考えられる。近年では、ZO-1が細胞内シグナル伝達分子や転写調節因子として働き、細胞増殖を調節するという報告もなされている。
脳神経系では、ZO-1は発生期の神経上皮組織において神経前駆細胞の極性形成に関わる。また、ギャップ結合を介したグリア細胞どうしの細胞間コミュニケーションへの関与も示唆されている。一方、血液脳関門や血液脳脊髄液関門などの組織と体液の境界領域において、様々な物質の透過を調節するバリアとして機能し、脳神経系の恒常性の維持に寄与している。
ZOタンパク質

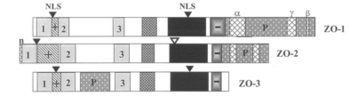
N末端側にPD domain(1,2,3の数字で示す)、SH3 domain、GUK(GK)domainが存在する。C末端側にはプロリンリッチな領域(P)、選択的スプライシング部位(α、β、γ)が存在する。+、-はそれぞれ塩基性領域、酸性領域を表す[2]。
ZOタンパク質(図1)は、membrane-associated guanylate kinase(MAGUK)ファミリーに分類され、Tight junction protein(Tjp)とも呼ばれる。ZOタンパク質には、分子量220kDaのZO-1[3] [4]、160kDaのZO-2[5] [6]、130kDaの ZO-3[7]の3種類がある。これらに共通の構造として、3個のPDZ domain, 1個のSrc homology 3(SH3)domain, 1個のguanylated kinase(GUKまたはGK)domainが挙げられる。また、プロリンリッチ領域が、ZO-1, ZO-2ではカルボキシル末端側、ZO-3では2nd PDZ domainと 3rd PDZ domainの間に存在する[2]。3種のZOタンパク質を区別するのはC末端領域の構造である。ZO-1のC末領域は他の2種よりも長い。また、ZO-1では選択的スプライシング部位が3カ所あるが、ZO-2では2カ所、ZO-3にはない[2]。これらの違いが、3種のタンパク質の機能の違いを生み出すと考えられている。
多細胞生物の上皮組織では、上皮細胞が単層あるいは重層に配列し、互いに接着したシート状構造を呈する。上皮シート構造の形成・維持には、頂端側に存在する密着結合・接着結合・接着斑からなる接着複合体が重要な役割を果たしている。ZOタンパク質は、細胞膜側で密着結合や接着結合を構成するタンパク質群と結合し、細胞質側で細胞骨格と結合する。これにより、細胞間接着構造を細胞の適切な位置に維持している。また、密着結合の形成により膜タンパク質の拡散が抑えられ、細胞の頂端側と基底側で膜組成に差が生まれることから、細胞極性形成にも関与すると考えられる。近年では、ZOタンパク質が核内に移動することにより、細胞内シグナル伝達や転写調節を担うことも報告されている[8]。
ZO-1の概要
ZO-1は、ZOタンパク質のひとつで、peripheral membrane protein表在性膜タンパク質に分類される[2]。1986年に、密着結合に含まれるタンパク質として同定された[3]。また、非上皮性の細胞や密着結合を欠く細胞では、接着結合部位でcadherinやcateninと結合する[4] [9]。さらに、ギャップ結合において、connexinファミリータンパク質との結合が報告されている[10]。これらの細胞間結合部位において、ZO-1は細胞膜側で細胞間結合を構成するタンパク質群と、細胞質側で細胞骨格成分と結合する。密着結合形成において、ZO-1はZO-2とともにclaudinsを細胞膜へ集積させる役割をもつ[11]。
タンパク質構造の特徴
ZOタンパク質に共通する構造(PDZ domain, SH3 domain, GUK domain)の他に、ZO-1は他2つのZOタンパク質に比べて長いC末領域を持つ(図2)。この領域にはactin binding regionがあり、細胞質側で細胞骨格系であるF-actinと結合する[12] [13]。さらに、C末端側には3カ所の選択的スプライシング部位α、β、γがあり、多様なスプライスバリアントが存在する[2] [14]。また、ZO-1は1st PDZ domainおよびGUK領域に核移行シグナル領域をもつ[15]。これらのことから、核内で遺伝子発現を調節する働きもあると考えられる。
神経組織における発現と機能
神経系形成初期における発現と機能
発生期の神経上皮では、脳室面が頂端(apical)側となる。ZO-1は神経系形成初期に神経板の脳室面において発現が見られる。神経板ではZO-1はoccludinと結合し、機能的な密着結合を形成している。神経管閉鎖時には脳室面におけるoccludinの発現が消失するが、ZO-1の発現は維持される[16]。脳室面では、接着結合の構成タンパク質であるN-cadherin[17]が発現してくる。
神経発生期における発現と機能
神経管閉鎖後の神経上皮組織では、神経前駆細胞から神経細胞が産生されるようになる。このとき、ZO-1は脳室面に発現が見られ[18]、細胞レベルでは神経前駆細胞のapical processに発現している。神経前駆細胞が分裂するとき、ZO-1陽性のapical processが2つの娘細胞に分配される。apical processとbasal processを受け継いだ娘細胞は、自己複製能をもつ神経前駆細胞となる。一方で、apical processのみ受け継いだ娘細胞は、神経細胞もしくはbasal progenitorとなってSVZで分裂し、2つの神経細胞を産生する[19]。したがって、ZO-1は、神経前駆細胞のapical-basalの極性形成に寄与すると考えられる。
グリア細胞における発現と機能
アストロサイトやオリゴデンドロサイトにおいて、ZO-1はギャップ結合に局在が見られる[20] [21] [22] [23]。ギャップ結合では、connexin ファミリーに属するタンパク質(Cx-)と結合する[24] 。アストロサイトのギャップ結合では、ZO-1はCx30, Cx43と結合する[10] [21]。オリゴデンドロサイトのギャップ結合では、ZO-1はCx47と結合する[23]。しかし、ギャップ結合形成におけるZO-1の役割は明らかになっていない。ZO-1がconnexinのmembrane traffic細胞内膜輸送に関与し、ギャップ結合のターンオーバーを担うという報告もあるが、まだ検証の余地を残している[25] [26] [27]。
血液脳関門における発現と機能
血液脳関門Blood-brain barrier(BBB)は、血管内皮細胞endothelial cell、アストロサイトastrocyte 、周皮細胞pericyteから構成される。最も内腔に位置する血管内皮細胞同士は密着結合で強固につながっている[28]。この構造により、不要な物質や薬物、病原体の中枢神経系への進入を防いでいる。BBBにおける密着結合にはoccludin, claudins-1およびclaudins-5が局在する[29] [30]。ZO-1は細胞質側からこれらに結合し、密着結合を支えている。また、ZO-1はアクチンとも結合し、内皮細胞の形態保持に関わっている[7]。
脈絡叢における発現と機能
脈絡叢は一層の上皮細胞からなる。側脳室、第3脳室、第4脳室に存在し、脳脊髄液(CSF)を産生・分泌する。頂端膜側は脳脊髄液に接し、基底膜側で血管に接している。脈絡叢の頂端膜側には密着結合が存在し、血液脳脊髄液関門blood-CSF barrierを形成する。密着結合の細胞質側でZO-1はClaudins-1, 2,11およびoccludinと結合し[31]、血液-脳脊髄液間の物質の移動を制御することで脳の恒常性を維持している。
関連項目
参考文献
- ↑ Resource not found in PubMed.
- ↑ 2.0 2.1 2.2 2.3 2.4 Resource not found in PubMed.
- ↑ 3.0 3.1 Resource not found in PubMed.
- ↑ 4.0 4.1 Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ 7.0 7.1 Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ 10.0 10.1 Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ 21.0 21.1 Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ 23.0 23.1 Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.