「てんかん」の版間の差分
細 →参考文献 |
|||
| (同じ利用者による、間の1版が非表示) | |||
| 3行目: | 3行目: | ||
''北東北てんかんセンター''<br> | ''北東北てんかんセンター''<br> | ||
DOI:<selfdoi /> 原稿受付日:2016年2月8日 原稿完成日:2016年3月12日<br> | DOI:<selfdoi /> 原稿受付日:2016年2月8日 原稿完成日:2016年3月12日<br> | ||
担当編集委員:[http://researchmap.jp/read0141446 漆谷 真] | 担当編集委員:[http://researchmap.jp/read0141446 漆谷 真](滋賀医科大学 医学部 神経内科)<br> | ||
</div> | </div> | ||
| 54行目: | 54行目: | ||
不整脈には[[wj:徐脈性不整脈|徐脈性不整脈]]([[wj:洞不全症候群|洞不全症候群]]、[[wj:AVブロック|AVブロック]])、[[wj:頻拍性不整脈|頻拍性不整脈]]([[wj:上室性頻拍|上室性頻拍]]、[[wj:心室性不整脈|心室性不整脈]])があり、[[wj:心電図|心電図]]検査を要する。 | 不整脈には[[wj:徐脈性不整脈|徐脈性不整脈]]([[wj:洞不全症候群|洞不全症候群]]、[[wj:AVブロック|AVブロック]])、[[wj:頻拍性不整脈|頻拍性不整脈]]([[wj:上室性頻拍|上室性頻拍]]、[[wj:心室性不整脈|心室性不整脈]])があり、[[wj:心電図|心電図]]検査を要する。 | ||
自律神経調節性失神には[[迷走神経緊張性失神]] | 自律神経調節性失神には[[迷走神経緊張性失神]](前駆症状は発汗、あくび、吐き気、腹痛)、[[頸動脈洞症候群]](振り向くような動作で起こる)、[[状況失神]](排尿、排便、咳、嚥下などが原因となる)がある。病歴の聴取が重要である。 | ||
==== 一過性脳虚血発作 ==== | ==== 一過性脳虚血発作 ==== | ||
2020年4月2日 (木) 12:54時点における版
兼子 直
北東北てんかんセンター
DOI:10.14931/bsd.6896 原稿受付日:2016年2月8日 原稿完成日:2016年3月12日
担当編集委員:漆谷 真(滋賀医科大学 医学部 神経内科)
てんかんとは種々の原因(遺伝、外因)により起きる慢性の脳の病気であり、自発性かつ反復性の発作(てんかん発作)を主徴とし、脳波検査で発作性放電を示し、焦点部位の機能異常により多彩な発作症状を示す疾患ないし症候群である。発作にはけいれんだけでなく意識障害を示すものもあり、同じ発作パターンが反復して出現する。脳波検査で発作性放電が出現しても臨床的な発作がなければてんかんではなく、1回のみの発作も治療の対象とはならない。治療は抗てんかん薬による薬物療法が主流である。約70%の症例は抗てんかん薬で発作が抑制され、抑制されない症例では食餌療法、外科治療、迷走神経刺激療法などが検討される。近年、てんかんの原因遺伝子が各種同定され、それに基づくてんかんの分子病態が報告されてきている。その流れからはてんかんを治癒できる薬剤の開発あるいはてんかんの発病を防止する治療が検討されるようになった。
てんかんとは
WHOの定義では、“てんかんとは種々の原因(遺伝、外因)により起きる慢性の脳の病気であり、自発性かつ反復性の発作(てんかん発作)を主徴とし、脳波検査で発作性放電を示し、焦点部位の機能異常により多彩な発作症状を示す疾患ないし症候群である”とされている。
発作症状は異常興奮を起こす脳部位、範囲により規定される。発作症状は同じパターンを繰り返す。発作にはけいれんだけでなく意識障害を示すものもある。各てんかん類型の発作症状は以下の診断、分類の項目で記述する。
診断
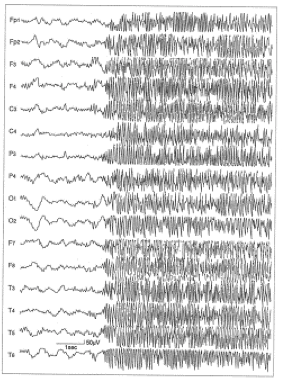
10歳女児の脳波で両側性に棘波の群発を認める。
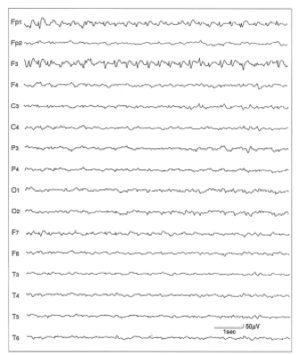
10歳男児の脳波で、左前頭葉に棘徐派結合を認める。
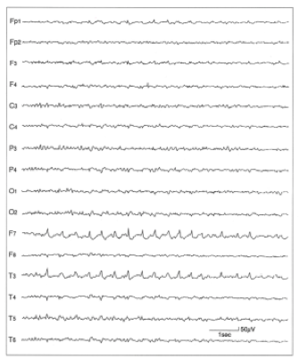
21歳女性の脳波で、左側頭前部から側頭中部にかけて、棘波、鋭波の群発を認める。
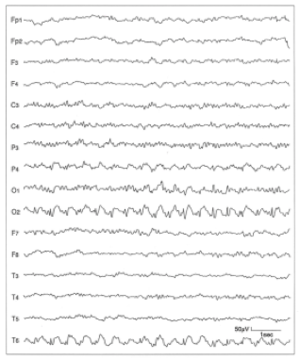
10歳男児の脳波で、右後頭葉優位に、棘徐波結合を認める。

左半球(左中心・側頭部)にローランド棘波を認める 。
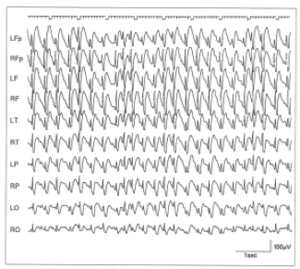
脳全体に3Hz(1秒間に3回の頻度)の棘波結合の持続的な出現を認める。
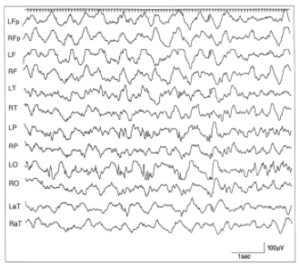
棘波、多棘波、高振幅の徐波が、同期せずばらばらに出現し、ヒプスアリスミア(hypsarrythmia)を示す。
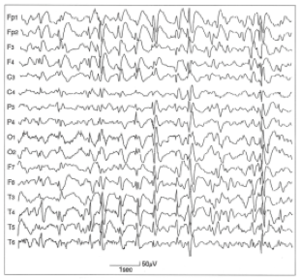
脳全体に3cpsより遅い棘徐波結合が頻会に出現する。
病歴
てんかんは慢性の脳疾患であり、脳神経細胞の異常興奮により惹起され、1回以上の発作を起こし、発作以外の症状も伴う。てんかん発作の症状はけいれん発作だけでなく、種々の程度の意識障害、行動障害を示す場合もあるが、重要な点は「発作は同じパターンを繰り返す」ことである。診断の際には、発作時に開眼しているか、チアノーゼがあるか、意識障害の有無や行動変化とその回復過程はどうなっているか、尿失禁、嘔吐、発作後の頭痛、もうろう状態などを伴うか否か、などの発作症状の観察や発病年齢の聴取が重要である。
検査所見
補助診断として脳波・ビデオ同時記録、睡眠ポリグラフィーが用いられ、脳MRI、SPECTなどが検査されるが、最近では遺伝子診断も試みられている。これらの所見を基に、てんかんか否かを判断し、てんかんと診断されれば次にてんかん発作型を分類することになる。
脳波
てんかんの診断に脳波検査は欠かせない。同じパターンを示す発作の確認と発作間歇期に発作波(棘徐波結合、鋭波-徐波結合、棘波、鋭波、徐波の群発などが記録されるとてんかんと考えられるが(脳波1-8[1]を参照。)、てんかんであっても脳波異常が記録されないときもあるため、発作症状からてんかんが疑われる場合には時間をおいて繰り返し、脳波を記録する必要がある。24時間連続して記録するビデオ脳波同時記録は服薬をしない状態で記録するため、発作時脳波を記録できる可能性が高く、鑑別診断の有力な手段である。
画像診断
てんかんの原因として脳奇形、脳腫瘍、脳出血、脳萎縮など脳の器質性疾患を見出すには MRI検査が有力であり,PETあるいはSPECTを併用し代謝、血流の変化する部位同定も焦点部位決定に役立つ。
遺伝子診断
一部のてんかん類型では遺伝子検査が行われる。特に生後間もない時に発病するてんかん類型(表3)では鑑別診断に有力な検査手段となる。てんかんの発病を防止しようとする動きがあり、これには発病前の治療が必要性であり、ハイリスク児同定に遺伝子検査が有力な手段となる[2]。
血液生化学
目撃者がいない場合にはけいれん発作後のクレアチンホスホキナーゼ (CPK)の上昇、複雑部分発作の30分以内なら血中プロラクチン濃度などの増加も診断上参考になる。
心電図
複雑部分発作などの意識障害の存在が疑われ、脳波異常がなければ、心電図検査、ホルター心電図検査も必要となる。
鑑別診断
患者の示す発作症状がてんかん性か否かが問題となる症例は少なくない。鑑別すべき重要な疾患、状態には以下のようなものがある。これらの内、てんかんを疑われて受診した患者では心因性非てんかん発作(psychogenic non-epileptic seizure: PNES)、循環器疾患に伴う失神.、およびレム睡眠行動障害、ナルコレプシー、睡眠時随伴症(夜驚症、夢中遊行)、入眠時ミオクローヌスの睡眠関連症状はしばしば鑑別を要する。
心因性非てんかん発作
心因性非てんかん発作(PNES)は精神医学でいう解離性障害あるいは転換性障害のひとつといえるが、まったく同一とはいえない。診断で難しいのはてんかんと 心因性非てんかん発作が合併した場合である。難治てんかんでは両者の合併は10-35%と高頻度である[3]。 症状は多彩である。首の横振り、後弓反張、不規則な手足の運動、刺激に反応する場合がある。発作時には閉眼していることが多く、開眼させようとすると抵抗し、対光反射は存在する。ビデオ脳波同時記録を行い、発作症状と脳波所見が一致するか否かが診断の要点となる。発作が始まった時期の前に“心因”の存在を見出すことが重要である。
循環器疾患に伴う失神
一過性の意識消失を失神というが、不整脈、自律神経調節性失神(NMS)がある。
不整脈には徐脈性不整脈(洞不全症候群、AVブロック)、頻拍性不整脈(上室性頻拍、心室性不整脈)があり、心電図検査を要する。
自律神経調節性失神には迷走神経緊張性失神(前駆症状は発汗、あくび、吐き気、腹痛)、頸動脈洞症候群(振り向くような動作で起こる)、状況失神(排尿、排便、咳、嚥下などが原因となる)がある。病歴の聴取が重要である。
一過性脳虚血発作
一過性脳虚血発作とは可逆的な経過をたどる脳卒中の病型の1つである。一過性脳虚血発作の症状持続時間は2-15分と報告されている[4]。
片頭痛
偏頭痛は発作性に見られる変則性の脈拍に一致した拍動性の頭痛である。予兆として閃光、暗点、視野欠損、錯視としての視覚の変形や大小の変化を示す片頭痛「不思議の国のアリス現象」などがある。片頭痛とてんかんの両者の特徴を持つてんかん性片頭痛症候群の存在に留意する必要がある[5]。
一過性健忘
60歳前後に発症ピークがあり、数時間持続する健忘を示す。診断基準としては逆行性健忘の存在、意識障害がなく自己同一性の喪失はない、認知機能障害は健忘のみで24時間以内に回復する[6]。
ナルコレプシー
ナルコレプシーは睡眠発作、情動脱力発作、睡眠麻痺、入眠時幻覚、自動症などを示す。診断には終夜睡眠ポリグラフで日中の過剰な睡眠と入眠時レム睡眠が見いだされること、確定診断として髄液中のオレキシンの低下がある[7]。
レム睡眠行動障害
レム睡眠期に一致して手足を動かし、叫ぶ、泣く、笑う、動き回るなどの異常行動が見られ、レム睡眠期が終わると終了する。
夜驚症、夢中遊行、錯乱性覚醒
いずれも主に小児にみられ、ノンレム睡眠からの覚醒障害により生ずると考えられている。夜驚症は睡眠中に突然起きだし恐怖に満ちた叫び、外界からの刺激に反応せず、混乱、失見当識を示す。夢中遊行は睡眠中に起き上がり、開眼し歩き回る。その後布団に戻って眠ることが多い。錯乱性覚醒は覚醒後数十分間、失見当識や思考の緩慢さが見られる。これらの状態は前頭葉てんかんとの鑑別に重要である。
入眠時ミオクローヌス
入眠時ミオクローヌスとは、入眠期に起こる短い不規則な筋の収縮であり、発生機序は不明である。ミオクロニー発作、単純部分発作との鑑別に重要である。周期性四肢運動障害は睡眠中に起こる足関節の背屈進展を伴う運動が頻回に出現する状態であり、入眠時ミオクローヌスとは異なる。
周期性四肢運動障害
周期性四肢運動障害とは睡眠中に起こる常同的四肢の運動で、むずむず脚症候群とオーバーラップする症候群として捉えられる。下肢に多く見られ、重症になると入眠が困難になる。病態として視床下部A11のドーパミン(DA)細胞の機能低下が考えられている[8]。
発作性ジスキネジア
発作性ジスキネジア(PD)はジストニア、アテトーゼ、バリスムス、舞踏病が単独あるいは複合して出現する。発作性運動誘発性ジスキネジア(paroxysmal kinesigenic dyskinesia: PKD)は男性に多く、家族性症例が多い。Proline-rich transmembrane protein 2が責任遺伝子の1つとして報告された[9]。意識障害はなく、発作間欠期は無症候性である。発作は数十秒で毎日のように頻回に出現する。随意運動の開始、ストレス、緊張などにより誘発され、前兆(感覚異常など)がある症例が多い。特発性発作性運動性ジスキネジアでは発作時脳波にも異常は見られない。症候性の場合には画像所見で異常が見いだされることもある。
非運動誘発性ジスキネジア
非運動誘発性ジスキネジア(paroxysmal non-kinesigenic dyskinesia: PNKD)は男性にやや多く、家族性の症例の多くではmyofibrillogenesis regulator 1 (MR-1)遺伝子が責任遺伝子として報告されている[10]。MR-1遺伝子変異がない症例の発病は12歳ころで、変異のある症例の発病は平均4歳である。症状は発作性運動誘発性ジスキネジアとほぼ同様であるが、MR-1変異がある症例ではジストニアあるいはジストニアと舞踏病の組み合わせで、変異がない症例ではジストニア、舞踏病、両者の組み合わせ、バリスムが観察される。発作は主に体肢に起こり、発作は週単位で10分から1時間の持続時間が多い。カフェイン、アルコール、情動変化、疲労、空腹などで誘発される。MR-1変異のない症例ではてんかんと合併することもあり、変異を有する症例では片頭痛を約半数が合併する。前兆には体肢の硬直、ふらふら感、しびれ感、などがある。
分類
てんかんの遺伝子解析の最近の進歩で、国際抗てんかん連盟(ILAE)は新たな分類を提案しているが、現実的にはてんかん発作型の分類が抗てんかん薬選択に用いれるため、てんかん発作の国際分類(1981年)[11]が多く使われている(表1)。
この分類では発作は全般発作と部分発作に 分類され、それぞれ、前者は欠神発作、ミオクロニー発作、間代発作、強直発作、強直間代発作、脱力発作に分けられ、後者は単純部分発作、複雑部分発作と2次性全般化発作に分けられる。これらの分類に従って治療のための抗てんかん薬が選択される。
| 部分発作(焦点性、局在性発作) | A.単純部分発作(意識減損はない)
(多くは“複雑部分発作”として経験される) |
B.複雑部分発作
| |
C.二次的に全般化する部分発作
| |
| 全般発作 | A. |
| B.ミオクロニー発作 | |
| C.間代発作 | |
| D.強直発作 | |
| E.強直間代発作 | |
| F.脱力(失立)発作 | |
| 未分類てんかん発作 | 不適切あるいは不完全なデータのため分類できないものや上記カテゴリーに分類できないすべてのものを含む。 |
全般発作
発作の起始から発作発射が脳全体に及び起こる発作で、発作直後から意識は失われる。原因として遺伝的素因が関与すると考えられている。
欠神発作
ごく短時間の意識喪失を示す発作で定型と非定型の2種類に分けられる。
定型欠神発作は数秒から十数秒の意識障害が突然始まり速やかに回復する。発作は頻発する傾向があり、思春期頃には消失することが多いが、一部は強直間代発作に移行する。発作時脳波は3Hz棘徐派結合ないし多棘徐派結合を示す。
否定形欠神発作は意識障害以外にも各種症状が混在した臨床症状(ミオクロニー、自働症、間代運動、自律神経症状など)がより多く見られ、脱力などの筋緊張の変化がみられることも多い。発作の始まりと終わりがゆっくりで、脳波所見も不規則で左右非対称、背景活動も突発性異常波が混在することもある。欠神発作は複雑部分発作との鑑別が必要なときがあるが、複雑部分発作は発作持続時間がより長く、成人に多い。
ミオクロニー発作
突然に両側同時に強い筋のれん縮が出現する。瞬間的なので意識障害を伴わず、光刺激により誘発されやすい。思春期に好発し、覚醒直後、入眠期に起こりやすい。発作時の脳波では両側同期性の棘徐波結合が出現し、棘波に一致し筋れん縮が起こる。
間代発作
意識消失とともに数秒から1分以上の左右対称性の全身の律動的な筋の痙攣を起こす。発作時脳波では10Hz以上の速波と徐派から構成され、棘徐派結合も出現する。
強直間代発作
突然の叫び(初期叫声)から始まることがあり、意識を突然消失し、左右対称性の全身の強直性けいれん(約30秒)が出現し、次いで間代性けいれん(30から90秒)に移行する。強直けいれんでは体幹・四肢近位が屈曲強直し、眼球が上転、口をかみしめ、呼吸筋も強直しているため呼吸できず顔面蒼白、チアノーゼが出現する。その他発作中には唾液分泌、尿失禁をすることもある。間代性けいれんは次第に収束するが、睡眠(終末睡眠)に移行し、あるいは発作後朦朧状態に移行する場合もある。この間の意識は無く、朦朧状態から回復しても頭痛、筋肉痛、嘔吐などを示すこともある。発作時脳波は強直けいれん時には筋電図やアーチファクトが入るが、間代けいれんに入ると次第に筋電図の間から見える脳波が読めるようになる。脳波は9Hz以上の低電位放電から始まり次第に周波数が減り振幅が増大化するが、発作前の脳波律動になるまでには数分間を要する。
脱力発作
一瞬(数秒以内)の全身の姿勢保持筋の緊張低下あるいは消失により起こるため、起立時に起これば転倒する。発作抑制は困難な症例もある。発作時脳波では多棘徐派結合、平坦化、低電位速波から構成される。
部分発作
脳波上の異常波が脳の一定部位から始まり、発作症状も脳の一定部位から始まる。部分発作は1)意識障害を伴わない単純部分発作、2)意識障害を伴う複雑部分発作、3)、二次性全般か発作に分類される。これらの単純部分発作は複雑部分発作、二次性全般化発作の初期症状として出現することも少なくない。
単純部分発作
意識障害を示さず、発作時脳波は脳皮質の局所性の放電である。これは発作症状から4種類に分けられる。
- 1. 運動徴候を伴う発作は焦点性運動発作、ジャクソン型発作、回転発作、姿勢発作、音声発作がある。焦点性運動発作は前中心回の運動領野に焦点があり、その脳部位に関連する身体部位のけいれんが出現する。ジャクソン型発作は前中心回の一部に始まった発作発射が周囲の脳部位に波及するため手ー腕ー下肢などのように同側の身体部位を巻き込んで発作が拡大してゆく。発作後に足などの麻痺が残ることがあり、これをトッドの麻痺という。
回転発作は脳皮質焦点の反対側へ眼球、顔、躯幹を向ける発作である。
姿勢発作は補足運動野に焦点がある場合、反対側の上肢を挙上し、それを見上げるように頭部、眼球を回転させる。音声発作は前中心回の発作発射により同じ言葉を反復する、叫ぶ、あるいは言葉を話せなくなる発作である。
2. 体性感覚ないし特殊感覚症状を伴う発作には体性感覚発作、視覚発作、聴覚発作、めまい発作がある。体性感覚発作は後中心回の発作発射によりその部位がつかさどる体の一部にしびれ感などの知覚異常が出現する。視覚発作は後頭葉にてんかん焦点があるとき、閃光、渦巻く雲が見えたり視野が狭くなったりする。
聴覚発作はてんかん焦点が側頭葉上部にあると、発作として音が聞こえあるいは逆に聞こえなくなる。鉤回に焦点があると匂いを感ずる発作が、焦点が島、弁蓋部にあると苦味、酸味などの味覚発作が出現する。側頭葉上回にあるとめまい発作が出現すると考えられている。
3. 自律神経症状ないし兆候を伴う発作は、数分以内の自律神経系症状(悪心、嘔吐、頭痛、腹部不快感など)を示す発作で、血圧の上昇、瞳孔散大、くしゃみなどもみられる。成人の場合には多彩な自律神経症状は発作症状の一部として出現する。
4. 精神症状を伴う発作 発作発射は側頭葉皮質から辺縁系の一部に限局するため、意識は失われない。発作症状は多彩であり、情動発作が多い。これは側頭葉下面皮質に焦点があるとき、不安、恐怖、怒り、多幸感、を感ずるものである。言語中枢付近に焦点がある場合、言葉を話せなくなる(運動性失語)あるいは言葉を理解できなくなる(感覚性失語)を起こす。
記憶障害発作は一過性の健忘、既視体験、未視体験などの発作症状を示し、認知発作には夢幻様体験、強制思考などがある。錯覚発作の症状として変形視、巨視症、小視症などの視覚症状と音が大きくあるいは小さく聞こえるなどの聴覚性症状がある。構成幻覚発作は人の声、動作が意味を持ち、情景が見え、音楽が聞こえるなどの複雑な幻覚を感ずる発作である。
複雑発作
発作時に意識障害を認め、発作後に健忘を残す。発作の始めから意識障害を示す発作と単純部分発作から複雑部分発作へと移行する発作があり、それぞれ意識障害のみを示す発作と自働症を伴う発作に細分化される。意識障害は数十秒から数分間に及び、意識障害の始まりと終わりは欠神発作に比較し、よりゆっくりとしている。発作中は動作が止まるときと体を奇妙に動かす自働症を示すこともある。側頭葉起源の自働症は運動を伴わない凝視と意識の断絶で始まり、噛む、嚥下する、衣類をなでるなどの、単純かつ定型的な自働症が続発する。側頭葉以外に起始場合には凝視を欠き、歩行性自働症、両側四肢の持続的運動および強直性の反体側への頭部、眼球の運動を特徴とする場合、あるいは転倒発作で開始され、錯乱と健忘を伴い、徐々に回復するタイプがある[12]。
前葉性の複雑部分発作の特徴は蹴ったり叩いたりする複雑な運動性自働症、奇妙な発語、軽症の発作後もうろう状態と急速な回復とがある。複雑部分発作時の脳波所見は側頭部、前頭部ないしは広範性の一側性ないしは両側性放電を示すが、脳波異常を記録できない場合もあり、心因性発作と誤診されることもある。
二次性全般化発作
単純部分発作から、複雑部分発作から、単純部分から複雑部分発作を経て二次性全般化発作にいたる3経路がある。強直・間代発作が多いが、強直あるいは間代だけの場合もある。発作時脳波は焦点性発射が全般化することが多く、発作間歇期には焦点性異常波が記録される。しかし、異常所見が記録されないこともある。
2006年の発作型の分類
てんかん学の進歩あるいは遺伝学の進歩に伴い国際抗てんかん連盟は分類の改定を行っている。表2に2006年提案の発作型の分類を示す[13]。この分類では、てんかんは全般性起始と焦点性起始、新生児発作に分けられる。 全般性発作(全般性起始)はA.強直もしくは間代性症状を有する発作、B.欠神発作、 C.ミオクロニー発作型、D.てんかん性スパズム、E. 脱力発作に分類される。
焦点性(部分性起始)発作はA.局所発作(焦点部位により新皮質、海馬・海馬傍回は局所内伝播の有無で細分される。B.同側への伝播、C.対側への伝播、D.2次性全般化、に分類された。この分類ではてんかん性スパスムズ(Epileptic spasms)が独立した名称で採用されたが、これは突然発作が起こり、終了する短い発作で(1秒程度)、体軸と近位筋の両側性の強直れん縮である。
発作時間は強直発作より短く、ミオクロニーれん縮(0.1秒)より長い。発作は覚醒直後に起こりやすく周期的に出現することが多い。この分類ではてんかん重積状態がリストされたが、この分類も改定されつつあり、当面は臨床では1981年の分類で薬剤を選択したほうが無難である。
発症年齢によるてんかん症候群と関連病態の分類(2006)を表3に示す。表のように、発症年齢によるてんかん症候群の分類は診断する際に参考になり、発症年齢の聴取は極めて重要である。
Ⅲ.新生児発作| 自己終息性てんかん発作 | Ⅰ.全般性起始 |
A.強直もしくは間代性症状を有する発作 |
| B.欠神発作 | ||
C.ミオクロニー発作型
| ||
| D.てんかん性スパズム | ||
| E.脱力発作 | ||
| Ⅱ.焦点性(部分性起始) | A.局所
| |
B.同側への伝播
| ||
C.対側への伝播
| ||
D.二次性全般化
| ||
| てんかん重積状態 | ||
| Ⅰ.持続性部分てんかん | ||
| Ⅱ.補足運動野てんかん重積状態 | ||
| Ⅲ.持続性前兆 | ||
| Ⅳ.認知障害性焦点性てんかん重積状態 | ||
| Ⅴ.強直間代てんかん重積状態 | ||
| Ⅵ.欠神てんかん重積状態 | ||
| Ⅶ.ミオクロニーてんかん重積状態 | ||
| Ⅷ.強直てんかん重積状態 | ||
| Ⅸ.微細てんかん重積状態 | ||
| 新生児期 | 青年期 |
| 良性家族性新生児発作 早期ミオクロニー脳症 大田原症候群 |
若年欠神てんかん 若年ミオクロニーてんかん 進行性ミオクローヌスてんかん |
| 乳児期 | 年齢と相関が低いもの |
| 早期乳児遊走性部分発作 West症候群 乳児ミオクロニーてんかん 良性乳児発作 Dravet症候群 非進行性ミオクロニー脳症 |
常染色体優性夜間前頭葉てんかん 家族性側頭葉てんかん 海馬硬化による内側側頭葉てんかん Rasmussen症候群 視床下部過誤腫による笑い発作 |
| 小児期 | 特殊なてんかん状態 |
| 早発良性小児後頭部てんかん 中心・側頭部棘波を示す良性小児てんかん ミオクロニー失立発作を持つてんかん 遅発小児後頭部てんかん ミオクロニー欠神てんかん Lennox-Gastaut症候群 Landau-Kleffner症候群を含む徐波睡眠期棘徐波を示すてんかん 小児欠神てんかん |
特定化されない症候性焦点性てんかん 全般性強直間代発作のみを持つてんかん 反射てんかん 熱性けいれんプラス 多様な焦点を示す家族性焦点性てんかん |
| てんかん診断を必要としないてんかん発作状態 | |
| 良性新生児発作 熱性発作 |
病態生理
てんかんの原因には遺伝性、脳血管性、外傷性、腫瘍性、変性、感染症性などがあるが、これにより神経細胞の抑制の低下または興奮性の亢進により神経細胞が興奮し、てんかん発作を起こす。てんかんを起こすようになる脳内の変化をてんかん原性(epileptogenesis)といい、発作を繰り返し起こすようになる変化を発作原性(ictogenesis)というが、それぞれの過程が脳内に成立する時期と期間が存在することが分かってきた[14] [15]。神経細胞自体の興奮性は細胞内外のイオン濃度の変化、グリア細胞からの影響を受ける。
遺伝子変異などにより、種々の変化がシナプスを中心にダイナミックな変化が起こる。神経細胞膜の各種チャネルの機能異常が起こり、神経細胞内外のイオン濃度が変化し、神経細胞は脱分極する。その結果、細胞外のカリウムイオン濃度上昇とカルシウムイオン濃度の減少を引き起こすが、カルシウムイオンの減少はアストロサイトのカルシウムシグナリングを活性化、グルタミン酸の遊離を誘発する。また、興奮したシナプスからあふれ出たグルタミン酸もアストロサイトのグルタミン酸受容体と結合し、カルシウムシグナリングを活性化させる。結果として突発的脱分極シフト(paroxysmal deporalization shift)が起こり、それが周囲の神経細胞群の興奮を引き起こし、発作発射にいたる。この領域の研究の進展は目覚しく、新たな知見が集積されつつある[16]。
治療
治療は抗てんかん薬による薬物療法が主流で、薬剤で発作抑制が困難な場合、外科治療の可能性が探られる。小児では食餌療法(ケトン食療法など)なども試みられ、外科治療困難例に対しては迷走神経刺激療法も開始されている。
治療薬選択
治療薬は発作型により選択されるが、全般発作に対してはバルプロ酸(VPS)、エトサクシミド(ETS)、ラモトリジン(LTG)、レベチラセタム(LEV)、ソニサミド(ZNS)などが選択され、部分発作に対してはカルバマゼピン(CBZ)、トピラメート(TPM)、レベチラセタム、ソニサミドなどが選択される。ドラヴェー症候群にスティリペントールが、レノックス・ガストー症候群にはルフイナミドが使用できるようになった。ガバペンチンは小児難治てんかんに効果を示すときがあり、クロバザムは全般、部分の両方に付加投与として処方されることが多い。
薬剤選択には副作用も考慮すべき要因である。容量依存性服作用はすべての抗てんかん薬で存在するため、投与量、血中濃度に留意する必要があるが、各薬剤特有の副作用が薬剤選択に重要である。フェニトインは歯肉増殖、多毛症のゆえに女性には避けるべきで、ソニサミド、トピラメートでうつ症状が出現することがあり、レベチラセタムでは行動異常が、ラモトリジンでは重篤な発疹が出現することがある。
抗てんかん薬には発疹を起こすものがあるが、HLA領域の遺伝子多型によることが明らかとなり、予測可能性が出てきた[17]。
個別化治療

膜の上は細胞外、下は細胞内を示す。GABA受容体には膜貫通部位が4個ある。
NはN端をCはC端を示し、数字は変異の位置を示す。[18]。
てんかんの遺伝情報に基づいた個別化治療の戦略はてんかんの病態(例えば、イオンチャネルの異常)、その異常に対応する抗てんかん薬、その抗てんかん薬の副作用を考慮し薬剤を選択する。一方、薬物代謝酵素、薬剤排泄トランスポーターの遺伝子多型からその個人の適量を決定する、という個別化治が示されている[17]。
表4は抗てんかん薬が基質となる代謝酵素(シトクロムP450;CYPs)分子種を示しているが、CYP3A4、CYP2C9、CYP2C19が抗てんかん薬の代謝に重要であり、各CYPには遺伝的多型が存在し代謝能力が異なる(extensive、intermediate、poor metabolizer)。日本人ではCYP2C19のpoor metabolizerは約18%、CYP2C9は約7%がpoor metabolizerである。
薬剤選択に関してその一例として図1にGABA受容体の膜展開図を示す[18]。膜の上は細胞外、下は細胞内を示す。GABRA1遺伝子上の4の位置(A322D)に変異があるとバルプロ酸が第一選択役となり、GABRG2の1の位置(R43Q)に変異があるとバルプロ酸、トピナ、バルビツール剤が選択される。GABRG2の変異位置がK289Mの場合、トピナ、バルビツール剤、ベンゾジアゼピン、ガバペンチンなどが選択され、Q351X変異を持つ症例では抗てんかん薬に抵抗性を示し、変異がR139Gの症例は熱性けいれんの可能性があり、抗てんかん薬が不要かもしれない[18]。
このように症例が持つ遺伝子異常の種類、変異の位置などにより薬剤の選択が可能となり、薬物代謝酵素、薬剤排泄トランスポーターなどの遺伝子多型から適量を算出することが理論的には可能である。一部の抗てんかん薬では患者の体重、併用薬剤、処方予定の抗てんかん薬に関わるCYPの多型、などからクリアランスを想定できるので、その患者の抗てんかん薬の至適容量を計算することができる[19]。近い将来、このような個別化治療が臨床で実施可能となり、薬剤選択と投与量調整における時間が短縮する。
| 抗てんかん薬 | 排泄経路 | |
| カルバマゼピン | CYP3A4/5, CYP2D6, CYP2C8, EPHX1 | 酸化 |
| エトサクシミド | CYP3A4 | 酸化 |
| バルプロ酸 | CYP2D6, CYP2C9, CYP2C19, CYP1A2, CYP2B1, CYP2B2, CYP2B4, CYP2E1, CYP4B1, UGT2B1 | 酸化(>50%)とグルクロン酸抱合(30-40%) |
| ガバペンチン | - | 腎排泄 |
| フェノバルビタール | CYP3A4, CYP2D6, CYP2C9, CYP2C19, CYP2B1, CYP4A1 | 酸化+N-グルコシル化(70%)と腎排泄(25%) |
| フェニトイン | CYP3A4, CYP2C8, CYP2C9, CYP2C10, CYP2C19 | 酸化 |
| トピラメート | CYP2C19 | 酸化(20-60%)と腎排泄(40-80%) |
| レベチラセタム | 水酸化酵素(アセトアミド基の酵素的加水分解) | 腎排泄(65%)と加水分解(35%) |
| ラモトリジン | UGT1A4, UGT2B7 | グルクロン酸抱合 |
| ゾニサミド | CYP3A4, CYP2D6 | 酸化 + 還元 + N-アセチル化(>50%)と腎排泄 |
| クロバザム | CYP3A4 | 酸化 |
太字で示されている酵素は抗てんかん薬代謝に関与する主な酵素である。CYP:酸化的代謝を行うチトクロームp450、EPH:エポキシド水解酵素、UGT:UDP-グルクロニールトランスフェラーゼ
| 抗てんかん薬 | 副作用 | HLAアリル | 人種 | オッズ比 | P値 |
| カルバマゼピン | SJS/TEN | HLA-B*1502 | 台湾の中国人 タイ人 |
2505 54.8 |
2.0×10-32 2.9×10-12 |
| SJS/TEN | HLA-B*1511 | 日本人 韓国人 |
16.3 18.4 |
0.0004 0.002 | |
| SJS/TEN (SJS/TEN/HSS/MPE) |
HLA-A*3101 | 日本人 コーカシアン |
33.9 (9.5) 25.9 (9.1) |
2.4×10-4 (1.09×10-16) 8.0×10-5 (1.0×10-7) | |
| MPE/HSS | HLA-A*3101 | 香港の中国人 | 12.2 | 0.0021 | |
| フェニトイン | SJS/TEN | HLA-B*1502 | タイ人 | 18.5 | 0.005 |
| カルバマゼピン/フェニトイン/ラモトリジン | SJS/TEN/HSS | HLA-B*1502 | 香港の中国人 | 17.6 | 0.001 |
SJS:スチーブンスジョンソン症候群、TEN:中毒性表皮壊死、HSS:過敏性症候群、MPE:斑丘疹
発病の防止
現在の薬物療法の対症療法であり、根治療法ではない。抗てんかん薬により発作を抑制し、自然治癒を待つという戦略である。前者に対してiPS細胞などの新たな薬剤スクリンーニングシステムの導入、後者に対しててんかんの発病防止戦略が考えられている[2]。
一例として、常染色体優性夜間前頭葉てんかんで同定されたCHRNA4の変異S284Lを導入した遺伝子改変動物[15]を用いた解析から発病前の特定の一定期間フロセミドで治療すると発病を防止できることが報告された[14]。フロセミドはNKCC1を阻害することから、細胞内塩化物イオン濃度を減少させ、GABAの抑制機能を回復するからと考えられている。同様にNKCC1を抑制するブメタナイド(bumetanide)は側頭葉てんかんに効果を示す[20] [21] [22]。これらの報告は部分発作に共通の分子基盤が存在し、その分子病態を補正する物質で適切な時期に治療するとてんかんの発病を防止できることを示している。
疫学
有病率(prevalence rate)とはある時点での患者の割合であるが、調査日における対象人口1000人あたりの患者数で示される。治療継続中または最終発作から5年未満の患者を活動性てんかんとみなして調査する。有病率を考える上で問題となるのは調査方法である。つまり、てんかんの診断方法をいかにするか、単発の発作を除いているか、小児期では発熱時の発作を除いているか、どの地域で調査するか、調査がpopulation based surveyなのか、hospital based surveyなのか、あるいは登録制度を持っている国ではそこに集積されたデータを用いているか、などである。調査地域の年齢構成が異なるため、対象年齢別の調査にする必要がある。これらの要因で有病率は異なる。
表6に地域調査による最近の年齢別に有病率が報告されているデータを示した。前年例で見ると4.8から15.4とばらつくが、これは調査の方法論に起因するものと考えられる。最近は先進国では高齢者が増加しているが、有病率は高齢者で比較的高くなる傾向が認められる。国内では地域調査は少ないが、小児期(0歳から12歳)の有病率は8.8、単発または発熱時の発作を除くと5.3と報告されている[23]。
| 国及び報告者 | 患者数 | 対象年齢 | 有病率(/1,000) |
| USA Hauserら 1991[25] |
383 | 全年齢 0~14歳 15~64歳 65歳以上 |
6.79 3.92 7.12 10.61 |
| Italy Maremmaniら 1991[26] |
51 | 全年齢層 0~19歳 20~59歳 60歳以上 |
5.1 6.3 4.9 4.5 |
| Tanzania Rwizaら 1992[27] |
185 | 全年齢 0~19歳 20~59歳 60歳以上 |
10.2 6.6 16.2 12.1 |
| Iceland Olafssonら 1999[28] |
428 | 全年齢 0~14歳 15~64歳 65歳以上 |
4.8 3.4 5.0 6.5 |
| Honduras Medinaら 2005[29] |
100 | 全年齢 0~19歳 20~59歳 60歳以上 |
15.4 13.7 19.0 9.5 |
| Croatia Bielenら 2007[30] |
1,022 | 全年齢 0~18歳 19~65歳 66歳以上 |
4.8 4.9 4.9 4.4 |
関連項目
参考文献
- ↑ 兼子直
追補改訂版、てんかん教室
新興医学出版、2003 - ↑ 2.0 2.1 兼子直、他
新しい抗てんかん薬の開発とてんかんの発病防止戦略
最新医学 70;1044-1050, 2015. - ↑ Krumholz A et al
Coexisting epilepsy and nonepileptic seizures.
In: Kaplan PW, et al, eds: Imitator of epilepsy.
Pp 261-276, Demos Medical Publishingm INC, New York, 2005. - ↑ 小坂昌宏
一過性脳虚血発作の症状
神経内科 72;562-568, 2010. - ↑
Panayiotopoulos, C.P. (1994).
Elementary visual hallucinations in migraine and epilepsy. Journal of neurology, neurosurgery, and psychiatry, 57(11), 1371-4. [PubMed:7964814] [PMC] [WorldCat] [DOI] - ↑
Bartsch, T., & Deuschl, G. (2010).
Transient global amnesia: functional anatomy and clinical implications. The Lancet. Neurology, 9(2), 205-14. [PubMed:20129169] [WorldCat] [DOI] - ↑ Americal Academy of Sleep Medicine
International Classification of Sleep Disorders. Second Edition. Diagnostic and coding Manual.
American Academy of Sleep Medicine, 2005 - ↑ 稲見康司、他
むずむず脚症候群、周期性四肢運動障害
日本臨床 71(増刊号5);485-490, 2013. - ↑
Groffen, A.J., Klapwijk, T., van Rootselaar, A.F., Groen, J.L., & Tijssen, M.A. (2013).
Genetic and phenotypic heterogeneity in sporadic and familial forms of paroxysmal dyskinesia. Journal of neurology, 260(1), 93-9. [PubMed:22752065] [PMC] [WorldCat] [DOI] - ↑
Bruno, M.K., Lee, H.Y., Auburger, G.W., Friedman, A., Nielsen, J.E., Lang, A.E., ..., & Ptácek, L. (2007).
Genotype-phenotype correlation of paroxysmal nonkinesigenic dyskinesia. Neurology, 68(21), 1782-9. [PubMed:17515540] [WorldCat] [DOI] - ↑
(1981).
Proposal for revised clinical and electroencephalographic classification of epileptic seizures. From the Commission on Classification and Terminology of the International League Against Epilepsy. Epilepsia, 22(4), 489-501. [PubMed:6790275] [WorldCat] [DOI] - ↑
Escueta, A.V., Bacsal, F.E., & Treiman, D.M. (1982).
Complex partial seizures on closed-circuit television and EEG: a study of 691 attacks in 79 patients. Annals of neurology, 11(3), 292-300. [PubMed:7092181] [WorldCat] [DOI] - ↑
Engel, J. (2006).
Report of the ILAE classification core group. Epilepsia, 47(9), 1558-68. [PubMed:16981873] [WorldCat] [DOI] - ↑ 14.0 14.1
Yamada, J., Zhu, G., Okada, M., Hirose, S., Yoshida, S., Shiba, Y., ..., & Kaneko, S. (2013).
A novel prophylactic effect of furosemide treatment on autosomal dominant nocturnal frontal lobe epilepsy (ADNFLE). Epilepsy research, 107(1-2), 127-37. [PubMed:24045013] [WorldCat] [DOI] - ↑ 15.0 15.1
Zhu, G., Okada, M., Yoshida, S., Ueno, S., Mori, F., Takahara, T., ..., & Hirose, S. (2008).
Rats harboring S284L Chrna4 mutation show attenuation of synaptic and extrasynaptic GABAergic transmission and exhibit the nocturnal frontal lobe epilepsy phenotype. The Journal of neuroscience : the official journal of the Society for Neuroscience, 28(47), 12465-76. [PubMed:19020039] [PMC] [WorldCat] [DOI] - ↑
Tomioka, N.H., Yasuda, H., Miyamoto, H., Hatayama, M., Morimura, N., Matsumoto, Y., ..., & Aruga, J. (2014).
Elfn1 recruits presynaptic mGluR7 in trans and its loss results in seizures. Nature communications, 5, 4501. [PubMed:25047565] [WorldCat] [DOI] - ↑ 17.0 17.1 17.2 17.3 吉田秀一ら
遺伝情報に基づいた個別化治療
医学のあゆみ 232;951-955, 2010. - ↑ 18.0 18.1 18.2
Kaneko, S., Yoshida, S., Kanai, K., Yasui-Furukori, N., & Iwasa, H. (2008).
Development of individualized medicine for epilepsy based on genetic information. Expert review of clinical pharmacology, 1(5), 661-81. [PubMed:24422737] [WorldCat] [DOI] - ↑
Saruwatari, J., Ogusu, N., Shimomasuda, M., Nakashima, H., Seo, T., Tanikawa, K., ..., & Nakagawa, K. (2014).
Effects of CYP2C19 and P450 oxidoreductase polymorphisms on the population pharmacokinetics of clobazam and N-desmethylclobazam in japanese patients with epilepsy. Therapeutic drug monitoring, 36(3), 302-9. [PubMed:24345815] [WorldCat] [DOI] - ↑
Eftekhari, S., Mehvari Habibabadi, J., Najafi Ziarani, M., Hashemi Fesharaki, S.S., Gharakhani, M., Mostafavi, H., ..., & Hadjighassem, M.R. (2013).
Bumetanide reduces seizure frequency in patients with temporal lobe epilepsy. Epilepsia, 54(1), e9-12. [PubMed:23061490] [WorldCat] [DOI] - ↑
Koyama, R., Tao, K., Sasaki, T., Ichikawa, J., Miyamoto, D., Muramatsu, R., ..., & Ikegaya, Y. (2012).
GABAergic excitation after febrile seizures induces ectopic granule cells and adult epilepsy. Nature medicine, 18(8), 1271-8. [PubMed:22797810] [WorldCat] [DOI] - ↑
Reid, A.Y., Riazi, K., Campbell Teskey, G., & Pittman, Q.J. (2013).
Increased excitability and molecular changes in adult rats after a febrile seizure. Epilepsia, 54(4), e45-8. [PubMed:23293960] [WorldCat] [DOI] - ↑
Koyama, R., Tao, K., Sasaki, T., Ichikawa, J., Miyamoto, D., Muramatsu, R., ..., & Ikegaya, Y. (2012).
GABAergic excitation after febrile seizures induces ectopic granule cells and adult epilepsy. Nature medicine, 18(8), 1271-8. [PubMed:22797810] [WorldCat] [DOI] - ↑ 大塚頌子
てんかんの疫学
臨床てんかん学、p17-22,医学書院、2015. - ↑
Hauser, W.A., Annegers, J.F., & Kurland, L.T. (1991).
Prevalence of epilepsy in Rochester, Minnesota: 1940-1980. Epilepsia, 32(4), 429-45. [PubMed:1868801] [WorldCat] [DOI] - ↑
Maremmani, C., Rossi, G., Bonuccelli, U., & Murri, L. (1991).
Descriptive epidemiologic study of epilepsy syndromes in a district of northwest Tuscany, Italy. Epilepsia, 32(3), 294-8. [PubMed:2044492] [WorldCat] [DOI] - ↑
Rwiza, H.T., Kilonzo, G.P., Haule, J., Matuja, W.B., Mteza, I., Mbena, P., ..., & Mwaijande, F. (1992).
Prevalence and incidence of epilepsy in Ulanga, a rural Tanzanian district: a community-based study. Epilepsia, 33(6), 1051-6. [PubMed:1464263] [WorldCat] [DOI] - ↑
Olafsson, E., & Hauser, W.A. (1999).
Prevalence of epilepsy in rural Iceland: a population-based study. Epilepsia, 40(11), 1529-34. [PubMed:10565579] [WorldCat] [DOI] - ↑
Medina, M.T., Durón, R.M., Martínez, L., Osorio, J.R., Estrada, A.L., Zúniga, C., ..., & Holden, K.R. (2005).
Prevalence, incidence, and etiology of epilepsies in rural Honduras: the Salamá Study. Epilepsia, 46(1), 124-31. [PubMed:15660778] [WorldCat] [DOI] - ↑
Bielen, I., Cvitanovic-Sojat, L., Bergman-Markovic, B., Kosicek, M., Planjar-Prvan, M., Vuksic, L., ..., & Matek, P. (2007).
Prevalence of epilepsy in Croatia: a population-based survey. Acta neurologica Scandinavica, 116(6), 361-7. [PubMed:17986093] [WorldCat] [DOI]