成長円錐
英語名 Growth cone
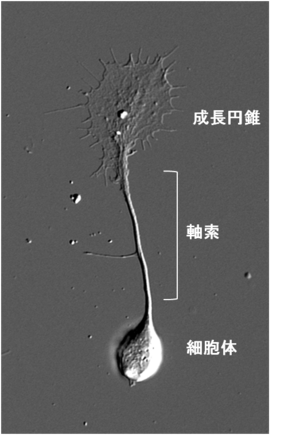
成長円錐は伸長中の神経突起の先端部に見られるアメーバ状の構造物である。19世紀にスペインの神経科学者Ramón y Cajalにより、固定染色した神経組織において神経軸索先端部に円錐状の構造が発見され、growth cone=成長円錐と名付けられた。2次元基質上で培養した場合は薄く扁平な形態をとり、多くが伸長中の神経軸索の先端に存在するが樹状突起の先端にも存在する。また、PC12細胞やN1E-115細胞のような株化細胞から伸びる神経突起様構造物の先端にも見られる。軸索の成長円錐の場合、標的神経細胞の樹状突起や組織へと到達した後は形態変化を起こし前シナプス部となる。成長円錐は極めて高い運動性を示し、細胞骨格や接着分子、膜輸送経路の制御を通じて前方へと移動し、神経突起を牽引することで伸長させる。また、成長円錐の形質膜には軸索ガイダンス因子に対する受容体が多数発現しており、軸索の成長円錐は細胞外環境に存在する軸索ガイダンス因子に応じてその運動性と進行方向を変化させ、神経軸索を正しい標的細胞へと投射させる。
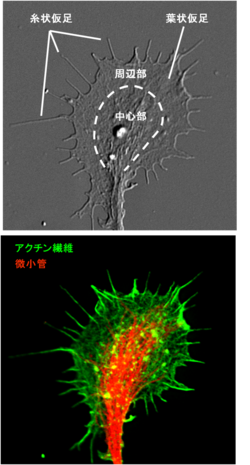
図2 ニワトリ胚DRG神経細胞の成長円錐の微分干渉顕微鏡像(上)とアクチン繊維-微小管の二重蛍光顕微鏡像(下)

成長円錐は2次元基質上では扇状に広がった手のような構造で、その形態から周辺部(Peripheral domain)と中心部(Central domain)の2つの部分に大別される。また、周辺部と中心部の境界部分を移行帯(Transition zone)として分類することもある。
周辺部
周辺部は扁平の構造で、成長円錐中央から放射状に伸びた細い指のような糸状仮足(filopodia)の間を、水掻きのような薄いシート状の葉状仮足(lamellipodia)が埋めている。成長円錐の周辺部はアクチン(actin)繊維に保持されているが、糸状仮足と葉状仮足ではアクチン繊維の形状が異なる。糸状仮足内のアクチン繊維は比較的長い束状の直線的な形状であるのに対し、葉状仮足内では短いアクチン繊維が枝分かれした網目状の構造をしている。また、周辺部には比較的動的な微小管(microtuble)末端も見られる[1] 。周辺部のアクチン繊維は糸状仮足、葉状仮足ともプラス端を外側に向けて配向しており、先端部における単量体アクチンの重合によるアクチン繊維の伸長が糸状仮足や葉状仮足の周辺部への拡大につながり、成長円錐の形質膜を前方に推し進める原動力となっている。
中心部
中心部は軸索からつながった成長円錐中央部の比較的厚みのある部分で、軸索から伸びている安定な微小管が主な構成成分である。軸索内の微小管はMicrotubule-associated proteins(MAPs)により束ねられているが、中心部では先端部がほどけ、一部の微小管は周辺部に向かって放射状に広がっている。中心部には比較的安定なアクチン繊維も存在し、細胞骨格の他にもミトコンドリアや小胞体などの細胞小器官、膜小胞などを多く含んでいる。
前進運動の分子メカニズム
成長円錐は①周辺部先端での糸状仮足の形成・伸長、②糸状仮足間への葉状仮足の流れ込みによる周辺部の拡大、③後方からの中心部の侵入、という3つの過程を繰り返すことで前方へと移動していく。この成長円錐の前方移動の分子メカニズムとして、前方移動の仕組みを自動車の走行に例えたクラッチ仮説が有力なものとして提唱されている。クラッチ仮説ではアクチン繊維のターンオーバーと成長円錐形質膜上に発現する接着分子、接着分子とアクチン繊維をつなぐクラッチ分子、接着分子のリサイクリングが協調して働き、成長円錐が前方移動を行っていると説明される。
動力源となるアクチン繊維のターンオーバー
周辺部に存在するアクチン繊維は、プラス端を成長円錐先端に、マイナス端を中心部側に向けて規則正しく配置されており、単量体アクチンのアクチン繊維への付加は主に先端部で、アクチン繊維の解離は主に中心部側で起こる。同時にアクチン繊維全体はモータータンパク質であるミオシン(myosin)ⅠbやミオシンⅡの作用により一定の速度(約5 μm/min)で先端部から中心部へと移動している。そのため、見かけ上、周辺部が運動を停止しているような場合でも、その内部に存在するアクチン繊維は先端部から中心部へと運ばれており、その移動分を補うように先端部では重合、中心部では脱重合が続いている(トレッドミル)。このような成長円錐における細胞骨格の動態は、Waterman-Storerのグループによって開発された蛍光スペックル顕微鏡法によって詳細な解析が可能である。
細胞外基質との接着
成長円錐の形質膜には免疫グロブリン(immunogloblin)ファミリー、カドヘリン(cadherin)ファミリー、インテグリン(integrin)ファミリーなどの接着分子が発現しており、細胞外基質、または隣接する細胞との接着を媒介している。多くの場合、細胞外領域での接着分子のリガンド結合および細胞表面での接着分子クラスタリングは細胞内領域における接着分子とアクチン繊維間の結合を誘導する。例えば、インテグリン細胞外領域におけるフィブロネクチン(fibronectin)との結合は、インテグリン細胞内領域と細胞骨格の結合を引き起こす。同様に、ショウジョウバエのL1ホモログであるニューログリアン(neuroglian)におけるリガンド依存性クラスタリングは、ニューログリアン細胞内領域とアンキリン(ankyrin)との結合を引き起こす。このような接着分子-アクチン繊維間の結合は、接着分子の接着性を増強するとともに、アクチン繊維の後方移動により発生した牽引力を細胞外周囲環境に伝達し、その結果として成長円錐が前方に推進されると考えられている。
アクチン繊維と接着分子をつなぐクラッチ分子
成長円錐の前方移動の仕組みを自動車の走行に例えると、エンジンの役割を果たすのがアクチン繊維の動態(重合・脱重合・後方移動)であり、タイヤの役割を果たすのが周辺環境と接着している接着分子である。このエンジンとタイヤをつなぐ役割を果たすものがクラッチ分子と呼ばれ、アクチン繊維の動態を、接着分子を介した成長円錐の推進力へと変換する役割を持っている。成長円錐内においてクラッチ分子の実態および制御機構は不明な点が多いが、アクチン繊維とL1間のクラッチ分子としてシューティン(shootin)が同定され、アンキリンやカテニン(catenin)といったリンカー分子もクラッチ分子として機能すると考えられている。
接着分子のリサイクリング
アクチン繊維と結合した接着分子は、アクチンの後方移動に伴って成長円錐中心部へと運ばれてしまう。そのために、成長円錐ではその前方移動を恒常的に維持するため、後方へ移動した接着分子を周辺環境から脱着し、再び成長円錐先端部へと輸送し再利用する機構が存在すると考えられている。例えば、アクチン繊維の後方移動により中心部に到達したL1は、クラスリン依存的エンドサイトーシスによって膜小胞に取り込まれた後、微小管のガイドによって細胞質内を成長円錐先端部まで輸送され、形質膜に再挿入される。一方、インテグリンは成長円錐形質膜上を中心部から先端部に向かって順行性に移動しうることから、エンドサイトーシス非依存的な接着分子のリサイクル機構も存在すると考えられている。
軸索ガイダンスによる制御
神経回路の形成過程において、成長円錐は細胞周辺に存在する軸索ガイダンス因子を検出するアンテナとして機能し、軸索ガイダンス因子の空間情報を軸索の伸長方向の制御へと変換するために必要な構造である。成長円錐の運動性は糸状仮足と葉状仮足の伸展と退縮と相関しているが、特に糸状仮足は成長円錐の中でも初めに軸索ガイダンス因子に遭遇する場所であり成長円錐の旋回運動の制御に重要であると考えられている。糸状仮足は誘引性ガイダンス因子に遭遇すると安定化され、一方反発性ガイダンス因子に遭遇すると退縮する。もし、この応答が成長円錐の前後軸に対し片側で起きると成長円錐はガイダンス因子に対し誘引あるいは反発する方向へと旋回する。このような成長円錐の旋回運動は経路選択過程や特定のチェックポイントにおいて重要である。
軸索ガイダンス因子
軸索ガイダンス因子は発生過程の組織内に領域特異的に存在することで成長円錐に空間情報を提供し、成長円錐を正しい標的細胞へと誘導する分子として定義できる。生体内における軸索ガイダンス因子は多種多様であるが、大きく4つの作用様式に分類される。細胞外基質や細胞膜に発現し接触を介して近距離に作用する接触因子と、分泌性で濃度勾配によって長距離に作用する拡散性因子、そしてそのそれぞれに対して誘引因子と反発因子が存在する。生体内ではこれら4種類のガイダンス因子が協調的に働くことで軸索を正しい標的へ導くと考えられる。接触性因子には、ラミニン、フィブロネクチン等の細胞外基質分子に加えて、カドヘリン、L1等の神経接着分子、膜貫通型セマフォリン、エフリン等のファミリーがある。拡散性因子としては、ネトリン、分泌型セマフォリン、Slit等のファミリーが存在する。成長円錐には個々の軸索ガイダンス因子に対する特異的な受容体ファミリーが存在しており、受容体の形質膜への発現は軸索ガイダンス因子に対する成長円錐の感受性を規定する。また、成長円錐には同一の軸索ガイダンス因子に対する反応性を場所や時期に応じて切り替える機構が備わっている。
引用文献
- ↑
Schaefer, A.W., Kabir, N., & Forscher, P. (2002).
Filopodia and actin arcs guide the assembly and transport of two populations of microtubules with unique dynamic parameters in neuronal growth cones. The Journal of cell biology, 158(1), 139-52. [PubMed:12105186] [PMC] [WorldCat] [DOI]