脊髄小脳変性症
横関明男
新潟大学大学院医歯学総合研究科 臓器連関学寄附講座
他田正義
新潟市民病院 脳神経内科
小野寺理
新潟大学脳研究所 脳神経内科学分野
DOI:10.14931/bsd.6769 原稿受付日:2021年1月29日 原稿完成日:2021年2月18日
担当編集委員:漆谷 真(滋賀医科大学 医学部 脳神経内科)
英:spinocerebellar degeneration 独:spinozerebellärer Degeneration 仏:dégénérescence spinocérébelleuse
英語略:SCD
脊髄小脳変性症は、小脳や脊髄の系統変性に伴う運動失調症の総称である。脊髄小脳変性症は、弧発性と遺伝性があり、遺伝性は顕性 (優性) 遺伝と潜在 (劣性) 遺伝に分類される。弧発性では、多系統萎縮症が最も頻度が高く、遺伝性は国により頻度が異なり、日本ではMachado-Joseph病 (MJD) 、spinocerebellar ataxia 6 (SCA6) 、spinocerebellar ataxia 31 (SCA31) の頻度が高い。臨床症状は、小脳および小脳への出入力に関する神経障害により、眼球運動障害、構音障害、歩行障害、体幹失調、筋トーヌス低下など様々な症状を認める。脊髄小脳変性症の治療は、失調症状の改善目的にTRH (thyrotropin releasing hormone) 製剤が使用されているが、効果は限定的であり、現在多くの薬剤で治験が実施されている。
背景
脊髄小脳変性症の報告は、1860年代にFriedreichが,幼小児期に家族性に発症した失調性疾患 (Friedreich失調症) を報告し、進行期の梅毒に合併する脊髄癆と異なる疾患として記載されたことが最初である[1] 。この報告以降,弧発性、家族性など種々の脊髄小脳変性症が報告され、知見が蓄積されてきた。その一方、臨床所見、病理所見で明確に区別することが困難であったことから、Holmes (1907) 、Greenfield (1954、1958) 、EscourolleおよびMasson (1967)、Skre (1972) 、高橋昭 (1974) 、Oppenheimer (1976) と様々な病型分類が報告されてきた[2] 。
1990年代に入り、免疫組織診断の発達により、弧発性の脊髄小脳変性症の中で最も頻度の高いオリーブ橋小脳変性症 (olivopontocerebellar atrophy、OPCA) 、パーキンソン症状を主体とする線条体黒質変性症 (striatenigral degeneration、SND) 、および自律神経症状が主体であるシャイ・ドレーガー症候群 (Shy-Drager syndrome、SDS) では、いずれも残存するオリゴデンドログリア内にαシヌクレイン陽性の封入体を形成することから、同一の疾患であることが明らかとなり[3] 、この疾患群は現在では多系統萎縮症 (multiple system atrophy、MSA) と診断されるようになった。
同じく1990~2000年代には、分子遺伝学の発達により、遺伝性脊髄小脳変性症の遺伝子座の同定、さらには原因遺伝子の同定が相次いで報告された。今後も次世代シークエンサーなど遺伝子解析手法の発達により、新たな疾患とその原因遺伝子の同定が進むことが予想される。
診断
「運動失調症の医療基盤に関する研究班」の診断基準が用いられている(表1、2)。
| 主要項目 |
|---|
| 脊髄小脳変性症は、運動失調を主要症候とする神経変性疾患の総称であり、臨床、病理あるいは遺伝子的に異なるいくつかの病型が含まれる。臨床的には以下の特徴を有する。 ① 小脳性ないしは後索性の運動失調又は痙性対麻痺を主要症候とする。 |
| Definite |
|---|
| 脊髄小脳変性症・痙性対麻痺に合致する症候と経過があり、遺伝子診断か神経病理学的診断がなされている場合。 |
| Probable |
| (1)脊髄小脳変性症に合致する症候があり、診断基準の主要項目①②⑤及び⑥を満たす場合、若しくは痙性対麻痺に合致する症候があり、主要項目①②及び⑥を満たす場合。 又は |
| Possible |
| 脊髄小脳変性症・痙性対麻痺に合致する症候があり、診断基準の主要項目①②⑤を満たす、又は痙性対麻痺に合致する症候があり、主要項目①②を満たすが、⑥が除外できない場合。 |
重症度分類:modified Rankin Scale(mRS)、食事・栄養、呼吸のそれぞれの評価スケールを用いて、いずれかが3以上が指定難病の申請基準である。
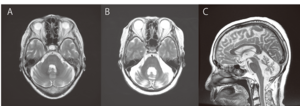
(A) 70歳女性の正常MRI、T2強調画像水平断。
(B、C) 発症年齢55歳、経過16年(71歳)のIDCA症例の頭部MRI、T2協調画像。(B)T2強調画像水平断、(C) T2強調画像矢状断。SCA1、SCA3、MJD、SCA6、SCA31、DRPLAの原因遺伝子に異常は認めない。構音障害、歩行障害を認めるが、自力歩行はかろうじて可能。小脳の萎縮を認めるが、脳幹は保たれている。
分類
ここでは遺伝の有無に基づく分類をする。
弧発性脊髄小脳変性症
多系統萎縮症
多系統萎縮症は、弧発性脊髄小脳変性症で最も頻度が高い。詳細は多系統萎縮症の項目を参照。
皮質性小脳萎縮症
皮質性小脳萎縮症 (cortical cerebellar atrophy、CCA; 純粋小脳型の失調症) は、小脳皮質の萎縮が主病変とする失調症の総称である (図1) 。多くは高齢発症であることから、晩発性皮質性小脳萎縮症 (late cortical cerebellar atrophy、LCCA) とも呼ばれてきた疾患群である。つまり、皮質性小脳萎縮症は単一の疾患ではなく、小脳皮質が比較的選択的に変性、脱落する疾患の一群を示している。
成人期に発症し、緩徐進行性の小脳失調を主体とする。
これまでsporadic adult-onset ataxia of unknown origin (SAOA) [4] 、特発性小脳失調症(idiopathic cerebellar ataxia, IDCA) [5] 、idiopathic cerebellar ataxia of late onset [6]など報告者によって様々な疾患名で呼ばれてきた経緯があり、疾患概念に混乱が生じていた。その理由は、診断特異的バイオマーカーや特異的なタンパク質の蓄積などが発見されていないため、除外診断によりなされる点である。つまり皮質性小脳萎縮症の診断においては、初期の多系統萎縮症、自己免疫性失調症、spinocerebellar ataxia 6 (SCA6)やspinocerebellar ataxia 31 (SCA31) のように小脳失調が主体の遺伝性脊髄小脳変性症など、高齢発症の他の脊髄小脳変性症を除外することが必須である。
このことから、本邦の「運動失調症の医療基盤に関する調査研究班」では、皮質性小脳萎縮症や晩発性皮質性小脳萎縮症に変わる臨床診断名として、特発性小脳失調症を提唱し、診断基準を策定した[7] 。本邦での特発性小脳失調症と従来報告されてきたSAOAを比較すると、特発性小脳失調症は小脳症状以外の神経症状の合併頻度が少なく、特に錐体路症状や排尿障害の合併はSAOAと比べて本邦の特発性小脳失調症は低いことが明かとなっている。つまり、本邦の特発性小脳失調症はより純粋小脳型の失調症を反映していると考えられる[7] 。今後、これらの知見の集積により、特発性小脳失調症から新たな疾患が分離独立することが予想される。
遺伝性脊髄小脳変性症
顕性 (優性) 遺伝と潜性 (劣性) 遺伝様式を取るものが存在する。
顕性遺伝型
顕性 (優性) 遺伝 を示し、遺伝子座が同定されたものは脊髄小脳失調症 (spinocerebellar ataxia, SCA) として命名されている。1993年に原因遺伝子が同定されたspinocerebellar ataxia 1 (SCA1)から2021年1月の時点で、SCA48まで同定されている (表3) 。
原因遺伝子により発症年齢が異なるが、SCA1、spinocerebellar ataxia 2 (SCA2)、マチャド・ジョセフ病 (Machado-Joseph disease, MJD。spinocerebellar ataxia 3 (SCA3)と同義)、spinocerebellar ataxia 6 (SCA6)、歯状核赤核淡蒼球ルイ体萎縮症 (dentatorubral-pallidoluysian atrophy, DRPLA) のように遺伝子変異がC(シトシン)、A(アデニン)、G(グアニン)、3塩基の組み合わせであるCAGリピートの異常伸長により発症する疾患は、CAGリピート長が長いほど、発症年齢は若年化し、より重症化する。また親から子に異常遺伝子が伝達される際に、子どものCAGリピート長が親のリピート長より伸長することにより、子供の発症年齢の若年化、症状が重症化する表現促進現象を認める。ただし、SCA6では、表現促進現象は認められてない[8] 。
| 疾患 | 原因遺伝子/遺伝子座 | Phenotype MIM number | 遺伝子変異および臨床的特徴 |
|---|---|---|---|
| SCA1 | ATXN1 | 164400 | CAGリピート伸長、表現促進現象 |
| SCA2 | ATXN2 | 183090 | CAGリピート伸長、表現促進現象、slow eye movement |
| MJD/SCA3 | ATXN3 | 109150 | CAGリピート伸長、表現促進現象、bulging eyes、末梢神経障害 |
| SCA4 | 16q22.1 | 600223 | axonal sensory neuropathy |
| SCA5 | SPTBN2 | 600224 | 進行が遅い |
| SCA6 | CACNA1A | 183086 | CAGリピート伸長、表現促進現象、発症は50歳以降 |
| SCA7 | ATXN7 | 164500 | CAGリピート伸長、網膜色素変性症 |
| SCA8 | ATXN8 | 608768 | CAGリピート伸長、表現促進現象、振動覚低下、進行は遅い |
| SCA9 | - | 612876 | 英国起源の米国人家系、臨床症状はMJDに類似 |
| SCA10 | ATXN10 | 603516 | ATTCTリピート伸長、脳波異常、てんかん |
| SCA11 | TTBK2 | 604432 | 症状はSCA6に類似 |
| SCA12 | PPP2R2B | 604326 | CAGリピート異常伸長(5’UTR)、振戦(上肢、頭部)、腱反射亢進、認知症 |
| SCA13 | KCNC3 | 605259 | 精神発達遅滞 |
| SCA14 | PRKCG | 605361 | 間欠的な体幹のミオクローヌス |
| SCA15/16 | ITPR1 | 606658 | 成人発症、進行は遅い |
| SCA17 | TBP | 607136 | CAG/CAAリピート伸長、認知機能障害、精神症状 |
| SCA18 | 7q22-q23 | 607458 | 末梢神経障害 |
| SCA19/22 | KCND3 | 607346 | 認知機能障害、ミオクローヌス、振戦 |
| SCA20 | 11q12.2-11q12.3 | 608687 | けいれん性発声障害、喉頭筋麻痺 |
| SCA21 | TMEM240 | 607454 | 認知機能障害、振戦 |
| SCA23 | PDYN | 610245 | 末梢神経障害 |
| SCA24 →SCAR24 |
|||
| SCA25 | 2p15-p21 | 608703 | 末梢性感覚障害、視力低下、顔面のチック、頻尿、消化器症状 |
| SCA26 | EEF2 | 609306 | 純粋小脳型 |
| SCA27 | FGF14 | 609307 | 振戦、顔面のジスキネジア、認知機能障害 |
| SCA28 | AFG3L2 | 610246 | slow saccades、眼筋麻痺、眼瞼下垂 |
| SCA29 | ITPR1 | 117360 | SCA15と同遺伝子、若年発症、軽度認知機能発達遅滞、非常に緩徐進行 |
| SCA30 | 4q34.3-q35.1. | 613371 | オーストラリア1家系6名、発症年齢平均52歳、腱反射亢進 |
| SCA31 | BEAN1 | 117210 | イントロンTGGAAリピート伸長、純粋小脳型、感音性難聴 |
| SCA32 | 7q32-q33 | 613909 | 中国1家系、認知機能障害、無精子症 |
| SCA33 | 登録なし | ||
| SCA34 | ELOVL4 | 133190 | 紅斑、魚鱗癬、角質増殖症、認知機能は正常 |
| SCA35 | TGM6 | 613908 | 進行は緩徐、手の振戦 |
| SCA36 | NOP56 | 614153 | イントロンGGCCTGリピート伸長、舌の線維束性収縮、上位運動ニューロン徴候 |
| SCA37 | DAB1 | 615945 | 発症年齢は10台後半~60歳代、緩徐進行 |
| SCA38 | ELOVL5 | 615957 | 末梢神経障害、認知機能は正常 |
| SCA39 | 11q21-q22.3 | 登録なし | フランスの1家系、spastic ataxia |
| SCA40 | CCDC88C | 616053 | 企図振戦、痙性対麻痺、腱反射亢進 |
| SCA41 | TRPC3 | 616410 | 成人期発症、神経伝導速度に異常なし |
| SCA42 | CACNA1G | 616795 | 発症年齢に大きな差(9~78歳)、振動覚低下や排尿症状(頻度少ない)、進行は比較的緩徐 |
| SCA43 | MME | 617018 | 末梢神経障害、凹足、下肢筋萎縮、認知機能正常 |
| SCA44 | GRM1 | 617691 | 20-50歳代発症、緩徐進行、車椅子使用までにならず、腱反射は正常~亢進 |
| SCA45 | FAT2 | 617769 | 40歳以降発症、純粋小脳型 |
| SCA46 | PLD3 | 617770 | オランダの大家系、成人発症、感覚性ニューロパチー |
| SCA47 | PUM1 | 617931 | 若年発症(重症はてんかん性脳症、筋トーヌス低下)、成人発症 |
| SCA48 | STUB1 | 618093 | 認知機能障害、不安症状、遂行機能障害 |
| DRPLA | ATN1 | 125370 | CAGリピート伸長、表現促進現象、ミオクローヌスてんかん |
SCA= spinocerebellar ataxia, MJD=マチャド・ジョセフ病, DRPLA=歯状核赤核淡蒼球ルイ体萎縮症 (dentatorubral-pallidoluysian atrophy)
潜性遺伝型
Friedreich失調症 (Friedreich ataxia、FRDA)、毛細血管拡張性小脳失調症 (ataxia telangiectasia、AT) など一部の疾患を除き、原因遺伝子座が同定されたものは常染色体潜性遺伝性脊髄小脳失調症 (spinocerebellar ataxia, autosomal recessive, SCAR) と命名され、SCAR28まで同定されている (表4) 。潜性遺伝の脊髄小脳変性症は、一般的に原因遺伝子タンパク質の機能喪失 (loss of function) により発症すると考えられており、そのため若年発症の疾患が多い。
| 疾患 | 原因遺伝子/遺伝子座 | Phenotype MIM number | 遺伝子変異および臨床的特徴 |
|---|---|---|---|
| Friedreich失調症(FRDA) | FXN | 229300 | 日本では報告なし、イントロンGAAリピート伸長、腱反射低下、深部感覚障害、心筋症 |
| ataxia-telangiectasia (AT) | ATM | 208900 | 毛細血管拡張、免疫不全、悪性腫瘍合併 |
| ATLD1 | MRE11A | 604391 | 眼球運動失行、ATに類似だが毛細血管拡張、免疫不全はない |
| ATLD2 | PCNA | 615919 | 発達障害、感音性難聴、低身長、毛細血管拡張 |
| EAOH/AOA1 | APTX | 208920 | 日本でFRDAと報告されていた症例の多く、眼球運動失行、低アルブミン血症、高コレステロール血症、末梢神経障害、認知機能障害 |
| SCAN2/AOA2/SCAR1 | SETX | 606002 | α-フェトプロテイン上昇、眼球運動失行、末梢神経障害 |
| AOA3 | PIK3R5 | 615217 | サウジアラビアの家系、20歳代発症、眼球運動失行、末梢神経障害 |
| AOA4 | PNKP | 616267 | シャルコー・マリー・トゥース病, type 2B2と同じ遺伝子、ジストニア、眼球運動失行、末梢神経障害 |
| SCAR2 | PMPCA | 213200 | 精神発達障害、運動発達障害、白内障、企図振戦 |
| SCAR3 | 6p23-p21 | 271250 | 視神経・蝸牛変性、レフサム病に類似 |
| SCAR4 | VPS13D | 607317 | 痙性歩行、腱反射亢進、発症年齢は小児期~成人、軽度認知機能障害 |
| GAMOS1/SCAR5 | WDR73 | 251300 | 発達障害、精神発達障害、痙性失調、小頭症、視神経萎縮 |
| SCAR6 | 20q11-q13 | 608029 | ノルウェーの家系、乳児発症、非進行性、筋トーヌス低下、知能は正常 |
| SCAR7 | TPP1 | 609270 | セロイドリポフスチン症2型と同一遺伝子、症状は軽症~重度まで差があり、腱反射亢進、後索障害による深部感覚障害 |
| SCAR8 | SYNE1 | 610743 | 発症は20~30歳代、痙性や二次性の筋骨格系変形を伴うこともある |
| COQ10D4/SCAR9 | ADCK3 | 612016 | 運動不耐性、痙攣や軽度知的障害を合併することがある、経口補酵素Q10は無効 |
| SCAR10 | ANO10 | 613728 | 筋内補酵素Q10が低下する症例あり、補酵素Q10が部分的に有効 |
| SCAR11 | SYT14 | 614229 | 日本から1家系(兄弟例)、精神運動障害 |
| SCAR12 | WWOX | 614322 | developmental and epileptic encephalopathy-28と同じ遺伝子、全身けいれん、精神運動障害 |
| SCAR13 | GRM1 | 614831 | 乳児期の精神運動障害、知的障害、脳室拡大 |
| SCAR14 | SPTBN2 | 615386 | 精神運動発達障害 |
| SCAR15 | RUBCN | 615705 | 知的障害、発達障害、てんかん |
| SCAR16 | STUB1 | 615768 | 下肢の痙性、感覚性末梢神経障害 |
| SCAR17 | CWF19L1 | 616127 | 知的障害 |
| SCAR18 | GRID2 | 616204 | 精神運動発達障害、腱反射亢進 |
| LIKNS/SCAR19 | SLC9A1 | 616291 | 重度の感音性難聴 |
| SCAR20 | SNX14 | 616354 | 重度の精神運動発達障害、小頭症、鼻翼が広い、厚い口唇、感音性難聴、けいれん |
| SCAR21 | SCYL1 | 616719 | 肝障害、末梢神経障害、軽度知的障害 |
| SCAR22 | VWA3B | 616948 | 日本の1家系、知的障害、腱反射亢進、痙性 |
| SCAR23 | TDP2 | 616949 | てんかん、知的障害 |
| SCAR24 | UBA5 | 617133 | 中国の1家系、成長が遅い、白内障、知能は正常 |
| SCAR25 | ATG5 | 617584 | トルコの1家系、精神運動発達障害 |
| SCAR26 | XRCC1 | 617633 | 祖先が東インドの患者1名、28歳歩行障害で発症、眼球運動失行、末梢神経障害 |
| SCAR27 | GDAP2 | 618369 | 成人発症、認知機能障害 |
| SCAR28 | THG1L | 618800 | 痙性、軽度知的障害 |
| SACS/ARSACS | SACS | 270550 | 末梢神経障害、網膜色素線条、知的障害を認めることもある、腱反射は低下~亢進、末梢神経障害 |
| SCAN1 | TDP1 | 607250 | サウジアラビアの1家系、末梢神経障害、低アルブミン血症、高コレステロール血症 |
ATLD= ataxia-telangiectasia-like disorder, EAOH=early onset ataxia with ocular motor apraxia and hypoalbuminemia, AOA=ataxia- ocular motor apraxia, SCAN= spinocerebellar ataxia with axonal neuropathy, SCAR=spinocerebellar ataxia, autosomal recessive, GAMOS1= Galloway-Mowat syndrome 1, COQ10D4=coenzyme Q10 deficiency, primary, 4, LIKNS=Lichtenstein-Knorr syndrome, SACS=Spastic ataxia, Charlevoix-Saguenay type, ARSACS=autosomal recessive spastic ataxia of Charlevoix-Saguenay
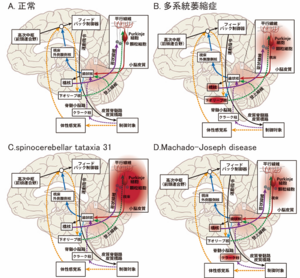
赤印が、障害部位を示し、濃い印は障害の程度が強いことを示す。参考文献[9]より改変。
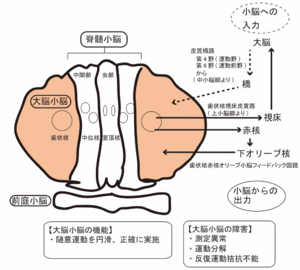
破線は小脳への入力、実線は小脳からの出力を示す。
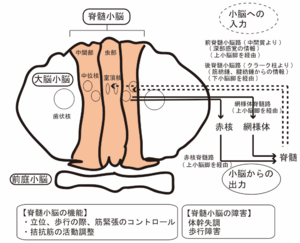
破線は小脳への入力、実線は小脳からの出力を示す。
破線は小脳への入力、実線は小脳からの出力を示す。
症状と病態生理
人が動作をする際には、小脳による運動制御が必須であるが、その制御を行う際には、脳内に内部モデルを必要とする「内部モデル仮説」が提唱されている[10] 。運動に必要な内部モデルの形成、情報処理、最適化において、小脳の役割が重要であると考えられている。
脊髄小脳変性症では、小脳や小脳につながる神経路の障害により運動失調を来すが、疾患により変性部位に差違がある (表5、図2) [9] 。つまり、障害される解剖学的部位により、小脳失調を生じる機序が異なると考えられる。一方現在の診察方法では、小脳症状は後述の通り表面的な症状でしか評価ができないため、表5に示すような障害されている部位を推定することは困難である。今後小脳症状の機能解析の新たな開発により、障害部位特異的な小脳症状の評価が可能となり、さらにはリハビリテーションを始めとする疾患特異的な治療法の開発が期待される。
| 障害される機能 | 感覚系からのフィードバック情報の障害 | 大脳からの入力障害 | 内部モデル本体の障害 | 出力の障害 | 誤差情報の障害 | |||
|---|---|---|---|---|---|---|---|---|
| 変性部位 | 後根神経節 | クラーク柱 | 前庭神経核 | 橋核 | 顆粒細胞 | プルキンエ細胞 | 歯状核 | 下オリーブ核 |
| DRPLA | - | - | - | - | - | + | +++ | - |
| SCA6 | - | - | - | - | + | +++ | ++ | + |
| SCA31 | - | - | - | - | - | +++ | - | - |
| MSA | - | - | + | +++ | - | + | - | +++ |
| SCA2 | - | - | ++ | +++ | +++ | +++ | ++ | +++ |
| SCA1 | - | ++ | + | + | ++ | ++ | ++ | ++ |
| MJD | - | +++ | ++ | ++ | - | + | +++ | - |
| EAOH | +++ | +++ | - | - | + | +++ | + | + |
DRPLA=dentatorubral-pallidoluysian atrophy、SCA6=spinocerebellar ataxia 6、SCA31=spinocerebellar ataxia 31、MSA=multiple system atrophy、SCA2=spinocerebellar ataxia 2、SCA1=spinocerebellar ataxia 1、MJD=Machado-Joseph disease、EAOH=early onset ataxia with ocular motor apraxia and hypoalbuminemia
変性の程度を重度(+++)、中等度(++)、軽度(+)で示す。
小脳やその経路に起因する症状、個々の疾患に合併する他の神経部位に起因する症状 (末梢神経障害や自律神経障害など) を認める。小脳失調は、障害される部位により、様々な症状である[11] 。
大脳小脳 (小脳半球外側部) の障害
小脳半球外側部と歯状核からなる大脳小脳は、脊髄などの末梢から直接入力は少なく、大脳皮質から橋を経由して入力を受ける。出力は、歯状核を起始部として、視床や赤核へ入力される。視床から大脳皮質広範囲に投射することにより、四肢の遠位筋の運動制御が行われる。そのため、同部位の障害では、運動分解 (decomposition) や、測定異常 (dysmetria) 、反復拮抗運動不能 (adiadochokinesis) など四肢の運動症状を認める (図3)。
脊髄小脳(小脳虫部、小脳半球内側部)の障害
小脳虫部および小脳半球内側部と中位核 (球状核、栓状核) からなる脊髄小脳は、脊髄からの触覚、圧覚、位置覚などの体性感覚の情報入力を受け、前庭や網様体へ投射し、前庭脊髄路、網様体脊髄路を経由して脊髄に出力される。これらの出力は、最終的に体幹筋に支配し姿勢制御に重要であり、脊髄小脳の障害では、小脳性の体幹失調や歩行障害を起こす (図4)。
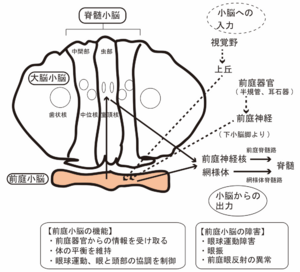
前庭小脳 (片葉小節葉) の障害
前庭小脳 (片葉小節葉) は、三半規管や耳石器などの前庭から入力を受ける。また、中脳および視覚野から視覚入力も受ける。前庭小脳からの出力は、前庭神経核に投射される。同部は、前庭眼反射の制御を行っており、障害されることにより眼振、眼球測定異常、前庭眼反射の異常などの眼球運動障害を起こす (図5)。
治療
脊髄小脳変性症の根本的治療法は、いまだ確立されていない。
本邦で小脳失調症状の改善を目的として、甲状腺刺激ホルモン放出ホルモン (thyrotropin releasing hormone, TRH) 誘導体が使用されている。TRH誘導体使用の経緯は、1970年代初頭に開発された失調症モデルマウスであるrolling mouse Nagoyaの解析に由来する[12] 。このマウスは、のちにP/Q-type Ca2+ channelsに変異を有していることが明かとなっている[13] 。このrolling mouse Nagoyaでは、小脳脳幹部のTRH含有量が減少していること[14] 、小脳ではノルアドレナリン神経終末に異常があることが報告され[15] 、TRHはノルアドレナリンのturnoverに関与することなどから、TRH投与が失調症状改善につながると可能性が期待された。実際にrolling mouse Nagoya にTRHを投与により失調症状に有効であることが示され[16] 、その後本邦の多施設での治験を経て1985年に点滴用TRH製剤であるプロチレリン酒石酸が脊髄小脳変性症の運動失調症状の改善として保険適応となり[17] 、2000年以降は内服のTRH製剤であるタルチレリン水和物が脊髄小脳変性症の運動失調の改善を目的として使用されている[18] 。タルチレリン水和物の失調症状の改善効果は極めて限定的であり、現在より効果の強いTRH製剤の開発が行われている[19] 。
脊髄小脳変性症などの神経変性疾患では、運動機能の維持、合併症の予防目的にリハビリテーションが実施されている。脊髄小脳変性症において、短期集中リハビリテーションが有効であることを日本の「運動失調症の病態解明と治療法開発に関する研究」を中心とする研究班での研究により示されている。このリハビリテーションの研究 (Trial for Cerebellar Ataxia Rehabilitation, CAR trial) では、小脳症状が主体であるSCA6、SCA31、皮質性小脳萎縮症患者に対して、1日1~2時間、週3~7回、4週間のバランスや歩行を中心とした短期集中リハビリテーションにより、運動失調や歩行の改善を認め、かつその効果が半年~1年継続することが示されている[20] 。
また現在まで、非常に種々の薬物等で治験が実施されており、現在も治験が進行中である (表6) 。一部は部分的に効果を認めているが、多くは効果を示すことができていない。今後は、遺伝性脊髄小脳変性症に対する核酸医療の開発も期待されている。
| 化合物 | ClinicalTrials.gov Identifier | 年 | 国 | 対象疾患 | Phase | 結果 |
|---|---|---|---|---|---|---|
| Taltirelin Hydrate | NCT04107740 | 2019- | 韓国 | SCD全般 | 4 | 現在進行中 |
| KPS-0373 (Rovatirelin) | NCT01970098 | 2013-2015 | 日本 | 軽度~中等度のSCD | 3 | 部分的に有効 |
| Riluzole | NCT03347344 | 2018-2019 | フランス | SCA2 | 3 | 不明 |
| Transcranial Magnetic Stimulation | NCT01975909 | 2013-2016 | 米国 | genetically-confirmed SCA | Not Applicable | 有効性なし |
| Lithium Carbonate | NCT00683943 | 2008-2010 | 米国 | SCA1 | 1 | |
| Intravenous Immune Globulin | NCT02287064 | 2015-2016 | 米国 | SCA types 1, 2, 3, 6, 10, or 11 | 1 | まだ発表なし |
| Oral Trehalose | NCT04399265 | 2020ー- | マレーシア | Genetically confirmed SCA 3 | Not Applicable | 進行中 |
| Varenicline (Chantix®) | NCT00992771 | 2009-2012 | 米国 | SCA3 | 2 | 有効 |
| Umbilical Cord Mesenchymal Stem Cells | NCT03378414 | 2017- | 中国 | SCA1,2,4,6 | 2 | 詳細不明 |
| Troriluzole | NCT03701399 | 2018- | 米国 | SCA1,2,3,6,7,8,10 | 2,3 | 進行中 |
| Sodium Phenylbutyrate | NCT01096095 | 2010-2012 | ブラジル | SCA3 | 2 | 中止 |
| Dalfampridine | NCT01811706 | 2013-2015 | 米国 | SCA1,2,3,6 | Not Applicable | 有効性なし |
| CAD-1883 | NCT04301284 | 2020- | 米国 | SCA1,2,3,6,7,10,17 | 2 | 延期(COVID-19のため |
| Docosahexaenoic Acid (DHA) | NCT03109626 | 2015-2018 | イタリア | SCA38 | Not Applicable | 有効 |
| Stemchymal® | NCT02540655 | 2015- | 台湾 | SCA2,3 | 2 | 不明 |
| Intravenous Cabaletta | NCT02147886 | 2014-2016 | イスラエル | SCA3 | 2 | 結果? |
| Coenzyme Q10 | NCT00957216 | 2009-2018 | 米国 | 弧発性SCD | 1 | 結果? |
| BHV-4157 | NCT03408080 | 2018- | 米国 | SCA1,2,3,6 | 3 | エントリー中止中 |
| Vatiquinone | NCT04577352 | 2020- | 米国 | Friedreich Ataxia | 2,3 | 開始前 |
| CTI-1601 | NCT04519567 | 2020- | 米国 | Friedreich Ataxia | 1 | 開始前 |
| Etravirine | NCT04273165 | 2020- | イタリア | Friedreich Ataxia | 2 | 開始前 |
| RT001 | NCT04102501 | 2019- | 米国 | Friedreich Ataxia | 3 | 進行中 |
| Resveratrol | NCT03933163 | 2019- | 米国 | Friedreich Ataxia | 2 | 進行中 |
| MIN-102 | NCT03917225 | 2019- | EU | Friedreich Ataxia | 2 | リクルート終了 |
| γ-interferon | NCT03888664 NCT02797080 NCT02593773 NCT01965327 |
Friedreich Ataxia | 2、3 | |||
| Nicotinamide | NCT03761511 | 2018- | EU | Friedreich Ataxia | 2 | 進行中 |
| TAK-831 | NCT03214588 | 2017-2019 | 米国 | Friedreich Ataxia | 2 | 有効性なし |
| Rosuvastatin | NCT02705547 | 2016-2018 | 米国 | Friedreich Ataxia | 1 | リクルート終了 |
| (+)-Epicatechin | NCT02660112 | 2016-2019 | 米国 | Friedreich Ataxia | 2 | 有効性なし |
| Methylprednisolone | NCT02424435 | 2015-2020 | 米国 | Friedreich Ataxia | 1 | リクルート終了 |
| EPI-743 (α-tocotrienol quinone) | NCT01962363 | 2013-2016 | 米国 | Friedreich's Ataxia with Point Mutations | 2 | 効果あり |
| Omaveloxolone | NCT02255435 | 2014- | 米国 | Friedreich Ataxia | 2 | リクルート停止 |
| Acetyl-L-Carnitine | NCT01921868 | 2013-2017 | 米国 | Friedreich Ataxia | Not Applicable | 結果未報告 |
| VP 20629 | NCT01898884 | 2013-2016 | 米国 | Friedreich Ataxia | 1 | リクルート終了 |
| EPI-743 | NCT01728064 | 2012-2015 | 米国 | Friedreich Ataxia | 2 | 有効性なし |
| Bupropion and Citalopram | NCT01716221 | 2012-2016 | 米国 | Friedreich Ataxia | 4 | 終了 |
| Resveratrol | NCT01339884 | 2011-2014 | オーストラリア | Friedreich Ataxia | 1,2 | 終了 |
| Idebenone | NCT01303406 | 2011-2016 | EU | Friedreich Ataxia | 3 | 有効性なし |
| A0001 (α-tocopherolquinone) | NCT01035671 | 2009-2011 | 米国 | Friedreich Ataxia | 2 | 容量依存性にFRDA評価スケール改善 |
| Erythropoietin | NCT01016366 | 2009-2016 | EU | Friedreich Ataxia | 2 | 有効性なし |
| idebenone | NCT00993967 | 2009-2016 | EU | Friedreich Ataxia | 3 | 認容性を副作用の確認 |
| deferiprone | NCT00530127 | 2007-2009 | EU | Friedreich Ataxia | 1,2 | 非重症例で進行抑制の可能性(+) |
| EGb 761 | NCT00824512 | 209-2013 | フランス | Friedreich Ataxia | 2 | 有効性なし |
| pioglitazone | NCT00811681 | 2008-2013 | フランス | Friedreich Ataxia | 3 | 終了 |
| varenicline | NCT00803868 | 2008-2010 | 米国 | Friedreich Ataxia | 2,3 | 途中で中止 |
| Triheptanoin | NCT04513002 | 2020- | オーストラリア | Ataxia Telangiectasia | 2 | リクルート開始前 |
| vitamin B3 | NCT03962114 | 2019- | オランダ | Ataxia Telangiectasia | 2 | リクルート中 |
| N-Acetyl-L-Leucine | NCT03759678 | 2018- | 米,英,独 | Ataxia Telangiectasia | 2 | リクルート中 |
| Metformin,Pioglitazone | NCT02733679 | 2016-2019 | 英国 | Ataxia Telangiectasia | 4 | 終了 |
| Somatropin, Clonidine, L-Arginin-Hydrochloride, Estradiol valerate | NCT01052623 | 2010-2011 | ドイツ | Ataxia Telangiectasia | 4 | 結果? |
| amantadine sulphate | NCT00950196 | 2009-2011 | イスラエル | Ataxia Telangiectasia | 4 | 運動症状を改善 |
| Baclofen | NCT00640003 | 2008-2011 | 米国 | Ataxia Telangiectasia | 1 | 結果? |
疫学
国や地域ごとに分布は異なっている。
弧発性脊髄小脳変性症では多系統萎縮症の頻度が最も高い。多系統萎縮症では、本邦では病初期に小脳症状が主体であるMSA-C (以前はオリーブ橋小脳萎縮症;olivopontocerebellar atrophy;OPCAと診断されていた臨床型) の頻度が高いが[21] 、ヨーロッパや北米では病初期はパーキンソン症状が主体であるMSA-P (以前は線条体黒質変性症;striatonigral degeneration;SNDと診断されていた臨床型) の頻度が高い[22] 。
遺伝性脊髄小脳変性症も、国や地域により疾患の分布は大きく異なる。世界規模では顕性遺伝のSCDでは、MJD (SCA3)の頻度が最も高く、それに続きSCA2 やSCA6の頻度が高いとされている。日本でもMJD、SCA6の頻度が高く、この他にSCA31の頻度が高い。また、日本国内においても、地域ごとに頻度が異なり、北海道や宮城県ではSCA1が他の地域と比較して頻度は高い。長野県や鳥取県では、MJDよりSCA6の頻度が高い[23] 。
潜性遺伝の脊髄小脳変性症では、白人ではFriedreich失調症の頻度が最も高いが、日本ではFriedreich失調症は1例も認められてない。一方日本では、Friedreich失調症に類似の臨床症状を示し、眼球運動失行、低アルブミン血症を合併するearly onset ataxia with ocular motor apraxia and hypoalbuminemia (EAOH) /ataxia-ocular motor apraxia type1 (AOA1) の頻度が高い[24] 。また、これまで日本からFriedreich失調症として報告されていた症例の多くが、EAOHであると考えられている。
関連項目
参考文献
- ↑ 中西孝雄 (1978).
日本における難病研究の現況脊髄小脳変性症. 内科. 41, 191-194 医中誌Web - ↑ 中村晴臣 (1977).
脊髄小脳変性症の分類とその主要症状. 神経研究の進歩. 21, 5-13 医中誌Web - ↑
Wakabayashi, K., Yoshimoto, M., Tsuji, S., & Takahashi, H. (1998).
Alpha-synuclein immunoreactivity in glial cytoplasmic inclusions in multiple system atrophy. Neuroscience letters, 249(2-3), 180-2. [PubMed:9682846] [WorldCat] [DOI] - ↑
Abele, M., Minnerop, M., Urbach, H., Specht, K., & Klockgether, T. (2007).
Sporadic adult onset ataxia of unknown etiology : a clinical, electrophysiological and imaging study. Journal of neurology, 254(10), 1384-9. [PubMed:17934884] [WorldCat] [DOI] - ↑
Burk, K., Globas, C., Wahl, T., Bühring, U., Dietz, K., Zuhlke, C., ..., & Dichgans, J. (2004).
MRI-based volumetric differentiation of sporadic cerebellar ataxia. Brain : a journal of neurology, 127(Pt 1), 175-81. [PubMed:14570820] [WorldCat] [DOI] - ↑
Klockgether, T., Schroth, G., Diener, H.C., & Dichgans, J. (1990).
Idiopathic cerebellar ataxia of late onset: natural history and MRI morphology. Journal of neurology, neurosurgery, and psychiatry, 53(4), 297-305. [PubMed:2341843] [PMC] [WorldCat] [DOI] - ↑ 7.0 7.1
Yoshida, K., Kuwabara, S., Nakamura, K., Abe, R., Matsushima, A., Beppu, M., ..., & Research Group on Ataxic Disorders (2018).
Idiopathic cerebellar ataxia (IDCA): Diagnostic criteria and clinical analyses of 63 Japanese patients. Journal of the neurological sciences, 384, 30-35. [PubMed:29249373] [WorldCat] [DOI] - ↑
Ishikawa, K., Tanaka, H., Saito, M., Ohkoshi, N., Fujita, T., Yoshizawa, K., ..., & Mizusawa, H. (1997).
Japanese families with autosomal dominant pure cerebellar ataxia map to chromosome 19p13.1-p13.2 and are strongly associated with mild CAG expansions in the spinocerebellar ataxia type 6 gene in chromosome 19p13.1. American journal of human genetics, 61(2), 336-46. [PubMed:9311738] [PMC] [WorldCat] [DOI] - ↑ 9.0 9.1 9.2
Tada, M., Nishizawa, M., & Onodera, O. (2015).
Redefining cerebellar ataxia in degenerative ataxias: lessons from recent research on cerebellar systems. Journal of neurology, neurosurgery, and psychiatry, 86(8), 922-8. [PubMed:25637456] [WorldCat] [DOI] - ↑
Wolpert, D.M., Miall, R.C., & Kawato, M. (1998).
Internal models in the cerebellum. Trends in cognitive sciences, 2(9), 338-47. [PubMed:21227230] [WorldCat] [DOI] - ↑ 筧慎治, 石川享宏, 本多武尊, 三苫博 (2015)
【小脳の最新知見-基礎研究と臨床の最前線】小脳は何をしているか 構造と機能の最先端 小脳の機能 平衡、協調運動機能. 医学のあゆみ. 255, 947-954 - ↑ 織田鉄一 (1973)
歩行異常マウスの発見と維持. 実験動物. 22, 281-288 - ↑
Mori, Y., Wakamori, M., Oda, S., Fletcher, C.F., Sekiguchi, N., Mori, E., ..., & Imoto, K. (2000).
Reduced voltage sensitivity of activation of P/Q-type Ca2+ channels is associated with the ataxic mouse mutation rolling Nagoya (tg(rol)). The Journal of neuroscience : the official journal of the Society for Neuroscience, 20(15), 5654-62. [PubMed:10908603] [PMC] [WorldCat] - ↑ 祖父江逸郎 (1977)
視床下部ホルモンと中枢神経機能との新しい接点TRHと運動失調との関連をめぐって. 臨床神経学. 17, 791-799 - ↑ Adachi, K. (1975).
Changes in the cerebellar noradrenaline nerve terminals of the neurological murine mutant rolling mouse Nagoya : A histofluorescence analysis. Neurobiol and Neurophys. 3, 329-330 CiNii - ↑ 小長谷正明, 高柳哲也, 室賀辰夫他 (1980)
RollingmouseNagoyaの脳内ノルアドレナリン代謝とthyrotropinreleasinghormoneの影響. 臨床神経学. 20, 181-188 - ↑ 祖父江逸郎, 高柳哲也, 中西孝 (1982).
脊髄小脳変性症に対するThyrotropin Releasing Hormone Tartrateの治療研究 二重盲検比較対照臨床試験による検討. 神経研究の進歩. 26, 1190-1214 - ↑ 金澤一郎, 里吉栄二郎, 平山惠造他 (1997).
Taltirelin hydrate(TA-0910)の脊髄小脳変性症に対する臨床評価 プラセボを対照とした臨床第III相二重盲検比較試験. 臨床医薬. 13, 4169-4224 - ↑
Nishizawa, M., Onodera, O., Hirakawa, A., Shimizu, Y., Yamada, M., & Rovatirelin Study Group (2020).
Effect of rovatirelin in patients with cerebellar ataxia: two randomised double-blind placebo-controlled phase 3 trials. Journal of neurology, neurosurgery, and psychiatry, 91(3), 254-262. [PubMed:31937586] [PMC] [WorldCat] [DOI] - ↑
Miyai, I., Ito, M., Hattori, N., Mihara, M., Hatakenaka, M., Yagura, H., ..., & Cerebellar Ataxia Rehabilitation Trialists Collaboration (2012).
Cerebellar ataxia rehabilitation trial in degenerative cerebellar diseases. Neurorehabilitation and neural repair, 26(5), 515-22. [PubMed:22140200] [WorldCat] [DOI] - ↑
Ozawa, T., Tada, M., Kakita, A., Onodera, O., Tada, M., Ishihara, T., ..., & Nishizawa, M. (2010).
The phenotype spectrum of Japanese multiple system atrophy. Journal of neurology, neurosurgery, and psychiatry, 81(11), 1253-5. [PubMed:20571046] [WorldCat] [DOI] - ↑
Stefanova, N., Bücke, P., Duerr, S., & Wenning, G.K. (2009).
Multiple system atrophy: an update. The Lancet. Neurology, 8(12), 1172-8. [PubMed:19909915] [WorldCat] [DOI] - ↑ 石川欽也 (2015).
【小脳の最新知見-基礎研究と臨床の最前線】小脳の病態 小脳疾患の診療の最前線 日本に多い優性遺伝性脊髄小脳変性症(SCA3、6、31、DRPLA). 医学のあゆみ. 255, 1026-1032 - ↑
Yokoseki, A., Ishihara, T., Koyama, A., Shiga, A., Yamada, M., Suzuki, C., ..., & Onodera, O. (2011).
Genotype-phenotype correlations in early onset ataxia with ocular motor apraxia and hypoalbuminaemia. Brain : a journal of neurology, 134(Pt 5), 1387-99. [PubMed:21486904] [WorldCat] [DOI]