オリゴデンドロサイト
英語:oligodendrocyte 独:Oligodendrozyt 仏:oligodendrocyte
同義語:オリゴデンドログリア、希突起膠細胞、希突起神経膠細胞、希突起グリア細胞、稀突起膠細胞、稀突起神経膠細胞、稀突起グリア細胞、乏突起膠細胞、乏突起神経膠細胞、乏突起グリア細胞
オリゴデンドロサイトは中枢神経系内のグリア細胞の一つで、ミエリン(髄鞘)形成を担う。オリゴデンドロサイトは、ミエリン形成により跳躍伝導を誘導し活動電位の伝導速度を高めることが主な機能である。中枢神経系全体に広く分布するが、存在する場所によって白質内のものはintrafascicular oligodendrocyte(束間オリゴデンドロサイト)、灰白質内に位置してニューロンの細胞体と密着しているものはperineuronal oligodendrocyte(衛星オリゴデンドロサイトもしくは傍神経オリゴデンドロサイト)に分けられる。ミエリンを形成しないオリゴデンドロサイトで神経細胞とコンタクトを持っている物は、ニューロンの代謝にかかわると考えられている[1]。
研究の歴史
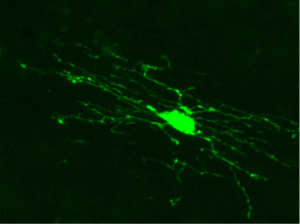
オリゴデンドロサイトは、Pio Del Rio-Hortega が、炭酸銀法と呼ばれる鍍銀染色法を開発して見出した。当時、すでにニューロンとアストロサイトは見つかっており、アストロサイトより少ない突起を持つグリア細胞という意味で名前が付けられた[2][3]。現在では、発見されていた当時に考えられていたより多くの突起を持つことが明らかにされている(図1)。
発生
オリゴデンドロサイトは、その発生の初期には神経管の限局した領域から出現する。オリゴデンドロサイト前駆細胞(oligodendrocyte precursor cell; OPC)に必須の転写因子であるOlig2の発現パターン等から、脊髄や後脳では底板に近接する腹側部から、終脳では線条体原基 (ganglionic eminence)から出現することが明らかにされており、また間脳ででも視床内境界板 (zona limitance intrathalamica)の腹側にある脳室層から産み出されると考えられる[4]。これら初期のオリゴデンドロサイト前駆細胞の出現はソニックヘッジホッグにより誘導される[5]。一方、初期の限局したオリゴデンドロサイト前駆細胞の誘導が終わった後には、比較的広い領域から比較的少数のオリゴデンドロサイト前駆細胞が誘導され、この発生にはFGFシグナルが関わると考えられている[6]。
オリゴデンドロサイト前駆細胞は脳室層から出た後、活発な移動と増殖を行いながらその分布を広げる。オリゴデンドロサイト前駆細胞の段階では均等な間隔を持って分布しており、細胞が何らかの機構で一定の距離を保つように調整さていることが示唆されている[7]。
オリゴデンドロサイト前駆細胞は、細胞表面抗原Pro-oligodendroblast、ミエリン形成前オリゴデンドロサイト (premyelinating oligodendrocyte)の段階を経てミエリン形成をはじめる。マウスでは胎生終末期から新生児期に相当し、おおよそ基本的な神経回路は出来ている時期である(皮質脊髄路は形成途上である)。これは、ミエリン形成に軸索からのシグナルが必要であることと関連している。神経活動依存的に軸索からATPが分泌されこれがアストロサイトからの白血病抑制因子 (leukemia inhibitory factor, LIF)の分泌を促進し、LIFがオリゴデンドロサイト前駆細胞からミエリン形成オリゴデンドロサイトへの分化を促進する[8]。
形態
組織像
オリゴデンドロサイトは、ヘマトキシリン・エオジン染色法やニッスル染色による光学顕微鏡観察では、塩基性色素で濃く染まる丸い核を持つ細胞として認められる[9]。このような細胞は白質に多くみられ、これがintrafascicular oligodendrocye(図1A)と呼ばれるものである。一方、灰白質内でニューロンに密着しているように観察されるものがperineuronal oligodendrocyteである。ミクログリアもオリゴデンドロサイトと同様にニューロン細胞体に密着している物が少なからずあるといわれている。これらの細胞を、組織切片上で厳密に同定・区別するには、ミエリンタンパク質をマーカーとしたin situハイブリダイゼーション法や電子顕微鏡観察が用いられる[10]。ミエリン鞘は、通常は細胞体から伸びる突起の先端に形成されることが多い(後述)。
微細形態
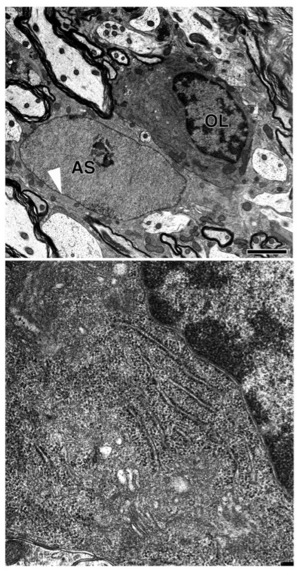
OLのは、ミエリンと連続性があり、また電子密度も高い。ASには中間径フィラメントが含まれている(矢頭)。下は、OLの細胞質の拡大。層板状の粗面小胞体と腔のやや広いGolgi装置がみられる。
電子顕微鏡観察に基づく典型的なオリゴデンドロサイトは、細胞質も核も電子密度が高く暗調である(図2)。ゴルジ装置、粗面小胞体、微小管はよく発達しており(図1B)、中心小体がみられることもある。しかし、アストロサイトでみられるグリコーゲン顆粒や中間径フィラメントは、オリゴデンドロサイトは持たないとされている。オリゴデンドロサイトには、ミエリンを形成しないものがあることやミエリンを形成していても、細胞体から離れたところに位置するため、ミエリンの有無は必ずしも微細形態上の特徴とはならない。核内の異染色質および正染色質ともに暗調であること、粗面小胞体が層板状に見られること、ゴルジ装置は比較的大きい腔を持つことなどが形態的特徴である(図2B)。一方、ミエリン形成を始めたばかりのオリゴデンドロサイトは、電子密度は低く明調である[11][12]。
突起の数
オリゴデンドロサイトが見いだされた当時は、突起のすべてを含む細胞の全体像を染めだすことが難しかったため、突起の少ない神経膠細胞ということでこの名前が付けられた。見出された当初から、細胞によって伸ばす突起の数が異なることが指摘されており、伸ばす突起の数が多い方からI型からIV型に分類されていた[1]。一方、1980年代の後半から、オリゴデンドロサイトに蛍光色素や西洋わさび過酸化酵素(horseradish peroxidase; HRP)を細胞内注入することで、その全体像が明らかにされるようになってきた[12]。また、電子顕微鏡観察でミエリン形成オリゴデンドロサイトを三次元再構築することによっても同様に明らかにされた。最近では、GFPやLacZなどのレポータータンパク質をミエリンタンパク質のプロモーターで発現させることにより、その全体像が示されている。これらの解析の結果、一つのオリゴデンドロサイトは1本から40~50本の軸索に対してミエリンを形成し、平均して15の突起を伸ばしていることが明らかにされた[9][13][14]。したがって、当初考えられていたより多い突起を伸ばしていることが示された。中には突起を伸ばさずシュワン細胞のように細胞体が軸索に取り巻いて髄鞘を形成するものがあることも明らかにされた[14]。
マーカー分子
オリゴデンドロサイトはミエリン形成をおこなうことから、ミエリンタンパク質やミエリンに含まれる脂質を特異的に発現する。したがって、そのような分子がマーカーとなりうる。
ガラクトセレブロシドとスルファチド
ミエリンは脂質に富み、乾燥重量の70 – 85%前後が脂質であるといわれている。ガラクトセレブロシド(GalC)はその代表で、セラミドの1-ヒドロキシ残基にガラクトースが結合したものである。ミエリン形成前のいわゆるPro-oligodendrocyte(ミエリン前駆細胞の事でしょうか?)の段階から発現している。GalCの発現は、モノクローナル抗体O1により認識される。また、GalCのガラクトースの4位のヒドロキシ基に硫酸基が結合したものが、スルファチド(Sulf)でこれもミエリン膜に豊富に存在する。Sulfはモノクローナル抗体O4により認識される。Sulfが発現する前のオリゴデンドロサイト前駆細胞も、このO4抗体により認識されるが、この抗原はSulfではなくいまだにその実態は明らかになっていない。GalCの合成にかかわる酵素としてセラミドガラクトシルトランスフェラーゼ(CGT, EC 2.4.1.45)が、Sulfの合成にかかわるものとしてセレブロシドスルフォトランスフェラーゼ(CST, EC 2.8.2.11)がある[15]。
ミエリンタンパク質
主なミエリンタンパク質としてミエリン・プロテオリピッドタンパク質(myelin proteolipid protein; PLP)とミエリン塩基性タンパク質(myelin basic protein; MBP)がある。PLPは、中枢神経系のミエリンに特異的に発現する(PLPのmRNAは末梢神経系でも発現が認められる)。4回膜貫通型タンパク質であり細胞外ドメインでミエリン膜どうしの相互作用に関わるとされている。MBPは、ミエリン膜の裏打ちタンパク質であり多くのスプライスバリアントが知られている。PLPまたはMBPの遺伝子が変異した自然発症ミュータントマウスでは、ミエリンの形成がみられない[16]。このほか、ミエリンに豊富に含まれるタンパク質としてはcyclicnucleotide phosphodiesterase (CNPase)、myelin-associated oligodendrocyte basic protein (MOBP)、myelin oligodendrocyte glycoprotein (MOG)、myelin-associated glycoprotein (MAG)などがある。成熟脳において、これらのミエリンタンパク質や脂質はミエリン膜に局在することが多く、免疫組織化学染色法では細胞体の検出は難しい。 細胞体の検出には、これらミエリンタンパク質や上記の脂質合成にかかわる酵素(CGTやCST)のmRNAを検出するIn situハイブリダイゼーション法がしばしば用いられている。
その他のマーカー
オリゴデンドロサイトを(免疫)組織化学的に検出するマーカーとしては、グルタチオンS-トランスフェラーゼπイソ型(GSTπ)、APC/CC1抗体、鉄イオンなどがある。このうち、鉄イオンはミエリンやそれを構成する脂質の合成に必須であることが明らかにされている[17]。
機能
オリゴデンドロサイトの機能は、軸索の伝導速度を高めることにある。オリゴデンドロサイトはその特殊化した細胞膜を軸索に巻き付けてミエリンを形成し、一種の絶縁体を形成する。そして、その継ぎ目であるランビエ絞輪でのみ活動電位を生じさせることにより跳躍伝導を引き起こす。この20年の間に、オリゴデンドロサイトが絶縁体を形成するのみならず、ランビエの絞輪にイオンチャネルのクラスター化を誘導する働きがあることが明らかになった。チャネルの局在の点からもランビエの絞輪以外で活動電位が生じにくいことがわかる[1][2]。
マウスの視神経では、同一の軸索がオリゴデンドロサイトのない網膜内では細くオリゴデンドロサイトの存在する視神経に入ると太くなることや、X線照射によりオリゴデンドロアイトを壊した視神経では軸索が太くならないことなどから、軸索径を増大させるという可能性が示唆されている[18]。軸索径が大きくなると伝導速度は大きくなることはよくわかっている。このように、オリゴデンドロサイトは2つの異なったメカニズムで、伝導速度を高めて神経機能に深くかかわっている。
一方で、オリゴデンドロサイトが作るミエリンには、Nogo、MAG、MOBPなどの軸索伸長阻害因子が発現している。成熟脳では、損傷を受けた場合、軸索再生がほとんど起こらないことが古くから知られているが、その阻害因子を作る細胞の一つがオリゴデンドロサイトである[19]。これらの阻害分子は、神経回路が形成されたのちに、その回路を大きく変化させず安定性を保つために発現しているものと考えられる。
付録
網膜とオリゴデンドロサイト・ミエリン形成
網膜と視神経は前脳胞に由来する構造であることから、中枢神経系に含まれる。視神経は、解剖学では便宜上脳神経のひとつとして末梢神経といっしょに扱われることがあるが、厳然として中枢神経の一部である。したがって視神経における髄鞘形成細胞はオリゴデンドロサイトである。一方、マウスやヒトを含む多くの哺乳動物網膜にはオリゴデンドロサイトは無く、網膜の視神経線維層の軸索は無髄線維である。一方、哺乳動物でもウサギや、鳥類以下の脊椎動物の網膜にはオリゴデンドロサイトが存在し、視神経線維層の軸索もコンパクトなミエリンにより髄鞘化されている。視神経や網膜のオリゴデンドロサイトは、末梢神経の髄鞘形成細胞(シュワン細胞)では発現しないPLPを強く発現し、またそれ以外のミエリンタンパク質の発現も見られる[20][21]。網膜のオリゴデンドロサイトは、前脳に由来し視神経を通って網膜に移動してくる[22][23]。主に視神経線維層と神経節細胞層に位置し、少数のものは内網状層にもみられる。ニワトリの網膜のミエリンは、脳や脊髄のものと比べると層板形成が薄い傾向にある。このような種差は、視神経の網膜側末端(optic nerve head)の構造的・分子的な違いに由来すると考えられているが、詳細は明らかにされていない。またその存在の意義についても、不明な点が多い。
最近になって、ミエリン様構造が海産無脊椎動物にも存在することが報告されており、驚異的な伝導速度の形成にかかわると考えられている[24]。
付記; Neuroglia(Kettenmann and Ransom Editors)第3版が2012年のうちに出版される予定であり、そこにはより詳細な記載が含まれている。
関連項目
参考文献
- ↑ 1.0 1.1 1.2
Takasaki, C., Yamasaki, M., Uchigashima, M., Konno, K., Yanagawa, Y., & Watanabe, M. (2010).
Cytochemical and cytological properties of perineuronal oligodendrocytes in the mouse cortex. The European journal of neuroscience, 32(8), 1326-36. [PubMed:20846325] [WorldCat] [DOI] - ↑ 2.0 2.1 工藤佳久. (2011)
脳とグリア細胞 知りたいサイエンス092, 技術評論社 - ↑ Verkhratsky A, and Butt A.
Glial Neurobiology, a textbook.
Wiley, 2007 - ↑
Ono, K., Takebayashi, H., & Ikenaka, K. (2009).
Olig2 transcription factor in the developing and injured forebrain; cell lineage and glial development. Molecules and cells, 27(4), 397-401. [PubMed:19390819] [WorldCat] [DOI] - ↑
Orentas, D.M., & Miller, R.H. (1996).
The origin of spinal cord oligodendrocytes is dependent on local influences from the notochord. Developmental biology, 177(1), 43-53. [PubMed:8660875] [WorldCat] [DOI] - ↑
Chandran, S., Kato, H., Gerreli, D., Compston, A., Svendsen, C.N., & Allen, N.D. (2003).
FGF-dependent generation of oligodendrocytes by a hedgehog-independent pathway. Development (Cambridge, England), 130(26), 6599-609. [PubMed:14660548] [WorldCat] [DOI] - ↑
Kirby, B.B., Takada, N., Latimer, A.J., Shin, J., Carney, T.J., Kelsh, R.N., & Appel, B. (2006).
In vivo time-lapse imaging shows dynamic oligodendrocyte progenitor behavior during zebrafish development. Nature neuroscience, 9(12), 1506-11. [PubMed:17099706] [WorldCat] [DOI] - ↑
Ishibashi, T., Dakin, K.A., Stevens, B., Lee, P.R., Kozlov, S.V., Stewart, C.L., & Fields, R.D. (2006).
Astrocytes promote myelination in response to electrical impulses. Neuron, 49(6), 823-32. [PubMed:16543131] [PMC] [WorldCat] [DOI] - ↑ 9.0 9.1 新潟大学脳研究所e-learning 神経病理より オリゴデンドロサイト
- ↑
Ono, K., Takebayashi, H., & Ikenaka, K. (2009).
Olig2 transcription factor in the developing and injured forebrain; cell lineage and glial development. Molecules and cells, 27(4), 397-401. [PubMed:19390819] [WorldCat] [DOI] - ↑ Peters A, Palay SL, Webster H de F
Fine structure of the nervous system. 3rd ed.,
Oxford Univ. Press, 1991 - ↑ 12.0 12.1 森司郎
稀突起膠細胞、小膠細胞.「神経:人体組織学8」(橋本、山元 編)
朝倉書店, 1984, pp117-132. - ↑
Butt, A.M., & Ransom, B.R. (1993).
Morphology of astrocytes and oligodendrocytes during development in the intact rat optic nerve. The Journal of comparative neurology, 338(1), 141-58. [PubMed:8300897] [WorldCat] [DOI] - ↑ 14.0 14.1
Hildebrand, C., Remahl, S., Persson, H., & Bjartmar, C. (1993).
Myelinated nerve fibres in the CNS. Progress in neurobiology, 40(3), 319-84. [PubMed:8441812] [WorldCat] [DOI] - ↑ ミエリンの脂質に関するサイト
http://www.glycoforum.gr.jp/science/glycogenes/10/10J.html - ↑
Mikoshiba, K., Okano, H., Tamura, T., & Ikenaka, K. (1991).
Structure and function of myelin protein genes. Annual review of neuroscience, 14, 201-17. [PubMed:1709560] [WorldCat] [DOI] - ↑
Todorich, B., Pasquini, J.M., Garcia, C.I., Paez, P.M., & Connor, J.R. (2009).
Oligodendrocytes and myelination: the role of iron. Glia, 57(5), 467-78. [PubMed:18837051] [WorldCat] [DOI] - ↑
Colello, R.J., Pott, U., & Schwab, M.E. (1994).
The role of oligodendrocytes and myelin on axon maturation in the developing rat retinofugal pathway. The Journal of neuroscience : the official journal of the Society for Neuroscience, 14(5 Pt 1), 2594-605. [PubMed:7514208] [WorldCat] - ↑
Yiu, G., & He, Z. (2003).
Signaling mechanisms of the myelin inhibitors of axon regeneration. Current opinion in neurobiology, 13(5), 545-51. [PubMed:14630216] [WorldCat] [DOI] - ↑
Gotoh, H., Ueda, T., Uno, A., Ohuchi, H., Ikenaka, K., & Ono, K. (2011).
Expression of myelin genes in the developing chick retina. Gene expression patterns : GEP, 11(8), 471-5. [PubMed:21872683] [WorldCat] [DOI] - ↑
Nakazawa, T., Tachi, S., Aikawa, E., & Ihnuma, M. (1993).
Formation of the myelinated nerve fiber layer in the chicken retina. Glia, 8(2), 114-21. [PubMed:7691736] [WorldCat] [DOI] - ↑
Ono, K., Tsumori, T., Kishi, T., Yokota, S., & Yasui, Y. (1998).
Developmental appearance of oligodendrocytes in the embryonic chick retina. The Journal of comparative neurology, 398(3), 309-22. [PubMed:9714145] [WorldCat] - ↑
Rompani, S.B., & Cepko, C.L. (2010).
A common progenitor for retinal astrocytes and oligodendrocytes. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(14), 4970-80. [PubMed:20371817] [PMC] [WorldCat] [DOI] - ↑
Wilson, C.H., & Hartline, D.K. (2011).
Novel organization and development of copepod myelin. ii. nonglial origin. The Journal of comparative neurology, 519(16), 3281-305. [PubMed:21674501] [WorldCat] [DOI]