「ネトリン」の版間の差分
細 (→機能) |
細編集の要約なし |
||
| 8行目: | 8行目: | ||
英:netrin | 英:netrin | ||
{{box|text= | {{box|text= 軸索ガイダンス分子の1つ。発生期に神経軸索の誘引または反発、および細胞移動の制御を行うことにより神経回路形成に関わる。線虫、ショウジョウバエ、哺乳動物で高度に保存されたファミリーを形成する。神経軸索ガイダンス以外に軸索分岐、シナプス形成オリゴデンドロサイトの分化と成熟に関わるほか、神経系以外の臓器の形態形成にも関与する。アポトーシス抑制への関与も提唱されている。}} | ||
== ネトリンとは == | == ネトリンとは == | ||
胎児期に神経[[軸索]]は[[誘引分子]]と[[反発分子]]の働きにより標的細胞へ誘導され神経回路が形成される。 | 胎児期に神経[[軸索]]は[[誘引分子]]と[[反発分子]]の働きにより標的細胞へ誘導され神経回路が形成される。 | ||
スペインの[[wj:サンティアゴ・ラモン・イ・カハール|Ramón y Cajal]]は、胎児[[脊髄]]において背側に位置する[[交連神経]]細胞の軸索が腹側へ伸張するのは腹側正中部に存在する[[底板|フロアープレート]] | スペインの[[wj:サンティアゴ・ラモン・イ・カハール|Ramón y Cajal]]は、胎児[[脊髄]]において背側に位置する[[交連神経]]細胞の軸索が腹側へ伸張するのは腹側正中部に存在する[[底板|フロアープレート]]細胞から分泌される化学物質が交連軸索を誘引するためだという[[化学向性説]](chemotropic theory)を提唱した<ref name=ref1><pubmed>7605072</pubmed></ref>。 | ||
ネトリンは、この化学誘引物質として同定されたものであり、[[ラット]]胎児脊髄培養片の交連神経軸索を伸張させるタンパク質として[[ニワトリ]]胚脳抽出物から精製された<ref name=ref2><pubmed>8062384</pubmed></ref> <ref name=ref3><pubmed>8062385</pubmed></ref>。[[wj:サンスクリット語|サンスクリット語]]で “導く” 意味を持つnetrから命名された。[[wj:遺伝子|遺伝子]][[wj:クローニング|クローニング]]の結果、これが[[線虫]]の[[UNC-6]]の[[wj:相同遺伝子|相同遺伝子]]であることが分かり、ネトリン/UNC-6は種を超えて広く保存された[[軸索ガイダンス分子]]であることが明らかとなった。 | |||
== 構造 == | == 構造 == | ||
[[image:ネトリン(図1).jpg|thumb|300px|'''図1.ネトリンの構造'''<br><ref name=ref4><pubmed>21558366</pubmed></ref>より引用、改変。]] | [[image:ネトリン(図1).jpg|thumb|300px|'''図1.ネトリンの構造'''<br>ネトリンは細胞基質蛋白質ラミニンのN末端領域に存在するドメインVI、ドメインVと相同性を示す。アミノ酸配列上、ネトリン1〜3はラミニンγ鎖に相同性が高く、ネトリン4とネトリンG1-G2はラミニンβ鎖に相同性が高い。<ref name=ref4><pubmed>21558366</pubmed></ref>より引用、改変。]] | ||
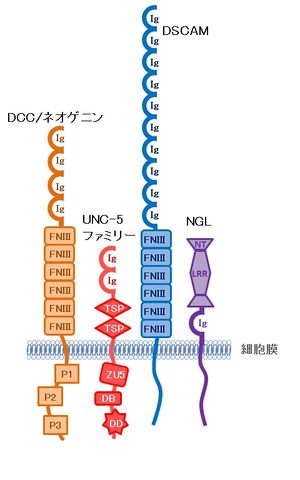
[[image:ネトリン(図2).jpg|thumb|300px|'''図2.ネトリン受容体の構造'''<br><ref name=ref4 />より引用、改変。]] | [[image:ネトリン(図2).jpg|thumb|300px|'''図2.ネトリン受容体の構造'''<br><ref name=ref4 />より引用、改変。]] | ||
約600アミノ酸残基からなる分泌タンパク質であり、線虫、[[ショウジョウバエ]]から[[哺乳動物]]まで高度に保存されている<ref name=ref4 /> | 約600アミノ酸残基からなる分泌タンパク質であり、線虫、[[ショウジョウバエ]]から[[哺乳動物]]まで高度に保存されている<ref name=ref4 />。哺乳動物では分泌型の[[ネトリン1]]〜[[ネトリン4|4]]以外に、[[GPIアンカー|グリコシルホスファチジルイノシトール(GPI)アンカー]]で[[細胞膜]]に結合した[[ネトリンG1]]と[[ネトリンG2]]が存在する<ref name=ref4 />。 | ||
いずれもN末端領域が、[[細胞基質]]タンパク質[[ラミニン]] | いずれもN末端領域が、[[細胞基質]]タンパク質[[ラミニン]]のN末端領域に存在するドメインVI、ドメインVに相同性を示す(図1)。ドメインVは3つの[[EGF]] ([[epidermal growth factor]]) 様の繰り返し配列から成る。ドメインVI・V領域のアミノ酸配列を比較すると、ネトリン1〜[[ネトリン3|3]]はラミニンγ鎖に相同性が高く、ネトリン4,ネトリンG1-G2は、ラミニンβ鎖に相同性が高い。 | ||
分泌型ネトリンのC末端領域(ドメインC、またはNTRモジュールと呼ばれる)は、塩基性アミノ酸に富み、[[ヘパリン]]と結合するが、ラミニンおよびネトリンGには存在しない。 | |||
==受容体== | |||
ネトリンの受容体としては、[[Deleted in Colorectal Cancer]] ([[DCC]])とそのパラログである[[ネオゲニン]] ([[neogenin]])、[[UNC-5]](哺乳動物では[[UNC5A]]-[[UNC5D|D]]の4種類が存在する)、および[[Down syndrome cell adhesion molecule]] ([[DSCAM]])がある<ref name=ref5><pubmed> 8861902</pubmed></ref> <ref name=ref6><pubmed>9126742</pubmed></ref> <ref name=ref7><pubmed>18585357</pubmed></ref>。DCCとネオゲニンは軸索誘引作用を持ち、UNC5は軸索反発作用を持つ。DCCとUNC5の両方を発現する細胞では軸索反発が起こる。 | ネトリンの受容体としては、[[Deleted in Colorectal Cancer]] ([[DCC]])とそのパラログである[[ネオゲニン]] ([[neogenin]])、[[UNC-5]](哺乳動物では[[UNC5A]]-[[UNC5D|D]]の4種類が存在する)、および[[Down syndrome cell adhesion molecule]] ([[DSCAM]])がある<ref name=ref5><pubmed> 8861902</pubmed></ref> <ref name=ref6><pubmed>9126742</pubmed></ref> <ref name=ref7><pubmed>18585357</pubmed></ref>。DCCとネオゲニンは軸索誘引作用を持ち、UNC5は軸索反発作用を持つ。DCCとUNC5の両方を発現する細胞では軸索反発が起こる。 | ||
ネトリンはヘパリンや[[ヘパラン硫酸]]と高い親和性で結合するため、細胞外に分泌されると細胞表面や[[基底膜]]に局在する。ネトリンは[[インテグリン]]とも結合し、[[細胞接着]]や移動を制御する。 | ネトリンはヘパリンや[[ヘパラン硫酸]]と高い親和性で結合するため、細胞外に分泌されると細胞表面や[[基底膜]]に局在する。ネトリンは[[インテグリン]]とも結合し、[[細胞接着]]や移動を制御する。 | ||
GPIアンカー型ネトリンは、[[ | GPIアンカー型ネトリンは、[[ネトリンGリガンド]] ([[NGL-1]], [[NGL-2]])に結合し、[[グルタミン酸]]作動性[[シナプス]]形成に関わる<ref name=ref8><pubmed>25411505</pubmed></ref>。 | ||
== 機能 == | |||
=== タンパク質機能 === | |||
分泌型ネトリンは、軸索の誘引、反発および細胞移動の制御を行う。例えば、交連神経細胞を含む胎児脊髄片を培養しネトリンを作用させると、交連神経軸索の伸張が促進される<ref name=ref2 />。また、培養片の中で交連神経軸索がネトリン分泌細胞へ向かって伸張方向を変えることが観察される<ref name=ref3 />。一部の神経細胞(例えば[[滑車神経]]細胞)の軸索はネトリンにより反発される。交連神経軸索の腹側への誘導において、フロアープレート細胞におけるネトリン1の発現は必須ではないが、脳室における発現が重要であることが最近相次いで報告され、ネトリンが化学向性説とは異なる機序で働く可能性が示唆されている <ref name=ref28445456 ><pubmed>28445456</pubmed></ref> <ref name=ref28434801 ><pubmed>28434801</pubmed></ref> <ref name=ref28931893 ><pubmed>28931893</pubmed></ref>。 | |||
=== 個体における機能 === | === 個体における機能 === | ||
ネトリン1遺伝子を欠損した[[マウス]]は神経発生異常を示し生後まもなく死亡する<ref name=ref9><pubmed>8978605</pubmed></ref>。脊髄交連神経細胞の軸索はほとんど伸張せず、この異常はDCC[[ノックアウトマウス]]で見られる異常と同一であることから、ネトリンとDCCが交連神経の形成に必要であることが示された<ref name=ref9 /> <ref name=ref10><pubmed>9126737 </pubmed></ref>。脊髄以外の交連([[脳梁]]、[[前交連]]、[[海馬]]交連)も形成されないか、低形成である<ref name=ref9 />。 | ネトリン1遺伝子を欠損した[[マウス]]は神経発生異常を示し生後まもなく死亡する<ref name=ref9><pubmed>8978605</pubmed></ref>。脊髄交連神経細胞の軸索はほとんど伸張せず、この異常はDCC[[ノックアウトマウス]]で見られる異常と同一であることから、ネトリンとDCCが交連神経の形成に必要であることが示された<ref name=ref9 /> <ref name=ref10><pubmed>9126737 </pubmed></ref>。脊髄以外の交連([[脳梁]]、[[前交連]]、[[海馬]]交連)も形成されないか、低形成である<ref name=ref9 />。 | ||
ネトリンは細胞移動にも必要であり、ネトリン1あるいはDCCのノックアウトマウスでは[[橋核]]が形成されない<ref name=ref9 /> <ref name=ref10 />。これは、[[下菱脳唇]]で誕生した[[ | ネトリンは細胞移動にも必要であり、ネトリン1あるいはDCCのノックアウトマウスでは[[橋核]]が形成されない<ref name=ref9 /> <ref name=ref10 />。これは、[[下菱脳唇]]で誕生した[[小脳前核]]細胞(DCC を発現している)が[[延髄]]腹側で発現するネトリン1により誘引されて橋核を形成するため、このシグナルが欠損すると[[神経細胞移動|細胞移動]]が正常に起こらず橋核が形成されないと考えられる。 | ||
ネトリンは、軸索ガイダンス、細胞移動の制御以外に、[[軸索分岐]]、[[シナプス形成]]、[[オリゴデンドロサイト]]の[[分化]]と成熟にも関与している<ref name=ref4 />。更に、[[乳腺]]、[[肺]]、[[膵臓]]、[[血管]]など神経系以外の組織における形態形成にも関わることが明らかになってきた<ref name=ref11><pubmed>17356579 </pubmed></ref>。 | ネトリンは、軸索ガイダンス、細胞移動の制御以外に、[[軸索分岐]]、[[シナプス形成]]、[[オリゴデンドロサイト]]の[[分化]]と成熟にも関与している<ref name=ref4 />。更に、[[乳腺]]、[[肺]]、[[膵臓]]、[[血管]]など神経系以外の組織における形態形成にも関わることが明らかになってきた<ref name=ref11><pubmed>17356579 </pubmed></ref>。 | ||
| 50行目: | 48行目: | ||
== 関連語 == | == 関連語 == | ||
*[[UNC-5]] | *[[UNC-5]] | ||
*[[UNC-6]] | *[[UNC-6]] | ||
*[[UNC-40]] | *[[UNC-40]] | ||
*[[DCC]] | *[[DCC]] | ||
*[[ネオゲニン]] | *[[ネオゲニン]] | ||
==参考文献== | ==参考文献== | ||
<references /> | <references /> | ||
2018年1月10日 (水) 20:20時点における版
桝 正幸、桝 和子
筑波大学 医学医療系 分子神経生物学
DOI:10.14931/bsd.7314 原稿受付日:2016年12月30日 原稿完成日:2016年月日
担当編集委員:村上 富士夫(大阪大学 大学院生命機能研究科)
英:netrin
軸索ガイダンス分子の1つ。発生期に神経軸索の誘引または反発、および細胞移動の制御を行うことにより神経回路形成に関わる。線虫、ショウジョウバエ、哺乳動物で高度に保存されたファミリーを形成する。神経軸索ガイダンス以外に軸索分岐、シナプス形成オリゴデンドロサイトの分化と成熟に関わるほか、神経系以外の臓器の形態形成にも関与する。アポトーシス抑制への関与も提唱されている。
ネトリンとは
胎児期に神経軸索は誘引分子と反発分子の働きにより標的細胞へ誘導され神経回路が形成される。
スペインのRamón y Cajalは、胎児脊髄において背側に位置する交連神経細胞の軸索が腹側へ伸張するのは腹側正中部に存在するフロアープレート細胞から分泌される化学物質が交連軸索を誘引するためだという化学向性説(chemotropic theory)を提唱した[1]。
ネトリンは、この化学誘引物質として同定されたものであり、ラット胎児脊髄培養片の交連神経軸索を伸張させるタンパク質としてニワトリ胚脳抽出物から精製された[2] [3]。サンスクリット語で “導く” 意味を持つnetrから命名された。遺伝子クローニングの結果、これが線虫のUNC-6の相同遺伝子であることが分かり、ネトリン/UNC-6は種を超えて広く保存された軸索ガイダンス分子であることが明らかとなった。
構造
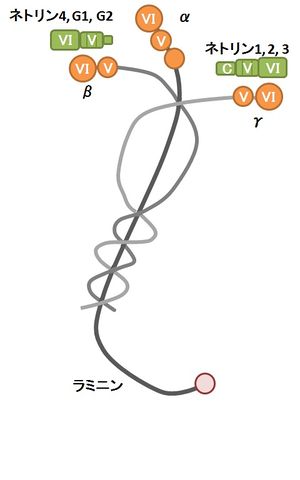
ネトリンは細胞基質蛋白質ラミニンのN末端領域に存在するドメインVI、ドメインVと相同性を示す。アミノ酸配列上、ネトリン1〜3はラミニンγ鎖に相同性が高く、ネトリン4とネトリンG1-G2はラミニンβ鎖に相同性が高い。[4]より引用、改変。
約600アミノ酸残基からなる分泌タンパク質であり、線虫、ショウジョウバエから哺乳動物まで高度に保存されている[4]。哺乳動物では分泌型のネトリン1〜4以外に、グリコシルホスファチジルイノシトール(GPI)アンカーで細胞膜に結合したネトリンG1とネトリンG2が存在する[4]。
いずれもN末端領域が、細胞基質タンパク質ラミニンのN末端領域に存在するドメインVI、ドメインVに相同性を示す(図1)。ドメインVは3つのEGF (epidermal growth factor) 様の繰り返し配列から成る。ドメインVI・V領域のアミノ酸配列を比較すると、ネトリン1〜3はラミニンγ鎖に相同性が高く、ネトリン4,ネトリンG1-G2は、ラミニンβ鎖に相同性が高い。
分泌型ネトリンのC末端領域(ドメインC、またはNTRモジュールと呼ばれる)は、塩基性アミノ酸に富み、ヘパリンと結合するが、ラミニンおよびネトリンGには存在しない。
受容体
ネトリンの受容体としては、Deleted in Colorectal Cancer (DCC)とそのパラログであるネオゲニン (neogenin)、UNC-5(哺乳動物ではUNC5A-Dの4種類が存在する)、およびDown syndrome cell adhesion molecule (DSCAM)がある[5] [6] [7]。DCCとネオゲニンは軸索誘引作用を持ち、UNC5は軸索反発作用を持つ。DCCとUNC5の両方を発現する細胞では軸索反発が起こる。
ネトリンはヘパリンやヘパラン硫酸と高い親和性で結合するため、細胞外に分泌されると細胞表面や基底膜に局在する。ネトリンはインテグリンとも結合し、細胞接着や移動を制御する。
GPIアンカー型ネトリンは、ネトリンGリガンド (NGL-1, NGL-2)に結合し、グルタミン酸作動性シナプス形成に関わる[8]。
機能
タンパク質機能
分泌型ネトリンは、軸索の誘引、反発および細胞移動の制御を行う。例えば、交連神経細胞を含む胎児脊髄片を培養しネトリンを作用させると、交連神経軸索の伸張が促進される[2]。また、培養片の中で交連神経軸索がネトリン分泌細胞へ向かって伸張方向を変えることが観察される[3]。一部の神経細胞(例えば滑車神経細胞)の軸索はネトリンにより反発される。交連神経軸索の腹側への誘導において、フロアープレート細胞におけるネトリン1の発現は必須ではないが、脳室における発現が重要であることが最近相次いで報告され、ネトリンが化学向性説とは異なる機序で働く可能性が示唆されている [9] [10] [11]。
個体における機能
ネトリン1遺伝子を欠損したマウスは神経発生異常を示し生後まもなく死亡する[12]。脊髄交連神経細胞の軸索はほとんど伸張せず、この異常はDCCノックアウトマウスで見られる異常と同一であることから、ネトリンとDCCが交連神経の形成に必要であることが示された[12] [13]。脊髄以外の交連(脳梁、前交連、海馬交連)も形成されないか、低形成である[12]。
ネトリンは細胞移動にも必要であり、ネトリン1あるいはDCCのノックアウトマウスでは橋核が形成されない[12] [13]。これは、下菱脳唇で誕生した小脳前核細胞(DCC を発現している)が延髄腹側で発現するネトリン1により誘引されて橋核を形成するため、このシグナルが欠損すると細胞移動が正常に起こらず橋核が形成されないと考えられる。
ネトリンは、軸索ガイダンス、細胞移動の制御以外に、軸索分岐、シナプス形成、オリゴデンドロサイトの分化と成熟にも関与している[4]。更に、乳腺、肺、膵臓、血管など神経系以外の組織における形態形成にも関わることが明らかになってきた[14]。
疾患との関わり
ネトリンの受容体であるDCCの変異で先天的鏡像運動症(congenital mirror movement syndrome)が生じる[15]。この遺伝性疾患は、片側の随意運動により反対側に不随意運動が誘発されるものであり、ネトリン—DCCシグナルがヒトにおいても神経回路、特に交差性線維の形成で重要な役割を担っていることを示唆する。ヒトのネトリン1遺伝子、あるいはDCC遺伝子の一塩基多型がパーキンソン病や筋萎縮性側索硬化症になりやすさに関連する。ネトリンG1遺伝子の変異はRett症候群の原因となる[16]。
関連語
参考文献
- ↑
Colamarino, S.A., & Tessier-Lavigne, M. (1995).
The role of the floor plate in axon guidance. Annual review of neuroscience, 18, 497-529. [PubMed:7605072] [WorldCat] [DOI] - ↑ 2.0 2.1
Serafini, T., Kennedy, T.E., Galko, M.J., Mirzayan, C., Jessell, T.M., & Tessier-Lavigne, M. (1994).
The netrins define a family of axon outgrowth-promoting proteins homologous to C. elegans UNC-6. Cell, 78(3), 409-24. [PubMed:8062384] [WorldCat] [DOI] - ↑ 3.0 3.1
Kennedy, T.E., Serafini, T., de la Torre, J.R., & Tessier-Lavigne, M. (1994).
Netrins are diffusible chemotropic factors for commissural axons in the embryonic spinal cord. Cell, 78(3), 425-35. [PubMed:8062385] [WorldCat] [DOI] - ↑ 4.0 4.1 4.2 4.3 4.4
Lai Wing Sun, K., Correia, J.P., & Kennedy, T.E. (2011).
Netrins: versatile extracellular cues with diverse functions. Development (Cambridge, England), 138(11), 2153-69. [PubMed:21558366] [WorldCat] [DOI] - ↑
Keino-Masu, K., Masu, M., Hinck, L., Leonardo, E.D., Chan, S.S., Culotti, J.G., & Tessier-Lavigne, M. (1996).
Deleted in Colorectal Cancer (DCC) encodes a netrin receptor. Cell, 87(2), 175-85. [PubMed:8861902] [WorldCat] [DOI] - ↑
Leonardo, E.D., Hinck, L., Masu, M., Keino-Masu, K., Ackerman, S.L., & Tessier-Lavigne, M. (1997).
Vertebrate homologues of C. elegans UNC-5 are candidate netrin receptors. Nature, 386(6627), 833-8. [PubMed:9126742] [WorldCat] [DOI] - ↑
Ly, A., Nikolaev, A., Suresh, G., Zheng, Y., Tessier-Lavigne, M., & Stein, E. (2008).
DSCAM is a netrin receptor that collaborates with DCC in mediating turning responses to netrin-1. Cell, 133(7), 1241-54. [PubMed:18585357] [PMC] [WorldCat] [DOI] - ↑
Matsukawa, H., Akiyoshi-Nishimura, S., Zhang, Q., Luján, R., Yamaguchi, K., Goto, H., ..., & Itohara, S. (2014).
Netrin-G/NGL complexes encode functional synaptic diversification. The Journal of neuroscience : the official journal of the Society for Neuroscience, 34(47), 15779-92. [PubMed:25411505] [PMC] [WorldCat] [DOI] - ↑
Dominici, C., Moreno-Bravo, J.A., Puiggros, S.R., Rappeneau, Q., Rama, N., Vieugue, P., ..., & Chédotal, A. (2017).
Floor-plate-derived netrin-1 is dispensable for commissural axon guidance. Nature, 545(7654), 350-354. [PubMed:28445456] [PMC] [WorldCat] [DOI] - ↑
Varadarajan, S.G., Kong, J.H., Phan, K.D., Kao, T.J., Panaitof, S.C., Cardin, J., ..., & Butler, S.J. (2017).
Netrin1 Produced by Neural Progenitors, Not Floor Plate Cells, Is Required for Axon Guidance in the Spinal Cord. Neuron, 94(4), 790-799.e3. [PubMed:28434801] [PMC] [WorldCat] [DOI] - ↑
Yamauchi, K., Yamazaki, M., Abe, M., Sakimura, K., Lickert, H., Kawasaki, T., ..., & Hirata, T. (2017).
Netrin-1 Derived from the Ventricular Zone, but not the Floor Plate, Directs Hindbrain Commissural Axons to the Ventral Midline. Scientific reports, 7(1), 11992. [PubMed:28931893] [PMC] [WorldCat] [DOI] - ↑ 12.0 12.1 12.2 12.3
Serafini, T., Colamarino, S.A., Leonardo, E.D., Wang, H., Beddington, R., Skarnes, W.C., & Tessier-Lavigne, M. (1996).
Netrin-1 is required for commissural axon guidance in the developing vertebrate nervous system. Cell, 87(6), 1001-14. [PubMed:8978605] [WorldCat] [DOI] - ↑ 13.0 13.1
Fazeli, A., Dickinson, S.L., Hermiston, M.L., Tighe, R.V., Steen, R.G., Small, C.G., ..., & Weinberg, R.A. (1997).
Phenotype of mice lacking functional Deleted in colorectal cancer (Dcc) gene. Nature, 386(6627), 796-804. [PubMed:9126737] [WorldCat] [DOI] - ↑
Cirulli, V., & Yebra, M. (2007).
Netrins: beyond the brain. Nature reviews. Molecular cell biology, 8(4), 296-306. [PubMed:17356579] [WorldCat] [DOI] - ↑
Depienne, C., Cincotta, M., Billot, S., Bouteiller, D., Groppa, S., Brochard, V., ..., & Roze, E. (2011).
A novel DCC mutation and genetic heterogeneity in congenital mirror movements. Neurology, 76(3), 260-4. [PubMed:21242494] [WorldCat] [DOI] - ↑
Woo, J., Kwon, S.K., & Kim, E. (2009).
The NGL family of leucine-rich repeat-containing synaptic adhesion molecules. Molecular and cellular neurosciences, 42(1), 1-10. [PubMed:19467332] [WorldCat] [DOI]