「CRMP」の版間の差分
細 (→CRMP2) |
細 (→CRMP4) |
||
| 157行目: | 157行目: | ||
CRMP4をノックアウトすると、海馬[[CA1]]の[[錐体細胞]]の[[尖端樹状突起]]が二分枝化する表現型が増加し<ref name="ref23"><pubmed> 22234963 </pubmed></ref>、これはSema3Aのノックアウトマウスにおいても観察される<ref name="ref5" />。Sema3Aにより樹状突起の伸長や枝分かれが促進されるが、CRMP4ノックアウトマウスの培養海馬神経細胞においては、Sema3Aを加えてもこれらの促進が認められない<ref name="ref23" />。これらのことから、Sema3AシグナルがCRMP4に伝わり、海馬CA1における錐体細胞の尖端樹状突起の二分枝化を負に制御することが示唆されている<ref name="ref5" /><ref name="ref23" />。 | CRMP4をノックアウトすると、海馬[[CA1]]の[[錐体細胞]]の[[尖端樹状突起]]が二分枝化する表現型が増加し<ref name="ref23"><pubmed> 22234963 </pubmed></ref>、これはSema3Aのノックアウトマウスにおいても観察される<ref name="ref5" />。Sema3Aにより樹状突起の伸長や枝分かれが促進されるが、CRMP4ノックアウトマウスの培養海馬神経細胞においては、Sema3Aを加えてもこれらの促進が認められない<ref name="ref23" />。これらのことから、Sema3AシグナルがCRMP4に伝わり、海馬CA1における錐体細胞の尖端樹状突起の二分枝化を負に制御することが示唆されている<ref name="ref5" /><ref name="ref23" />。 | ||
CRMP4 | CRMP4 [[mRNA]]のマウス脳での詳細な発現分布、発現強度の生後変化が報告された <ref name=Tsutiya2012><pubmed>22816653</pubmed></ref>。視床下部 (AVPV) でのCRMP4の発現が、視床下部性差形成時期において雌雄で異なり、CRMP4はメス特異的にAVPVに存在するドーパミンニューロン (THニューロン) の数を調節することが報告された<ref name=Iwakura2013><pubmed>23420586</pubmed></ref>。CRMP4欠損仔マウスの嗅球において 、グルタミン酸受容体1 (GluR1) とGluR2の発現が増加すること、嗅球ニューロンの興奮が亢進すること、匂い識別能力が低下することが示された <ref name=Tsutiya2015><pubmed>26118640</pubmed></ref>('''表2''')。 | ||
CRM4欠損あるいはノックダウンした神経細胞では、樹状突起の分岐点の数が増加し、樹状突起伸長が促進されること、CRMP4を過剰発現した神経細胞では樹状突起伸長が抑制されることから、CRMP4は樹状突起の分岐および伸長を抑制することが示唆されている<ref name="ref23" /><ref name=Tsutiya2016><pubmed>26739921</pubmed></ref> | CRM4欠損あるいはノックダウンした神経細胞では、樹状突起の分岐点の数が増加し、樹状突起伸長が促進されること、CRMP4を過剰発現した神経細胞では樹状突起伸長が抑制されることから、CRMP4は樹状突起の分岐および伸長を抑制することが示唆されている<ref name="ref23" /><ref name=Tsutiya2016><pubmed>26739921</pubmed></ref> | ||
2021年12月15日 (水) 20:54時点における最新版
久保 祐亮、浦崎明宏、稲垣 直之
奈良先端科学技術大学院大学 神経システム生物学研究室
DOI:10.14931/bsd.2286 原稿受付日:2012年8月3日 原稿完成日:2012年10月26日 改訂版受付日:2017年5月30日
担当編集委員:大隅 典子(東北大学 大学院医学系研究科 附属創生応用医学研究センター 脳神経科学コアセンター 発生発達神経科学分野)
英:collapsin response mediator protein、英略語:CRMP
同義語:コラプシン反応媒介タンパク質、ジヒドロピリミジナーゼ様タンパク質 (dihydropyrimidinase-like protein)
コラプシン反応媒介タンパク質(collapsin response mediator proteins, CRMPs)は、軸索の反発性因子であるセマフォリン3A(Sema3A)の細胞内シグナルを伝達する分子として最初に同定された[1]。CRMPsは、細胞質タンパク質であり、これまでに5つのサブタイプ(CRMP1~5)が同定されている。これらの発現は主に発生時期の神経系に認められ、それぞれ特異的な発現分布と発現時期を示す[2]。CRMPsは線虫Unc-33の相同分子であり、Unc-33の突然変異は線虫の神経細胞において軸索の伸長やガイダンスの異常を引き起こす[3]。CRMPsはリン酸化タンパク質であり、リン酸化の制御は神経の発達や成熟に重要な役割を果たす[4][5]。また、初代培養神経細胞やノックアウトマウスを使った研究により、CRMPsの役割が明らかになってきており、極性・軸索形成や神経細胞の遊走、シナプス形成、シナプス可塑性、神経疾患といった様々な神経機能と病態に関与することが報告されている[4][5]。
| Collapsin response mediator protein 1 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Identifiers | |||||||||
| Symbol | ? | ||||||||
| Pfam | PF01979 | ||||||||
| SCOP | 1kcx | ||||||||
| SUPERFAMILY | 1kcx | ||||||||
| |||||||||
構造
CRMPsはウラシルとチミジンの異化反応に関わるジヒドロピリミジナーゼ(DPYS)、バクテリアの酵素のヒダントイナーゼとそれぞれ58%および40%の相同性を示すが、CRMPs自体にはこれらの酵素活性は認められない。CRMPsはリン酸化、脱アミド化、酸化、糖鎖修飾などの翻訳後修飾を受けることが明らかになっている。よくわかっている翻訳後修飾がリン酸化であり、主にCRMPsのC末端部でRhoキナーゼやCdk5、GSK-3βなどによりリン酸化されることがわかっている。
サブファミリー
これまでに5つのサブタイプ(CRMP1~5)が同定されている。線虫Unc-33の相同分子であり、CRMP1-4は互いに~75%相同性がある。CRMP5は他のCRMPと50-51%相同性がある。哺乳類のCRMP1、2、4は選択的スプライシングを受けることが報告されている。
CRMP1、CRMP2、CRMP3、CRMP4、CRMP5は、それぞれDPYSL1(Ulip3, DRP1, C22)、DPYSL2(Ulip2, DRP2, TOAD-64)、DPYSL4(Ulip4, DRP4)、DPYSL3(Ulip1, DRP3, hUlip)、DPYSL5(Ulip6, DRP5, CRAM)などとも呼ばれる
発現
発生期の神経系
ラットにおいては、初期胚から有糸分裂後の神経細胞において強く発現し、生後1週間前後でピークに達し、その後は発現量が低下する。どのCRMPsも時空間的に調節された発現パターンを示す[2](表1) 。CRMP2は最も広範な発現パターンを示し、大多数の神経細胞の発生初期において発現する[6]。CRMP1とCRMP4は神経細胞の遊走後に発現し、胎生後期から出生後初期において最も発現量が高くなり、その後発現量が低下する[6]。CRMP3の発現は、主に小脳の顆粒細胞に限られている[6]。CRMP5の発現は新皮質、海馬、脊髄に顕著であり、有糸分裂後の神経細胞で発現する[7]。
| E12-E16 | E18 | P0 | P5-P7 | P14 | P21 | Adult | |
| CRMP1 | + | +++ | +++ | +++ | ++ | + | +/- |
| CRMP2/dihydropyrimidinase-like 2 | ++ | +++ | +++ | +++ | ++ | ++ | ++ |
| CRMP3/dihydropyrimidinase-like 4 | + | ++ | ++ | ++ | + | + | + |
| CRMP4/dihydropyrimidinase-like 3 | + | +++ | +++ | +++ | + | +/- | +/- |
| CRMP5/dihydropyrimidinase-like 5 | + | +++ | +++ | +++ | ++ | + | + |
E=胎生期, P=出生後, +/-=very weak, +=weak, ++=average, +++=strong
成体の神経系
ラットの成体脳において、CRMPsは劇的に発現量が低下し、主に可塑性や神経新生を保持する領域(嗅球、海馬、小脳)で発現が認められる。
CRMP1は主に小脳のプルキンエ細胞において発現する[6]。
CRMP2は成体脳においてはCRMPの中でも発現量が最も高く、嗅覚系や小脳、海馬で多く検出されている[2][6]。
CRMP3は小脳顆粒細胞や下オリーブ核、海馬歯状回で発現する[2][6]。
CRMP4は成体脳においてはCRMPsの中でも発現量が最も低く、嗅球や海馬、小脳の内顆粒層におけるわずかな細胞で発現が確認されている[2][8]。
CRMP5は嗅球や嗅上皮における有糸分裂後の神経細胞、海馬歯状回で発現しており、また、末梢神経の軸索や感覚神経でも発現していることが報告されている[2]。
機能
CRMP1
CRMP1は、生後1日目のラット大脳皮質で強く発現する[6]。CRMP1ノックアウトマウスでは、小脳の顆粒細胞の増殖とアポトーシスの減少 [9]、大脳皮質神経細胞の遊走の低下[10]。、スパイン形成の障害[11]を示すことが報告されている(表2)。
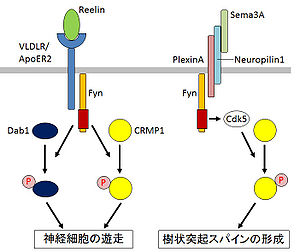
CRMP1はFynの基質であり、リーリン(Reelin)が受容体(VLDLR/ApoER2)に結合すると、FynによりCRMP1とDab1がチロシンリン酸化され、これらが相乗的にシグナルのメディエーターとして働き、神経細胞の遊走を制御すると考えられている[10](図1)。また、Cdk5によるCRMP1のリン酸化が、Sema3Aによる樹状突起スパインの形成に関与することが報告されている[12](図1)。
CRMP2
CRMP2はCRMPsの中でも最初に同定され、最も解析が進んでいる分子である。CRMP2は、様々な結合パートナーと相互作用することにより、神経極性形成、微小管ダイナミクス、軸索の伸長・退縮、キネシン依存的軸索輸送、Ca2+ホメオスタシスなどに関与する[4][13]。
CRMP2は培養海馬神経細胞の伸長中の軸索に濃縮し、CRMP2の過剰発現により複数本の軸索(過剰軸索)が誘導される[14]。誘導された過剰軸索は、シナプトフィジン陽性のシナプス末端を持つことから、CRMP2は成熟した軸索の形成を誘導し、維持すると考えられる[4][14]。さらに、過剰発現により樹状突起が軸索に変化したことから、過剰発現されたCRMP2が未成熟な神経突起だけでなく、樹状突起にも軸索のアイデンティティを与え得ることが示唆された[4][14]。
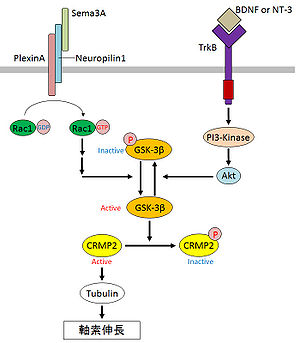
CRMP2による軸索形成の分子メカニズムとして、微小管ダイナミクスの制御が報告されている。CRMP2はチューブリンヘテロ二量体と結合して微小管の重合を促進すること、また、この微小管重合活性がCRMP2により誘導される軸索伸長に必要であることが明らかになっている[15]。CRMP2のチューブリンへの結合はダイナミックに制御されており、Sema3A受容体であるニューロピリン-1(NP-1)やプレキシンA(PlexA)がRac1を活性化し、下流のキナーゼに影響を与え、最終的にGSK-3βが活性化され、CRMP2がリン酸化を受ける[13][16]。リン酸化されたCRMP2はチューブリンへのアフィニティーが弱くなり、軸索の退縮が促進される[16](図2)。逆に、ニューロトロフィン-3や脳由来神経成長因子(BDNF)によりGSK-3βが阻害され、CRMP2のリン酸化が抑制されることで、軸索伸長が促進する[16](図2)。また、CRMP2の結合タンパク質としてNumbが同定されており、CRMP2が軸索先端でNumbを介したL1のエンドサイトーシスおよびリサイクリングに関与する可能性が示唆されている[17]。RhoキナーゼがCRMP2をリン酸化することにより、CRMP2がNumbと結合できなくなり、軸索伸長が阻害されることも報告されている[18]。
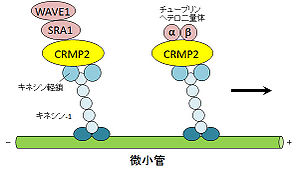
CRMP2はキネシン依存性軸索輸送にも関与する。CRMP2がチューブリンヘテロ二量体もしくはSra-1をキネシン-1につなぎとめ、CRMP2/キネシン-1複合体がチューブリン二量体やSra-1/WAVE-1複合体の輸送を制御する[19][20](図3)。また、TrkB/Slp1/Rab27複合体がCRMP2を介してキネシン-1に結合し、これらが順行性輸送されることが報告されている[21](図3)。
CRMP2のCa2+ホメオスタシスへの関与としては、CRMP2が直接的にCaV2.2(N型電位依存性カルシウムチャネル)と結合すると、シナプス前部の膜表面でのCaV2.2の局在が増加してCa2+の流入が増加することにより、神経伝達物質の放出が増加することが報告されている[22]。
Cdk5の主要なリン酸化部位 (S522) に変異を入れた非活性型CRMP2 (CRMP2 S522A) のノックインマウス(CRMP2KI/KI)の解析によると、CRMP1-/-バックグラウンドにおいて樹状突起パターンに異常が見られることが報告された[23](表2)。また、CRMP4-/-バックグラウンドのCRMP2KI/KIにおいて、海馬CA1錐体ニューロンの樹状突起の分岐が増加することが報告された[24](表2) 。これらより、樹状突起パターンや樹状突起の分岐にCRMP2のリン酸化が重要な役割をしていることが示唆されている。
CRMP3
CRMP3ノックアウトマウスの海馬において、樹状突起の長さや枝分かれの数が減少することが報告された[25](表2)。また、CRMP3を過剰発現させると、樹状突起の長さや枝分かれの数が減少や、プリオンタンパク質の過剰発現による樹状突起の委縮を抑制する効果があることが報告された[26](表2) 。CRMP3のC末端が樹状突起形成に関与していることが示唆された[27]。さらに、樹状突起スパインの形成も異常になることから、CRMP3は樹状突起の形成や樹状突起スパインの成熟に関与すると考えられている[25]。また、CRMP3のその他の役割として、微小管の重合を阻害することにより神経突起の伸長を抑制することや、興奮毒性のあるグルタミン酸で処理した神経細胞において、神経細胞が壊死する前の核凝縮時にカルパインにより切断されたCRMP3が核膜孔を通り核内に移行することで核凝縮に関わる可能性が示唆されている[28]。
CRMP4
CRMP4をノックアウトすると、海馬CA1の錐体細胞の尖端樹状突起が二分枝化する表現型が増加し[29]、これはSema3Aのノックアウトマウスにおいても観察される[5]。Sema3Aにより樹状突起の伸長や枝分かれが促進されるが、CRMP4ノックアウトマウスの培養海馬神経細胞においては、Sema3Aを加えてもこれらの促進が認められない[29]。これらのことから、Sema3AシグナルがCRMP4に伝わり、海馬CA1における錐体細胞の尖端樹状突起の二分枝化を負に制御することが示唆されている[5][29]。
CRMP4 mRNAのマウス脳での詳細な発現分布、発現強度の生後変化が報告された [30]。視床下部 (AVPV) でのCRMP4の発現が、視床下部性差形成時期において雌雄で異なり、CRMP4はメス特異的にAVPVに存在するドーパミンニューロン (THニューロン) の数を調節することが報告された[31]。CRMP4欠損仔マウスの嗅球において 、グルタミン酸受容体1 (GluR1) とGluR2の発現が増加すること、嗅球ニューロンの興奮が亢進すること、匂い識別能力が低下することが示された [32](表2)。
CRM4欠損あるいはノックダウンした神経細胞では、樹状突起の分岐点の数が増加し、樹状突起伸長が促進されること、CRMP4を過剰発現した神経細胞では樹状突起伸長が抑制されることから、CRMP4は樹状突起の分岐および伸長を抑制することが示唆されている[29][33] (表2)。CRMP4欠損細胞では、軸索伸長と成長円錐形成の阻害が見られることが報告されている[34](表2) 。CRMP4は微小管重合とF-アクチンの束化を促進することにより、成長円錐形成を制御することが示唆されている[34]。
CRMP5
CRMP5はCRAMと名付けられたCRMP-associated proteinとして同定された。CRMP5は成長円錐の糸状仮足に局在し、糸状仮足のダイナミクスや成長円錐の形態を制御するのに重要な役割を果たす[35]。また、CRMP5がMAP2およびチューブリンと複合体を形成し、これにより神経突起の伸長が阻害されることが報告されている[36]。海馬神経細胞において、CRMP5は発生の初期段階ではMinor processと呼ばれる未成熟な突起に強く発現しており、将来樹状突起になる突起の伸長を抑制する[36]。一方、CRMP5とCRMP2の両方が共発現している際には、CRMP2により誘導される神経突起伸長を抑制すると考えられている[36]。
小脳のプルキンエ細胞において、CRMP5はシナプス可塑性に重要な役割を果たすことが報告されている[37]。プルキンエ細胞におけるCRMP5の発現は、出生後21日から28日において確認されており、CRMP5をノックアウトすると、プルキンエ細胞の細胞体のサイズや樹状突起の長さが減少する。さらに、平行線維とプルキンエ細胞間の興奮性シナプス伝達の長期抑圧(LTD;long-term depression)の誘導が阻害されることが報告されている[37]。プルキンエ細胞の樹状突起の形態制御にはBDNF-TrkBシグナルが関与する可能性が示唆されている[5]。CRMP5ノックアウトマウスのプルキンエ細胞におけるBDNFの効果はまだ解析されていないが、ノックアウトマウスの培養海馬神経細胞において、BDNFにより誘導される樹状突起伸長の促進が減弱し、樹状突起の形態も損なわれる。さらに、TrkBによりCRMP5がチロシンリン酸化されることも明らかになり、BDNF-TrkBシグナルがCRMP5に伝わり、プルキンエ細胞の樹状突起の形態の制御に関与する可能性が示唆されている[5][37]。
CRMP5は、ミエリン化されてないシュワン細胞で発現し、ミエリン化されたシュワン細胞では発現が低下することが報告されている[38] 。CRMP5ノックアウト細胞では、軸索とシュワン細胞の相互作用に異常が見られることから、CRMP5は軸索とシュワン細胞の相互作用を調節していることが示唆されている[38](表2)。
疾患との関わり
神経疾患
中枢神経系では、特定領域の神経変性がアルツハイマー病やパーキンソン病などの神経変性疾患の発症に重要な役割を果たしている。
これまでの研究により、CRMP2がアルツハイマー病の発症に関与している可能性が示唆されている。3F4と呼ばれる抗リン酸化CRMP2抗体が、粗精製した過剰にリン酸化されたタウの集合体(神経原線維変化)と反応することが報告された[39]。この抗体はCdk5やGSK3βによりリン酸化されたCRMP2を認識することから、CRMP2のリン酸化がアルツハイマー病の原因因子の一つである可能性がある[40]。
さらに、リン酸化CRMP2がアルツハイマー病の脳やアルツハイマー病の疾患モデルマウスにおいて増加することが確認されている[41]。また、アルツハイマー病の海馬CA1領域においてSema3A陽性神経細胞の数が増加することが報告されていることから[42]、アルツハイマー病の脳において、増加したSema3Aのシグナル伝達によりCRMP2のリン酸化が促進される可能性が考えられる。
CRPMノックアウトマウスの解析において、神経発生に関する表現型だけでなく、行動異常や疾患に関連する表現型も観察されている(表2)[43] 。
CRMP1ノックアウトマウスの行動解析により、高活動性、空間学習と記憶の障害、プレパルス抑制などの統合失調症に見られる症状に異常が見られた[44]。
非活性型CRMP2 (CRMP2 S522A) のノックインマウスでは、中枢神経に障害を受けた際に起こる炎症と瘢痕形成に抑制効果が見られた[43] 。CRMP2ノックアウトマウスの包括的な行動解析により、高活動性、感情行動障害、社会性低下などの神経精神疾患に見られる症状に異常が見られた[45] 。
CRMP4ノックアウトマウスでは、中枢神経に障害を受けた際に起こる炎症と瘢痕形成に抑制効果が見られ、障害を受けた後の運動性の回復に改善が見られることが報告された[46]。パーキンソン病モデルマウスにおいて、CRMP4の欠失はドーパミン作動性神経細胞死の遅延と炎症抑制を示すことが報告されている[47]。
| 遺伝子 | 表現型 | 参考文献 |
| 神経発生に関する表現型 | ||
| CRMP1 | 顆粒細胞の増殖とアポトーシスの減少 | [9] |
| 神経細胞移動の減少 | [48] | |
| スパイン形成障害 | [11] | |
| CRMP2 | 樹状突起パターンの異常 | [23] |
| 樹状突起の分岐の増加 | [24] | |
| CRMP3 | 海馬樹状突起の発生障害 | [49][26] |
| CRMP4 | 樹状突起の分岐の増加 | [50] |
| 樹状突起伸長の促進 | [33] | |
| 匂い識別能力の低下 | [32] | |
| 軸索伸長と成長円錐形成の阻害 | [34] | |
| CRMP5 | プルキンエ細胞の細胞体サイズと樹状突起長の減少 | [51] |
| 軸索-シュワン細胞相互作用の異常 | [38] | |
| 行動異常や疾患に関連する表現型 | ||
| CRMP1 | 高活動性、空間学習と記憶の障害 | [52][44] |
| CRMP2 | 高活動性、感情行動障害、社会性低下 | [45] |
| CRMP4 | 炎症と瘢痕形成の抑制 | [46] |
| ドーパミン作動性神経細胞死の遅延と炎症抑制 | [47] | |
腫瘍
腫瘍組織におけるCRMPの発現の変化も報告されている(表3)[53]。
肺がん細胞において、CRMP1の発現は増加し、通常より長いCRMP1のアイソフォーム(LCRMP1)は低下する[54] [55]。
CRMP2の発現は、大腸がん、肺がんで上昇し、乳がんで低下することが報告されている[56][57][58]。乳がんにおいて、全体のCRMP2は低下しているが、核に移行したリン酸化CRMP2は増加しており、CRMP2のリン酸化は乳がんの進行に関与している可能性が示唆されている[57] 。
CRMP4の発現は、前立腺がんで低下し、膵臓がんや神経芽腫では上昇していることが報告されている[59][60][61][62] 。
CRMP5の発現は、神経内分泌肺がんや膠芽腫で上昇していることが報告されている[63][64]。がん組織における発現量の違いと病因の関係の理解やがん診断のためのバイオマーカーとしての利用などが期待される。
| 遺伝子 | 腫瘍組織での発現 | 参考文献 |
| CRMP1 | ||
| 肺がん | 増加 | [55] |
| LCRMP1 | ||
| 肺がん | 減少 | [54] |
| CRMP2 | ||
| 大腸がん | 増加 | [58] |
| 肺がん | 増加 | [56] |
| 増加 (核P-CRMP2) | ||
| 乳がん | 減少 | [57] |
| 増加 (核P-CRMP2) | ||
| CRMP4 | ||
| 前立腺がん | 減少 | [60] |
| 膵臓がん | 増加 | [61] |
| 神経芽腫 | 増加 | [59][62] |
| CRMP5 | ||
| 神経内分泌肺がん | 増加 | [64] |
| 膠芽腫 | 増加 | [63] |
| 増加 (核P-CRMP2) | ||
LCRMP1, long-form CRMP1; P-CRMP, phosphorylated CRMP
関連項目
参考文献
- ↑
Goshima, Y., Nakamura, F., Strittmatter, P., & Strittmatter, S.M. (1995).
Collapsin-induced growth cone collapse mediated by an intracellular protein related to UNC-33. Nature, 376(6540), 509-14. [PubMed:7637782] [WorldCat] [DOI] - ↑ 2.0 2.1 2.2 2.3 2.4 2.5
Charrier, E., Reibel, S., Rogemond, V., Aguera, M., Thomasset, N., & Honnorat, J. (2003).
Collapsin response mediator proteins (CRMPs): involvement in nervous system development and adult neurodegenerative disorders. Molecular neurobiology, 28(1), 51-64. [PubMed:14514985] [WorldCat] [DOI] - ↑
Li, W., Herman, R.K., & Shaw, J.E. (1992).
Analysis of the Caenorhabditis elegans axonal guidance and outgrowth gene unc-33. Genetics, 132(3), 675-89. [PubMed:1468626] [PMC] [WorldCat] - ↑ 4.0 4.1 4.2 4.3 4.4
Arimura, N., & Kaibuchi, K. (2007).
Neuronal polarity: from extracellular signals to intracellular mechanisms. Nature reviews. Neuroscience, 8(3), 194-205. [PubMed:17311006] [WorldCat] [DOI] - ↑ 5.0 5.1 5.2 5.3 5.4 5.5
Yamashita, N., & Goshima, Y. (2012).
Collapsin response mediator proteins regulate neuronal development and plasticity by switching their phosphorylation status. Molecular neurobiology, 45(2), 234-46. [PubMed:22351471] [WorldCat] [DOI] - ↑ 6.0 6.1 6.2 6.3 6.4 6.5 6.6
Wang, L.H., & Strittmatter, S.M. (1996).
A family of rat CRMP genes is differentially expressed in the nervous system. The Journal of neuroscience : the official journal of the Society for Neuroscience, 16(19), 6197-207. [PubMed:8815901] [WorldCat] - ↑
Ricard, D., Rogemond, V., Charrier, E., Aguera, M., Bagnard, D., Belin, M.F., ..., & Honnorat, J. (2001).
Isolation and expression pattern of human Unc-33-like phosphoprotein 6/collapsin response mediator protein 5 (Ulip6/CRMP5): coexistence with Ulip2/CRMP2 in Sema3a- sensitive oligodendrocytes. The Journal of neuroscience : the official journal of the Society for Neuroscience, 21(18), 7203-14. [PubMed:11549731] [PMC] [WorldCat] - ↑
Nacher, J., Rosell, D.R., & McEwen, B.S. (2000).
Widespread expression of rat collapsin response-mediated protein 4 in the telencephalon and other areas of the adult rat central nervous system. The Journal of comparative neurology, 424(4), 628-39. [PubMed:10931485] [WorldCat] [DOI] - ↑ 9.0 9.1
Charrier, E., Mosinger, B., Meissirel, C., Aguera, M., Rogemond, V., Reibel, S., ..., & Kolattukudy, P. (2006).
Transient alterations in granule cell proliferation, apoptosis and migration in postnatal developing cerebellum of CRMP1-/- mice. Genes to cells : devoted to molecular & cellular mechanisms, 11(12), 1337-52. [PubMed:17121542] [WorldCat] [DOI] - ↑ 10.0 10.1
Yamashita, N., Uchida, Y., Ohshima, T., Hirai, S., Nakamura, F., Taniguchi, M., ..., & Goshima, Y. (2006).
Collapsin response mediator protein 1 mediates reelin signaling in cortical neuronal migration. The Journal of neuroscience : the official journal of the Society for Neuroscience, 26(51), 13357-62. [PubMed:17182786] [PMC] [WorldCat] [DOI] - ↑ 11.0 11.1
Yamashita, N., Morita, A., Uchida, Y., Nakamura, F., Usui, H., Ohshima, T., ..., & Goshima, Y. (2007).
Regulation of spine development by semaphorin3A through cyclin-dependent kinase 5 phosphorylation of collapsin response mediator protein 1. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(46), 12546-54. [PubMed:18003833] [PMC] [WorldCat] [DOI] - ↑
Yamashita, N., Morita, A., Uchida, Y., Nakamura, F., Usui, H., Ohshima, T., ..., & Goshima, Y. (2007).
Regulation of spine development by semaphorin3A through cyclin-dependent kinase 5 phosphorylation of collapsin response mediator protein 1. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(46), 12546-54. [PubMed:18003833] [PMC] [WorldCat] [DOI] - ↑ 13.0 13.1
Hensley, K., Venkova, K., Christov, A., Gunning, W., & Park, J. (2011).
Collapsin response mediator protein-2: an emerging pathologic feature and therapeutic target for neurodisease indications. Molecular neurobiology, 43(3), 180-91. [PubMed:21271304] [WorldCat] [DOI] - ↑ 14.0 14.1 14.2
Inagaki, N., Chihara, K., Arimura, N., Ménager, C., Kawano, Y., Matsuo, N., ..., & Kaibuchi, K. (2001).
CRMP-2 induces axons in cultured hippocampal neurons. Nature neuroscience, 4(8), 781-2. [PubMed:11477421] [WorldCat] [DOI] - ↑
Fukata, Y., Itoh, T.J., Kimura, T., Ménager, C., Nishimura, T., Shiromizu, T., ..., & Kaibuchi, K. (2002).
CRMP-2 binds to tubulin heterodimers to promote microtubule assembly. Nature cell biology, 4(8), 583-91. [PubMed:12134159] [WorldCat] [DOI] - ↑ 16.0 16.1 16.2
Yoshimura, T., Kawano, Y., Arimura, N., Kawabata, S., Kikuchi, A., & Kaibuchi, K. (2005).
GSK-3beta regulates phosphorylation of CRMP-2 and neuronal polarity. Cell, 120(1), 137-49. [PubMed:15652488] [WorldCat] [DOI] - ↑
Nishimura, T., Fukata, Y., Kato, K., Yamaguchi, T., Matsuura, Y., Kamiguchi, H., & Kaibuchi, K. (2003).
CRMP-2 regulates polarized Numb-mediated endocytosis for axon growth. Nature cell biology, 5(9), 819-26. [PubMed:12942088] [WorldCat] [DOI] - ↑ 有村奈利子、木村俊秀、藤井佳代、貝淵弘三
RhoキナーゼによるCRMP-2のリン酸化とその活性制御について
脳21:2004 - ↑
Arimura, N., & Kaibuchi, K. (2005).
Key regulators in neuronal polarity. Neuron, 48(6), 881-4. [PubMed:16364893] [WorldCat] [DOI] - ↑
Kawano, Y., Yoshimura, T., Tsuboi, D., Kawabata, S., Kaneko-Kawano, T., Shirataki, H., ..., & Kaibuchi, K. (2005).
CRMP-2 is involved in kinesin-1-dependent transport of the Sra-1/WAVE1 complex and axon formation. Molecular and cellular biology, 25(22), 9920-35. [PubMed:16260607] [PMC] [WorldCat] [DOI] - ↑
Arimura, N., Kimura, T., Nakamuta, S., Taya, S., Funahashi, Y., Hattori, A., ..., & Kaibuchi, K. (2009).
Anterograde transport of TrkB in axons is mediated by direct interaction with Slp1 and Rab27. Developmental cell, 16(5), 675-86. [PubMed:19460344] [WorldCat] [DOI] - ↑
Brittain, J.M., Piekarz, A.D., Wang, Y., Kondo, T., Cummins, T.R., & Khanna, R. (2009).
An atypical role for collapsin response mediator protein 2 (CRMP-2) in neurotransmitter release via interaction with presynaptic voltage-gated calcium channels. The Journal of biological chemistry, 284(45), 31375-90. [PubMed:19755421] [PMC] [WorldCat] [DOI] - ↑ 23.0 23.1
Yamashita, N., Ohshima, T., Nakamura, F., Kolattukudy, P., Honnorat, J., Mikoshiba, K., & Goshima, Y. (2012).
Phosphorylation of CRMP2 (collapsin response mediator protein 2) is involved in proper dendritic field organization. The Journal of neuroscience : the official journal of the Society for Neuroscience, 32(4), 1360-5. [PubMed:22279220] [PMC] [WorldCat] [DOI] - ↑ 24.0 24.1
Niisato, E., Nagai, J., Yamashita, N., Nakamura, F., Goshima, Y., & Ohshima, T. (2013).
Phosphorylation of CRMP2 is involved in proper bifurcation of the apical dendrite of hippocampal CA1 pyramidal neurons. Developmental neurobiology, 73(2), 142-51. [PubMed:22826151] [WorldCat] [DOI] - ↑ 25.0 25.1
Quach, T.T., Massicotte, G., Belin, M.F., Honnorat, J., Glasper, E.R., Devries, A.C., ..., & Kolattukudy, P.E. (2008).
CRMP3 is required for hippocampal CA1 dendritic organization and plasticity. FASEB journal : official publication of the Federation of American Societies for Experimental Biology, 22(2), 401-9. [PubMed:17785607] [PMC] [WorldCat] [DOI] - ↑ 26.0 26.1
Quach, T.T., Wang, Y., Khanna, R., Chounlamountri, N., Auvergnon, N., Honnorat, J., & Duchemin, A.M. (2011).
Effect of CRMP3 expression on dystrophic dendrites of hippocampal neurons. Molecular psychiatry, 16(7), 689-91. [PubMed:21339751] [WorldCat] [DOI] - ↑
Quach, T.T., Wilson, S.M., Rogemond, V., Chounlamountri, N., Kolattukudy, P.E., Martinez, S., ..., & Duchemin, A.M. (2013).
Mapping CRMP3 domains involved in dendrite morphogenesis and voltage-gated calcium channel regulation. Journal of cell science, 126(Pt 18), 4262-73. [PubMed:23868973] [WorldCat] [DOI] - ↑
Aylsworth, A., Jiang, S.X., Desbois, A., & Hou, S.T. (2009).
Characterization of the role of full-length CRMP3 and its calpain-cleaved product in inhibiting microtubule polymerization and neurite outgrowth. Experimental cell research, 315(16), 2856-68. [PubMed:19559021] [WorldCat] [DOI] - ↑ 29.0 29.1 29.2 29.3
Niisato, E., Nagai, J., Yamashita, N., Abe, T., Kiyonari, H., Goshima, Y., & Ohshima, T. (2012).
CRMP4 suppresses apical dendrite bifurcation of CA1 pyramidal neurons in the mouse hippocampus. Developmental neurobiology, 72(11), 1447-57. [PubMed:22234963] [WorldCat] [DOI] - ↑
Tsutiya, A., & Ohtani-Kaneko, R. (2012).
Postnatal alteration of collapsin response mediator protein 4 mRNA expression in the mouse brain. Journal of anatomy, 221(4), 341-51. [PubMed:22816653] [PMC] [WorldCat] [DOI] - ↑
Iwakura, T., Sakoh, M., Tsutiya, A., Yamashita, N., Ohtani, A., Tsuda, M.C., ..., & Ohtani-Kaneko, R. (2013).
Collapsin response mediator protein 4 affects the number of tyrosine hydroxylase-immunoreactive neurons in the sexually dimorphic nucleus in female mice. Developmental neurobiology, 73(7), 502-17. [PubMed:23420586] [WorldCat] [DOI] - ↑ 32.0 32.1
Tsutiya, A., Nishihara, M., Goshima, Y., & Ohtani-Kaneko, R. (2015).
Mouse pups lacking collapsin response mediator protein 4 manifest impaired olfactory function and hyperactivity in the olfactory bulb. The European journal of neuroscience, 42(6), 2335-45. [PubMed:26118640] [WorldCat] [DOI] - ↑ 33.0 33.1
Tsutiya, A., Watanabe, H., Nakano, Y., Nishihara, M., Goshima, Y., & Ohtani-Kaneko, R. (2016).
Deletion of collapsin response mediator protein 4 results in abnormal layer thickness and elongation of mitral cell apical dendrites in the neonatal olfactory bulb. Journal of anatomy, 228(5), 792-804. [PubMed:26739921] [PMC] [WorldCat] [DOI] - ↑ 34.0 34.1 34.2
Khazaei, M.R., Girouard, M.P., Alchini, R., Ong Tone, S., Shimada, T., Bechstedt, S., ..., & Fournier, A.E. (2014).
Collapsin response mediator protein 4 regulates growth cone dynamics through the actin and microtubule cytoskeleton. The Journal of biological chemistry, 289(43), 30133-43. [PubMed:25225289] [PMC] [WorldCat] [DOI] - ↑
Hotta, A., Inatome, R., Yuasa-Kawada, J., Qin, Q., Yamamura, H., & Yanagi, S. (2005).
Critical role of collapsin response mediator protein-associated molecule CRAM for filopodia and growth cone development in neurons. Molecular biology of the cell, 16(1), 32-9. [PubMed:15509652] [PMC] [WorldCat] [DOI] - ↑ 36.0 36.1 36.2
Brot, S., Rogemond, V., Perrot, V., Chounlamountri, N., Auger, C., Honnorat, J., & Moradi-Améli, M. (2010).
CRMP5 interacts with tubulin to inhibit neurite outgrowth, thereby modulating the function of CRMP2. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(32), 10639-54. [PubMed:20702696] [PMC] [WorldCat] [DOI] - ↑ 37.0 37.1 37.2
Yamashita, N., Mosinger, B., Roy, A., Miyazaki, M., Ugajin, K., Nakamura, F., ..., & Goshima, Y. (2011).
CRMP5 (collapsin response mediator protein 5) regulates dendritic development and synaptic plasticity in the cerebellar Purkinje cells. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(5), 1773-9. [PubMed:21289187] [PMC] [WorldCat] [DOI] - ↑ 38.0 38.1 38.2
Camdessanché, J.P., Ferraud, K., Boutahar, N., Lassablière, F., Mutter, M., Touret, M., ..., & Antoine, J.C. (2012).
The collapsin response mediator protein 5 onconeural protein is expressed in Schwann cells under axonal signals and regulates axon-Schwann cell interactions. Journal of neuropathology and experimental neurology, 71(4), 298-311. [PubMed:22437341] [WorldCat] [DOI] - ↑
Yoshida, H., Watanabe, A., & Ihara, Y. (1998).
Collapsin response mediator protein-2 is associated with neurofibrillary tangles in Alzheimer's disease. The Journal of biological chemistry, 273(16), 9761-8. [PubMed:9545313] [WorldCat] [DOI] - ↑
Gu, Y., Hamajima, N., & Ihara, Y. (2000).
Neurofibrillary tangle-associated collapsin response mediator protein-2 (CRMP-2) is highly phosphorylated on Thr-509, Ser-518, and Ser-522. Biochemistry, 39(15), 4267-75. [PubMed:10757975] [WorldCat] [DOI] - ↑
Cole, A.R., Noble, W., van Aalten, L., Plattner, F., Meimaridou, R., Hogan, D., ..., & Sutherland, C. (2007).
Collapsin response mediator protein-2 hyperphosphorylation is an early event in Alzheimer's disease progression. Journal of neurochemistry, 103(3), 1132-44. [PubMed:17683481] [WorldCat] [DOI] - ↑
Good, P.F., Alapat, D., Hsu, A., Chu, C., Perl, D., Wen, X., ..., & Kohtz, D.S. (2004).
A role for semaphorin 3A signaling in the degeneration of hippocampal neurons during Alzheimer's disease. Journal of neurochemistry, 91(3), 716-36. [PubMed:15485501] [WorldCat] [DOI] - ↑ 43.0 43.1
Nagai, J., Owada, K., Kitamura, Y., Goshima, Y., & Ohshima, T. (2016).
Inhibition of CRMP2 phosphorylation repairs CNS by regulating neurotrophic and inhibitory responses. Experimental neurology, 277, 283-295. [PubMed:26795088] [WorldCat] [DOI] - ↑ 44.0 44.1
Yamashita, N., Takahashi, A., Takao, K., Yamamoto, T., Kolattukudy, P., Miyakawa, T., & Goshima, Y. (2013).
Mice lacking collapsin response mediator protein 1 manifest hyperactivity, impaired learning and memory, and impaired prepulse inhibition. Frontiers in behavioral neuroscience, 7, 216. [PubMed:24409129] [PMC] [WorldCat] [DOI] - ↑ 45.0 45.1
Nakamura, H., Yamashita, N., Kimura, A., Kimura, Y., Hirano, H., Makihara, H., ..., & Goshima, Y. (2016).
Comprehensive behavioral study and proteomic analyses of CRMP2-deficient mice. Genes to cells : devoted to molecular & cellular mechanisms, 21(10), 1059-1079. [PubMed:27582038] [WorldCat] [DOI] - ↑ 46.0 46.1
Nagai, J., Kitamura, Y., Owada, K., Yamashita, N., Takei, K., Goshima, Y., & Ohshima, T. (2015).
Crmp4 deletion promotes recovery from spinal cord injury by neuroprotection and limited scar formation. Scientific reports, 5, 8269. [PubMed:25652774] [PMC] [WorldCat] [DOI] - ↑ 47.0 47.1
Tonouchi, A., Nagai, J., Togashi, K., Goshima, Y., & Ohshima, T. (2016).
Loss of collapsin response mediator protein 4 suppresses dopaminergic neuron death in an 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine-induced mouse model of Parkinson's disease. Journal of neurochemistry, 137(5), 795-805. [PubMed:26991935] [WorldCat] [DOI] - ↑
Yamashita, N., Uchida, Y., Ohshima, T., Hirai, S., Nakamura, F., Taniguchi, M., ..., & Goshima, Y. (2006).
Collapsin response mediator protein 1 mediates reelin signaling in cortical neuronal migration. The Journal of neuroscience : the official journal of the Society for Neuroscience, 26(51), 13357-62. [PubMed:17182786] [PMC] [WorldCat] [DOI] - ↑
Quach, T.T., Massicotte, G., Belin, M.F., Honnorat, J., Glasper, E.R., Devries, A.C., ..., & Kolattukudy, P.E. (2008).
CRMP3 is required for hippocampal CA1 dendritic organization and plasticity. FASEB journal : official publication of the Federation of American Societies for Experimental Biology, 22(2), 401-9. [PubMed:17785607] [PMC] [WorldCat] [DOI] - ↑
Niisato, E., Nagai, J., Yamashita, N., Abe, T., Kiyonari, H., Goshima, Y., & Ohshima, T. (2012).
CRMP4 suppresses apical dendrite bifurcation of CA1 pyramidal neurons in the mouse hippocampus. Developmental neurobiology, 72(11), 1447-57. [PubMed:22234963] [WorldCat] [DOI] - ↑
Yamashita, N., Mosinger, B., Roy, A., Miyazaki, M., Ugajin, K., Nakamura, F., ..., & Goshima, Y. (2011).
CRMP5 (collapsin response mediator protein 5) regulates dendritic development and synaptic plasticity in the cerebellar Purkinje cells. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(5), 1773-9. [PubMed:21289187] [PMC] [WorldCat] [DOI] - ↑
Su, K.Y., Chien, W.L., Fu, W.M., Yu, I.S., Huang, H.P., Huang, P.H., ..., & Lin, S.W. (2007).
Mice deficient in collapsin response mediator protein-1 exhibit impaired long-term potentiation and impaired spatial learning and memory. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(10), 2513-24. [PubMed:17344389] [PMC] [WorldCat] [DOI] - ↑
Tan, F., Thiele, C.J., & Li, Z. (2014).
Collapsin response mediator proteins: Potential diagnostic and prognostic biomarkers in cancers (Review). Oncology letters, 7(5), 1333-1340. [PubMed:24765134] [PMC] [WorldCat] [DOI] - ↑ 54.0 54.1
Pan, S.H., Chao, Y.C., Hung, P.F., Chen, H.Y., Yang, S.C., Chang, Y.L., ..., & Yang, P.C. (2011).
The ability of LCRMP-1 to promote cancer invasion by enhancing filopodia formation is antagonized by CRMP-1. The Journal of clinical investigation, 121(8), 3189-205. [PubMed:21747164] [PMC] [WorldCat] [DOI] - ↑ 55.0 55.1
Shih, J.Y., Yang, S.C., Hong, T.M., Yuan, A., Chen, J.J., Yu, C.J., ..., & Yang, P.C. (2001).
Collapsin response mediator protein-1 and the invasion and metastasis of cancer cells. Journal of the National Cancer Institute, 93(18), 1392-400. [PubMed:11562390] [WorldCat] [DOI] - ↑ 56.0 56.1
Oliemuller, E., Peláez, R., Garasa, S., Pajares, M.J., Agorreta, J., Pío, R., ..., & Rouzaut, A. (2013).
Phosphorylated tubulin adaptor protein CRMP-2 as prognostic marker and candidate therapeutic target for NSCLC. International journal of cancer, 132(9), 1986-95. [PubMed:23023514] [WorldCat] [DOI] - ↑ 57.0 57.1 57.2
Shimada, K., Ishikawa, T., Nakamura, F., Shimizu, D., Chishima, T., Ichikawa, Y., ..., & Goshima, Y. (2014).
Collapsin response mediator protein 2 is involved in regulating breast cancer progression. Breast cancer (Tokyo, Japan), 21(6), 715-23. [PubMed:23381229] [WorldCat] [DOI] - ↑ 58.0 58.1
Wu, C.C., Chen, H.C., Chen, S.J., Liu, H.P., Hsieh, Y.Y., Yu, C.J., ..., & Chang, Y.S. (2008).
Identification of collapsin response mediator protein-2 as a potential marker of colorectal carcinoma by comparative analysis of cancer cell secretomes. Proteomics, 8(2), 316-32. [PubMed:18203259] [WorldCat] [DOI] - ↑ 59.0 59.1
Choi, Y.L., Kim, C.J., Matsuo, T., Gaetano, C., Falconi, R., Suh, Y.L., ..., & Thiele, C.J. (2005).
HUlip, a human homologue of unc-33-like phosphoprotein of Caenorhabditis elegans; Immunohistochemical localization in the developing human brain and patterns of expression in nervous system tumors. Journal of neuro-oncology, 73(1), 19-27. [PubMed:15933812] [WorldCat] [DOI] - ↑ 60.0 60.1
Gao, X., Pang, J., Li, L.Y., Liu, W.P., Di, J.M., Sun, Q.P., ..., & Li, B.Y. (2010).
Expression profiling identifies new function of collapsin response mediator protein 4 as a metastasis-suppressor in prostate cancer. Oncogene, 29(32), 4555-66. [PubMed:20543870] [WorldCat] [DOI] - ↑ 61.0 61.1
Hiroshima, Y., Nakamura, F., Miyamoto, H., Mori, R., Taniguchi, K., Matsuyama, R., ..., & Endo, I. (2013).
Collapsin response mediator protein 4 expression is associated with liver metastasis and poor survival in pancreatic cancer. Annals of surgical oncology, 20 Suppl 3, S369-78. [PubMed:22805864] [WorldCat] [DOI] - ↑ 62.0 62.1
Tan, F., Wahdan-Alaswad, R., Yan, S., Thiele, C.J., & Li, Z. (2013).
Dihydropyrimidinase-like protein 3 expression is negatively regulated by MYCN and associated with clinical outcome in neuroblastoma. Cancer science, 104(12), 1586-92. [PubMed:24011394] [PMC] [WorldCat] [DOI] - ↑ 63.0 63.1
Liang, Y., Diehn, M., Watson, N., Bollen, A.W., Aldape, K.D., Nicholas, M.K., ..., & Israel, M.A. (2005).
Gene expression profiling reveals molecularly and clinically distinct subtypes of glioblastoma multiforme. Proceedings of the National Academy of Sciences of the United States of America, 102(16), 5814-9. [PubMed:15827123] [PMC] [WorldCat] [DOI] - ↑ 64.0 64.1
Meyronet, D., Massoma, P., Thivolet, F., Chalabreysse, L., Rogemond, V., Schlama, A., ..., & Thomasset, N. (2008).
Extensive expression of collapsin response mediator protein 5 (CRMP5) is a specific marker of high-grade lung neuroendocrine carcinoma. The American journal of surgical pathology, 32(11), 1699-708. [PubMed:18769332] [WorldCat] [DOI]