セプチン
上田(石原) 奈津実、木下 専
名古屋大学 理学研究科 生命理学専攻
DOI:10.14931/bsd.484 原稿受付日:2012年1月25日 原稿完成日:2012年2月25日
担当編集委員:林 康紀(独立行政法人理化学研究所 脳科学総合研究センター)
英語名:Septin 英語略名:SEPT
| Septin | |||||||||
|---|---|---|---|---|---|---|---|---|---|
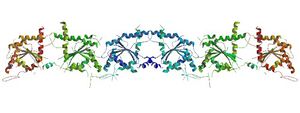 Crystallographic structure of the septin hexatamer[1]. | |||||||||
| Identifiers | |||||||||
| Symbol | SEPT | ||||||||
| Pfam | PF00735 | ||||||||
| Pfam clan | CL0023 | ||||||||
| InterPro | IPR000038 | ||||||||
| |||||||||
歴史
細胞質分裂(septation)と形態形成の異常を呈する出芽酵母Saccharomyces cerevisiaeの変異体Cdc3、Cdc10、Cdc11、Cdc12の原因遺伝子産物が出芽部位の細胞膜を環状に裏打ちするフィラメントの構成成分であることと、これらのホモログが多様な生物種に存在することが90年代半ばまでに判明し、セプチン(septin)と命名された[4]。
ファミリー
| 種 | グループ1A | グループ1B | グループ2A | グループ2B | グループ2C | グループ3 | グループ4 |
|---|---|---|---|---|---|---|---|
| 出芽酵母 | Cdc10 | Cdc3 | Cdc11 | Cdc12 | |||
| Shs1 | Spr3 | ||||||
| Spr28 | |||||||
| 線虫 | UNC-61 | UNC-59 | |||||
| ショウジョウバエ | Sep2 | Pnut | Sep1 | ||||
| Sep5 | Sep4 | ||||||
| 哺乳類 | SEPT3 | SEPT6 | SEPT7 | SEPT1 | |||
| SEPT9 | SEPT8 | (SEPT13) | SEPT2 | ||||
| SEPT12 | SEPT10 | SEPT4 | |||||
| SEPT11 | SEPT5 | ||||||
| SEPT14 |
セプチンファミリーに属する遺伝子は植物を除く真核生物のゲノムに2-14種類存在し、一次構造によって種ごとに2-4グループに分類できる(表)。菌類と後生動物の間ではグループ間の対応関係の推定が困難であることから、多細胞化の過程で生化学的特性(後述)を保存しつつ共進化したものと推測される。
構造
中核部分にRasタンパク質様のGTP結合領域とファミリー固有の相同領域を持ち、多くはC末側に可動性に富む100残基までのコイルドコイル領域を持つ。異なるグループ(表)に属するセプチンが一定の規則で会合してヘテロ2/3/4量体を形成し、これら2つが対向した4/6/8量体が定型的な構造単位とされているが、非定型的な組み合わせのオリゴマーも試験管内で調製可能であり、生体内にも存在する可能性が高い。哺乳類の定型的なセプチン6量体[SEPT7(GDP):SEPT6(GTP):SEPT2(GDP)][SEPT2(GDP):SEPT6(GTP):SEPT7(GDP)]の結晶構造は解かれたが、ヌクレオチドの交換/水解反応が極端に遅いこともあり、酵素反応と共役した構造変換と重合反応/脱重合との関係は未だ不明である[1]。セプチン・ヘテロオリゴマーは長軸方向に連結して無極性フィラメントを形成するが、長軸と直交する方向にコイルドコイルが突出するため短軸方向には非対称となる。2本のフィラメントがコイルドコイルを対向させたpaired filamentも形成されるが、フィラメント濃度が高い場合は中核部分を介して密な線維束を形成する。線維束は湾曲して外径0.6 µm、内径0.4 µm前後の環状またはらせん状となって安定化する(図1.1)[5]。一方、イノシトールリン脂質(PI)含有リポソーム上ではヘテロオリゴマーが柵状に2次元配列し、内径0.4 µm前後の曲率で管状化して脂質膜を変形させる(図1.2)。これら独特の高次集合性、線維束の曲率指向性、PI親和性は種を超えて保存された物性である[6]。さらに、哺乳類のセプチンはPI以外に多様なタンパク質(チュブリン、シンタキシン、ミオシン、アニリン(anillin)、グルタミン酸トランスポーター(GLAST)、α-シヌクレインなど)への親和性を有し、アクトミオシン線維束など既存の細胞内構造を鋳型にして集合する(図1.3)。
神経系における発現パタン
|
|
大脳皮質 | 嗅球 | 海馬 | 線条体/ 淡蒼球 |
小脳 | 視床/ 視床下部 |
中脳/橋 /延髄 |
神経細胞/ グリア細胞 |
シナプス 前部/後部 | |
| Sept1 | - | - | - | - | - | - | - | -/- | -/- | |
| Sept2 | - | - | - | - | + | - | - | -/+ | -/- | |
| Sept3 | + | + | ++ | + | ++ | + | + | +/- | +/+ | |
| Sept4 | + | + | + | + | ++ | + | + | +/+ | +/- | |
| Sept5 | + | + | ++ | + | + | + | + | +/+ | +/+ | |
| Sept6 | + | + | + | + | + | + | + | +/+ | +/+ | |
| Sept7 | + | + | + | + | ++ | + | + | +/+ | +/+ | |
| Sept8 | + | - | + | - | + | - | - | +/+ | ? | |
| Sept9 | ++ | + | ++ | + | ++ | + | + | +/+? | ? | |
| Sept10 | + | + | + | + | + | + | + | +/+? | ? | |
| Sept11 | + | + | + | + | + | + | + | +/+ | ? | |
| Sept12 | - | - | - | - | - | - | - | -/- | -/- | |
| Sept14 | + | - | - | - | - | - | - | +/-? | ? |
マウスでは脳におけるセプチンの発現・局在パターンはサブユニットや細胞ごとに大きく異なる。例えばSEPT3,5はニューロンに発現して樹状突起棘や軸索末端に局在し、SEPT2,4はグリアに発現して突起の特定の膜ドメインを裏打ちする(図2)[10]。
神経系における生理機能
セプチンを最も大量に発現する組織が神経系であることやヒトの精神・神経・筋疾患との関連から神経系におけるセプチン機能に関心が集まっている。ショウジョウバエの致死性セプチン変異体pnutは初期胚の表割(細胞膜形成/cellularization)の異常を呈し、神経系の形質は不明であるが、眼の光受容細胞R7を欠損するsina変異体のエンハンサーであることが知られている。線虫の運動障害(unc)変異体として見出されたセプチン欠損変異体unc-59/-61では特定の細胞を除いて細胞分裂は顕在化せず、神経突起形成ないしガイダンスの異常を呈する[11]。これまでに報告されたセプチン遺伝子欠損マウスのうち、Sept7,9の欠損は胎生致死となる一方、Sept3,4,5,6の欠損による神経系の異常は軽度なレベルにとどまる[12]。後者の理由として同じグループに属する機能重複遺伝子による代償が推測されるが、興味深い事実も明らかになってきた。例えばSept4欠損マウスでは聴覚性プレパルス抑制の減弱から、黒質-線条体投射系のドーパミンニューロンの軸索末端においてドパミン代謝機構がダウンレギュレーションしていることがわかった[13][14]。。一方、Sept5欠損マウスでは聴覚系シナプスcalyx of Heldの軸索末端におけるシナプス小胞の開口放出の調節が異常となる[15]。いずれも足場ないし拡散障壁機能の欠損によるものと想定されるが、詳細なメカニズムの解明や他のニューロンやグリアにおけるセプチン機能の探索は今後の課題である。
参考文献
- ↑ 1.0 1.1
Sirajuddin, M., Farkasovsky, M., Hauer, F., Kühlmann, D., Macara, I.G., Weyand, M., ..., & Wittinghofer, A. (2007).
Structural insight into filament formation by mammalian septins. Nature, 449(7160), 311-5. [PubMed:17637674] [WorldCat] [DOI] - ↑
Weirich, C.S., Erzberger, J.P., & Barral, Y. (2008).
The septin family of GTPases: architecture and dynamics. Nature reviews. Molecular cell biology, 9(6), 478-89. [PubMed:18478031] [WorldCat] [DOI] - ↑
Kuhlenbäumer, G., Hannibal, M.C., Nelis, E., Schirmacher, A., Verpoorten, N., Meuleman, J., ..., & Chance, P.F. (2005).
Mutations in SEPT9 cause hereditary neuralgic amyotrophy. Nature genetics, 37(10), 1044-6. [PubMed:16186812] [WorldCat] [DOI] - ↑
Longtine, M.S., DeMarini, D.J., Valencik, M.L., Al-Awar, O.S., Fares, H., De Virgilio, C., & Pringle, J.R. (1996).
The septins: roles in cytokinesis and other processes. Current opinion in cell biology, 8(1), 106-19. [PubMed:8791410] [WorldCat] [DOI] - ↑
Kinoshita, M., Field, C.M., Coughlin, M.L., Straight, A.F., & Mitchison, T.J. (2002).
Self- and actin-templated assembly of Mammalian septins. Developmental cell, 3(6), 791-802. [PubMed:12479805] [WorldCat] - ↑
Tanaka-Takiguchi, Y., Kinoshita, M., & Takiguchi, K. (2009).
Septin-mediated uniform bracing of phospholipid membranes. Current biology : CB, 19(2), 140-5. [PubMed:19167227] [WorldCat] [DOI] - ↑ Allen Brain Atlas
- ↑ Brain Gene Expression Map
- ↑ BioGPS
- ↑
Kinoshita, A., Noda, M., & Kinoshita, M. (2000).
Differential localization of septins in the mouse brain. The Journal of comparative neurology, 428(2), 223-39. [PubMed:11064363] [WorldCat] [DOI] - ↑
Finger, F.P., Kopish, K.R., & White, J.G. (2003).
A role for septins in cellular and axonal migration in C. elegans. Developmental biology, 261(1), 220-34. [PubMed:12941631] [WorldCat] [DOI] - ↑ 木下 専
セプチン細胞骨格の変幻自在な高次集合性と多彩な生理機能
蛋白質・核酸・酵素 2009, 54(9);1150-8 - ↑
Ihara, M., Yamasaki, N., Hagiwara, A., Tanigaki, A., Kitano, A., Hikawa, R., ..., & Kinoshita, M. (2007).
Sept4, a component of presynaptic scaffold and Lewy bodies, is required for the suppression of alpha-synuclein neurotoxicity. Neuron, 53(4), 519-33. [PubMed:17296554] [WorldCat] [DOI] - ↑ 木下 専
ドーパミン神経伝達と変性におけるセプチン細胞骨格系の役割
日本神経精神薬理学会誌 2012, 32;25-9 - ↑
Yang, Y.M., Fedchyshyn, M.J., Grande, G., Aitoubah, J., Tsang, C.W., Xie, H., ..., & Wang, L.Y. (2010).
Septins regulate developmental switching from microdomain to nanodomain coupling of Ca(2+) influx to neurotransmitter release at a central synapse. Neuron, 67(1), 100-15. [PubMed:20624595] [PMC] [WorldCat] [DOI]