「ニューロリギン」の版間の差分
細編集の要約なし |
編集の要約なし |
||
| (2人の利用者による、間の23版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">[http://profiles.umassmed.edu/profiles/ProfileDetails.aspx?Person=3324 渡辺 拓也]、[http://researchmap.jp/kennyfutai 二井 健介]</font><br> | <font size="+1">[http://profiles.umassmed.edu/profiles/ProfileDetails.aspx?Person=3324 渡辺 拓也]、[http://researchmap.jp/kennyfutai 二井 健介]</font><br> | ||
''マサチューセッツ州立大学 メディカルスクール''<br> | ''マサチューセッツ州立大学 メディカルスクール''<br> | ||
DOI [[XXXX]]/XXXX 原稿受付日:2013年6月4日 原稿完成日:2013年7月xx日<br> | |||
担当編集委員:[http://researchmap.jp/2rikenbsi 林 康紀](独立行政法人理化学研究所) | 担当編集委員:[http://researchmap.jp/2rikenbsi 林 康紀](独立行政法人理化学研究所) | ||
</div> | </div> | ||
| 10行目: | 10行目: | ||
英語名:neuroligin | 英語名:neuroligin | ||
{{box|text= | {{box|text= ニューロリギンはシナプス後部(postsynapse)に存在する1回膜貫通型タンパク質であり、シナプス前末端(presynapse,presynaptic terminal)に存在する[[ニューレキシン]](Neurexin: NRXN)の内因性リガンドであり、シナプスの成熟や機能を調整している<ref name=ref1><pubmed>18923512</pubmed></ref>。ニューロリギンのアイソフォームは、グルタミン酸作動性・GABA作動性神経シナプスの構築の選別に影響すると考えられている。また、自閉症や統合失調症のリスク遺伝子として考えられており、遺伝子改変マウスは自閉症様行動を示す<ref name=ref1><pubmed>17823315</pubmed></ref> <ref name=ref2><pubmed>21808020</pubmed></ref> <ref><pubmed>23183221</pubmed></ref> <ref name=ref3><pubmed>19243448</pubmed></ref>。 | ||
}} | }} | ||
== 歴史 == | == 歴史 == | ||
ニューレキシン1βの[[wikipedia:ja:アフィニティーカラム|アフィニティーカラム]]を用いた実験により、ニューレキシン1βの結合タンパク質としてニューロリギン1が初めて同定された<ref name=ref4><pubmed>7736595</pubmed></ref>。 | |||
==サブタイプ== | ==サブタイプ== | ||
ヒトでは5つのニューロリギン遺伝子がある([[ニューロリギン1|NLGN1]]、[[ニューロリギン2|NLGN2]]、[[ニューロリギン3|NLGN3]]、[[ニューロリギン4|NLGN4]]、[[ニューロリギン4Y|NLGN4Y]])<ref name=ref4 /> <ref name=ref5><pubmed>11368788</pubmed></ref> <ref><pubmed>18434543</pubmed></ref> <ref><pubmed>8576240</pubmed></ref>。また、ショウジョウバエ(4遺伝子<ref><pubmed>20547130</pubmed></ref> <ref><pubmed>21228178</pubmed></ref>)やアメフラシ(1遺伝子<ref><pubmed>21555073</pubmed></ref>)、ミツバチ(5遺伝子<ref><pubmed>18974885</pubmed></ref> <ref><pubmed>20161754</pubmed></ref>、線虫(1遺伝子<ref><pubmed>20083577</pubmed></ref>)などの無脊椎動物においてもニューロリギン遺伝子の発現が認められている。 | |||
{| class="wikitable" | {| class="wikitable" | ||
|+ 表1.ニューロリギンとニューレキシンのスプライス変異体の結合様式<ref | |+ 表1.ニューロリギンとニューレキシンのスプライス変異体の結合様式<ref><pubmed>16242404</pubmed></ref> <ref><pubmed>20624592</pubmed></ref> <ref><pubmed>20543817</pubmed></ref><br>灰色内:結合能の相対的比較 | ||
|- | |- | ||
| | | | ||
| 82行目: | 72行目: | ||
|- | |- | ||
|} | |} | ||
=== スプライシング変異体 === | |||
ニューロリギン1は選択的スプライシング部位A(alternative splice site A:SSA)と選択的スプライシング部位B(SSB)の2つを、ニューロリギン2,ニューロリギン3とニューロリギン4はSSAのみを有しており[ニューロリギン3には2つのスプライシング部位(SSA1, SSA2)が存在]、合計12種類のスプライス変異体(ニューロリギン1:4、ニューロリギン2:2、ニューロリギン3:4、ニューロリギン4:2)が存在する<ref><pubmed>20510934</pubmed></ref>。ニューロリギンは選択的スプライシングの有無により、ニューレキシンとの[[結合親和性]]が異なることが報告されている(表1)。SSBを有さないニューロリギン [NLGN1(-), NLGN1A, NLGN2(-)とNLGN2A]はβニューレキシンのSS4の有無に関わらず高親和性に結合するが、ニューロリギンのSSBの挿入(NLGN1B, NLGN1AB)はβニューレキシンのスプライス変異体との結合親和性を低下させる<ref name=ref1000><pubmed>16846852</pubmed></ref> <ref><pubmed>16624946</pubmed></ref>。さらに、SSBを有するニューロリギンはαニューレキシンと結合しない<ref><pubmed>16242404</pubmed></ref>。SSBの挿入は抑制性シナプスの形成を阻害することが示唆されている<ref><pubmed>16846852</pubmed></ref>。 | |||
==構造== | ==構造== | ||
[[image:図1.ニューロリギンのドメイン構造.jpg|thumb|350px|'''図1.ニューロリギンのドメイン構造'''<br>矢印:選択的スプライシング部位 SP:シグナルペプチド、CHO: carbohydrate-attachment sequence、TM:膜貫通領域、PDZ-BD:PDZ-domain-binding site]] | |||
[[image:図2.興奮性シナプスにおけるニューレキシンとニューロリギンの結合模式図.jpg|thumb|350px|'''図2.興奮性シナプスにおけるニューレキシンとニューロリギンの結合模式図'''<br>ニューレキシンとニューロリギンはシナプス前末端とシナプス後部間で結合している。ニューレキシンとニューロリギンはそれぞれシナプス前末端とシナプス後部のシナプス局在分子と直接・間接的に結合している。]] | |||
ニューロリギンは1回膜貫通型蛋[[白質]]であり、細胞外ドメインと比較的短い細胞内ドメインを有している(図1)。細胞外ドメインはアセチルコチンエステラーゼ(acetylcholinesterase:AChE)と相同性を有しているが、[[コリン]]エステラーゼ活性は無く、ニューレキシン結合領域となっている<ref name=ref4 />。 | |||
ニューロリギンとβニューレキシン複合体の3次元構造が明らかとなっている<ref><pubmed>18093522</pubmed></ref> <ref>https://www.youtube.com/watch?v=DuARiSOGy88</ref>。AChE相同領域にはSSAがあり、加えてニューロリギン1にのみ同領域にSSBが存在する。in situ chemical cross-linking法([[細胞膜]]表面に存在するcis複合体を保持する為)と免疫沈降法を組み合わせた解析によって、全てのニューロリギンアイソフォームがホモ二量体を形成することが示唆され、ニューロリギン1-ニューロリギン2とニューロリギン1-ニューロリギン3ヘテロ二量体の存在が確認されている<ref name=ref1002><pubmed>22671294</pubmed></ref>。上記の解析ではニューロリギン2-ニューロリギン3ヘテロ二量体は認められていないが<ref name=ref1002 />、他グループの免疫沈降法では報告されている<ref name=ref1003><pubmed>17897391</pubmed></ref>。二量体形成は、ニューロリギンの細胞膜への輸送に必要であり<ref name=ref1002 />、この形成に関与する部位はAChE相同領域に存在する<ref><pubmed>12796785</pubmed></ref> <ref name=ref1002 />。細胞外ドメインの膜貫通ドメイン側にはCHO配列(carbohydrate-attachment sequence)がある。細胞内ドメインのC-末端には、シナプス足場蛋白([[PSD]]-95等)との結合に重要であると推定されるPDZドメイン[postsynaptic [[density]] (PSD)-95/ discs large/ zona-occludens-1ドメイン]結合部位が存在する<ref><pubmed>15555927</pubmed></ref> <ref><pubmed>9278515</pubmed></ref> <ref><pubmed>15458844</pubmed></ref>。また、膜貫通ドメインとPDZドメイン結合部位の間には、gephyrin結合ドメインと、構造が同定されていないcriticalドメインが存在する(図2)<ref><pubmed>19755106</pubmed></ref> <ref><pubmed>21532576</pubmed></ref>。 | |||
== 発現 == | == 発現 == | ||
ニューロリギン1とニューロリギン2はそれぞれ中枢神経系の[[グルタミン酸]]作動性神経(興奮性)シナプスと[[GABA作動性]]神経(抑制性)シナプスに発現している<ref><pubmed>9927700</pubmed></ref> <ref><pubmed>15540461</pubmed></ref> <ref><pubmed>15620359</pubmed></ref>。ニューロリギンの興奮性・抑制性シナプスにおける局在はシナプス足場蛋白(PSD-95とgephyrin)によって調節されていることが示唆されている<ref><pubmed>1991435</pubmed></ref>。また、ヒトでは、ニューロリギン2の膵島と大腸における発現が確認されている<ref><pubmed>18755801</pubmed></ref>。ニューロリギン3は興奮性と抑制性の両シナプスに発現しており<ref name=ref1003 />、げっ歯類ではグリア細胞にも発現が確認されている<ref><pubmed>11329178</pubmed></ref>。また、ヒトではニューロリギン3は心臓、骨格筋、胎盤、膵臓にも発現している<ref><pubmed>10767552</pubmed></ref>。ニューロリギン4は心臓、肝臓、骨格筋、膵臓に発現し、脳では低レベルで発現しており<ref name=ref5 />、網膜の[[グリシン]]作動性神経シナプス後部に発現していることが報告されている<ref><pubmed>21282647</pubmed></ref>。 | |||
Allen Brain Atlasでの発現パターン(Mouse) | |||
[[http://mouse.brain-map.org/experiment/show?id=70300553 NLGN1]] | |||
[[http://mouse.brain-map.org/experiment/show?id=77656728 NLGN2]] | |||
[[http://mouse.brain-map.org/experiment/show?id=70300559 NLGN3]] | |||
==機能== | ==機能== | ||
===神経=== | ===神経=== | ||
非神経細胞でのニューロリギン強制発現は、共培養した神経細胞の[[ | 非神経細胞でのニューロリギン強制発現は、共培養した神経細胞の[[シナプス前]]末端の[[分化]]を誘導する<ref><pubmed>10892652</pubmed></ref>。また、ニューロリギンはシナプス後部の分化にも重要である。 | ||
ニューロリギン1またはニューロリギン3の強制発現は[[興奮性シナプス]]伝達機能を増加させ、一方、ニューロリギン2強制発現は[[抑制性シナプス]]伝達機能を増加させる<ref><pubmed>17582332</pubmed></ref> <ref><pubmed>17237775</pubmed></ref> <ref><pubmed>21532576</pubmed></ref>。ニューロリギン1とニューロリギン2は、それぞれβ-、αニューレキシンと機能的なシナプスを形成することから、ニューロリギンとニューレキシンのアイソフォームの特異的な組み合わせが興奮性と抑制性シナプスの仕分けに関与していることが示唆されている。また、ニューロリギンのシナプス伝達への機能には、細胞内ドメインではなく細胞外ドメインが重要であると考えられている<ref><pubmed>23426688</pubmed></ref>。 | |||
ニューロリギン1はPSD-95との結合によって、選択的に興奮性シナプスを構築する<ref><pubmed>15358863</pubmed></ref>。一方、ニューロリギン2は抑制性シナプス後部特異的な足場蛋白であるgephyrinを介して、抑制性シナプスを構築する<ref><pubmed>19755106</pubmed></ref>。また、ニューロリギン1の細胞外ドメインは、NMDA型受容体と相互作用を示し、シナプス後部におけるNMDA型受容体の機能を調節していると報告されている<ref><pubmed>23269831</pubmed></ref>。シナプスの形成にはニューロリギンのホモ二量体、ヘテロ二量体形成が必要であることが報告されている<ref><pubmed>17897391</pubmed></ref> <ref><pubmed>23129658</pubmed></ref> <ref><pubmed>22671294</pubmed></ref>。 | |||
神経活動依存的にニューロリギン1は翻訳後修飾を受けることが知られている。細胞膜上のニューロリギン1は、NMDA受容体依存的に活性化されたプロテアーゼによって切断される<ref><pubmed>23083741</pubmed></ref> <ref><pubmed>23083742</pubmed></ref>。その結果、興奮性シナプス伝達能の低下する<ref><pubmed>23083741</pubmed></ref>。この活動依存的NLGN1切断はシナプス密度を調節し<ref><pubmed>23083742</pubmed></ref>、興奮性シナプス伝達効率を変化させる<ref><pubmed>23083741</pubmed></ref>。 | |||
ニューロリギン1は記憶と学習の分子基盤と考えられる長期増強現象(long-term potentiation:LTP)の発現に必要であり、SSBの存在が寄与している<ref><pubmed>23083734</pubmed></ref> <ref><pubmed>20147539</pubmed></ref> <ref><pubmed>18579781</pubmed></ref>。一方、ニューロリギン3は、knockdown実験とknockoutマウスではLTPには関与しないことが報告されているが、ミスセンス変異(Arg451Cys置換)ニューロリギン3 knockinマウスではLTPの増大が認められている<ref><pubmed>23083734</pubmed></ref> <ref name=ref2 />。 | |||
PSD-95とニューロリギン1の複合体による逆行性の神経伝達物質放出機調節はβニューレキシンを介して行われていることが示唆されている<ref><pubmed>17237775</pubmed></ref>。遺伝子改変マウス | |||
====ニューロリギン1 knockout, knock downマウス==== | |||
空間記憶ならびに恐怖記憶の障害を示す。NMDA受容体を介したシナプス伝達応答とLTPの減弱が認められる<ref><pubmed>20147539</pubmed></ref> <ref><pubmed>18579781</pubmed></ref> <ref><pubmed>17582332</pubmed></ref>。 | |||
==== | ====ニューロリギン2 knockoutマウス==== | ||
抑制性シナプス伝達能の低下と不安様行動の増加が認められる<ref><pubmed>19016888</pubmed></ref> <ref><pubmed>20530218</pubmed></ref> <ref><pubmed>17582332</pubmed></ref>。パルバルブミン(Parvalbumin)陽性抑制性細胞を介した抑制性シナプス伝達効率は減弱するが、ソマトスタチン(Somatostatin)陽性抑制性細胞を介した伝達はニューロリギン2のノックアウト効果が見られない<ref><pubmed>19889999</pubmed></ref>。この結果は、抑制性入力に依存して異なるニューロリギンとニューレキシン結合が抑制性シナプスの機能に寄与していることを示唆している。 | |||
===== | ====ニューロリギン3 knockoutマウス==== | ||
社会的行動の障害(social novelty preferenceの低下)とultrasonic vocalizationの減少を示す<ref name=ref3 />。脳容積の減少が認められる<ref name=ref3 />。抑制性シナプス伝達能の僅かな増加と興奮性シナプス伝達能の僅かな減少が認められるが、シナプス可塑性の変化は認められない<ref name=ref2 />。また、[[海馬]]ではパルバルブミン陽性抑制性細胞を介した抑制性シナプス伝達効率の変化は認められないが、コレシストキニン(cholesystokinin)陽性抑制性細胞を介した伝達効率の増加が認められる<ref><pubmed>23583622</pubmed></ref>。 | |||
====ニューロリギン4 knockoutマウス==== | |||
社会的行動の障害(reciprocal social interaction)とultrasonic vocalizationの減少を示す。脳容積の減少が認められる<ref><pubmed>18227507</pubmed></ref>。 | |||
====ニューロリギン1,2,3 knockoutマウス==== | |||
呼吸器障害により生後間もなく死亡する。この呼吸器障害は神経伝達の低下によると示唆されているが、シナプスの構造は野生型マウスに比べ差異が見られない<ref><pubmed>16982420</pubmed></ref>。これはニューロリギンがシナプス構造構築ではなく、シナプス機能を制御していることを示唆している。 | 呼吸器障害により生後間もなく死亡する。この呼吸器障害は神経伝達の低下によると示唆されているが、シナプスの構造は野生型マウスに比べ差異が見られない<ref><pubmed>16982420</pubmed></ref>。これはニューロリギンがシナプス構造構築ではなく、シナプス機能を制御していることを示唆している。 | ||
====ニューロリギン3 Arg451Cys knockinマウス==== | |||
[[自閉症]]患者より発見されたニューロリギン3の変異を[[模倣]]したノックインマウス。 | [[自閉症]]患者より発見されたニューロリギン3の変異を[[模倣]]したノックインマウス。 | ||
[[ | [[体性感覚]]皮質(somatosensory cortex)において抑制性シナプス伝達能の増加が認められ<ref name=ref1 />、海馬では興奮性シナプス伝達効率およびLTPの増加が認められる<ref name=ref2 />。さらに、海馬ではパルバルブミン陽性抑制性細胞を介した抑制性シナプス伝達効率の減弱と、コレシストキニン陽性抑制性細胞を介した伝達効率の増加が認められる<ref><pubmed>23583622</pubmed></ref>。皮質においてパルバルブミン陽性細胞の数が減弱している<ref><pubmed>20664807</pubmed></ref>。社会的行動障害を示すことが報告されているが<ref name=ref1 /> <ref name=ref2 />、明白な障害を示さないという報告もある<ref><pubmed>19360662</pubmed></ref>。 | ||
====ニューロリギン3 Arg704Cys knockinマウス==== | |||
Arg704Cysのアミノ酸置換はニューロリギン4において発見されたが、ニューロリギン3でのArg704Cysの影響が検討されている。ニューロリギン3 Arg704Cys | Arg704Cysのアミノ酸置換はニューロリギン4において発見されたが、ニューロリギン3でのArg704Cysの影響が検討されている。ニューロリギン3 Arg704Cys knockinマウスではシナプス構造の著名な変化は認められないが、AMPA型受容体を介したシナプス伝達応答の減弱が認められる<ref><pubmed>21642956</pubmed></ref>。 | ||
===血管=== | ===血管=== | ||
| 163行目: | 136行目: | ||
===膵臓=== | ===膵臓=== | ||
ニューロリギン2はβ細胞からのインスリン[[分泌]]を調節している<ref><pubmed>18755801</pubmed></ref> <ref><pubmed>22528485</pubmed></ref>。 | |||
== 疾患との関連 == | == 疾患との関連 == | ||
===自閉症=== | ===自閉症=== | ||
X染色体に局在するニューロリギン3とニューロリギン4の変異が報告されている<ref><pubmed>12669065</pubmed></ref> <ref><pubmed>15622415</pubmed></ref> <ref><pubmed>19726642</pubmed></ref>。ニューロリギン3の細胞外ドメインのArg451がCysに変異した兄弟において、一人は自閉症を、もう一人はアスペルガー症候群を示し、自閉症スペクトラムの中でも異なる症状を示すことは興味深い<ref><pubmed>12669065</pubmed></ref>。 | |||
===統合失調症=== | ===統合失調症=== | ||
| 174行目: | 147行目: | ||
===アルツハイマー病=== | ===アルツハイマー病=== | ||
ニューロリギン1はアミロイドβ蛋白と結合することが報告されており、[[アルツハイマー病]]発症への関与が示唆されている<ref><pubmed>21838267</pubmed></ref>。また、アミロイド前駆体蛋白を切断するADAM10(A disintegrin and metalloproteinase 10)やγ-secretase、アミロイドβ蛋白の代謝に関与する[[MMP-9]]がニューロリギン1の切断にも関与することが報告されている<ref><pubmed>23083741</pubmed></ref> <ref><pubmed>23083742</pubmed></ref>。 | |||
== 参考文献 == | == 参考文献 == | ||
<references /> | <references /> | ||
2013年7月30日 (火) 04:07時点における版
渡辺 拓也、二井 健介
マサチューセッツ州立大学 メディカルスクール
DOI XXXX/XXXX 原稿受付日:2013年6月4日 原稿完成日:2013年7月xx日
担当編集委員:林 康紀(独立行政法人理化学研究所)
| Neuroligin 2 | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Identifiers | |||||||||||||
| Symbols | NLGN2; KIAA1366 | ||||||||||||
| External IDs | OMIM: 606479 MGI: 2681835 HomoloGene: 69317 GeneCards: NLGN2 Gene | ||||||||||||
| |||||||||||||
| Orthologs | |||||||||||||
| Species | Human | Mouse | |||||||||||
| Entrez | 57555 | 216856 | |||||||||||
| Ensembl | ENSG00000169992 | ENSMUSG00000051790 | |||||||||||
| UniProt | Q8NFZ4 | Q69ZK9 | |||||||||||
| RefSeq (mRNA) | NM_020795 | NM_198862 | |||||||||||
| RefSeq (protein) | NP_065846 | NP_942562 | |||||||||||
| Location (UCSC) |
Chr 17: 7.31 – 7.32 Mb |
Chr 11: 69.82 – 69.84 Mb | |||||||||||
| PubMed search | [3] | [4] | |||||||||||
| Neuroligin 3 | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Identifiers | |||||||||||||
| Symbols | NLGN3; HNL3 | ||||||||||||
| External IDs | OMIM: 300336 MGI: 2444609 HomoloGene: 23133 GeneCards: NLGN3 Gene | ||||||||||||
| |||||||||||||
| RNA expression pattern | |||||||||||||
 | |||||||||||||
| More reference expression data | |||||||||||||
| Orthologs | |||||||||||||
| Species | Human | Mouse | |||||||||||
| Entrez | 54413 | 245537 | |||||||||||
| Ensembl | ENSG00000196338 | ENSMUSG00000031302 | |||||||||||
| UniProt | Q9NZ94 | Q8BYM5 | |||||||||||
| RefSeq (mRNA) | NM_001166660 | NM_172932 | |||||||||||
| RefSeq (protein) | NP_001160132 | NP_766520 | |||||||||||
| Location (UCSC) |
Chr X: 70.36 – 70.39 Mb |
Chr X: 101.3 – 101.33 Mb | |||||||||||
| PubMed search | [5] | [6] | |||||||||||
| Neuroligin 4, X-linked | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||
| |||||||||||||
| Identifiers | |||||||||||||
| Symbols | NLGN4X; ASPGX2; AUTSX2; HLNX; HNL4X; HNLX; NLGN; NLGN4 | ||||||||||||
| External IDs | OMIM: 300427 HomoloGene: 124472 GeneCards: NLGN4X Gene | ||||||||||||
| |||||||||||||
| RNA expression pattern | |||||||||||||
 | |||||||||||||
| More reference expression data | |||||||||||||
| Orthologs | |||||||||||||
| Species | Human | Mouse | |||||||||||
| Entrez | 57502 | n/a | |||||||||||
| Ensembl | ENSG00000146938 | n/a | |||||||||||
| UniProt | Q8N0W4 | n/a | |||||||||||
| RefSeq (mRNA) | NM_020742 | n/a | |||||||||||
| RefSeq (protein) | NP_065793 | n/a | |||||||||||
| Location (UCSC) |
Chr X: 5.76 – 6.15 Mb | n/a | |||||||||||
| PubMed search | [7] | n/a | |||||||||||
英語名:neuroligin
ニューロリギンはシナプス後部(postsynapse)に存在する1回膜貫通型タンパク質であり、シナプス前末端(presynapse,presynaptic terminal)に存在するニューレキシン(Neurexin: NRXN)の内因性リガンドであり、シナプスの成熟や機能を調整している[1]。ニューロリギンのアイソフォームは、グルタミン酸作動性・GABA作動性神経シナプスの構築の選別に影響すると考えられている。また、自閉症や統合失調症のリスク遺伝子として考えられており、遺伝子改変マウスは自閉症様行動を示す[1] [2] [3] [4]。
歴史
ニューレキシン1βのアフィニティーカラムを用いた実験により、ニューレキシン1βの結合タンパク質としてニューロリギン1が初めて同定された[5]。
サブタイプ
ヒトでは5つのニューロリギン遺伝子がある(NLGN1、NLGN2、NLGN3、NLGN4、NLGN4Y)[5] [6] [7] [8]。また、ショウジョウバエ(4遺伝子[9] [10])やアメフラシ(1遺伝子[11])、ミツバチ(5遺伝子[12] [13]、線虫(1遺伝子[14])などの無脊椎動物においてもニューロリギン遺伝子の発現が認められている。
| αニューレキシン(+SS4) | αニューレキシン(-SS4) | βニューレキシン(+SS4) | βニューレキシン(-SS4) | |
| ニューロリギン1(-) | + | + | +++ | ++++ |
| ニューロリギン1A | + | + | +++ | ++++ |
| ニューロリギン1B | - | - | ++ | ++++ |
| ニューロリギン1AB | - | - | ++ | ++++ |
| ニューロリギン2 | + | + | ++ | ++++ |
| ニューロリギン3 | + | + | + | ++ |
| ニューロリギン4 | + |
スプライシング変異体
ニューロリギン1は選択的スプライシング部位A(alternative splice site A:SSA)と選択的スプライシング部位B(SSB)の2つを、ニューロリギン2,ニューロリギン3とニューロリギン4はSSAのみを有しており[ニューロリギン3には2つのスプライシング部位(SSA1, SSA2)が存在]、合計12種類のスプライス変異体(ニューロリギン1:4、ニューロリギン2:2、ニューロリギン3:4、ニューロリギン4:2)が存在する[18]。ニューロリギンは選択的スプライシングの有無により、ニューレキシンとの結合親和性が異なることが報告されている(表1)。SSBを有さないニューロリギン [NLGN1(-), NLGN1A, NLGN2(-)とNLGN2A]はβニューレキシンのSS4の有無に関わらず高親和性に結合するが、ニューロリギンのSSBの挿入(NLGN1B, NLGN1AB)はβニューレキシンのスプライス変異体との結合親和性を低下させる[19] [20]。さらに、SSBを有するニューロリギンはαニューレキシンと結合しない[21]。SSBの挿入は抑制性シナプスの形成を阻害することが示唆されている[22]。
構造
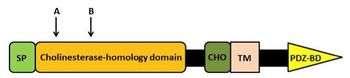
矢印:選択的スプライシング部位 SP:シグナルペプチド、CHO: carbohydrate-attachment sequence、TM:膜貫通領域、PDZ-BD:PDZ-domain-binding site
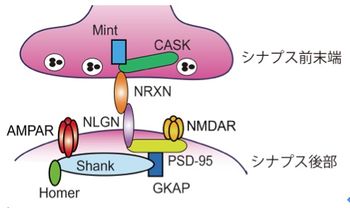
ニューレキシンとニューロリギンはシナプス前末端とシナプス後部間で結合している。ニューレキシンとニューロリギンはそれぞれシナプス前末端とシナプス後部のシナプス局在分子と直接・間接的に結合している。
ニューロリギンは1回膜貫通型蛋白質であり、細胞外ドメインと比較的短い細胞内ドメインを有している(図1)。細胞外ドメインはアセチルコチンエステラーゼ(acetylcholinesterase:AChE)と相同性を有しているが、コリンエステラーゼ活性は無く、ニューレキシン結合領域となっている[5]。
ニューロリギンとβニューレキシン複合体の3次元構造が明らかとなっている[23] [24]。AChE相同領域にはSSAがあり、加えてニューロリギン1にのみ同領域にSSBが存在する。in situ chemical cross-linking法(細胞膜表面に存在するcis複合体を保持する為)と免疫沈降法を組み合わせた解析によって、全てのニューロリギンアイソフォームがホモ二量体を形成することが示唆され、ニューロリギン1-ニューロリギン2とニューロリギン1-ニューロリギン3ヘテロ二量体の存在が確認されている[25]。上記の解析ではニューロリギン2-ニューロリギン3ヘテロ二量体は認められていないが[25]、他グループの免疫沈降法では報告されている[26]。二量体形成は、ニューロリギンの細胞膜への輸送に必要であり[25]、この形成に関与する部位はAChE相同領域に存在する[27] [25]。細胞外ドメインの膜貫通ドメイン側にはCHO配列(carbohydrate-attachment sequence)がある。細胞内ドメインのC-末端には、シナプス足場蛋白(PSD-95等)との結合に重要であると推定されるPDZドメイン[postsynaptic density (PSD)-95/ discs large/ zona-occludens-1ドメイン]結合部位が存在する[28] [29] [30]。また、膜貫通ドメインとPDZドメイン結合部位の間には、gephyrin結合ドメインと、構造が同定されていないcriticalドメインが存在する(図2)[31] [32]。
発現
ニューロリギン1とニューロリギン2はそれぞれ中枢神経系のグルタミン酸作動性神経(興奮性)シナプスとGABA作動性神経(抑制性)シナプスに発現している[33] [34] [35]。ニューロリギンの興奮性・抑制性シナプスにおける局在はシナプス足場蛋白(PSD-95とgephyrin)によって調節されていることが示唆されている[36]。また、ヒトでは、ニューロリギン2の膵島と大腸における発現が確認されている[37]。ニューロリギン3は興奮性と抑制性の両シナプスに発現しており[26]、げっ歯類ではグリア細胞にも発現が確認されている[38]。また、ヒトではニューロリギン3は心臓、骨格筋、胎盤、膵臓にも発現している[39]。ニューロリギン4は心臓、肝臓、骨格筋、膵臓に発現し、脳では低レベルで発現しており[6]、網膜のグリシン作動性神経シナプス後部に発現していることが報告されている[40]。
Allen Brain Atlasでの発現パターン(Mouse) [NLGN1] [NLGN2] [NLGN3]
機能
神経
非神経細胞でのニューロリギン強制発現は、共培養した神経細胞のシナプス前末端の分化を誘導する[41]。また、ニューロリギンはシナプス後部の分化にも重要である。 ニューロリギン1またはニューロリギン3の強制発現は興奮性シナプス伝達機能を増加させ、一方、ニューロリギン2強制発現は抑制性シナプス伝達機能を増加させる[42] [43] [44]。ニューロリギン1とニューロリギン2は、それぞれβ-、αニューレキシンと機能的なシナプスを形成することから、ニューロリギンとニューレキシンのアイソフォームの特異的な組み合わせが興奮性と抑制性シナプスの仕分けに関与していることが示唆されている。また、ニューロリギンのシナプス伝達への機能には、細胞内ドメインではなく細胞外ドメインが重要であると考えられている[45]。
ニューロリギン1はPSD-95との結合によって、選択的に興奮性シナプスを構築する[46]。一方、ニューロリギン2は抑制性シナプス後部特異的な足場蛋白であるgephyrinを介して、抑制性シナプスを構築する[47]。また、ニューロリギン1の細胞外ドメインは、NMDA型受容体と相互作用を示し、シナプス後部におけるNMDA型受容体の機能を調節していると報告されている[48]。シナプスの形成にはニューロリギンのホモ二量体、ヘテロ二量体形成が必要であることが報告されている[49] [50] [51]。
神経活動依存的にニューロリギン1は翻訳後修飾を受けることが知られている。細胞膜上のニューロリギン1は、NMDA受容体依存的に活性化されたプロテアーゼによって切断される[52] [53]。その結果、興奮性シナプス伝達能の低下する[54]。この活動依存的NLGN1切断はシナプス密度を調節し[55]、興奮性シナプス伝達効率を変化させる[56]。
ニューロリギン1は記憶と学習の分子基盤と考えられる長期増強現象(long-term potentiation:LTP)の発現に必要であり、SSBの存在が寄与している[57] [58] [59]。一方、ニューロリギン3は、knockdown実験とknockoutマウスではLTPには関与しないことが報告されているが、ミスセンス変異(Arg451Cys置換)ニューロリギン3 knockinマウスではLTPの増大が認められている[60] [2]。
PSD-95とニューロリギン1の複合体による逆行性の神経伝達物質放出機調節はβニューレキシンを介して行われていることが示唆されている[61]。遺伝子改変マウス
ニューロリギン1 knockout, knock downマウス
空間記憶ならびに恐怖記憶の障害を示す。NMDA受容体を介したシナプス伝達応答とLTPの減弱が認められる[62] [63] [64]。
ニューロリギン2 knockoutマウス
抑制性シナプス伝達能の低下と不安様行動の増加が認められる[65] [66] [67]。パルバルブミン(Parvalbumin)陽性抑制性細胞を介した抑制性シナプス伝達効率は減弱するが、ソマトスタチン(Somatostatin)陽性抑制性細胞を介した伝達はニューロリギン2のノックアウト効果が見られない[68]。この結果は、抑制性入力に依存して異なるニューロリギンとニューレキシン結合が抑制性シナプスの機能に寄与していることを示唆している。
ニューロリギン3 knockoutマウス
社会的行動の障害(social novelty preferenceの低下)とultrasonic vocalizationの減少を示す[4]。脳容積の減少が認められる[4]。抑制性シナプス伝達能の僅かな増加と興奮性シナプス伝達能の僅かな減少が認められるが、シナプス可塑性の変化は認められない[2]。また、海馬ではパルバルブミン陽性抑制性細胞を介した抑制性シナプス伝達効率の変化は認められないが、コレシストキニン(cholesystokinin)陽性抑制性細胞を介した伝達効率の増加が認められる[69]。
ニューロリギン4 knockoutマウス
社会的行動の障害(reciprocal social interaction)とultrasonic vocalizationの減少を示す。脳容積の減少が認められる[70]。
ニューロリギン1,2,3 knockoutマウス
呼吸器障害により生後間もなく死亡する。この呼吸器障害は神経伝達の低下によると示唆されているが、シナプスの構造は野生型マウスに比べ差異が見られない[71]。これはニューロリギンがシナプス構造構築ではなく、シナプス機能を制御していることを示唆している。
ニューロリギン3 Arg451Cys knockinマウス
自閉症患者より発見されたニューロリギン3の変異を模倣したノックインマウス。
体性感覚皮質(somatosensory cortex)において抑制性シナプス伝達能の増加が認められ[1]、海馬では興奮性シナプス伝達効率およびLTPの増加が認められる[2]。さらに、海馬ではパルバルブミン陽性抑制性細胞を介した抑制性シナプス伝達効率の減弱と、コレシストキニン陽性抑制性細胞を介した伝達効率の増加が認められる[72]。皮質においてパルバルブミン陽性細胞の数が減弱している[73]。社会的行動障害を示すことが報告されているが[1] [2]、明白な障害を示さないという報告もある[74]。
ニューロリギン3 Arg704Cys knockinマウス
Arg704Cysのアミノ酸置換はニューロリギン4において発見されたが、ニューロリギン3でのArg704Cysの影響が検討されている。ニューロリギン3 Arg704Cys knockinマウスではシナプス構造の著名な変化は認められないが、AMPA型受容体を介したシナプス伝達応答の減弱が認められる[75]。
血管
ニューロリギン1は腫瘍形成環境下において血管新生を促進する[76]。
膵臓
ニューロリギン2はβ細胞からのインスリン分泌を調節している[77] [78]。
疾患との関連
自閉症
X染色体に局在するニューロリギン3とニューロリギン4の変異が報告されている[79] [80] [81]。ニューロリギン3の細胞外ドメインのArg451がCysに変異した兄弟において、一人は自閉症を、もう一人はアスペルガー症候群を示し、自閉症スペクトラムの中でも異なる症状を示すことは興味深い[82]。
統合失調症
ニューロリギン2に変異が発見されている[83]。
アルツハイマー病
ニューロリギン1はアミロイドβ蛋白と結合することが報告されており、アルツハイマー病発症への関与が示唆されている[84]。また、アミロイド前駆体蛋白を切断するADAM10(A disintegrin and metalloproteinase 10)やγ-secretase、アミロイドβ蛋白の代謝に関与するMMP-9がニューロリギン1の切断にも関与することが報告されている[85] [86]。
参考文献
- ↑ 1.0 1.1 1.2 1.3
Südhof, T.C. (2008).
Neuroligins and neurexins link synaptic function to cognitive disease. Nature, 455(7215), 903-11. [PubMed:18923512] [PMC] [WorldCat] [DOI] 引用エラー: 無効な<ref>タグ; name "ref1"が異なる内容で複数回定義されています - ↑ 2.0 2.1 2.2 2.3 2.4
Etherton, M., Földy, C., Sharma, M., Tabuchi, K., Liu, X., Shamloo, M., ..., & Südhof, T.C. (2011).
Autism-linked neuroligin-3 R451C mutation differentially alters hippocampal and cortical synaptic function. Proceedings of the National Academy of Sciences of the United States of America, 108(33), 13764-9. [PubMed:21808020] [PMC] [WorldCat] [DOI] - ↑
El-Kordi, A., Winkler, D., Hammerschmidt, K., Kästner, A., Krueger, D., Ronnenberg, A., ..., & Ehrenreich, H. (2013).
Development of an autism severity score for mice using Nlgn4 null mutants as a construct-valid model of heritable monogenic autism. Behavioural brain research, 251, 41-9. [PubMed:23183221] [WorldCat] [DOI] - ↑ 4.0 4.1 4.2
Radyushkin, K., Hammerschmidt, K., Boretius, S., Varoqueaux, F., El-Kordi, A., Ronnenberg, A., ..., & Ehrenreich, H. (2009).
Neuroligin-3-deficient mice: model of a monogenic heritable form of autism with an olfactory deficit. Genes, brain, and behavior, 8(4), 416-25. [PubMed:19243448] [WorldCat] [DOI] - ↑ 5.0 5.1 5.2
Ichtchenko, K., Hata, Y., Nguyen, T., Ullrich, B., Missler, M., Moomaw, C., & Südhof, T.C. (1995).
Neuroligin 1: a splice site-specific ligand for beta-neurexins. Cell, 81(3), 435-43. [PubMed:7736595] [WorldCat] [DOI] - ↑ 6.0 6.1
Bolliger, M.F., Frei, K., Winterhalter, K.H., & Gloor, S.M. (2001).
Identification of a novel neuroligin in humans which binds to PSD-95 and has a widespread expression. The Biochemical journal, 356(Pt 2), 581-8. [PubMed:11368788] [PMC] [WorldCat] [DOI] - ↑
Bolliger, M.F., Pei, J., Maxeiner, S., Boucard, A.A., Grishin, N.V., & Südhof, T.C. (2008).
Unusually rapid evolution of Neuroligin-4 in mice. Proceedings of the National Academy of Sciences of the United States of America, 105(17), 6421-6. [PubMed:18434543] [PMC] [WorldCat] [DOI] - ↑
Ichtchenko, K., Nguyen, T., & Südhof, T.C. (1996).
Structures, alternative splicing, and neurexin binding of multiple neuroligins. The Journal of biological chemistry, 271(5), 2676-82. [PubMed:8576240] [WorldCat] [DOI] - ↑
Banovic, D., Khorramshahi, O., Owald, D., Wichmann, C., Riedt, T., Fouquet, W., ..., & Aberle, H. (2010).
Drosophila neuroligin 1 promotes growth and postsynaptic differentiation at glutamatergic neuromuscular junctions. Neuron, 66(5), 724-38. [PubMed:20547130] [WorldCat] [DOI] - ↑
Sun, M., Xing, G., Yuan, L., Gan, G., Knight, D., With, S.I., ..., & Xie, W. (2011).
Neuroligin 2 is required for synapse development and function at the Drosophila neuromuscular junction. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(2), 687-99. [PubMed:21228178] [PMC] [WorldCat] [DOI] - ↑
Choi, Y.B., Li, H.L., Kassabov, S.R., Jin, I., Puthanveettil, S.V., Karl, K.A., ..., & Kandel, E.R. (2011).
Neurexin-neuroligin transsynaptic interaction mediates learning-related synaptic remodeling and long-term facilitation in aplysia. Neuron, 70(3), 468-81. [PubMed:21555073] [PMC] [WorldCat] [DOI] - ↑
Biswas, S., Russell, R.J., Jackson, C.J., Vidovic, M., Ganeshina, O., Oakeshott, J.G., & Claudianos, C. (2008).
Bridging the synaptic gap: neuroligins and neurexin I in Apis mellifera. PloS one, 3(10), e3542. [PubMed:18974885] [PMC] [WorldCat] [DOI] - ↑
Biswas, S., Reinhard, J., Oakeshott, J., Russell, R., Srinivasan, M.V., & Claudianos, C. (2010).
Sensory regulation of neuroligins and neurexin I in the honeybee brain. PloS one, 5(2), e9133. [PubMed:20161754] [PMC] [WorldCat] [DOI] - ↑
Hunter, J.W., Mullen, G.P., McManus, J.R., Heatherly, J.M., Duke, A., & Rand, J.B. (2010).
Neuroligin-deficient mutants of C. elegans have sensory processing deficits and are hypersensitive to oxidative stress and mercury toxicity. Disease models & mechanisms, 3(5-6), 366-76. [PubMed:20083577] [PMC] [WorldCat] [DOI] - ↑
Boucard, A.A., Chubykin, A.A., Comoletti, D., Taylor, P., & Südhof, T.C. (2005).
A splice code for trans-synaptic cell adhesion mediated by binding of neuroligin 1 to alpha- and beta-neurexins. Neuron, 48(2), 229-36. [PubMed:16242404] [WorldCat] [DOI] - ↑
Koehnke, J., Katsamba, P.S., Ahlsen, G., Bahna, F., Vendome, J., Honig, B., ..., & Jin, X. (2010).
Splice form dependence of beta-neurexin/neuroligin binding interactions. Neuron, 67(1), 61-74. [PubMed:20624592] [PMC] [WorldCat] [DOI] - ↑
Leone, P., Comoletti, D., Ferracci, G., Conrod, S., Garcia, S.U., Taylor, P., ..., & Marchot, P. (2010).
Structural insights into the exquisite selectivity of neurexin/neuroligin synaptic interactions. The EMBO journal, 29(14), 2461-71. [PubMed:20543817] [PMC] [WorldCat] [DOI] - ↑
Baudouin, S., & Scheiffele, P. (2010).
SnapShot: Neuroligin-neurexin complexes. Cell, 141(5), 908, 908.e1. [PubMed:20510934] [WorldCat] [DOI] - ↑
Chih, B., Gollan, L., & Scheiffele, P. (2006).
Alternative splicing controls selective trans-synaptic interactions of the neuroligin-neurexin complex. Neuron, 51(2), 171-8. [PubMed:16846852] [WorldCat] [DOI] - ↑
Graf, E.R., Kang, Y., Hauner, A.M., & Craig, A.M. (2006).
Structure function and splice site analysis of the synaptogenic activity of the neurexin-1 beta LNS domain. The Journal of neuroscience : the official journal of the Society for Neuroscience, 26(16), 4256-65. [PubMed:16624946] [PMC] [WorldCat] [DOI] - ↑
Boucard, A.A., Chubykin, A.A., Comoletti, D., Taylor, P., & Südhof, T.C. (2005).
A splice code for trans-synaptic cell adhesion mediated by binding of neuroligin 1 to alpha- and beta-neurexins. Neuron, 48(2), 229-36. [PubMed:16242404] [WorldCat] [DOI] - ↑
Chih, B., Gollan, L., & Scheiffele, P. (2006).
Alternative splicing controls selective trans-synaptic interactions of the neuroligin-neurexin complex. Neuron, 51(2), 171-8. [PubMed:16846852] [WorldCat] [DOI] - ↑
Araç, D., Boucard, A.A., Ozkan, E., Strop, P., Newell, E., Südhof, T.C., & Brunger, A.T. (2007).
Structures of neuroligin-1 and the neuroligin-1/neurexin-1 beta complex reveal specific protein-protein and protein-Ca2+ interactions. Neuron, 56(6), 992-1003. [PubMed:18093522] [WorldCat] [DOI] - ↑ https://www.youtube.com/watch?v=DuARiSOGy88
- ↑ 25.0 25.1 25.2 25.3
Poulopoulos, A., Soykan, T., Tuffy, L.P., Hammer, M., Varoqueaux, F., & Brose, N. (2012).
Homodimerization and isoform-specific heterodimerization of neuroligins. The Biochemical journal, 446(2), 321-30. [PubMed:22671294] [WorldCat] [DOI] - ↑ 26.0 26.1
Budreck, E.C., & Scheiffele, P. (2007).
Neuroligin-3 is a neuronal adhesion protein at GABAergic and glutamatergic synapses. The European journal of neuroscience, 26(7), 1738-48. [PubMed:17897391] [WorldCat] [DOI] - ↑
Dean, C., Scholl, F.G., Choih, J., DeMaria, S., Berger, J., Isacoff, E., & Scheiffele, P. (2003).
Neurexin mediates the assembly of presynaptic terminals. Nature neuroscience, 6(7), 708-16. [PubMed:12796785] [PMC] [WorldCat] [DOI] - ↑
Iida, J., Hirabayashi, S., Sato, Y., & Hata, Y. (2004).
Synaptic scaffolding molecule is involved in the synaptic clustering of neuroligin. Molecular and cellular neurosciences, 27(4), 497-508. [PubMed:15555927] [WorldCat] [DOI] - ↑
Irie, M., Hata, Y., Takeuchi, M., Ichtchenko, K., Toyoda, A., Hirao, K., ..., & Südhof, T.C. (1997).
Binding of neuroligins to PSD-95. Science (New York, N.Y.), 277(5331), 1511-5. [PubMed:9278515] [WorldCat] [DOI] - ↑
Meyer, G., Varoqueaux, F., Neeb, A., Oschlies, M., & Brose, N. (2004).
The complexity of PDZ domain-mediated interactions at glutamatergic synapses: a case study on neuroligin. Neuropharmacology, 47(5), 724-33. [PubMed:15458844] [WorldCat] [DOI] - ↑
Poulopoulos, A., Aramuni, G., Meyer, G., Soykan, T., Hoon, M., Papadopoulos, T., ..., & Varoqueaux, F. (2009).
Neuroligin 2 drives postsynaptic assembly at perisomatic inhibitory synapses through gephyrin and collybistin. Neuron, 63(5), 628-42. [PubMed:19755106] [WorldCat] [DOI] - ↑
Shipman, S.L., Schnell, E., Hirai, T., Chen, B.S., Roche, K.W., & Nicoll, R.A. (2011).
Functional dependence of neuroligin on a new non-PDZ intracellular domain. Nature neuroscience, 14(6), 718-26. [PubMed:21532576] [PMC] [WorldCat] [DOI] - ↑
Song, J.Y., Ichtchenko, K., Südhof, T.C., & Brose, N. (1999).
Neuroligin 1 is a postsynaptic cell-adhesion molecule of excitatory synapses. Proceedings of the National Academy of Sciences of the United States of America, 96(3), 1100-5. [PubMed:9927700] [PMC] [WorldCat] [DOI] - ↑
Varoqueaux, F., Jamain, S., & Brose, N. (2004).
Neuroligin 2 is exclusively localized to inhibitory synapses. European journal of cell biology, 83(9), 449-56. [PubMed:15540461] [WorldCat] [DOI] - ↑
Graf, E.R., Zhang, X., Jin, S.X., Linhoff, M.W., & Craig, A.M. (2004).
Neurexins induce differentiation of GABA and glutamate postsynaptic specializations via neuroligins. Cell, 119(7), 1013-26. [PubMed:15620359] [PMC] [WorldCat] [DOI] - ↑
(1991).
Major cross-country differences in risk of dying for people with IDDM. Diabetes Epidemiology Research International Mortality Study Group. Diabetes care, 14(1), 49-54. [PubMed:1991435] [WorldCat] [DOI] - ↑
Suckow, A.T., Comoletti, D., Waldrop, M.A., Mosedale, M., Egodage, S., Taylor, P., & Chessler, S.D. (2008).
Expression of neurexin, neuroligin, and their cytoplasmic binding partners in the pancreatic beta-cells and the involvement of neuroligin in insulin secretion. Endocrinology, 149(12), 6006-17. [PubMed:18755801] [PMC] [WorldCat] [DOI] - ↑
Gilbert, M., Smith, J., Roskams, A.J., & Auld, V.J. (2001).
Neuroligin 3 is a vertebrate gliotactin expressed in the olfactory ensheathing glia, a growth-promoting class of macroglia. Glia, 34(3), 151-64. [PubMed:11329178] [WorldCat] - ↑
Philibert, R.A., Winfield, S.L., Sandhu, H.K., Martin, B.M., & Ginns, E.I. (2000).
The structure and expression of the human neuroligin-3 gene. Gene, 246(1-2), 303-10. [PubMed:10767552] [WorldCat] [DOI] - ↑
Hoon, M., Soykan, T., Falkenburger, B., Hammer, M., Patrizi, A., Schmidt, K.F., ..., & Varoqueaux, F. (2011).
Neuroligin-4 is localized to glycinergic postsynapses and regulates inhibition in the retina. Proceedings of the National Academy of Sciences of the United States of America, 108(7), 3053-8. [PubMed:21282647] [PMC] [WorldCat] [DOI] - ↑
Scheiffele, P., Fan, J., Choih, J., Fetter, R., & Serafini, T. (2000).
Neuroligin expressed in nonneuronal cells triggers presynaptic development in contacting axons. Cell, 101(6), 657-69. [PubMed:10892652] [WorldCat] [DOI] - ↑
Chubykin, A.A., Atasoy, D., Etherton, M.R., Brose, N., Kavalali, E.T., Gibson, J.R., & Südhof, T.C. (2007).
Activity-dependent validation of excitatory versus inhibitory synapses by neuroligin-1 versus neuroligin-2. Neuron, 54(6), 919-31. [PubMed:17582332] [PMC] [WorldCat] [DOI] - ↑
Futai, K., Kim, M.J., Hashikawa, T., Scheiffele, P., Sheng, M., & Hayashi, Y. (2007).
Retrograde modulation of presynaptic release probability through signaling mediated by PSD-95-neuroligin. Nature neuroscience, 10(2), 186-95. [PubMed:17237775] [PMC] [WorldCat] [DOI] - ↑
Shipman, S.L., Schnell, E., Hirai, T., Chen, B.S., Roche, K.W., & Nicoll, R.A. (2011).
Functional dependence of neuroligin on a new non-PDZ intracellular domain. Nature neuroscience, 14(6), 718-26. [PubMed:21532576] [PMC] [WorldCat] [DOI] - ↑
Futai, K., Doty, C.D., Baek, B., Ryu, J., & Sheng, M. (2013).
Specific trans-synaptic interaction with inhibitory interneuronal neurexin underlies differential ability of neuroligins to induce functional inhibitory synapses. The Journal of neuroscience : the official journal of the Society for Neuroscience, 33(8), 3612-23. [PubMed:23426688] [PMC] [WorldCat] [DOI] - ↑
Prange, O., Wong, T.P., Gerrow, K., Wang, Y.T., & El-Husseini, A. (2004).
A balance between excitatory and inhibitory synapses is controlled by PSD-95 and neuroligin. Proceedings of the National Academy of Sciences of the United States of America, 101(38), 13915-20. [PubMed:15358863] [PMC] [WorldCat] [DOI] - ↑
Poulopoulos, A., Aramuni, G., Meyer, G., Soykan, T., Hoon, M., Papadopoulos, T., ..., & Varoqueaux, F. (2009).
Neuroligin 2 drives postsynaptic assembly at perisomatic inhibitory synapses through gephyrin and collybistin. Neuron, 63(5), 628-42. [PubMed:19755106] [WorldCat] [DOI] - ↑
Budreck, E.C., Kwon, O.B., Jung, J.H., Baudouin, S., Thommen, A., Kim, H.S., ..., & Kim, J.H. (2013).
Neuroligin-1 controls synaptic abundance of NMDA-type glutamate receptors through extracellular coupling. Proceedings of the National Academy of Sciences of the United States of America, 110(2), 725-30. [PubMed:23269831] [PMC] [WorldCat] [DOI] - ↑
Budreck, E.C., & Scheiffele, P. (2007).
Neuroligin-3 is a neuronal adhesion protein at GABAergic and glutamatergic synapses. The European journal of neuroscience, 26(7), 1738-48. [PubMed:17897391] [WorldCat] [DOI] - ↑
Shipman, S.L., & Nicoll, R.A. (2012).
Dimerization of postsynaptic neuroligin drives synaptic assembly via transsynaptic clustering of neurexin. Proceedings of the National Academy of Sciences of the United States of America, 109(47), 19432-7. [PubMed:23129658] [PMC] [WorldCat] [DOI] - ↑
Poulopoulos, A., Soykan, T., Tuffy, L.P., Hammer, M., Varoqueaux, F., & Brose, N. (2012).
Homodimerization and isoform-specific heterodimerization of neuroligins. The Biochemical journal, 446(2), 321-30. [PubMed:22671294] [WorldCat] [DOI] - ↑
Peixoto, R.T., Kunz, P.A., Kwon, H., Mabb, A.M., Sabatini, B.L., Philpot, B.D., & Ehlers, M.D. (2012).
Transsynaptic signaling by activity-dependent cleavage of neuroligin-1. Neuron, 76(2), 396-409. [PubMed:23083741] [PMC] [WorldCat] [DOI] - ↑
Suzuki, K., Hayashi, Y., Nakahara, S., Kumazaki, H., Prox, J., Horiuchi, K., ..., & Iwatsubo, T. (2012).
Activity-dependent proteolytic cleavage of neuroligin-1. Neuron, 76(2), 410-22. [PubMed:23083742] [WorldCat] [DOI] - ↑
Peixoto, R.T., Kunz, P.A., Kwon, H., Mabb, A.M., Sabatini, B.L., Philpot, B.D., & Ehlers, M.D. (2012).
Transsynaptic signaling by activity-dependent cleavage of neuroligin-1. Neuron, 76(2), 396-409. [PubMed:23083741] [PMC] [WorldCat] [DOI] - ↑
Suzuki, K., Hayashi, Y., Nakahara, S., Kumazaki, H., Prox, J., Horiuchi, K., ..., & Iwatsubo, T. (2012).
Activity-dependent proteolytic cleavage of neuroligin-1. Neuron, 76(2), 410-22. [PubMed:23083742] [WorldCat] [DOI] - ↑
Peixoto, R.T., Kunz, P.A., Kwon, H., Mabb, A.M., Sabatini, B.L., Philpot, B.D., & Ehlers, M.D. (2012).
Transsynaptic signaling by activity-dependent cleavage of neuroligin-1. Neuron, 76(2), 396-409. [PubMed:23083741] [PMC] [WorldCat] [DOI] - ↑
Shipman, S.L., & Nicoll, R.A. (2012).
A subtype-specific function for the extracellular domain of neuroligin 1 in hippocampal LTP. Neuron, 76(2), 309-16. [PubMed:23083734] [PMC] [WorldCat] [DOI] - ↑
Blundell, J., Blaiss, C.A., Etherton, M.R., Espinosa, F., Tabuchi, K., Walz, C., ..., & Powell, C.M. (2010).
Neuroligin-1 deletion results in impaired spatial memory and increased repetitive behavior. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(6), 2115-29. [PubMed:20147539] [PMC] [WorldCat] [DOI] - ↑
Kim, J., Jung, S.Y., Lee, Y.K., Park, S., Choi, J.S., Lee, C.J., ..., & Kim, J.H. (2008).
Neuroligin-1 is required for normal expression of LTP and associative fear memory in the amygdala of adult animals. Proceedings of the National Academy of Sciences of the United States of America, 105(26), 9087-92. [PubMed:18579781] [PMC] [WorldCat] [DOI] - ↑
Shipman, S.L., & Nicoll, R.A. (2012).
A subtype-specific function for the extracellular domain of neuroligin 1 in hippocampal LTP. Neuron, 76(2), 309-16. [PubMed:23083734] [PMC] [WorldCat] [DOI] - ↑
Futai, K., Kim, M.J., Hashikawa, T., Scheiffele, P., Sheng, M., & Hayashi, Y. (2007).
Retrograde modulation of presynaptic release probability through signaling mediated by PSD-95-neuroligin. Nature neuroscience, 10(2), 186-95. [PubMed:17237775] [PMC] [WorldCat] [DOI] - ↑
Blundell, J., Blaiss, C.A., Etherton, M.R., Espinosa, F., Tabuchi, K., Walz, C., ..., & Powell, C.M. (2010).
Neuroligin-1 deletion results in impaired spatial memory and increased repetitive behavior. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(6), 2115-29. [PubMed:20147539] [PMC] [WorldCat] [DOI] - ↑
Kim, J., Jung, S.Y., Lee, Y.K., Park, S., Choi, J.S., Lee, C.J., ..., & Kim, J.H. (2008).
Neuroligin-1 is required for normal expression of LTP and associative fear memory in the amygdala of adult animals. Proceedings of the National Academy of Sciences of the United States of America, 105(26), 9087-92. [PubMed:18579781] [PMC] [WorldCat] [DOI] - ↑
Chubykin, A.A., Atasoy, D., Etherton, M.R., Brose, N., Kavalali, E.T., Gibson, J.R., & Südhof, T.C. (2007).
Activity-dependent validation of excitatory versus inhibitory synapses by neuroligin-1 versus neuroligin-2. Neuron, 54(6), 919-31. [PubMed:17582332] [PMC] [WorldCat] [DOI] - ↑
Blundell, J., Tabuchi, K., Bolliger, M.F., Blaiss, C.A., Brose, N., Liu, X., ..., & Powell, C.M. (2009).
Increased anxiety-like behavior in mice lacking the inhibitory synapse cell adhesion molecule neuroligin 2. Genes, brain, and behavior, 8(1), 114-26. [PubMed:19016888] [PMC] [WorldCat] [DOI] - ↑
Jedlicka, P., Hoon, M., Papadopoulos, T., Vlachos, A., Winkels, R., Poulopoulos, A., ..., & Schwarzacher, S.W. (2011).
Increased dentate gyrus excitability in neuroligin-2-deficient mice in vivo. Cerebral cortex (New York, N.Y. : 1991), 21(2), 357-67. [PubMed:20530218] [WorldCat] [DOI] - ↑
Chubykin, A.A., Atasoy, D., Etherton, M.R., Brose, N., Kavalali, E.T., Gibson, J.R., & Südhof, T.C. (2007).
Activity-dependent validation of excitatory versus inhibitory synapses by neuroligin-1 versus neuroligin-2. Neuron, 54(6), 919-31. [PubMed:17582332] [PMC] [WorldCat] [DOI] - ↑
Gibson, J.R., Huber, K.M., & Südhof, T.C. (2009).
Neuroligin-2 deletion selectively decreases inhibitory synaptic transmission originating from fast-spiking but not from somatostatin-positive interneurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 29(44), 13883-97. [PubMed:19889999] [PMC] [WorldCat] [DOI] - ↑
Földy, C., Malenka, R.C., & Südhof, T.C. (2013).
Autism-associated neuroligin-3 mutations commonly disrupt tonic endocannabinoid signaling. Neuron, 78(3), 498-509. [PubMed:23583622] [PMC] [WorldCat] [DOI] - ↑
Jamain, S., Radyushkin, K., Hammerschmidt, K., Granon, S., Boretius, S., Varoqueaux, F., ..., & Brose, N. (2008).
Reduced social interaction and ultrasonic communication in a mouse model of monogenic heritable autism. Proceedings of the National Academy of Sciences of the United States of America, 105(5), 1710-5. [PubMed:18227507] [PMC] [WorldCat] [DOI] - ↑
Varoqueaux, F., Aramuni, G., Rawson, R.L., Mohrmann, R., Missler, M., Gottmann, K., ..., & Brose, N. (2006).
Neuroligins determine synapse maturation and function. Neuron, 51(6), 741-54. [PubMed:16982420] [WorldCat] [DOI] - ↑
Földy, C., Malenka, R.C., & Südhof, T.C. (2013).
Autism-associated neuroligin-3 mutations commonly disrupt tonic endocannabinoid signaling. Neuron, 78(3), 498-509. [PubMed:23583622] [PMC] [WorldCat] [DOI] - ↑
Gogolla, N., Leblanc, J.J., Quast, K.B., Südhof, T.C., Fagiolini, M., & Hensch, T.K. (2009).
Common circuit defect of excitatory-inhibitory balance in mouse models of autism. Journal of neurodevelopmental disorders, 1(2), 172-81. [PubMed:20664807] [PMC] [WorldCat] [DOI] - ↑
Chadman, K.K., Gong, S., Scattoni, M.L., Boltuck, S.E., Gandhy, S.U., Heintz, N., & Crawley, J.N. (2008).
Minimal aberrant behavioral phenotypes of neuroligin-3 R451C knockin mice. Autism research : official journal of the International Society for Autism Research, 1(3), 147-58. [PubMed:19360662] [PMC] [WorldCat] [DOI] - ↑
Etherton, M.R., Tabuchi, K., Sharma, M., Ko, J., & Südhof, T.C. (2011).
An autism-associated point mutation in the neuroligin cytoplasmic tail selectively impairs AMPA receptor-mediated synaptic transmission in hippocampus. The EMBO journal, 30(14), 2908-19. [PubMed:21642956] [PMC] [WorldCat] [DOI] - ↑
Bottos, A., Destro, E., Rissone, A., Graziano, S., Cordara, G., Assenzio, B., ..., & Arese, M. (2009).
The synaptic proteins neurexins and neuroligins are widely expressed in the vascular system and contribute to its functions. Proceedings of the National Academy of Sciences of the United States of America, 106(49), 20782-7. [PubMed:19926856] [PMC] [WorldCat] [DOI] - ↑
Suckow, A.T., Comoletti, D., Waldrop, M.A., Mosedale, M., Egodage, S., Taylor, P., & Chessler, S.D. (2008).
Expression of neurexin, neuroligin, and their cytoplasmic binding partners in the pancreatic beta-cells and the involvement of neuroligin in insulin secretion. Endocrinology, 149(12), 6006-17. [PubMed:18755801] [PMC] [WorldCat] [DOI] - ↑
Suckow, A.T., Zhang, C., Egodage, S., Comoletti, D., Taylor, P., Miller, M.T., ..., & Chessler, S.D. (2012).
Transcellular neuroligin-2 interactions enhance insulin secretion and are integral to pancreatic β cell function. The Journal of biological chemistry, 287(24), 19816-26. [PubMed:22528485] [PMC] [WorldCat] [DOI] - ↑
Jamain, S., Quach, H., Betancur, C., Råstam, M., Colineaux, C., Gillberg, I.C., ..., & Paris Autism Research International Sibpair Study (2003).
Mutations of the X-linked genes encoding neuroligins NLGN3 and NLGN4 are associated with autism. Nature genetics, 34(1), 27-9. [PubMed:12669065] [PMC] [WorldCat] [DOI] - ↑
Yan, J., Oliveira, G., Coutinho, A., Yang, C., Feng, J., Katz, C., ..., & Sommer, S.S. (2005).
Analysis of the neuroligin 3 and 4 genes in autism and other neuropsychiatric patients. Molecular psychiatry, 10(4), 329-32. [PubMed:15622415] [WorldCat] [DOI] - ↑
Zhang, C., Milunsky, J.M., Newton, S., Ko, J., Zhao, G., Maher, T.A., ..., & Südhof, T.C. (2009).
A neuroligin-4 missense mutation associated with autism impairs neuroligin-4 folding and endoplasmic reticulum export. The Journal of neuroscience : the official journal of the Society for Neuroscience, 29(35), 10843-54. [PubMed:19726642] [PMC] [WorldCat] [DOI] - ↑
Jamain, S., Quach, H., Betancur, C., Råstam, M., Colineaux, C., Gillberg, I.C., ..., & Paris Autism Research International Sibpair Study (2003).
Mutations of the X-linked genes encoding neuroligins NLGN3 and NLGN4 are associated with autism. Nature genetics, 34(1), 27-9. [PubMed:12669065] [PMC] [WorldCat] [DOI] - ↑
Sun, C., Cheng, M.C., Qin, R., Liao, D.L., Chen, T.T., Koong, F.J., ..., & Chen, C.H. (2011).
Identification and functional characterization of rare mutations of the neuroligin-2 gene (NLGN2) associated with schizophrenia. Human molecular genetics, 20(15), 3042-51. [PubMed:21551456] [PMC] [WorldCat] [DOI] - ↑
Dinamarca, M.C., Weinstein, D., Monasterio, O., & Inestrosa, N.C. (2011).
The synaptic protein neuroligin-1 interacts with the amyloid β-peptide. Is there a role in Alzheimer's disease? Biochemistry, 50(38), 8127-37. [PubMed:21838267] [WorldCat] [DOI] - ↑
Peixoto, R.T., Kunz, P.A., Kwon, H., Mabb, A.M., Sabatini, B.L., Philpot, B.D., & Ehlers, M.D. (2012).
Transsynaptic signaling by activity-dependent cleavage of neuroligin-1. Neuron, 76(2), 396-409. [PubMed:23083741] [PMC] [WorldCat] [DOI] - ↑
Suzuki, K., Hayashi, Y., Nakahara, S., Kumazaki, H., Prox, J., Horiuchi, K., ..., & Iwatsubo, T. (2012).
Activity-dependent proteolytic cleavage of neuroligin-1. Neuron, 76(2), 410-22. [PubMed:23083742] [WorldCat] [DOI]