「トランスフォーミング増殖因子β」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (同じ利用者による、間の3版が非表示) | |||
| 1行目: | 1行目: | ||
<div align="right"> | <div align="right"> | ||
<font size="+1">[https://researchmap.jp/ | <font size="+1">[https://researchmap.jp/p03164chelsea 中島崇行]</font><br> | ||
''大阪公立大学 大学院獣医学研究科獣医解剖学教室''<br> | ''大阪公立大学 大学院獣医学研究科獣医解剖学教室''<br> | ||
DOI:<selfdoi /> 原稿受付日:2025年3月27日 原稿完成日:2025年4月4日<br> | DOI:<selfdoi /> 原稿受付日:2025年3月27日 原稿完成日:2025年4月4日<br> | ||
| 7行目: | 7行目: | ||
英:Transforming growth factor-β<br> | 英:Transforming growth factor-β<br> | ||
英略語:TGF-β | 英略語:TGF-β | ||
{{box|text= TGF-βは、骨形成因子やアクチビン、インヒビンなどと共にTGF-βスーパーファミリーに属するサイトカインで、発生過程や成体において多様な細胞機能を調節する。哺乳類のTGF-βには、β1、β2、β3の3つのアイソフォームがあり、これらは神経系で異なる発現パターンを示す。TGF-βはN末端シグナルペプチド、潜在関連ペプチド(LAP)、C末端成熟フラグメントの3つのフラグメントからなる前駆体タンパク質として細胞内で産生される。前駆体タンパク質は細胞内でプロセッシングを受けた後、small latent complex (SLC)と呼ばれる二量体複合体となる。この二量体複合体はlatent TGF-β-binding protein (LTBP)と結合してlarge latent complex (LLC)と呼ばれるさらに大きな潜在型複合体となった後、細胞外へ分泌される。TGF-βが生理的作用を発揮するにはLLC内から成熟TGF-βが遊離される必要がある。遊離した成熟型TGF-βが細胞表面にある受容体に結合すると、細胞内シグナルタンパク質であるSMADが活性化する。活性化したSMADは細胞質から核に移行して標的遺伝子の発現を調節する。TGF-βの細胞内シグナル伝達にはSMADの代わりにMAP | {{box|text= TGF-βは、骨形成因子やアクチビン、インヒビンなどと共にTGF-βスーパーファミリーに属するサイトカインで、発生過程や成体において多様な細胞機能を調節する。哺乳類のTGF-βには、β1、β2、β3の3つのアイソフォームがあり、これらは神経系で異なる発現パターンを示す。TGF-βはN末端シグナルペプチド、潜在関連ペプチド(LAP)、C末端成熟フラグメントの3つのフラグメントからなる前駆体タンパク質として細胞内で産生される。前駆体タンパク質は細胞内でプロセッシングを受けた後、small latent complex (SLC)と呼ばれる二量体複合体となる。この二量体複合体はlatent TGF-β-binding protein (LTBP)と結合してlarge latent complex (LLC)と呼ばれるさらに大きな潜在型複合体となった後、細胞外へ分泌される。TGF-βが生理的作用を発揮するにはLLC内から成熟TGF-βが遊離される必要がある。遊離した成熟型TGF-βが細胞表面にある受容体に結合すると、細胞内シグナルタンパク質であるSMADが活性化する。活性化したSMADは細胞質から核に移行して標的遺伝子の発現を調節する。TGF-βの細胞内シグナル伝達にはSMADの代わりにMAP kinaseやNFBを介した経路もある。神経系でのTGF-βは、神経細胞やグリア細胞の機能に影響を与え、細胞増殖や生存に関与する。TGF-βはアルツハイマー病やパーキンソン病などの神経疾患に関連していることが示唆されている。特にTGF-βはパーキンソン病と関連性が深い黒質線条体ドーパミン細胞の生存に寄与していることが示唆されている。}} | ||
== トランスフォーミング増殖因子βとは == | == トランスフォーミング増殖因子βとは == | ||
| 47行目: | 47行目: | ||
==== 非古典的シグナル伝達経路 ==== | ==== 非古典的シグナル伝達経路 ==== | ||
SMAD非依存的シグナル伝達経路である。TGF-βは[[ | SMAD非依存的シグナル伝達経路である。TGF-βは[[extracellular signal-regulated kinase 1]]/[[extracellular signal-regulated kinase 2|2]] ([[Erk1]]/[[Erk2|2]]) 、[[c-Jun N-terminal kinase]] ([[JNK]])、[[p38 MAPK]]を含む[[mitogen-activated protein kinases]] ([[MAPKs]])、[[nuclear factor-kappa B]] ([[NF-κB]])、[[Rho-like GTPases]]、[[phosphatidylinositol-3-kinase]] ([[PI3K]])/[[AKT]]も活性化させる<ref name=Mu2012><pubmed>21701805</pubmed></ref><ref name=Choi2012><pubmed>22835455</pubmed></ref><ref name=Freudlsperger2013><pubmed>22641218</pubmed></ref>。これらのシグナル伝達分子のうち、JNKとp38 MAPKはセリン/スレオニンタンパク質リン酸化酵素である[[TGF-β-activated kinase1]] ([[TAK1]]) 活性の経路によって活性化される。TAK1は[[TAK1-binding protein 2]] ([[TAB2]]) および[[ユビキチンリガーゼ]]である[[tumor necrosis factor receptor associated factor 6]] ([[TRAF6]]) との複合体を形成することでTβRIと結合しているが、TGF-β1の受容体への結合によってTAK1は[[TβRI]]から遊離される。遊離したTAK1はTAB1と相互作用することで自己リン酸化を引き起こし、活性状態となる。活性化したTAK1は[[MKK3]]-p38や[[MKK4]]-JNKカスケードなどの下流のシグナル伝達経路を活性化することで、細胞内にTGF-βの刺激を伝達する<ref name=Choi2012></ref>。 | ||
このように、TAK1の活性を起点とするMAPKs経路の活性化はSMAD依存経路とは異なり、TGF-β受容体であるTβRIキナーゼ活性に依存せずに生じる。TGF-βによるTAK1の活性は[[IκB kinase]] ([[IKK]])を介してNF-κBシグナル伝達を活性化し、IκBαのリン酸化、NF-κBサブユニット[[p65]]の核移行およびリン酸化、ならびにNF-κB下流標的の活性化をもたらす<ref name=Freudlsperger2013><pubmed>22641218</pubmed></ref>。 | このように、TAK1の活性を起点とするMAPKs経路の活性化はSMAD依存経路とは異なり、TGF-β受容体であるTβRIキナーゼ活性に依存せずに生じる。TGF-βによるTAK1の活性は[[IκB kinase]] ([[IKK]])を介してNF-κBシグナル伝達を活性化し、IκBαのリン酸化、NF-κBサブユニット[[p65]]の核移行およびリン酸化、ならびにNF-κB下流標的の活性化をもたらす<ref name=Freudlsperger2013><pubmed>22641218</pubmed></ref>。 | ||
2025年4月8日 (火) 00:47時点における版
中島崇行
大阪公立大学 大学院獣医学研究科獣医解剖学教室
DOI:10.14931/bsd.10959 原稿受付日:2025年3月27日 原稿完成日:2025年4月4日
担当編集委員:山形 方人(ハーバード大学・脳科学センター)
英:Transforming growth factor-β
英略語:TGF-β
TGF-βは、骨形成因子やアクチビン、インヒビンなどと共にTGF-βスーパーファミリーに属するサイトカインで、発生過程や成体において多様な細胞機能を調節する。哺乳類のTGF-βには、β1、β2、β3の3つのアイソフォームがあり、これらは神経系で異なる発現パターンを示す。TGF-βはN末端シグナルペプチド、潜在関連ペプチド(LAP)、C末端成熟フラグメントの3つのフラグメントからなる前駆体タンパク質として細胞内で産生される。前駆体タンパク質は細胞内でプロセッシングを受けた後、small latent complex (SLC)と呼ばれる二量体複合体となる。この二量体複合体はlatent TGF-β-binding protein (LTBP)と結合してlarge latent complex (LLC)と呼ばれるさらに大きな潜在型複合体となった後、細胞外へ分泌される。TGF-βが生理的作用を発揮するにはLLC内から成熟TGF-βが遊離される必要がある。遊離した成熟型TGF-βが細胞表面にある受容体に結合すると、細胞内シグナルタンパク質であるSMADが活性化する。活性化したSMADは細胞質から核に移行して標的遺伝子の発現を調節する。TGF-βの細胞内シグナル伝達にはSMADの代わりにMAP kinaseやNFBを介した経路もある。神経系でのTGF-βは、神経細胞やグリア細胞の機能に影響を与え、細胞増殖や生存に関与する。TGF-βはアルツハイマー病やパーキンソン病などの神経疾患に関連していることが示唆されている。特にTGF-βはパーキンソン病と関連性が深い黒質線条体ドーパミン細胞の生存に寄与していることが示唆されている。
トランスフォーミング増殖因子βとは
トランスフォーミング増殖因子β (transforming growth factor β; TGF-β) は骨形成因子、抗ミュラー管ホルモン、アクチビン、インヒビンとともにTGF-βスーパーファミリータンパク質に含まれるサイトカインで、発生過程および成体において様々な細胞機能の調節を行っている[1]。異なるTGF-βスーパーファミリーのメンバーは機能が重複している場合もあるが、互いの機能を拮抗させたりすることもある。ここでは哺乳類のTGF-βについて述べる。
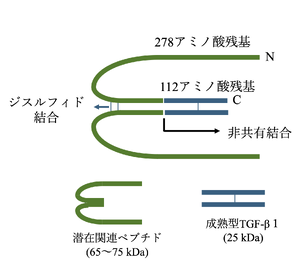
構造
TGF-βは前駆体タンパク質(プレプロタンパク質)として細胞内で産生される(図1)[2][3][4]。前駆体タンパク質は、N末端シグナルペプチド、潜在関連ペプチド(latency-associated peptide: LAP)、C末端成熟フラグメントの3つのフラグメントで構成されている。小胞体内腔で前駆体タンパク質からシグナルペプチドが切断された後、残りの前駆体タンパク質(プロタンパク質)はジスルフィド結合を介して二量体化し、ゴルジ装置に移行する。ゴルジ装置ではプロテアーゼであるフーリン(furin)によって成熟型(活性型)TGF-βと潜伏関連ペプチドの2つの部位に分解される。成熟TGF-βとLAPのそれぞれの二量体は非共有結合で相互作用し、small latent complex (SLC)と呼ばれる潜在型複合体となるが、このSLCは潜在型TGF-β結合タンパク質(latent TGFβ binding protein; LTBP)との結合によってlarge latent complex (LLC)と呼ばれるさらに大きな潜在型複合体となる。LLCはその後、細胞外マトリックスへ分泌される[4][5]。
実際に様々な生理学的作用を発揮するのはこの成熟TGF-βであり、TGF-βが生理的作用を発揮するにはLLC内のSLCから成熟型TGF-βが遊離される必要がある。LLCから分離した成熟TGF-βはC末端部分からの25kDaの二量体で、LAPはN末端領域からの65~75kDaの二量体である[4]。アシドーシスやタンパク質分解による切断など、LLCから成熟型TGF-βを遊離するメカニズム方法はin vitroの実験によっていくつか提唱されているが[4]、生体内での正確なメカニズムプロセスについては不明な点が多く残されている。
サブファミリー
哺乳類のTGF-βにはTGF-β1、-β2、-β3の3つのアイソフォームがある[6][7][8][9][10][11]。各アイソフォームは別々の遺伝子の産物である。TGF-β1および-β3前駆体はそれぞれ、390と412個のアミノ酸からなる。一方で、TGF-β2前駆体にはアイソフォーム1と2の2つのアイソフォームが存在し、それぞれ414個と442個のアミノ酸からなる。一般に、これらのTGF-βはそれぞれβ1、β2、β3サブユニットの二量体からなる。
神経系における発現
ラット、マウス、ヒトの中枢神経系におけるTGF-βの局在およびその遺伝子発現パターンは免疫染色あるいはin situ hybridizationを用いた研究によって調べられている。TGF-βの局在およびその遺伝子発現パターンには若干の動物種差がある。ここでは成体ラット脳組織切片を用いて調べられたTGF-βの局在およびその遺伝子発現パターンについて紹介する[12][13][14]。免疫組織化学によって検出されるTGF-β免疫性反応とin situハイブリダイゼーションで検出されるTGF-β mRNAシグナルの分布パターンは必ずしも一致していない。
TGF-β1免疫反応性は海馬の錐体細胞、髄膜、脈絡叢で検出されている。TGF-β2および -β3免疫反応性は大脳皮質、海馬、視床、視床下部、中脳、脊髄など様々な領域の神経細胞および白質内のアストロサイトで検出されている。
TGF-β1 mRNAに対する強いシグナルは大脳皮質、海馬、扁桃体中心核、内側視索前野、視床下部室傍核、黒質、脳幹網様体などで検出されている。TGF-β2 mRNAの強いシグナルは深部皮質層、歯状回、正中線視床核、後視床下部および乳頭体、上オリーブ核、モノアミン作動性ニューロンの領域、三叉神経脊髄路核、背側迷走神経複合体、小脳、および脈絡叢で検出されている。TGF-β3 mRNAの強いシグナルは大脳皮質、海馬、扁桃体基底核、外側中隔核、いくつかの視床核、弓状核および乳頭体上核、上丘、上オリーブ核、脳幹網様体、最後野、および下オリーブ核で検出されている。
グリア細胞におけるTGF-βの発現については培養細胞を用いたin vitroの研究でも報告されている。培養アストロサイトではTGF-β1、-β2、-β3 mRNAが検出されており、TGF-β1および-β2についてはタンパク質レベルでもその発現が確認されている[15]。培養ミクログリアでは、TGF-β1、-β2、-β3に対する免疫陽性反応が検出されているとともに、TGF-β1 mRNAが産生されていることも報告されている[16]。TGF-β1mRNAの産生は培養アストロサイトと培養オリゴデンドロサイトでも報告されている[17]。
機能
シグナル伝達
TGF-βシグナルの細胞内伝達様式は古典的伝達経路と非古典的伝達経路に分けられる。神経系におけるTGF-βシグナルの古典的伝達経路の活性とその機能についてはよく調べられている。一方で、非古典的伝達経路が神経系を構成する各細胞で機能しているかについては不明な点が多い。
古典的シグナル伝達経路
細胞内シグナル分子であるSMADタンパク質を介したシグナル伝達経路で、最終的に遺伝子の新規発現につながる[17][18]。
哺乳類ではSMADは8種類あることが知られている。これらのSMADはreceptor-regulated SMAD (R-SMAD)、common-regulated SMAD (Co-SMAD)、inhibitory SMAD (I-SMAD)の3タイプに分けられる。
R-SMADはTGF-β受容体によるリン酸化を受けるSMADであり、このタイプにはSMAD1、2、3、5あるいは8(9とも呼ばれる)が含まれる。TGF-βの受容体はセリン/スレオニンタンパク質リン酸化酵素ファミリーの受容体に属するI型受容体とII型受容体のサブユニットで構成されている。I型およびII型受容体はそれぞれ二量体を形成する。TGF-βがII型の受容体に結合すると、I型受容体と会合して四量体を形成し、II型受容体がI型受容体のセリン残基をリン酸化することでI型受容体が活性化し、R-SMADのリン酸化を引き起こす。
TGF-βスーパーファミリータンパク質の受容体として、7種類のI型受容体と5種類のII型受容体がこれまでに同定されているが、そのうち、TGF-βRI/アクチビン様キナーゼ受容体5 (ALK5)とアクチビン様キナーゼ受容体1 (ALK1)がI型受容体として、TβRIIがII型受容体としてそれぞれ機能している。神経系におけるほとんどの細胞では、TGF-βはALK5を介してシグナルを細胞内に伝達するが、ニューロンでは、ALK1を介してシグナルを細胞内に伝達することもある。Co-SMADはリン酸化されたR-SMADと複合体を形成し、R-SMADとともに核内に移行して転写制御因子として働く。SMAD4はCo-SMADに分類される。また、I-SMADはR-SMADのI型受容体やCo-SMADへの結合の阻害やI型受容体のダウンレギュレーションなどを介してTGF-βシグナルの伝達を阻害する役割を持つ。I-SMADにはSMAD6とSMAD7が含まれる。
一般に、核内に移行したR-SMADとCo-SMADの複合体はSMAD binding elements (SBEs)と呼ばれる遺伝子DNA上の塩基配列(5'-AGAC-3')に結合して、その下流に位置する遺伝子のmRNAへの転写を促進する。
非古典的シグナル伝達経路
SMAD非依存的シグナル伝達経路である。TGF-βはextracellular signal-regulated kinase 1/2 (Erk1/2) 、c-Jun N-terminal kinase (JNK)、p38 MAPKを含むmitogen-activated protein kinases (MAPKs)、nuclear factor-kappa B (NF-κB)、Rho-like GTPases、phosphatidylinositol-3-kinase (PI3K)/AKTも活性化させる[19][20][21]。これらのシグナル伝達分子のうち、JNKとp38 MAPKはセリン/スレオニンタンパク質リン酸化酵素であるTGF-β-activated kinase1 (TAK1) 活性の経路によって活性化される。TAK1はTAK1-binding protein 2 (TAB2) およびユビキチンリガーゼであるtumor necrosis factor receptor associated factor 6 (TRAF6) との複合体を形成することでTβRIと結合しているが、TGF-β1の受容体への結合によってTAK1はTβRIから遊離される。遊離したTAK1はTAB1と相互作用することで自己リン酸化を引き起こし、活性状態となる。活性化したTAK1はMKK3-p38やMKK4-JNKカスケードなどの下流のシグナル伝達経路を活性化することで、細胞内にTGF-βの刺激を伝達する[20]。
このように、TAK1の活性を起点とするMAPKs経路の活性化はSMAD依存経路とは異なり、TGF-β受容体であるTβRIキナーゼ活性に依存せずに生じる。TGF-βによるTAK1の活性はIκB kinase (IKK)を介してNF-κBシグナル伝達を活性化し、IκBαのリン酸化、NF-κBサブユニットp65の核移行およびリン酸化、ならびにNF-κB下流標的の活性化をもたらす[21]。
神経細胞での機能
TGF-βの神経細胞における細胞増殖/細胞生存への影響がいくつかの研究グループによって評価されている。ウズラ神経堤細胞を用いたin vitro実験では、TGF-βは神経堤細胞の増殖を阻害する一方で、神経新生を著しく増加することが報告されている[22]。発達中のマウスの海馬および大脳皮質由来の初代培養神経細胞を用いた研究では、TGF-βは神経前駆細胞に対して増殖抑制効果を発揮することが報告されている[23]。また、ニワトリ胚由来培養運動ニューロンを用いた研究では、TGF-βは塩基性線維芽細胞増殖因子と相乗的に作用して運動ニューロンの生存を助けることが報告されている[24]。
グリア細胞での機能
In vitroの研究によって、グリア細胞の細胞増殖、細胞生存、貪食能、遺伝子発現を含む様々な細胞機能に対するTGF-βの影響が報告されている。
アストロサイトおよびミクログリアの細胞増殖能
TGF-βのアストロサイト増殖能への影響についていくつかの研究グループによって評価されているが、その効果についての見解は研究グループ間で異なっている。LindholmらはTGF-β1は大脳皮質由来の培養アストロサイトに対して増殖抑制効果を発揮することを報告している[25]。一方、JohnsらはTGF-β1は脳幹由来のアストロサイトに対して増殖促進効果を示すが、前脳由来のアストロサイトの増殖には影響を及ぼさないことを報告している[26]。研究グループ間のTGF-β1のアストロサイト増殖能への影響の違いは培養条件などが考えられるが、詳細については不明である。
TGF-β1はミクログリア増殖能にも影響する。TGF-β1はGM-CSFおよびM-CSFおよび特異的抗原活性化によって誘導されるミクログリアの増殖を阻害する [27][28]。
ミクログリアおよびオリゴデンドロサイトの細胞生存/細胞死
TGF-β1のミクログリアの細胞生存/細胞死への効果に対する見解は研究グループ間で異なっている。MitchellらはTGF-β1がミクログリアの細胞死を誘導することを報告している[29]。これに対して、SalimiらはTGF-β1は無血清培地下でミクログリアの生存を維持することを報告している[30]。
TGF-β1はオリゴデンドロサイトに対して細胞死を誘導することも報告されている[31]。
アストロサイトおよびミクログリアの遺伝子発現
TGF-β1はアストロサイトでのGFAP、ラミニン、フィブロネクチン、I型コラーゲンの発現レベルを上昇させる[32]。また、TGF-β1はミクログリアにおいてKlf10、インテグリンβ5、セルピン、Smurf、フィブロネクチン、フーリン、マトリックスメタロペプチダーゼ、トロンボスポンジンなどの遺伝子発現レベルを上昇させる[33]。TGF-βは培養アストロサイトおよびミクログリアにおけるTNF-αやIL-1β、誘導型一酸化窒素合成酵素 (iNOS)などの炎症誘導性メディエーターの産生調節因子として機能することが示されている。
アストロサイトでは、TGF-βはインターフェロンγ (IFN-γ)/リポポリサッカライド (LPS)、IFN-γ/IL-1βおよびTNF-αによって誘導されるTNF-α発現を抑制する一方で、IFN-γ/LPSによって誘導されるiNOS発現を促進する[34][35]。一方、ミクログリアでは、TGF-βはLPSによって誘導されるiNOS、IL-1βおよびTNF-α発現を抑制する[36]。
ミクログリアの貪食能
TGF-βはミクログリアのlatex beads貪食能を低下させるとの研究結果が報告されている[37]。
神経内分泌機構
視索前組織の組織片をTGF-β1とともに培養すると、個々のニューロンにおけるGnRH mRNA発現が用量依存的に有意に減少する。また、このTGF-β1誘導性のGnRH mRNA発現レベル減少は可溶性TGF-β受容体IIを培養培地に添加することで阻害される[38]。若いマウスの視交叉上核と室傍核では、TGF-βとSMAD3の発現の日内パターンが見られる[39]。
疾患との関わり
アルツハイマー病
アルツハイマー病患者やモデルマウスの脳では、TGF-β1やTGF-β2の発現レベルが上昇している [40][41][42]。しかしながら、TGF-β発現レベル上昇のメカニズムは完全には理解されていない。一方で、TGF-βタイプII受容体がアルツハイマー病患者の脳のニューロンで減少していることが報告されている [43]。そのため、アルツハイマー病患者脳でのTGF-β発現レベル上昇はTGF-βシグナル減衰の代償メカニズムである可能性が考えられている。
パーキンソン病
パーキンソン病では線条体に投射する黒質線条体ドーパミン細胞が喪失する。TGF-βは胎仔ラット中脳由来のチロシン水酸化酵素(TH)免疫反応性ドーパミン作動性ニューロンのin vitro生存を促進する[44]。また、胎仔ラット由来中脳細胞をTGF-βで処理すると、24時間以内にTH陽性ドーパミン作動性ニューロンの数が大幅に増加する。このTGF-β誘導性のTH陽性ドーパミン作動性ニューロン数増加はTGF-β中和抗体の添加によって完全に消失する[45]。
関連語
参考文献
- ↑
Burt, D.W., & Law, A.S. (1994).
Evolution of the transforming growth factor-beta superfamily. Progress in growth factor research, 5(1), 99-118. [PubMed:8199356] [WorldCat] [DOI] - ↑
Blanchette, F., Day, R., Dong, W., Laprise, M.H., & Dubois, C.M. (1997).
TGFbeta1 regulates gene expression of its own converting enzyme furin. The Journal of clinical investigation, 99(8), 1974-83. [PubMed:9109442] [PMC] [WorldCat] [DOI] - ↑
Dubois, C.M., Laprise, M.H., Blanchette, F., Gentry, L.E., & Leduc, R. (1995).
Processing of transforming growth factor beta 1 precursor by human furin convertase. The Journal of biological chemistry, 270(18), 10618-24. [PubMed:7737999] [WorldCat] [DOI] - ↑ 4.0 4.1 4.2 4.3
Khalil, N. (1999).
TGF-beta: from latent to active. Microbes and infection, 1(15), 1255-63. [PubMed:10611753] [WorldCat] [DOI] - ↑
Saharinen, J., Taipale, J., & Keski-Oja, J. (1996).
Association of the small latent transforming growth factor-beta with an eight cysteine repeat of its binding protein LTBP-1. The EMBO journal, 15(2), 245-53. [PubMed:8617200] [PMC] [WorldCat] - ↑
Gentry, L.E., & Nash, B.W. (1990).
The pro domain of pre-pro-transforming growth factor beta 1 when independently expressed is a functional binding protein for the mature growth factor. Biochemistry, 29(29), 6851-7. [PubMed:2397217] [WorldCat] [DOI] - ↑
Schlunegger, M.P., & Grütter, M.G. (1992).
An unusual feature revealed by the crystal structure at 2.2 A resolution of human transforming growth factor-beta 2. Nature, 358(6385), 430-4. [PubMed:1641027] [WorldCat] [DOI] - ↑
ten Dijke, P., Iwata, K.K., Thorikay, M., Schwedes, J., Stewart, A., & Pieler, C. (1990).
Molecular characterization of transforming growth factor type beta 3. Annals of the New York Academy of Sciences, 593, 26-42. [PubMed:2375596] [WorldCat] [DOI] - ↑
Derynck, R., Jarrett, J.A., Chen, E.Y., Eaton, D.H., Bell, J.R., Assoian, R.K., ..., & Goeddel, D.V. (1985).
Human transforming growth factor-beta complementary DNA sequence and expression in normal and transformed cells. Nature, 316(6030), 701-5. [PubMed:3861940] [WorldCat] [DOI] - ↑
Clark, D.A., & Coker, R. (1998).
Transforming growth factor-beta (TGF-beta). The international journal of biochemistry & cell biology, 30(3), 293-8. [PubMed:9611771] [WorldCat] [DOI] - ↑
Wang, M.Y., Liu, W.J., Wu, L.Y., Wang, G., Zhang, C.L., & Liu, J. (2023).
The Research Progress in Transforming Growth Factor-β2. Cells, 12(23). [PubMed:38067167] [PMC] [WorldCat] [DOI] - ↑
Knuckey, N.W., Finch, P., Palm, D.E., Primiano, M.J., Johanson, C.E., Flanders, K.C., & Thompson, N.L. (1996).
Differential neuronal and astrocytic expression of transforming growth factor beta isoforms in rat hippocampus following transient forebrain ischemia. Brain research. Molecular brain research, 40(1), 1-14. [PubMed:8840007] [WorldCat] [DOI] - ↑
Unsicker, K., Flanders, K.C., Cissel, D.S., Lafyatis, R., & Sporn, M.B. (1991).
Transforming growth factor beta isoforms in the adult rat central and peripheral nervous system. Neuroscience, 44(3), 613-25. [PubMed:1754055] [WorldCat] [DOI] - ↑
Vincze, C., Pál, G., Wappler, E.A., Szabó, E.R., Nagy, Z.G., Lovas, G., & Dobolyi, A. (2010).
Distribution of mRNAs encoding transforming growth factors-beta1, -2, and -3 in the intact rat brain and after experimentally induced focal ischemia. The Journal of comparative neurology, 518(18), 3752-70. [PubMed:20653032] [WorldCat] [DOI] - ↑
Flanders, K.C., Lüdecke, G., Renzing, J., Hamm, C., Cissel, D.S., & Unsicker, K. (1993).
Effects of TGF-betas and bFGF on Astroglial Cell Growth and Gene Expression in Vitro. Molecular and cellular neurosciences, 4(5), 406-17. [PubMed:19912947] [WorldCat] [DOI] - ↑
da Cunha, A., Jefferson, J.A., Jackson, R.W., & Vitković, L. (1993).
Glial cell-specific mechanisms of TGF-beta 1 induction by IL-1 in cerebral cortex. Journal of neuroimmunology, 42(1), 71-85. [PubMed:8423208] [WorldCat] [DOI] - ↑ 17.0 17.1
Derynck, R., & Zhang, Y.E. (2003).
Smad-dependent and Smad-independent pathways in TGF-beta family signalling. Nature, 425(6958), 577-84. [PubMed:14534577] [WorldCat] [DOI] - ↑
König, H.G., Kögel, D., Rami, A., & Prehn, J.H. (2005).
TGF-{beta}1 activates two distinct type I receptors in neurons: implications for neuronal NF-{kappa}B signaling. The Journal of cell biology, 168(7), 1077-86. [PubMed:15781474] [PMC] [WorldCat] [DOI] - ↑
Mu, Y., Gudey, S.K., & Landström, M. (2012).
Non-Smad signaling pathways. Cell and tissue research, 347(1), 11-20. [PubMed:21701805] [WorldCat] [DOI] - ↑ 20.0 20.1
Choi, M.E., Ding, Y., & Kim, S.I. (2012).
TGF-β signaling via TAK1 pathway: role in kidney fibrosis. Seminars in nephrology, 32(3), 244-52. [PubMed:22835455] [PMC] [WorldCat] [DOI] - ↑ 21.0 21.1
Freudlsperger, C., Bian, Y., Contag Wise, S., Burnett, J., Coupar, J., Yang, X., ..., & Van Waes, C. (2013).
TGF-β and NF-κB signal pathway cross-talk is mediated through TAK1 and SMAD7 in a subset of head and neck cancers. Oncogene, 32(12), 1549-59. [PubMed:22641218] [PMC] [WorldCat] [DOI] - ↑
Zhang, J.M., Hoffmann, R., & Sieber-Blum, M. (1997).
Mitogenic and anti-proliferative signals for neural crest cells and the neurogenic action of TGF-beta1. Developmental dynamics : an official publication of the American Association of Anatomists, 208(3), 375-86. [PubMed:9056641] [WorldCat] [DOI] - ↑
Vogel, T., Ahrens, S., Büttner, N., & Krieglstein, K. (2010).
Transforming growth factor beta promotes neuronal cell fate of mouse cortical and hippocampal progenitors in vitro and in vivo: identification of Nedd9 as an essential signaling component. Cerebral cortex (New York, N.Y. : 1991), 20(3), 661-71. [PubMed:19587023] [PMC] [WorldCat] [DOI] - ↑
Gouin, A., Bloch-Gallego, E., Tanaka, H., Rosenthal, A., & Henderson, C.E. (1996).
Transforming growth factor-beta 3, glial cell line-derived neurotrophic factor, and fibroblast growth factor-2, act in different manners to promote motoneuron survival in vitro. Journal of neuroscience research, 43(4), 454-64. [PubMed:8699531] [WorldCat] [DOI] - ↑
Lindholm, D., Castrén, E., Kiefer, R., Zafra, F., & Thoenen, H. (1992).
Transforming growth factor-beta 1 in the rat brain: increase after injury and inhibition of astrocyte proliferation. The Journal of cell biology, 117(2), 395-400. [PubMed:1560032] [PMC] [WorldCat] [DOI] - ↑
Johns, L.D., Babcock, G., Green, D., Freedman, M., Sriram, S., & Ransohoff, R.M. (1992).
Transforming growth factor-beta 1 differentially regulates proliferation and MHC class-II antigen expression in forebrain and brainstem astrocyte primary cultures. Brain research, 585(1-2), 229-36. [PubMed:1511306] [WorldCat] [DOI] - ↑
Suzumura, A., Marunouchi, T., & Yamamoto, H. (1991).
Morphological transformation of microglia in vitro. Brain research, 545(1-2), 301-6. [PubMed:1907214] [WorldCat] [DOI] - ↑
Xiao, B.G., Zhang, G.X., Ma, C.G., & Link, H. (1996).
Transforming growth factor-beta 1 (TGF-beta1)-mediated inhibition of glial cell proliferation and down-regulation of intercellular adhesion molecule-1 (ICAM-1) are interrupted by interferon-gamma (IFN-gamma). Clinical and experimental immunology, 103(3), 475-81. [PubMed:8608649] [PMC] [WorldCat] [DOI] - ↑
Mitchell, K., Shah, J.P., Tsytsikova, L.V., Campbell, A.M., Affram, K., & Symes, A.J. (2014).
LPS antagonism of TGF-β signaling results in prolonged survival and activation of rat primary microglia. Journal of neurochemistry, 129(1), 155-68. [PubMed:24251648] [WorldCat] [DOI] - ↑
Salimi, K., Moser, K.V., Marksteiner, J., Reindl, M., & Humpel, C. (2003).
GDNF and TGF-beta1 promote cell survival in serum-free cultures of primary rat microglia. Cell and tissue research, 312(1), 135-9. [PubMed:12712323] [WorldCat] [DOI] - ↑
Schulz, R., Vogel, T., Dressel, R., & Krieglstein, K. (2008).
TGF-beta superfamily members, ActivinA and TGF-beta1, induce apoptosis in oligodendrocytes by different pathways. Cell and tissue research, 334(3), 327-38. [PubMed:19002501] [WorldCat] [DOI] - ↑
Baghdassarian, D., Toru-Delbauffe, D., Gavaret, J.M., & Pierre, M. (1993).
Effects of transforming growth factor-beta 1 on the extracellular matrix and cytoskeleton of cultured astrocytes. Glia, 7(3), 193-202. [PubMed:8454306] [WorldCat] [DOI] - ↑
Spittau, B., Wullkopf, L., Zhou, X., Rilka, J., Pfeifer, D., & Krieglstein, K. (2013).
Endogenous transforming growth factor-beta promotes quiescence of primary microglia in vitro. Glia, 61(2), 287-300. [PubMed:23065670] [WorldCat] [DOI] - ↑
Benveniste, E.N., Kwon, J., Chung, W.J., Sampson, J., Pandya, K., & Tang, L.P. (1994).
Differential modulation of astrocyte cytokine gene expression by TGF-beta. Journal of immunology (Baltimore, Md. : 1950), 153(11), 5210-21. [PubMed:7963576] [WorldCat] - ↑
Hamby, M.E., Hewett, J.A., & Hewett, S.J. (2006).
TGF-beta1 potentiates astrocytic nitric oxide production by expanding the population of astrocytes that express NOS-2. Glia, 54(6), 566-77. [PubMed:16921522] [WorldCat] [DOI] - ↑
Islam, A., Choudhury, M.E., Kigami, Y., Utsunomiya, R., Matsumoto, S., Watanabe, H., ..., & Tanaka, J. (2018).
Sustained anti-inflammatory effects of TGF-β1 on microglia/macrophages. Biochimica et biophysica acta. Molecular basis of disease, 1864(3), 721-734. [PubMed:29269050] [WorldCat] [DOI] - ↑
von Zahn, J., Möller, T., Kettenmann, H., & Nolte, C. (1997).
Microglial phagocytosis is modulated by pro- and anti-inflammatory cytokines. Neuroreport, 8(18), 3851-6. [PubMed:9462454] [WorldCat] [DOI] - ↑
Bouret, S., De Seranno, S., Beauvillain, J.C., & Prevot, V. (2004).
Transforming growth factor beta1 may directly influence gonadotropin-releasing hormone gene expression in the rat hypothalamus. Endocrinology, 145(4), 1794-801. [PubMed:14670985] [WorldCat] [DOI] - ↑
Beynon, A.L., Thome, J., & Coogan, A.N. (2009).
Age and time of day influences on the expression of transforming growth factor-beta and phosphorylated SMAD3 in the mouse suprachiasmatic and paraventricular nuclei. Neuroimmunomodulation, 16(6), 392-9. [PubMed:19609088] [WorldCat] [DOI] - ↑
Lippa, C.F., Smith, T.W., & Flanders, K.C. (1995).
Transforming growth factor-beta: neuronal and glial expression in CNS degenerative diseases. Neurodegeneration : a journal for neurodegenerative disorders, neuroprotection, and neuroregeneration, 4(4), 425-32. [PubMed:8846236] [WorldCat] [DOI] - ↑
Morimoto, K., Horio, J., Satoh, H., Sue, L., Beach, T., Arita, S., ..., & Konishi, Y. (2011).
Expression profiles of cytokines in the brains of Alzheimer's disease (AD) patients compared to the brains of non-demented patients with and without increasing AD pathology. Journal of Alzheimer's disease : JAD, 25(1), 59-76. [PubMed:21368376] [PMC] [WorldCat] [DOI] - ↑
Wirths, O., Breyhan, H., Marcello, A., Cotel, M.C., Brück, W., & Bayer, T.A. (2010).
Inflammatory changes are tightly associated with neurodegeneration in the brain and spinal cord of the APP/PS1KI mouse model of Alzheimer's disease. Neurobiology of aging, 31(5), 747-57. [PubMed:18657882] [WorldCat] [DOI] - ↑
Tesseur, I., Zou, K., Esposito, L., Bard, F., Berber, E., Can, J.V., ..., & Wyss-Coray, T. (2006).
Deficiency in neuronal TGF-beta signaling promotes neurodegeneration and Alzheimer's pathology. The Journal of clinical investigation, 116(11), 3060-9. [PubMed:17080199] [PMC] [WorldCat] [DOI] - ↑
Krieglstein, K., & Unsicker, K. (1994).
Transforming growth factor-beta promotes survival of midbrain dopaminergic neurons and protects them against N-methyl-4-phenylpyridinium ion toxicity. Neuroscience, 63(4), 1189-96. [PubMed:7700516] [WorldCat] [DOI] - ↑
Farkas, L.M., Dünker, N., Roussa, E., Unsicker, K., & Krieglstein, K. (2003).
Transforming growth factor-beta(s) are essential for the development of midbrain dopaminergic neurons in vitro and in vivo. The Journal of neuroscience : the official journal of the Society for Neuroscience, 23(12), 5178-86. [PubMed:12832542] [PMC] [WorldCat] [DOI]