「ヒアルロン酸」の版間の差分
細編集の要約なし |
|||
| 13行目: | 13行目: | ||
== 構造 == | == 構造 == | ||
[[ファイル:Oohashi Hyalronic acid Fig1.jpg|サムネイル|400px|'''図1. ヒアルロン酸とヒアルロン酸合成酵素'''<br>文献<ref name=Kobayashi2020 />9より改変]] | [[ファイル:Oohashi Hyalronic acid Fig1.jpg|サムネイル|400px|'''図1. ヒアルロン酸とヒアルロン酸合成酵素'''<br>文献<ref name=Kobayashi2020 />9より改変]] | ||
ヒアルロン酸は、[[w:Karl Meyer (biochemist)|カール・マイヤー]]とジョン・パルマーによって1934年に牛の[[硝子体]]から発見された。[[N-アセチルグルコサミン]](GlcNAc)と[[グルクロン酸]](GlcA)の繰り返し単位から構成されており、これらの単位は交互にβ-1,3とβ-1,4結合で連結されている('''図1A''')。この2糖繰り返しのポリマーは、分子量が非常に高く、10<sup>5</sup>から10<sup>7</sup>Daの範囲である | ヒアルロン酸は、[[w:Karl Meyer (biochemist)|カール・マイヤー]]とジョン・パルマーによって1934年に牛の[[硝子体]]から発見された。[[N-アセチルグルコサミン]](GlcNAc)と[[グルクロン酸]](GlcA)の繰り返し単位から構成されており、これらの単位は交互にβ-1,3とβ-1,4結合で連結されている('''図1A''')。この2糖繰り返しのポリマーは、分子量が非常に高く、10<sup>5</sup>から10<sup>7</sup>Daの範囲である<ref name=Itano2008><pubmed>18390876</pubmed></ref>。 | ||
== 発現 == | == 発現 == | ||
[[脊椎動物]]のほとんどの支持組織の[[細胞外マトリックス]]の主要な構成成分として、細胞の構造的枠組みを提供している。脳細胞外マトリックスは、[[神経細胞]]と[[グリア細胞]]によって分泌される[[グリコサミノグリカン]]、[[プロテオグリカン]]、および[[グリコプロテイン]]からなるネットワークである。それらの中でもヒアルロン酸と[[ヒアルロン酸結合コンドロイチン硫酸プロテオグリカン]]([[レクティカンファミリー]])は重要な成分である。 | [[脊椎動物]]のほとんどの支持組織の[[細胞外マトリックス]]の主要な構成成分として、細胞の構造的枠組みを提供している。脳細胞外マトリックスは、[[神経細胞]]と[[グリア細胞]]によって分泌される[[グリコサミノグリカン]]、[[プロテオグリカン]]、および[[グリコプロテイン]]からなるネットワークである。それらの中でもヒアルロン酸と[[ヒアルロン酸結合コンドロイチン硫酸プロテオグリカン]]([[レクティカンファミリー]])は重要な成分である。 | ||
脳ではヒアルロン酸は、[[拡散型細胞外マトリックス]]と[[凝縮型細胞外マトリックス]]という2つの異なるタイプの細胞外マトリックスを形成する<ref name=Deepa2006><pubmed>16644727</pubmed></ref><ref name=Takechi2020><pubmed>32623025</pubmed></ref> | 脳ではヒアルロン酸は、[[拡散型細胞外マトリックス]]と[[凝縮型細胞外マトリックス]]という2つの異なるタイプの細胞外マトリックスを形成する<ref name=Deepa2006><pubmed>16644727</pubmed></ref><ref name=Takechi2020><pubmed>32623025</pubmed></ref>。拡散型細胞外マトリックスは、脳実質全体に見られる生理食塩水および[[界面活性剤]]に可溶性の緩い構造で構成されている。凝縮型細胞外マトリックスは凝集体を形成し、[[尿素]]による変性後にのみ組織から抽出可能である。[[パルブアルブミン]]ニューロンなどのニューロンの亜集団を取り囲む[[ペリニューロナルネット]]は、凝縮型細胞外マトリックスの代表的な例である<ref name=Fawcett2019><pubmed>31263252</pubmed></ref>。 | ||
==合成酵素== | ==合成酵素== | ||
最初の哺乳類[[ヒアルロン酸合成酵素]](HAS)遺伝子は、機能的発現クローニングによりItanoらにより同定され、 [[ヒアルロン酸合成酵素1]] ([[HAS1]])と命名された | 最初の哺乳類[[ヒアルロン酸合成酵素]](HAS)遺伝子は、機能的発現クローニングによりItanoらにより同定され、 [[ヒアルロン酸合成酵素1]] ([[HAS1]])と命名された<ref name=Itano1996><pubmed>8626618</pubmed></ref>。ヒアルロン酸の産生に欠陥のあるマウス乳がん細胞にヒアルロン酸合成酵素1 cDNAを導入することによりヒアルロン酸の合成とマトリックス形成を誘導した。さらに別グループにより[[ヒアルロン酸合成酵素2]] ([[HAS2]])と[[ヒアルロン酸合成酵素3]] ([[HAS3]])が、[[縮重RT-PCR]]法を用いて同定された<ref name=Watanabe1996><pubmed>8798477</pubmed></ref><ref name=Spicer1996><pubmed>8798545</pubmed></ref>。3つの遺伝子の構造は、[[哺乳類]]種間で進化的によく保存されている<ref name=Spicer1998><pubmed>9442026</pubmed></ref>。哺乳類のヒアルロン酸合成酵素には、7つの推定膜貫通領域が含まれており、そのうち2つはN末端側に、5つはC末端側に位置している('''図1B''')<ref name=Itano2002><pubmed>12512858</pubmed></ref>。大きな細胞質ループには、推定される[[糖転移酵素]]の触媒部位と[[UDP]]結合モチーフが含まれている。マウスヒアルロン酸合成酵素1タンパク質の細胞質ループにおけるアミノ酸のサイト特異的突然変異法により、糖転移酵素活性に責任を有するドメイン構造と[[アミノ酸]]残基が同定された<ref name=Yoshida2000><pubmed>10617644</pubmed></ref>。 | ||
各ヒアルロン酸合成酵素アイソフォームは活性、ヒアルロン酸鎖合成速度、および安定性において異なる<ref name=Itano1999><pubmed>10455188</pubmed></ref><ref name=Kobayashi2020><pubmed>33171800</pubmed></ref> | 各ヒアルロン酸合成酵素アイソフォームは活性、ヒアルロン酸鎖合成速度、および安定性において異なる<ref name=Itano1999><pubmed>10455188</pubmed></ref><ref name=Kobayashi2020><pubmed>33171800</pubmed></ref>。例えば、ヒアルロン酸合成酵素2は比較的高い分子量のヒアルロン酸を合成する傾向があるのに対し、ヒアルロン酸合成酵素3はより低い分子量のヒアルロン酸を合成することが示唆されている。各アイソフォームによって合成される長さの異なるヒアルロン酸は異なる生理的機能をもつと考えられている。したがって、複数のHASアイソフォームが存在するのは、異なる酵素的性質を有する複数の酵素が機能的に補完し合っているためであると推定されている。 | ||
興味深いことに、ペリニューロナルネットを有する神経細胞は、中枢神経系の領域と発達段階に応じてヒアルロン酸合成酵素の発現が異なる | 興味深いことに、ペリニューロナルネットを有する神経細胞は、中枢神経系の領域と発達段階に応じてヒアルロン酸合成酵素の発現が異なる<ref name=Kwok2011><pubmed>21898855</pubmed></ref>。[[小脳核]]と[[視覚野]]の神経細胞はヒアルロン酸合成酵素2とヒアルロン酸合成酵素3を発現し、[[脊髄]]の神経細胞はヒアルロン酸合成酵素1とヒアルロン酸合成酵素3を発現する。ただし、発達中の脊髄ではヒアルロン酸合成酵素1とヒアルロン酸合成酵素3が発現しているが、成熟した脊髄ではヒアルロン酸合成酵素3のみが同定されている。異なる長さのヒアルロン酸を合成する異なるヒアルロン酸合成酵素は、ヒアルロン酸マトリックスに異なる構造と機械的特性をもたらす可能性がある。ヒアルロン酸合成酵素はヒアルロン酸ポリマーを合成し細胞表面から分泌する際に、成長中のポリマーを保持するため、ペリニューロナルネットのアンカー分子として機能する可能性がある('''図1C''')<ref name=Fawcett2019 /><ref name=Toole2004><pubmed>15229478</pubmed></ref>。 | ||
== 機能・疾患とのかかわり == | == 機能・疾患とのかかわり == | ||
ヒアルロン酸は脳の細胞外マトリックスの主要な構成成分である。Has1ノックアウト、Has2コンディショナルノックアウトおよびHas3ノックアウトマウスは、いずれも[[てんかん]]様活動を示す。このうち、Has3 KOマウスはてんかん発作の頻度が最も高く、[[海馬]]のヒアルロン酸マトリックスの著しい減少を示した<ref name=Arranz2014><pubmed>24790187</pubmed></ref>。ちなみに、このHas3ノックアウトマウスではペリニューロナルネット形成には影響を及ぼさずに細胞外空間が減少した。その高い水和力のため、ヒアルロン酸の欠乏は脳の細胞外空間容積の減少をもたらす。細胞外空間容積の減少は、神経細胞間での電場を介した相互作用(いわゆる[[エファプス相互作用]])の増強と、細胞外[[カリウム]]濃度の上昇により、てんかん様活動を促進すると考察している。Mukhinaらが、海馬におけるヒアルロン酸の消化が出生後早期にけいれんを引き起こすかどうか試したところ、ヒアルロニダーゼの投与が新生児動物において[[聴覚]]誘発性けいれんを促進することが示された。ヒアルロン酸を酵素消化した後の海馬組織の[[トランスクリプトーム]]解析では、[[炎症]]反応に関連するタンパク質の遺伝子発現が増加していることが明らかになった<ref name=Balashova2019><pubmed>31632233</pubmed></ref>。 | |||
関連した研究として、ヒアルロン酸が[[グルタミン酸]]のクリアランスを促進することで興奮性シグナルを遮断するのに役立つことが報告された。[[ヒアルロニダーゼ]]処理は[[ラット]]海馬培養においてニューロンを活性化し、グルタミン酸興奮毒性によるニューロン損傷を引き起こした。さらに、グリア型[[グルタミン酸トランスポーター1]] ([[GLT1]])をアストロサイトの細胞プロセスにリクルートする分子として[[CD44]]は除外され、その代わり3つのヒアルロン酸合成酵素アイソフォームすべての関与が示された | 関連した研究として、ヒアルロン酸が[[グルタミン酸]]のクリアランスを促進することで興奮性シグナルを遮断するのに役立つことが報告された。[[ヒアルロニダーゼ]]処理は[[ラット]]海馬培養においてニューロンを活性化し、グルタミン酸興奮毒性によるニューロン損傷を引き起こした。さらに、グリア型[[グルタミン酸トランスポーター1]] ([[GLT1]])をアストロサイトの細胞プロセスにリクルートする分子として[[CD44]]は除外され、その代わり3つのヒアルロン酸合成酵素アイソフォームすべての関与が示された<ref name=Hayashi2019><pubmed>31188471</pubmed></ref>。過剰な細胞外グルタミン酸は、[[興奮毒性]]によるニューロン損傷を引き起こし多くの精神疾患に関与することが知られており、ヒアルロン酸がグルタミン酸のクリアランス促進に働くことは興味深い研究結果である。 | ||
ヒアルロン酸合成酵素2は、[[ミエリン鞘]]の形成にも関与しており、Has2 cKOマウスではミエリン鞘の異常が増加し、その結果、ミエリン層がより不均一になり軸索の直径が減少する。[[脳梁]]の細胞外空間拡大と水拡散率の低下が観察された | ヒアルロン酸合成酵素2は、[[ミエリン鞘]]の形成にも関与しており、Has2 cKOマウスではミエリン鞘の異常が増加し、その結果、ミエリン層がより不均一になり軸索の直径が減少する。[[脳梁]]の細胞外空間拡大と水拡散率の低下が観察された<ref name=Sherpa2000><pubmed>31175541</pubmed></ref>。 | ||
ヒアルロン酸研究の手法として、Has遺伝子KOマウス利用やヒアルロニダーゼ消化以外にヒアルロン酸合成酵素[[阻害剤]]の[[4-メチルウンベルリフェロン]] ([[4-MU]])を使うことがある<ref name=Kakizaki2004><pubmed>15190064</pubmed></ref><ref name=Dubisova2022><pubmed>35066096</pubmed></ref> | ヒアルロン酸研究の手法として、Has遺伝子KOマウス利用やヒアルロニダーゼ消化以外にヒアルロン酸合成酵素[[阻害剤]]の[[4-メチルウンベルリフェロン]] ([[4-MU]])を使うことがある<ref name=Kakizaki2004><pubmed>15190064</pubmed></ref><ref name=Dubisova2022><pubmed>35066096</pubmed></ref>。4-MU経口投与によるヒアルロン酸合成の阻害は、ペリニューロナルネットと拡散型細胞外マトリックスを破壊し、[[アストロサイト]]ネットワークを減少させ、細胞外空間の体積を増大させ、細胞外空間の幾何学構造を変容させた<ref name=Syková2025><pubmed>39753300</pubmed></ref>。この結果は、細胞外マトリックスの破壊が細胞外空間におけるイオン、[[神経伝達物質]]、神経活性物質の輸送効率を向上させ、これによりシナプス外伝達を介した広範な神経細胞間コミュニケーションを可能にすることを示唆している。 | ||
ヒアルロン酸は凝縮型細胞外マトリックス構造であるペリニューロナルネットや[[ランビエ絞輪]] | ヒアルロン酸は凝縮型細胞外マトリックス構造であるペリニューロナルネットや[[ランビエ絞輪]]、軸索被膜の細胞外マトリックスなどの枠組みとしても重要である。したがってアグリカン、ブレビカンなどのヒアルロン酸結合コンドロイチン硫酸プロテオグリカンなどを介した多様な機能も知られている<ref name=Fawcett2019><pubmed>31263252</pubmed></ref>。 | ||
==関連項目== | ==関連項目== | ||
2025年7月16日 (水) 22:23時点における版
大橋 俊孝
岡山大学 医歯薬学総合研究科
DOI:10.14931/bsd.11118 原稿受付日:2025年7月11日 原稿完成日:2025年7月13日
担当編集委員:和田 圭司(国立研究開発法人国立精神・神経医療研究センター)
同義語:hyaluronic acid
英略語:HA
ヒアルロン酸(HA)はグルクロン酸とN-アセチルグルコサミンの2糖が直鎖上に交互に結合した繰り返し構造よりなるグリコサミノグリカン鎖の一種である。脳の細胞外マトリックスの主要な構成成分として細胞に構造的な枠組みを与える。高い水和力があるという物性に加え、ヒアルロン酸結合コンドロイチン硫酸プロテオグリカンなどの結合マトリックス分子による構造によっても多様な機能が発揮される。
構造
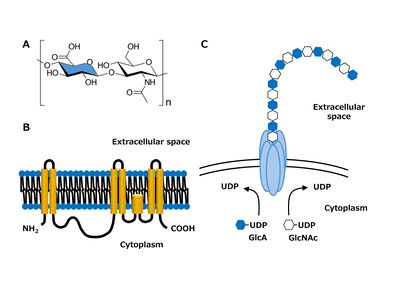
文献[1]9より改変
ヒアルロン酸は、カール・マイヤーとジョン・パルマーによって1934年に牛の硝子体から発見された。N-アセチルグルコサミン(GlcNAc)とグルクロン酸(GlcA)の繰り返し単位から構成されており、これらの単位は交互にβ-1,3とβ-1,4結合で連結されている(図1A)。この2糖繰り返しのポリマーは、分子量が非常に高く、105から107Daの範囲である[2]。
発現
脊椎動物のほとんどの支持組織の細胞外マトリックスの主要な構成成分として、細胞の構造的枠組みを提供している。脳細胞外マトリックスは、神経細胞とグリア細胞によって分泌されるグリコサミノグリカン、プロテオグリカン、およびグリコプロテインからなるネットワークである。それらの中でもヒアルロン酸とヒアルロン酸結合コンドロイチン硫酸プロテオグリカン(レクティカンファミリー)は重要な成分である。
脳ではヒアルロン酸は、拡散型細胞外マトリックスと凝縮型細胞外マトリックスという2つの異なるタイプの細胞外マトリックスを形成する[3][4]。拡散型細胞外マトリックスは、脳実質全体に見られる生理食塩水および界面活性剤に可溶性の緩い構造で構成されている。凝縮型細胞外マトリックスは凝集体を形成し、尿素による変性後にのみ組織から抽出可能である。パルブアルブミンニューロンなどのニューロンの亜集団を取り囲むペリニューロナルネットは、凝縮型細胞外マトリックスの代表的な例である[5]。
合成酵素
最初の哺乳類ヒアルロン酸合成酵素(HAS)遺伝子は、機能的発現クローニングによりItanoらにより同定され、 ヒアルロン酸合成酵素1 (HAS1)と命名された[6]。ヒアルロン酸の産生に欠陥のあるマウス乳がん細胞にヒアルロン酸合成酵素1 cDNAを導入することによりヒアルロン酸の合成とマトリックス形成を誘導した。さらに別グループによりヒアルロン酸合成酵素2 (HAS2)とヒアルロン酸合成酵素3 (HAS3)が、縮重RT-PCR法を用いて同定された[7][8]。3つの遺伝子の構造は、哺乳類種間で進化的によく保存されている[9]。哺乳類のヒアルロン酸合成酵素には、7つの推定膜貫通領域が含まれており、そのうち2つはN末端側に、5つはC末端側に位置している(図1B)[10]。大きな細胞質ループには、推定される糖転移酵素の触媒部位とUDP結合モチーフが含まれている。マウスヒアルロン酸合成酵素1タンパク質の細胞質ループにおけるアミノ酸のサイト特異的突然変異法により、糖転移酵素活性に責任を有するドメイン構造とアミノ酸残基が同定された[11]。
各ヒアルロン酸合成酵素アイソフォームは活性、ヒアルロン酸鎖合成速度、および安定性において異なる[12][1]。例えば、ヒアルロン酸合成酵素2は比較的高い分子量のヒアルロン酸を合成する傾向があるのに対し、ヒアルロン酸合成酵素3はより低い分子量のヒアルロン酸を合成することが示唆されている。各アイソフォームによって合成される長さの異なるヒアルロン酸は異なる生理的機能をもつと考えられている。したがって、複数のHASアイソフォームが存在するのは、異なる酵素的性質を有する複数の酵素が機能的に補完し合っているためであると推定されている。
興味深いことに、ペリニューロナルネットを有する神経細胞は、中枢神経系の領域と発達段階に応じてヒアルロン酸合成酵素の発現が異なる[13]。小脳核と視覚野の神経細胞はヒアルロン酸合成酵素2とヒアルロン酸合成酵素3を発現し、脊髄の神経細胞はヒアルロン酸合成酵素1とヒアルロン酸合成酵素3を発現する。ただし、発達中の脊髄ではヒアルロン酸合成酵素1とヒアルロン酸合成酵素3が発現しているが、成熟した脊髄ではヒアルロン酸合成酵素3のみが同定されている。異なる長さのヒアルロン酸を合成する異なるヒアルロン酸合成酵素は、ヒアルロン酸マトリックスに異なる構造と機械的特性をもたらす可能性がある。ヒアルロン酸合成酵素はヒアルロン酸ポリマーを合成し細胞表面から分泌する際に、成長中のポリマーを保持するため、ペリニューロナルネットのアンカー分子として機能する可能性がある(図1C)[5][14]。
機能・疾患とのかかわり
ヒアルロン酸は脳の細胞外マトリックスの主要な構成成分である。Has1ノックアウト、Has2コンディショナルノックアウトおよびHas3ノックアウトマウスは、いずれもてんかん様活動を示す。このうち、Has3 KOマウスはてんかん発作の頻度が最も高く、海馬のヒアルロン酸マトリックスの著しい減少を示した[15]。ちなみに、このHas3ノックアウトマウスではペリニューロナルネット形成には影響を及ぼさずに細胞外空間が減少した。その高い水和力のため、ヒアルロン酸の欠乏は脳の細胞外空間容積の減少をもたらす。細胞外空間容積の減少は、神経細胞間での電場を介した相互作用(いわゆるエファプス相互作用)の増強と、細胞外カリウム濃度の上昇により、てんかん様活動を促進すると考察している。Mukhinaらが、海馬におけるヒアルロン酸の消化が出生後早期にけいれんを引き起こすかどうか試したところ、ヒアルロニダーゼの投与が新生児動物において聴覚誘発性けいれんを促進することが示された。ヒアルロン酸を酵素消化した後の海馬組織のトランスクリプトーム解析では、炎症反応に関連するタンパク質の遺伝子発現が増加していることが明らかになった[16]。
関連した研究として、ヒアルロン酸がグルタミン酸のクリアランスを促進することで興奮性シグナルを遮断するのに役立つことが報告された。ヒアルロニダーゼ処理はラット海馬培養においてニューロンを活性化し、グルタミン酸興奮毒性によるニューロン損傷を引き起こした。さらに、グリア型グルタミン酸トランスポーター1 (GLT1)をアストロサイトの細胞プロセスにリクルートする分子としてCD44は除外され、その代わり3つのヒアルロン酸合成酵素アイソフォームすべての関与が示された[17]。過剰な細胞外グルタミン酸は、興奮毒性によるニューロン損傷を引き起こし多くの精神疾患に関与することが知られており、ヒアルロン酸がグルタミン酸のクリアランス促進に働くことは興味深い研究結果である。
ヒアルロン酸合成酵素2は、ミエリン鞘の形成にも関与しており、Has2 cKOマウスではミエリン鞘の異常が増加し、その結果、ミエリン層がより不均一になり軸索の直径が減少する。脳梁の細胞外空間拡大と水拡散率の低下が観察された[18]。
ヒアルロン酸研究の手法として、Has遺伝子KOマウス利用やヒアルロニダーゼ消化以外にヒアルロン酸合成酵素阻害剤の4-メチルウンベルリフェロン (4-MU)を使うことがある[19][20]。4-MU経口投与によるヒアルロン酸合成の阻害は、ペリニューロナルネットと拡散型細胞外マトリックスを破壊し、アストロサイトネットワークを減少させ、細胞外空間の体積を増大させ、細胞外空間の幾何学構造を変容させた[21]。この結果は、細胞外マトリックスの破壊が細胞外空間におけるイオン、神経伝達物質、神経活性物質の輸送効率を向上させ、これによりシナプス外伝達を介した広範な神経細胞間コミュニケーションを可能にすることを示唆している。
ヒアルロン酸は凝縮型細胞外マトリックス構造であるペリニューロナルネットやランビエ絞輪、軸索被膜の細胞外マトリックスなどの枠組みとしても重要である。したがってアグリカン、ブレビカンなどのヒアルロン酸結合コンドロイチン硫酸プロテオグリカンなどを介した多様な機能も知られている[5]。
関連項目
参考文献
- ↑ 1.0 1.1
Kobayashi, T., Chanmee, T., & Itano, N. (2020).
Hyaluronan: Metabolism and Function. Biomolecules, 10(11). [PubMed:33171800] [PMC] [WorldCat] [DOI] - ↑
Itano, N. (2008).
Simple primary structure, complex turnover regulation and multiple roles of hyaluronan. Journal of biochemistry, 144(2), 131-7. [PubMed:18390876] [WorldCat] [DOI] - ↑
Deepa, S.S., Carulli, D., Galtrey, C., Rhodes, K., Fukuda, J., Mikami, T., ..., & Fawcett, J.W. (2006).
Composition of perineuronal net extracellular matrix in rat brain: a different disaccharide composition for the net-associated proteoglycans. The Journal of biological chemistry, 281(26), 17789-800. [PubMed:16644727] [WorldCat] [DOI] - ↑
Takechi, M., Oshima, K., Nadano, D., Kitagawa, H., Matsuda, T., & Miyata, S. (2020).
A pericellular hyaluronan matrix is required for the morphological maturation of cortical neurons. Biochimica et biophysica acta. General subjects, 1864(10), 129679. [PubMed:32623025] [WorldCat] [DOI] - ↑ 5.0 5.1 5.2
Fawcett, J.W., Oohashi, T., & Pizzorusso, T. (2019).
The roles of perineuronal nets and the perinodal extracellular matrix in neuronal function. Nature reviews. Neuroscience, 20(8), 451-465. [PubMed:31263252] [WorldCat] [DOI] - ↑
Itano, N., & Kimata, K. (1996).
Expression cloning and molecular characterization of HAS protein, a eukaryotic hyaluronan synthase. The Journal of biological chemistry, 271(17), 9875-8. [PubMed:8626618] [WorldCat] [DOI] - ↑
Watanabe, K., & Yamaguchi, Y. (1996).
Molecular identification of a putative human hyaluronan synthase. The Journal of biological chemistry, 271(38), 22945-8. [PubMed:8798477] [WorldCat] [DOI] - ↑
Spicer, A.P., Augustine, M.L., & McDonald, J.A. (1996).
Molecular cloning and characterization of a putative mouse hyaluronan synthase. The Journal of biological chemistry, 271(38), 23400-6. [PubMed:8798545] [WorldCat] [DOI] - ↑
Spicer, A.P., & McDonald, J.A. (1998).
Characterization and molecular evolution of a vertebrate hyaluronan synthase gene family. The Journal of biological chemistry, 273(4), 1923-32. [PubMed:9442026] [WorldCat] [DOI] - ↑
Itano, N., & Kimata, K. (2002).
Mammalian hyaluronan synthases. IUBMB life, 54(4), 195-9. [PubMed:12512858] [WorldCat] [DOI] - ↑
Yoshida, M., Itano, N., Yamada, Y., & Kimata, K. (2000).
In vitro synthesis of hyaluronan by a single protein derived from mouse HAS1 gene and characterization of amino acid residues essential for the activity. The Journal of biological chemistry, 275(1), 497-506. [PubMed:10617644] [WorldCat] [DOI] - ↑
Itano, N., Sawai, T., Yoshida, M., Lenas, P., Yamada, Y., Imagawa, M., ..., & Kimata, K. (1999).
Three isoforms of mammalian hyaluronan synthases have distinct enzymatic properties. The Journal of biological chemistry, 274(35), 25085-92. [PubMed:10455188] [WorldCat] [DOI] - ↑
Kwok, J.C., Dick, G., Wang, D., & Fawcett, J.W. (2011).
Extracellular matrix and perineuronal nets in CNS repair. Developmental neurobiology, 71(11), 1073-89. [PubMed:21898855] [WorldCat] [DOI] - ↑
Toole, B.P. (2004).
Hyaluronan: from extracellular glue to pericellular cue. Nature reviews. Cancer, 4(7), 528-39. [PubMed:15229478] [WorldCat] [DOI] - ↑
Arranz, A.M., Perkins, K.L., Irie, F., Lewis, D.P., Hrabe, J., Xiao, F., ..., & Yamaguchi, Y. (2014).
Hyaluronan deficiency due to Has3 knock-out causes altered neuronal activity and seizures via reduction in brain extracellular space. The Journal of neuroscience : the official journal of the Society for Neuroscience, 34(18), 6164-76. [PubMed:24790187] [PMC] [WorldCat] [DOI] - ↑
Balashova, A., Pershin, V., Zaborskaya, O., Tkachenko, N., Mironov, A., Guryev, E., ..., & Mukhina, I. (2019).
Enzymatic Digestion of Hyaluronan-Based Brain Extracellular Matrix in vivo Can Induce Seizures in Neonatal Mice. Frontiers in neuroscience, 13, 1033. [PubMed:31632233] [PMC] [WorldCat] [DOI] - ↑
Hayashi, M.K., Nishioka, T., Shimizu, H., Takahashi, K., Kakegawa, W., Mikami, T., ..., & Sato, K. (2019).
Hyaluronan synthesis supports glutamate transporter activity. Journal of neurochemistry, 150(3), 249-263. [PubMed:31188471] [WorldCat] [DOI] - ↑
Sherpa, A.D., Guilfoyle, D.N., Naik, A.A., Isakovic, J., Irie, F., Yamaguchi, Y., ..., & Hrabetova, S. (2020).
Integrity of White Matter is Compromised in Mice with Hyaluronan Deficiency. Neurochemical research, 45(1), 53-67. [PubMed:31175541] [PMC] [WorldCat] [DOI] - ↑
Kakizaki, I., Kojima, K., Takagaki, K., Endo, M., Kannagi, R., Ito, M., ..., & Itano, N. (2004).
A novel mechanism for the inhibition of hyaluronan biosynthesis by 4-methylumbelliferone. The Journal of biological chemistry, 279(32), 33281-9. [PubMed:15190064] [WorldCat] [DOI] - ↑
Dubisova, J., Burianova, J.S., Svobodova, L., Makovicky, P., Martinez-Varea, N., Cimpean, A., ..., & Kubinova, S. (2022).
Oral treatment of 4-methylumbelliferone reduced perineuronal nets and improved recognition memory in mice. Brain research bulletin, 181, 144-156. [PubMed:35066096] [PMC] [WorldCat] [DOI] - ↑
Syková, E., Voříšek, I., Starčuk, Z., Kratochvíla, J., Pavlova, I., Ichikawa, Y., ..., & Žilka, N. (2025).
Disruption of Extracellular Matrix and Perineuronal Nets Modulates Extracellular Space Volume and Geometry. The Journal of neuroscience : the official journal of the Society for Neuroscience, 45(8). [PubMed:39753300] [PMC] [WorldCat] [DOI]