「Adenomatous polyposis coli」の版間の差分
細編集の要約なし |
|||
| (同じ利用者による、間の3版が非表示) | |||
| 15行目: | 15行目: | ||
Apc遺伝子の発現は[[脳]]と[[腸管]]で多いが、全身のほとんどの組織に広く発現している<ref name=Bhat1994><pubmed>8182459</pubmed></ref><ref name=Miyashiro1995><pubmed>7624136</pubmed></ref><ref name=Midgley1997><pubmed>9196441</pubmed></ref><ref name=HumanProteinAtlas />。 | Apc遺伝子の発現は[[脳]]と[[腸管]]で多いが、全身のほとんどの組織に広く発現している<ref name=Bhat1994><pubmed>8182459</pubmed></ref><ref name=Miyashiro1995><pubmed>7624136</pubmed></ref><ref name=Midgley1997><pubmed>9196441</pubmed></ref><ref name=HumanProteinAtlas />。 | ||
Apc遺伝子産物(APCタンパク質)は多くの結合タンパク質との相互作用によって、細胞の運動、[[接着]]、[[増殖]]、[[情報伝達]] | Apc遺伝子産物(APCタンパク質)は多くの結合タンパク質との相互作用によって、細胞の運動、[[接着]]、[[増殖]]、[[情報伝達]]など多彩な細胞機能に関与している<ref name=Hanson2005><pubmed>16185824</pubmed></ref>。細胞増殖や形態形成に関与する[[Wnt]]シグナル伝達系を抑制する<ref name=Goss2000><pubmed>10784639</pubmed></ref><ref name=Nusse2017><pubmed>28575679</pubmed></ref>。変異あるいは不活性化したAPCはWnt系を制御できず、細胞が異常増殖しがんを生じる。 | ||
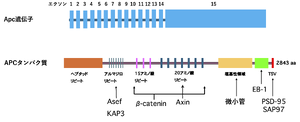
[[ファイル:Senda APC Fig1.png|サムネイル|'''図1. Apcの遺伝子構造(上)と産物であるAPCタンパク質構造(下)''']] | [[ファイル:Senda APC Fig1.png|サムネイル|'''図1. Apcの遺伝子構造(上)と産物であるAPCタンパク質構造(下)''']] | ||
| 22行目: | 22行目: | ||
Apcはヒトの第5染色体長腕(5q21-22)に位置する<ref name=Goss2000><pubmed>10784639</pubmed></ref><ref name=vanEs2001><pubmed>11237529</pubmed></ref><ref name=Fearnhead2001><pubmed>11257105</pubmed></ref>。遺伝子の全長は100kb以上と推定され、8.5kbの[[mRNA]]を経てAPCタンパク質をコードする。Apc遺伝子の[[エキソン]]数は15('''図1'''、上)。最後のエキソン15は非常に長く、C末端領域をほぼすべてコードしている。そのエキソン15の中央付近に変異の多くが集中している(Mutation Cluster Region: MCR)。 | Apcはヒトの第5染色体長腕(5q21-22)に位置する<ref name=Goss2000><pubmed>10784639</pubmed></ref><ref name=vanEs2001><pubmed>11237529</pubmed></ref><ref name=Fearnhead2001><pubmed>11257105</pubmed></ref>。遺伝子の全長は100kb以上と推定され、8.5kbの[[mRNA]]を経てAPCタンパク質をコードする。Apc遺伝子の[[エキソン]]数は15('''図1'''、上)。最後のエキソン15は非常に長く、C末端領域をほぼすべてコードしている。そのエキソン15の中央付近に変異の多くが集中している(Mutation Cluster Region: MCR)。 | ||
APCはアミノ酸2,843個、分子量310kDaの巨大タンパク質である<ref name=Goss2000><pubmed>10784639</pubmed></ref><ref name=Hanson2005><pubmed>16185824</pubmed></ref><ref name=vanEs2001><pubmed>11237529</pubmed></ref><ref name=Fearnhead2001><pubmed>11257105</pubmed></ref>('''図1'''、下)。N末端のヘプタッドリピート構造は、APC分子をオリゴマー化するのに必要である。分子中央部には、Wnt系の中心となるタンパク質である[[βカテニン]]との結合部位がある。APC分子のC末端側には[[微小管]]や[[微小管調節タンパク質]]である[[EB-1]]との結合部位があり、さらに、神経系で高発現する[[PSD-95]]や細胞接着に関係する[[SAP97]]<ref name=Matsumine1996><pubmed>8638125</pubmed></ref>。 | APCはアミノ酸2,843個、分子量310kDaの巨大タンパク質である<ref name=Goss2000><pubmed>10784639</pubmed></ref><ref name=Hanson2005><pubmed>16185824</pubmed></ref><ref name=vanEs2001><pubmed>11237529</pubmed></ref><ref name=Fearnhead2001><pubmed>11257105</pubmed></ref>('''図1'''、下)。N末端のヘプタッドリピート構造は、APC分子をオリゴマー化するのに必要である。分子中央部には、Wnt系の中心となるタンパク質である[[βカテニン]]との結合部位がある。APC分子のC末端側には[[微小管]]や[[微小管調節タンパク質]]である[[EB-1]]との結合部位があり、さらに、神経系で高発現する[[PSD-95]]や細胞接着に関係する[[SAP97]]との結合部位がある<ref name=Matsumine1996><pubmed>8638125</pubmed></ref>。 | ||
== 類似タンパク質 == | == 類似タンパク質 == | ||
| 34行目: | 34行目: | ||
[[グリア細胞]]については、[[星状膠細胞]]<ref name=vanEs1999><pubmed>10021369</pubmed></ref><ref name=Lee2010><pubmed>19655246</pubmed></ref>と[[稀突起膠細胞]]<ref name=Lee2010><pubmed>19655246</pubmed></ref><ref name=Bhat1996><pubmed>8776583</pubmed></ref>で発現・局在する。同時に、脳形成期の[[放射状グリア細胞]]におけるAPCの発現は、大脳皮質の層形成と[[軸索]]投射に重要であることが示された<ref name=Yokota2009><pubmed>19146812</pubmed></ref>。 | [[グリア細胞]]については、[[星状膠細胞]]<ref name=vanEs1999><pubmed>10021369</pubmed></ref><ref name=Lee2010><pubmed>19655246</pubmed></ref>と[[稀突起膠細胞]]<ref name=Lee2010><pubmed>19655246</pubmed></ref><ref name=Bhat1996><pubmed>8776583</pubmed></ref>で発現・局在する。同時に、脳形成期の[[放射状グリア細胞]]におけるAPCの発現は、大脳皮質の層形成と[[軸索]]投射に重要であることが示された<ref name=Yokota2009><pubmed>19146812</pubmed></ref>。 | ||
腸管上皮にも豊富に発現しているが、腸上皮での発現は一様ではない。[[絨毛]]の先端に行くほどAPCの発現は高く、逆に絨毛の基部から[[腸陰窩]] | 腸管上皮にも豊富に発現しているが、腸上皮での発現は一様ではない。[[絨毛]]の先端に行くほどAPCの発現は高く、逆に絨毛の基部から[[腸陰窩]]に入ると発現は急激に減弱する<ref name=Miyashiro1995><pubmed>7624136</pubmed></ref>。腸上皮細胞は陰窩内にある[[幹細胞]]で分裂増殖し、陰窩から絨毛を上りながら4腫類の上皮細胞に分化成熟することがわかっている。Wnt系を負に制御して細胞増殖を抑制するAPCの発現が陰窩で少なく、絨毛先端で多いことから、APCは腸上皮全体の増殖・分化の制御に関わっていることを示唆する。上皮細胞内では、細胞の頂部(微絨毛を含む)と隣の細胞と接着している側部[[細胞膜]]直下にAPCの局在が見られる。 | ||
[[ファイル:Senda APC Fig2.png|サムネイル|'''図2. APC変異体によるWntシグナルの異常活性化機構'''<br>'''左.''' 正常APCはβカテニンに結合 ⇒βカテニンは分解される(Wnt系を抑制)<br>'''右.''' 変異APCはβカテニンに結合できない ⇒βカテニンは核に入り、転写因子と結合(Wnt系促進)⇒細胞増殖亢進・がん化]] | [[ファイル:Senda APC Fig2.png|サムネイル|'''図2. APC変異体によるWntシグナルの異常活性化機構'''<br>'''左.''' 正常APCはβカテニンに結合 ⇒βカテニンは分解される(Wnt系を抑制)<br>'''右.''' 変異APCはβカテニンに結合できない ⇒βカテニンは核に入り、転写因子と結合(Wnt系促進)⇒細胞増殖亢進・がん化]] | ||
== 機能 == | == 機能 == | ||
[[がん抑制タンパク質]]としてのAPCの機能は、Wntシグナル伝達系を抑制することである<ref name=Goss2000><pubmed>10784639</pubmed></ref><ref name=Nusse2017><pubmed>28575679</pubmed></ref>。Wnt系は細胞外リガンド、Wntの刺激を受けて、細胞増殖や細胞分化を促進するシグナルを核内に伝える。APCはWnt系の中心のタンパクであるβカテニンと結合し、その分解を促進することによってWntシグナルの[[核]]への移行を阻止する。APCに変異が生じ、βカテニン結合部位が欠損すると、βカテニンは分解されずに細胞質に蓄積し、次いで核に移行して細胞増殖をオンにする[[転写因子]]を活性化する('''図2''')。 | |||
APCにはβカテニン以外にも様々なタンパク質との結合部位が存在する。APCはこれらのタンパク質との結合を介して、Wnt系の制御以外の様々な機能に関与していることが示された<ref name=Fearnhead2001><pubmed>11257105</pubmed></ref><ref name=Senda2005><pubmed>16158975</pubmed></ref>。 | APCにはβカテニン以外にも様々なタンパク質との結合部位が存在する。APCはこれらのタンパク質との結合を介して、Wnt系の制御以外の様々な機能に関与していることが示された<ref name=Fearnhead2001><pubmed>11257105</pubmed></ref><ref name=Senda2005><pubmed>16158975</pubmed></ref>。 | ||
| 47行目: | 47行目: | ||
APCの塩基性領域は、微小管や微小管結合タンパク質EB-1と結合する。したがって、微小管が関与する様々な細胞機能にAPCが関わっていると想定される。実際、微小管が誘導する細胞分裂時の[[染色体]]分離に、APCが関与している事が報告されており、Apcの異常によって、染色体分離がうまくいかずに染色体不安定性が増大し、がん化を誘発すると考えられる<ref name=Fodde2001><pubmed>11283620</pubmed></ref><ref name=Dikovskaya2007><pubmed>17227893</pubmed></ref>。上皮細胞においてもニューロンにおいても、APCは細胞辺縁部あるいは細胞突起の先端に集積する傾向がある。APCは微小管と結合し、微小管に沿って細胞の辺縁部あるいは突起の先端に運ばれていると考えられている<ref name=Nathke1996><pubmed>8698812</pubmed></ref><ref name=MimoriKiyosue2000><pubmed>10662776</pubmed></ref><ref name=Votin2005><pubmed>16303851</pubmed></ref>。 | APCの塩基性領域は、微小管や微小管結合タンパク質EB-1と結合する。したがって、微小管が関与する様々な細胞機能にAPCが関わっていると想定される。実際、微小管が誘導する細胞分裂時の[[染色体]]分離に、APCが関与している事が報告されており、Apcの異常によって、染色体分離がうまくいかずに染色体不安定性が増大し、がん化を誘発すると考えられる<ref name=Fodde2001><pubmed>11283620</pubmed></ref><ref name=Dikovskaya2007><pubmed>17227893</pubmed></ref>。上皮細胞においてもニューロンにおいても、APCは細胞辺縁部あるいは細胞突起の先端に集積する傾向がある。APCは微小管と結合し、微小管に沿って細胞の辺縁部あるいは突起の先端に運ばれていると考えられている<ref name=Nathke1996><pubmed>8698812</pubmed></ref><ref name=MimoriKiyosue2000><pubmed>10662776</pubmed></ref><ref name=Votin2005><pubmed>16303851</pubmed></ref>。 | ||
APCのC末端には、分子内に[[PDZドメイン]]を持つ[[MAGUKs]]と呼ばれる、一連の類縁タンパク質が結合する<ref name=vanEs2001><pubmed>11237529</pubmed></ref><ref name=Senda2007><pubmed>17572842</pubmed></ref>。この中にはSAP97、PSD-95、[[PSD-93]]、[[SAP102]]など、シナプスに局在するタンパク質が多い。神経伝達物質の[[受容体]]や[[イオンチャネル]]は、これらのPDZドメインタンパク質と結合してシナプス膜に凝集し、高次神経機能の基盤となるシナプス伝達を担っていると考えられる。実際、APCが[[アセチルコリン受容体]]<ref name=Wang2003><pubmed>14502292</pubmed></ref><ref name=Temburni2004><pubmed>15282282</pubmed></ref>、[[グルタミン酸受容体]]<ref name=Shimomura2007><pubmed>17714185</pubmed></ref>および[[シナプス接着分子]]([[ニューロリギン]]、[[ニューレキシン]])<ref name=Rosenberg2010><pubmed>20720115</pubmed></ref>をシナプス膜に集積させていることが示された。 | |||
発生期の[[マウス]]脳においてAPCを放射状グリア細胞で欠失させると、放射状グリア細胞の微小管細胞骨格が不安定化し、極性を維持できなくなる<ref name=Yokota2009><pubmed>19146812</pubmed></ref>。同時に、ニューロンの新生と移動が阻害され、大脳皮質の層形成や軸索投射が障害される。 | 発生期の[[マウス]]脳においてAPCを放射状グリア細胞で欠失させると、放射状グリア細胞の微小管細胞骨格が不安定化し、極性を維持できなくなる<ref name=Yokota2009><pubmed>19146812</pubmed></ref>。同時に、ニューロンの新生と移動が阻害され、大脳皮質の層形成や軸索投射が障害される。 | ||
| 57行目: | 57行目: | ||
== 疾患との関わり == | == 疾患との関わり == | ||
=== 腫瘍・がん === | === 腫瘍・がん === | ||
[[がん抑制遺伝子]]として発見されたAPCは、遺伝子変異による腫瘍抑制機能の喪失によって、全身の様々ながん・腫瘍の発生に関わっている。 | |||
FAPは、変異Apc遺伝子を[[胚性遺伝]]によって受け継いでいる人に生じる若年性の大腸腺腫症である<ref name=Galiatsatos2006 /><ref name=Iwama2014 />。10歳代より大腸粘膜に腺腫性ポリープが出現し、年齢と共にポリープは増えていき、大腸全体に数百~数千個のポリープができ、それに伴う様々な[[消化管]]症状が出現する。FAPの診断がつけば予防的に大腸切除が施されるが、放置すれば20~40歳代でほぼ100%の確率でがん化する。FAPの大腸外病変として、[[デスモイド腫瘍]]、[[骨腫瘍]]、軟部組織腫瘍([[線維腫]]、[[脂肪腫]]など)、[[甲状腺]][[乳頭がん]]、[[肝芽腫]]、膵腫瘍、[[網膜色素上皮肥厚]]、[[小脳髄芽腫]]などが合併することがある。 | FAPは、変異Apc遺伝子を[[胚性遺伝]]によって受け継いでいる人に生じる若年性の大腸腺腫症である<ref name=Galiatsatos2006 /><ref name=Iwama2014 />。10歳代より大腸粘膜に腺腫性ポリープが出現し、年齢と共にポリープは増えていき、大腸全体に数百~数千個のポリープができ、それに伴う様々な[[消化管]]症状が出現する。FAPの診断がつけば予防的に大腸切除が施されるが、放置すれば20~40歳代でほぼ100%の確率でがん化する。FAPの大腸外病変として、[[デスモイド腫瘍]]、[[骨腫瘍]]、軟部組織腫瘍([[線維腫]]、[[脂肪腫]]など)、[[甲状腺]][[乳頭がん]]、[[肝芽腫]]、膵腫瘍、[[網膜色素上皮肥厚]]、[[小脳髄芽腫]]などが合併することがある。 | ||
| 66行目: | 66行目: | ||
=== 自閉スペクトラム症 === | === 自閉スペクトラム症 === | ||
Apcをマウス[[前脳]]ニューロンで欠損させると、[[社会性]]の低下、[[反復行動]]の増加、[[学習]]・[[記憶]]能の低下などの[[自閉症]]様行動・[[認知障害]]が認められた<ref name=Mohn2014><pubmed>24934177</pubmed></ref>。このマウスでは、海馬[[シナプス棘]]密度の増加、シナプス機能異常([[興奮性微小電流]]の増加、[[長期増強]] ([[long-term potentiation]], [[LTP]] | Apcをマウス[[前脳]]ニューロンで欠損させると、[[社会性]]の低下、[[反復行動]]の増加、[[学習]]・[[記憶]]能の低下などの[[自閉症]]様行動・[[認知障害]]が認められた<ref name=Mohn2014><pubmed>24934177</pubmed></ref>。このマウスでは、海馬[[シナプス棘]]密度の増加、シナプス機能異常([[興奮性微小電流]]の増加、[[長期増強]] ([[long-term potentiation]], [[LTP]])の増強など)が見られ、βカテニンの過剰蓄積が認められた。 | ||
ヒトにおける疫学的エビデンスとしては、Apc内にある[[一塩基多型]](re1804197)が[[自閉スペクトラム症]]と関連する可能性があるという報告<ref name=Zhou2007><pubmed>17221838</pubmed></ref>と、[[統合失調症]]患者において、APCの発現(末梢血白血球)が健常者よりも高いという報告がある<ref name=Cui2005><pubmed>15768050</pubmed></ref>。 | ヒトにおける疫学的エビデンスとしては、Apc内にある[[一塩基多型]](re1804197)が[[自閉スペクトラム症]]と関連する可能性があるという報告<ref name=Zhou2007><pubmed>17221838</pubmed></ref>と、[[統合失調症]]患者において、APCの発現(末梢血白血球)が健常者よりも高いという報告がある<ref name=Cui2005><pubmed>15768050</pubmed></ref>。 | ||
=== 認知障害 === | === 認知障害 === | ||
FAP患者では認知機能の低下とともに、安静時[[機能MRI]]における脳の機能的ネットワークの広範な変調が確認された<ref name=Cali2021><pubmed>34693396</pubmed></ref>。 | FAP患者では認知機能の低下とともに、安静時[[機能MRI]]における脳の機能的ネットワークの広範な変調が確認された<ref name=Cali2021><pubmed>34693396</pubmed></ref>。 | ||
2025年8月26日 (火) 10:10時点における最新版
千田 隆夫
園田学園大学 人間健康学部食マネジメント学科
DOI:10.14931/bsd.11317 原稿受付日:2025年8月21日 原稿完成日:2025年8月24日
担当編集委員:河崎 洋志(金沢大学 医学系 脳神経医学教室)
英略称:Apc
Adenomatous Polyposis Coli (Apc)遺伝子は遺伝性(家族性腺腫性ポリポーシス:FAP)および非遺伝性の大腸腫瘍・がんで変異を起こしているがん抑制遺伝子である。その産物であるAPCタンパク質はβカテニンと結合して、それを分解することによって、細胞増殖を促進するWntシグナル伝達系を抑制する。APCは多くのタンパク質と結合し、それを介して、細胞増殖、細胞接着、細胞運動に関与する。全身の臓器・組織で発現しているが、特に脳と腸上皮に多い。APCは脳の発生・形態形成と生後の脳ではシナプス伝達に深く関わっている。Apcの変異は大腸がんや消化器系のがんを引き起こすが、大量に発現している脳においては、疾患モデル動物とFAP患者の双方で、APCと自閉症、認知障害及び統合失調症との関連を示唆する数多くの報告がある。
はじめに
家族性腺腫性ポリポーシス (familial adenomatous polyposis, FAP)は、若年で大腸に多数のポリープが発生し、高率に癌化する予後不良の遺伝性疾患である[1][2]。このFAPの原因遺伝子として、1991年にAdenomatous Polyposis Coli (Apc)遺伝子が同定された[3][4][5][6]。非遺伝性の大腸腺腫・がんでも、高率にApcに変異が生じている[7]。大腸がん以外にも、胃がん、肝がん、膵がん、甲状腺がんなどで、Apcの変異が見つかっている。
Apc遺伝子の発現は脳と腸管で多いが、全身のほとんどの組織に広く発現している[8][9][10][11]。
Apc遺伝子産物(APCタンパク質)は多くの結合タンパク質との相互作用によって、細胞の運動、接着、増殖、情報伝達など多彩な細胞機能に関与している[12]。細胞増殖や形態形成に関与するWntシグナル伝達系を抑制する[13][14]。変異あるいは不活性化したAPCはWnt系を制御できず、細胞が異常増殖しがんを生じる。
構造
Apcはヒトの第5染色体長腕(5q21-22)に位置する[13][15][16]。遺伝子の全長は100kb以上と推定され、8.5kbのmRNAを経てAPCタンパク質をコードする。Apc遺伝子のエキソン数は15(図1、上)。最後のエキソン15は非常に長く、C末端領域をほぼすべてコードしている。そのエキソン15の中央付近に変異の多くが集中している(Mutation Cluster Region: MCR)。
APCはアミノ酸2,843個、分子量310kDaの巨大タンパク質である[13][12][15][16](図1、下)。N末端のヘプタッドリピート構造は、APC分子をオリゴマー化するのに必要である。分子中央部には、Wnt系の中心となるタンパク質であるβカテニンとの結合部位がある。APC分子のC末端側には微小管や微小管調節タンパク質であるEB-1との結合部位があり、さらに、神経系で高発現するPSD-95や細胞接着に関係するSAP97との結合部位がある[17]。
類似タンパク質
APCと構造・機能が類似したタンパク質としてAPC2(adenomatous polyposis coli-like, APCL)が知られている[18][19]。APC2の分子構造はAPCと非常によく似ている。しかし、全身に広く発現するAPCと異なり、APC2は主に中枢神経系(特に、大脳皮質と小脳)で高発現する。発生期のニューロンには際立って豊富である。
発現・分布・細胞内局在
APCは大腸がん抑制因子として発見されたが、その発現は腸管だけでなく、全身の組織細胞に広く分布している(脳、耳下腺、顎下腺、食道、胃、小腸、肝臓、胆嚢、膵臓、結腸、腎臓、膀胱、精巣、子宮内膜、胎盤、乳腺、皮膚、胸腺など)[8][9][10][11]。
発生期でも生後でも、神経組織でのAPCの発現は顕著である[8]。生後の脳では、Apc(APC)の発現に部位差が生じ、大脳皮質、海馬、嗅球、小脳皮質では生後も多量のApc(APC)の存在が認められる。APCはニューロンには豊富である。神経組織内では細胞体にAPCの豊富な発現が見られるニューロンがある[20][21]。分化した培養ニューロンではAPCは神経突起や樹状突起にも分布し、シナプス形成部に濃縮するようになる[22]。
グリア細胞については、星状膠細胞[19][23]と稀突起膠細胞[23][24]で発現・局在する。同時に、脳形成期の放射状グリア細胞におけるAPCの発現は、大脳皮質の層形成と軸索投射に重要であることが示された[25]。
腸管上皮にも豊富に発現しているが、腸上皮での発現は一様ではない。絨毛の先端に行くほどAPCの発現は高く、逆に絨毛の基部から腸陰窩に入ると発現は急激に減弱する[9]。腸上皮細胞は陰窩内にある幹細胞で分裂増殖し、陰窩から絨毛を上りながら4腫類の上皮細胞に分化成熟することがわかっている。Wnt系を負に制御して細胞増殖を抑制するAPCの発現が陰窩で少なく、絨毛先端で多いことから、APCは腸上皮全体の増殖・分化の制御に関わっていることを示唆する。上皮細胞内では、細胞の頂部(微絨毛を含む)と隣の細胞と接着している側部細胞膜直下にAPCの局在が見られる。
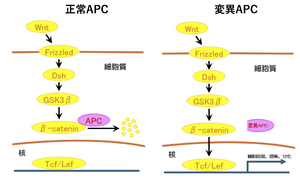
左. 正常APCはβカテニンに結合 ⇒βカテニンは分解される(Wnt系を抑制)
右. 変異APCはβカテニンに結合できない ⇒βカテニンは核に入り、転写因子と結合(Wnt系促進)⇒細胞増殖亢進・がん化
機能
がん抑制タンパク質としてのAPCの機能は、Wntシグナル伝達系を抑制することである[13][14]。Wnt系は細胞外リガンド、Wntの刺激を受けて、細胞増殖や細胞分化を促進するシグナルを核内に伝える。APCはWnt系の中心のタンパクであるβカテニンと結合し、その分解を促進することによってWntシグナルの核への移行を阻止する。APCに変異が生じ、βカテニン結合部位が欠損すると、βカテニンは分解されずに細胞質に蓄積し、次いで核に移行して細胞増殖をオンにする転写因子を活性化する(図2)。
APCにはβカテニン以外にも様々なタンパク質との結合部位が存在する。APCはこれらのタンパク質との結合を介して、Wnt系の制御以外の様々な機能に関与していることが示された[16][26]。
APCはN末端側のアルマジロリピート部位で、GTP結合タンパク質を調節するAsefと結合する[27]。Asefはアクチン細胞骨格を改編して細胞運動を制御するので、APCはAsefを介して細胞運動に関与していると考えられる[28]。
APCの塩基性領域は、微小管や微小管結合タンパク質EB-1と結合する。したがって、微小管が関与する様々な細胞機能にAPCが関わっていると想定される。実際、微小管が誘導する細胞分裂時の染色体分離に、APCが関与している事が報告されており、Apcの異常によって、染色体分離がうまくいかずに染色体不安定性が増大し、がん化を誘発すると考えられる[29][30]。上皮細胞においてもニューロンにおいても、APCは細胞辺縁部あるいは細胞突起の先端に集積する傾向がある。APCは微小管と結合し、微小管に沿って細胞の辺縁部あるいは突起の先端に運ばれていると考えられている[31][32][33]。
APCのC末端には、分子内にPDZドメインを持つMAGUKsと呼ばれる、一連の類縁タンパク質が結合する[15][34]。この中にはSAP97、PSD-95、PSD-93、SAP102など、シナプスに局在するタンパク質が多い。神経伝達物質の受容体やイオンチャネルは、これらのPDZドメインタンパク質と結合してシナプス膜に凝集し、高次神経機能の基盤となるシナプス伝達を担っていると考えられる。実際、APCがアセチルコリン受容体[35][36]、グルタミン酸受容体[22]およびシナプス接着分子(ニューロリギン、ニューレキシン)[37]をシナプス膜に集積させていることが示された。
発生期のマウス脳においてAPCを放射状グリア細胞で欠失させると、放射状グリア細胞の微小管細胞骨格が不安定化し、極性を維持できなくなる[25]。同時に、ニューロンの新生と移動が阻害され、大脳皮質の層形成や軸索投射が障害される。
成熟脳では、嗅球と海馬においてニューロン新生が継続するが、グリア線維性酸性タンパク質 (glial fibrillary acidic protein, GFAP)陽性細胞に由来する神経幹細胞でAPCを欠失させると、βカテニンが細胞内に蓄積し細胞は未分化状態を脱することができない。その結果、神経前駆細胞から神経芽細胞への分化が阻害される[38]。
APCは微小管や中間系フィラメントと結合し、ニューロンやグリア細胞の突起伸展・極性形成および細胞移動に関与しており、APC欠損や機能阻害によりこれらの動的現象は阻害される[39][40][41][42]。
疾患との関わり
腫瘍・がん
がん抑制遺伝子として発見されたAPCは、遺伝子変異による腫瘍抑制機能の喪失によって、全身の様々ながん・腫瘍の発生に関わっている。
FAPは、変異Apc遺伝子を胚性遺伝によって受け継いでいる人に生じる若年性の大腸腺腫症である[1][2]。10歳代より大腸粘膜に腺腫性ポリープが出現し、年齢と共にポリープは増えていき、大腸全体に数百~数千個のポリープができ、それに伴う様々な消化管症状が出現する。FAPの診断がつけば予防的に大腸切除が施されるが、放置すれば20~40歳代でほぼ100%の確率でがん化する。FAPの大腸外病変として、デスモイド腫瘍、骨腫瘍、軟部組織腫瘍(線維腫、脂肪腫など)、甲状腺乳頭がん、肝芽腫、膵腫瘍、網膜色素上皮肥厚、小脳髄芽腫などが合併することがある。
非遺伝性の大腸腺腫・大腸がんでも、多くの症例ではApc遺伝子の変異が腫瘍発生の第一ステップとなり[7]、その後、いくつかのがん遺伝子の活性化とがん抑制遺伝子の失活が連続して生じている(大腸がんの多段階発がん)[43]。大腸以外の消化管では、十二指腸腫瘍や胃ポリープ・腺腫でApc遺伝子の変異が見つかることがある。
中枢神経系にはAPCが高発現しているが、脳腫瘍とApc遺伝子の関係はまだ十分に解明されていない。しかし、大腸腺腫症に中枢神経系腫瘍(髄芽腫、上衣腫、星細胞腫)が合併することがある(Turcot症候群)[1][2][44]。
自閉スペクトラム症
Apcをマウス前脳ニューロンで欠損させると、社会性の低下、反復行動の増加、学習・記憶能の低下などの自閉症様行動・認知障害が認められた[45]。このマウスでは、海馬シナプス棘密度の増加、シナプス機能異常(興奮性微小電流の増加、長期増強 (long-term potentiation, LTP)の増強など)が見られ、βカテニンの過剰蓄積が認められた。
ヒトにおける疫学的エビデンスとしては、Apc内にある一塩基多型(re1804197)が自閉スペクトラム症と関連する可能性があるという報告[46]と、統合失調症患者において、APCの発現(末梢血白血球)が健常者よりも高いという報告がある[47]。
認知障害
FAP患者では認知機能の低下とともに、安静時機能MRIにおける脳の機能的ネットワークの広範な変調が確認された[48]。
統合失調症
C末端側が欠損したAPCを発現するマウスでは、統合失調症様行動異常(作業記憶の欠如、活動性の増加、不安行動の減少、社会的交流の低下)が認められた。このマウスの海馬ニューロンでは、樹状突起棘の形態異常と海馬CA1領域におけるシナプス伝達の長期増強の障害を示した。さらにこのマウス脳ではドーパミンとセロトニンの分布異常が認められた[49]。
関連項目
- Wntシグナル伝達系
- βカテニン
- 微小管
- EB-1
- PSD-95
- SAP97
- APC2(APCL: adenomatous polyposis coli-like)
- Asef
- Turcot症候群
- 自閉症スペクトラム
- 認知障害
- 統合失調症
参考文献
- ↑ 1.0 1.1 1.2
Galiatsatos, P., & Foulkes, W.D. (2006).
Familial adenomatous polyposis. The American journal of gastroenterology, 101(2), 385-98. [PubMed:16454848] [WorldCat] [DOI] - ↑ 2.0 2.1 2.2 岩間毅夫 (2014).:家族性大腸腺腫症概論 -FAP診療研究の温故知新- リフレ出版(東京)ISBN: 978-4-86223-723-1 C3047
- ↑
Groden, J., Thliveris, A., Samowitz, W., Carlson, M., Gelbert, L., Albertsen, H., ..., & Robertson, M. (1991).
Identification and characterization of the familial adenomatous polyposis coli gene. Cell, 66(3), 589-600. [PubMed:1651174] [WorldCat] [DOI] - ↑
Joslyn, G., Carlson, M., Thliveris, A., Albertsen, H., Gelbert, L., Samowitz, W., ..., & Robertson, M. (1991).
Identification of deletion mutations and three new genes at the familial polyposis locus. Cell, 66(3), 601-13. [PubMed:1678319] [WorldCat] [DOI] - ↑
Kinzler, K.W., Nilbert, M.C., Su, L.K., Vogelstein, B., Bryan, T.M., Levy, D.B., ..., & McKechnie, D. (1991).
Identification of FAP locus genes from chromosome 5q21. Science (New York, N.Y.), 253(5020), 661-5. [PubMed:1651562] [WorldCat] [DOI] - ↑
Rise, M.L., Frankel, W.N., Coffin, J.M., & Seyfried, T.N. (1991).
Genes for epilepsy mapped in the mouse. Science (New York, N.Y.), 253(5020), 669-73. [PubMed:1871601] [WorldCat] [DOI] - ↑ 7.0 7.1
Powell, S.M., Zilz, N., Beazer-Barclay, Y., Bryan, T.M., Hamilton, S.R., Thibodeau, S.N., ..., & Kinzler, K.W. (1992).
APC mutations occur early during colorectal tumorigenesis. Nature, 359(6392), 235-7. [PubMed:1528264] [WorldCat] [DOI] - ↑ 8.0 8.1 8.2
Bhat, R.V., Baraban, J.M., Johnson, R.C., Eipper, B.A., & Mains, R.E. (1994).
High levels of expression of the tumor suppressor gene APC during development of the rat central nervous system. The Journal of neuroscience : the official journal of the Society for Neuroscience, 14(5 Pt 2), 3059-71. [PubMed:8182459] [PMC] [WorldCat] [DOI] - ↑ 9.0 9.1 9.2
Miyashiro, I., Senda, T., Matsumine, A., Baeg, G.H., Kuroda, T., Shimano, T., ..., & Monden, M. (1995).
Subcellular localization of the APC protein: immunoelectron microscopic study of the association of the APC protein with catenin. Oncogene, 11(1), 89-96. [PubMed:7624136] [WorldCat] - ↑ 10.0 10.1
Midgley, C.A., White, S., Howitt, R., Save, V., Dunlop, M.G., Hall, P.A., ..., & Bubb, V.J. (1997).
APC expression in normal human tissues. The Journal of pathology, 181(4), 426-33. [PubMed:9196441] [WorldCat] [DOI] - ↑ 11.0 11.1 Human Protein Atlas – APC (ENSG00000134982)
- ↑ 12.0 12.1
Hanson, C.A., & Miller, J.R. (2005).
Non-traditional roles for the Adenomatous Polyposis Coli (APC) tumor suppressor protein. Gene, 361, 1-12. [PubMed:16185824] [WorldCat] [DOI] - ↑ 13.0 13.1 13.2 13.3
Goss, K.H., & Groden, J. (2000).
Biology of the adenomatous polyposis coli tumor suppressor. Journal of clinical oncology : official journal of the American Society of Clinical Oncology, 18(9), 1967-79. [PubMed:10784639] [WorldCat] [DOI] - ↑ 14.0 14.1
Nusse, R., & Clevers, H. (2017).
Wnt/β-Catenin Signaling, Disease, and Emerging Therapeutic Modalities. Cell, 169(6), 985-999. [PubMed:28575679] [WorldCat] [DOI] - ↑ 15.0 15.1 15.2
van Es, J.H., Giles, R.H., & Clevers, H.C. (2001).
The many faces of the tumor suppressor gene APC. Experimental cell research, 264(1), 126-34. [PubMed:11237529] [WorldCat] [DOI] - ↑ 16.0 16.1 16.2
Fearnhead, N.S., Britton, M.P., & Bodmer, W.F. (2001).
The ABC of APC. Human molecular genetics, 10(7), 721-33. [PubMed:11257105] [WorldCat] [DOI] - ↑
Matsumine, A., Ogai, A., Senda, T., Okumura, N., Satoh, K., Baeg, G.H., ..., & Akiyama, T. (1996).
Binding of APC to the human homolog of the Drosophila discs large tumor suppressor protein. Science (New York, N.Y.), 272(5264), 1020-3. [PubMed:8638125] [WorldCat] [DOI] - ↑
Nakagawa, H., Murata, Y., Koyama, K., Fujiyama, A., Miyoshi, Y., Monden, M., ..., & Nakamura, Y. (1998).
Identification of a brain-specific APC homologue, APCL, and its interaction with beta-catenin. Cancer research, 58(22), 5176-81. [PubMed:9823329] [WorldCat] - ↑ 19.0 19.1
van Es, J.H., Kirkpatrick, C., van de Wetering, M., Molenaar, M., Miles, A., Kuipers, J., ..., & Clevers, H. (1999).
Identification of APC2, a homologue of the adenomatous polyposis coli tumour suppressor. Current biology : CB, 9(2), 105-8. [PubMed:10021369] [WorldCat] [DOI] - ↑
Senda, T., Iino, S., Matsushita, K., Matsumine, A., Kobayashi, S., & Akiyama, T. (1998).
Localization of the adenomatous polyposis coli tumour suppressor protein in the mouse central nervous system. Neuroscience, 83(3), 857-66. [PubMed:9483569] [WorldCat] [DOI] - ↑
Brakeman, J.S., Gu, S.H., Wang, X.B., Dolin, G., & Baraban, J.M. (1999).
Neuronal localization of the Adenomatous polyposis coli tumor suppressor protein. Neuroscience, 91(2), 661-72. [PubMed:10366023] [WorldCat] [DOI] - ↑ 22.0 22.1
Shimomura, A., Ohkuma, M., Iizuka-Kogo, A., Kohu, K., Nomura, R., Miyachi, E., ..., & Senda, T. (2007).
Requirement of the tumour suppressor APC for the clustering of PSD-95 and AMPA receptors in hippocampal neurons. The European journal of neuroscience, 26(4), 903-12. [PubMed:17714185] [WorldCat] [DOI] - ↑ 23.0 23.1
Lee, H.N., Jeon, G.S., Kim, D.W., Cho, I.H., & Cho, S.S. (2010).
Expression of adenomatous polyposis coli protein in reactive astrocytes in hippocampus of kainic acid-induced rat. Neurochemical research, 35(1), 114-21. [PubMed:19655246] [WorldCat] [DOI] - ↑
Bhat, R.V., Axt, K.J., Fosnaugh, J.S., Smith, K.J., Johnson, K.A., Hill, D.E., ..., & Baraban, J.M. (1996).
Expression of the APC tumor suppressor protein in oligodendroglia. Glia, 17(2), 169-74. [PubMed:8776583] [WorldCat] [DOI] - ↑ 25.0 25.1
Yokota, Y., Kim, W.Y., Chen, Y., Wang, X., Stanco, A., Komuro, Y., ..., & Anton, E.S. (2009).
The adenomatous polyposis coli protein is an essential regulator of radial glial polarity and construction of the cerebral cortex. Neuron, 61(1), 42-56. [PubMed:19146812] [PMC] [WorldCat] [DOI] - ↑
Senda, T., Shimomura, A., & Iizuka-Kogo, A. (2005).
Adenomatous polyposis coli (Apc) tumor suppressor gene as a multifunctional gene. Anatomical science international, 80(3), 121-31. [PubMed:16158975] [WorldCat] [DOI] - ↑
Kawasaki, Y., Senda, T., Ishidate, T., Koyama, R., Morishita, T., Iwayama, Y., ..., & Akiyama, T. (2000).
Asef, a link between the tumor suppressor APC and G-protein signaling. Science (New York, N.Y.), 289(5482), 1194-7. [PubMed:10947987] [WorldCat] [DOI] - ↑
Kawasaki, Y., Sato, R., & Akiyama, T. (2003).
Mutated APC and Asef are involved in the migration of colorectal tumour cells. Nature cell biology, 5(3), 211-5. [PubMed:12598901] [WorldCat] [DOI] - ↑
Fodde, R., Kuipers, J., Rosenberg, C., Smits, R., Kielman, M., Gaspar, C., ..., & Clevers, H. (2001).
Mutations in the APC tumour suppressor gene cause chromosomal instability. Nature cell biology, 3(4), 433-8. [PubMed:11283620] [WorldCat] [DOI] - ↑
Dikovskaya, D., Schiffmann, D., Newton, I.P., Oakley, A., Kroboth, K., Sansom, O., ..., & Näthke, I.S. (2007).
Loss of APC induces polyploidy as a result of a combination of defects in mitosis and apoptosis. The Journal of cell biology, 176(2), 183-95. [PubMed:17227893] [PMC] [WorldCat] [DOI] - ↑
Näthke, I.S., Adams, C.L., Polakis, P., Sellin, J.H., & Nelson, W.J. (1996).
The adenomatous polyposis coli tumor suppressor protein localizes to plasma membrane sites involved in active cell migration. The Journal of cell biology, 134(1), 165-79. [PubMed:8698812] [PMC] [WorldCat] [DOI] - ↑
Mimori-Kiyosue, Y., Shiina, N., & Tsukita, S. (2000).
Adenomatous polyposis coli (APC) protein moves along microtubules and concentrates at their growing ends in epithelial cells. The Journal of cell biology, 148(3), 505-18. [PubMed:10662776] [PMC] [WorldCat] [DOI] - ↑
Votin, V., Nelson, W.J., & Barth, A.I. (2005).
Neurite outgrowth involves adenomatous polyposis coli protein and beta-catenin. Journal of cell science, 118(Pt 24), 5699-708. [PubMed:16303851] [PMC] [WorldCat] [DOI] - ↑
Senda, T., Iizuka-Kogo, A., Onouchi, T., & Shimomura, A. (2007).
Adenomatous polyposis coli (APC) plays multiple roles in the intestinal and colorectal epithelia. Medical molecular morphology, 40(2), 68-81. [PubMed:17572842] [WorldCat] [DOI] - ↑
Wang, J., Jing, Z., Zhang, L., Zhou, G., Braun, J., Yao, Y., & Wang, Z.Z. (2003).
Regulation of acetylcholine receptor clustering by the tumor suppressor APC. Nature neuroscience, 6(10), 1017-8. [PubMed:14502292] [WorldCat] [DOI] - ↑
Temburni, M.K., Rosenberg, M.M., Pathak, N., McConnell, R., & Jacob, M.H. (2004).
Neuronal nicotinic synapse assembly requires the adenomatous polyposis coli tumor suppressor protein. The Journal of neuroscience : the official journal of the Society for Neuroscience, 24(30), 6776-84. [PubMed:15282282] [PMC] [WorldCat] [DOI] - ↑
Rosenberg, M.M., Yang, F., Mohn, J.L., Storer, E.K., & Jacob, M.H. (2010).
The postsynaptic adenomatous polyposis coli (APC) multiprotein complex is required for localizing neuroligin and neurexin to neuronal nicotinic synapses in vivo. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(33), 11073-85. [PubMed:20720115] [PMC] [WorldCat] [DOI] - ↑
Imura, T., Wang, X., Noda, T., Sofroniew, M.V., & Fushiki, S. (2010).
Adenomatous polyposis coli is essential for both neuronal differentiation and maintenance of adult neural stem cells in subventricular zone and hippocampus. Stem cells (Dayton, Ohio), 28(11), 2053-2064. [PubMed:21089118] [PMC] [WorldCat] [DOI] - ↑
Shi, S.H., Cheng, T., Jan, L.Y., & Jan, Y.N. (2004).
APC and GSK-3beta are involved in mPar3 targeting to the nascent axon and establishment of neuronal polarity. Current biology : CB, 14(22), 2025-32. [PubMed:15556865] [WorldCat] [DOI] - ↑
Etienne-Manneville, S., Manneville, J.B., Nicholls, S., Ferenczi, M.A., & Hall, A. (2005).
Cdc42 and Par6-PKCzeta regulate the spatially localized association of Dlg1 and APC to control cell polarization. The Journal of cell biology, 170(6), 895-901. [PubMed:16157700] [PMC] [WorldCat] [DOI] - ↑
Koester, M.P., Müller, O., & Pollerberg, G.E. (2007).
Adenomatous polyposis coli is differentially distributed in growth cones and modulates their steering. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(46), 12590-600. [PubMed:18003838] [PMC] [WorldCat] [DOI] - ↑
Sakamoto, Y., Boëda, B., & Etienne-Manneville, S. (2013).
APC binds intermediate filaments and is required for their reorganization during cell migration. The Journal of cell biology, 200(3), 249-58. [PubMed:23382461] [PMC] [WorldCat] [DOI] - ↑
Fodde, R. (2002).
The APC gene in colorectal cancer. European journal of cancer (Oxford, England : 1990), 38(7), 867-71. [PubMed:11978510] [WorldCat] [DOI] - ↑
Hamilton, S.R., Liu, B., Parsons, R.E., Papadopoulos, N., Jen, J., Powell, S.M., ..., & Tetu, B. (1995).
The molecular basis of Turcot's syndrome. The New England journal of medicine, 332(13), 839-47. [PubMed:7661930] [WorldCat] [DOI] - ↑
Mohn, J.L., Alexander, J., Pirone, A., Palka, C.D., Lee, S.Y., Mebane, L., ..., & Jacob, M.H. (2014).
Adenomatous polyposis coli protein deletion leads to cognitive and autism-like disabilities. Molecular psychiatry, 19(10), 1133-42. [PubMed:24934177] [PMC] [WorldCat] [DOI] - ↑
Zhou, X.L., Giacobini, M., Anderlid, B.M., Anckarsäter, H., Omrani, D., Gillberg, C., ..., & Lindblom, A. (2007).
Association of adenomatous polyposis coli (APC) gene polymorphisms with autism spectrum disorder (ASD). American journal of medical genetics. Part B, Neuropsychiatric genetics : the official publication of the International Society of Psychiatric Genetics, 144B(3), 351-4. [PubMed:17221838] [WorldCat] [DOI] - ↑
Cui, D.H., Jiang, K.D., Jiang, S.D., Xu, Y.F., & Yao, H. (2005).
The tumor suppressor adenomatous polyposis coli gene is associated with susceptibility to schizophrenia. Molecular psychiatry, 10(7), 669-77. [PubMed:15768050] [WorldCat] [DOI] - ↑
Cali, R.J., Nephew, B.C., Moore, C.M., Chumachenko, S., Sala, A.C., Cintron, B., ..., & Cruz-Correa, M. (2021).
Altered neural networks and cognition in a hereditary colon cancer. IBRO neuroscience reports, 11, 137-143. [PubMed:34693396] [PMC] [WorldCat] [DOI] - ↑
Onouchi, T., Kobayashi, K., Sakai, K., Shimomura, A., Smits, R., Sumi-Ichinose, C., ..., & Senda, T. (2014).
Targeted deletion of the C-terminus of the mouse adenomatous polyposis coli tumor suppressor results in neurologic phenotypes related to schizophrenia. Molecular brain, 7, 21. [PubMed:24678719] [PMC] [WorldCat] [DOI]